Artículos Especializados
Artículo especializado
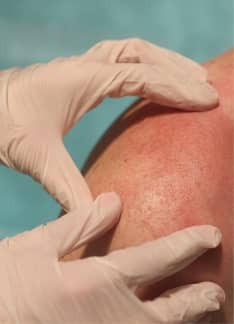
Eritrodermia: ¿Cómo se produce?
La eritrodermia es una enfermedad inflamatoria de la piel que, en su versión más grave, puede suponer la aparición de importantes complicaciones para el paciente, potencialmente mortales.
La eritrodermia se caracteriza por el eritema generalizado y la descamación de la piel. Puede estar causado por una amplia variedad de enfermedades y factores exógenos.
¿Qué es la eritrodermia?
La eritrodermia −anteriormente conocida como dermatitis exfoliativa− es un síndrome inflamatorio grave de la piel caracterizado por eritema y descamación cutánea que afecta a más del 90% de la superficie de la piel.
Se trata de una urgencia dermatológica en el que los casos graves requieren el ingreso hospitalario.
Es una patología poco frecuente que suele afectar más a los hombres (proporción hombre-mujer de 2-4 a 1).
¿Cómo se produce la eritrodermia?
La eritrodermia suele constituir la etapa final de muchas enfermedades dermatológicas. De este modo, la eritrodermia suele asociarse a una exacerbación o agravamiento de una enfermedad de la piel preexistente.
La causa más frecuente de eritrodermia es la psoriasis, representando el 25-50% de los casos, según algunos estudios.
Otros trastornos cutáneos que pueden provocar eritrodermia incluyen:
Dermatitis (incluyendo dermatitis atópica, dermatitis de contacto alérgica y dermatitis seborreica, entre otras).
Pitiriasis rubra pilaris.
Liquen plano.
Linfoma cutáneo.
Ictiosis
La eritrodermia también se puede desarrollar espontáneamente en personas que no tienen antecedentes de trastornos cutáneos.
Otra de las causas más habituales es la reacción frente a medicamentos. La lista de fármacos que pueden provocar eritrodermia es amplia. Incluye los medicamentos antiepilépticos, siendo la carbamacepina el fármaco antiepiléptico más comúnmente relacionado con este síndrome. El alopurinol, utilizado para el tratamiento de la gota, también es uno de los fármacos más relacionados, así como los antituberculosos en pacientes VIH seropositivos.
Otros fármacos que también se relacionan con esta enfermedad incluyen: la fenitoína, los betalactámicos, las sulfonamidas, el fenobarbital, la sulfasalacina y los inhibidores de la bomba de protones. Finalmente, los materiales de contraste no iónico también se consideran como posibles inductores de la eritrodermia.
Síntomas de la eritrodermia
La eritrodermia se presenta de manera gradual, excepto en los casos de origen medicamentoso.
Las placas de eritema o enrojecimiento se extienden y se fusionan hasta que acaban afectando a casi toda la superficie de la piel. En cuanto a la descamación , esta aparece de 2 a 6 días después. El aspecto de piel muestra un color rojo brillante, seco, caliente y áspero.
Otro de los síntomas en la mayoría de los pacientes es el dolor y el prurito o picor. En las fases agudas, las escamas son grandes y de aspecto costroso, mientras que en los estadios crónicos tienden a ser de menor tamaño y más secas.
Otros síntomas típicos en pacientes con eritrodermia incluyen:
Temblores y sensación de frío.
Hipotermia.
Fiebre.
Edema en la cara, los pies y las piernas.
Caquexia o pérdida significativa y rápida de peso.
Hepatomegalia y esplenomegalia.
Diagnóstico de la eritrodermia
El diagnóstico de la eritrodermia puede ser sencillo si se identifica el eritema generalizado y la descamación masiva de la piel. Sin embargo, el reto es poder determinar la enfermedad o factores causantes, por lo que el historial médico del paciente juega un papel crucial.
Tratamiento de la eritrodermia
El tratamiento requiere de la interrupción de cualquier medicamento innecesario y un examen dirigido a excluir cualquier tipo de malignidad subyacente.
El tratamiento inicial, independientemente de la causa, incluye el control de la temperatura ambiental, por el deterioro termorregulador que experimentan los pacientes. La función de barrera de la piel puede mejorarse mediante baños coloides y compresas húmedas, junto con cremas emolientes y corticosteroides tópicos de baja potencia.
Los antihistamínicos con efecto sedante intramusculares o intravenosos pueden disminuir el prurito, previniendo infecciones cutáneas debidas al rascado.
El abordaje terapéutico inicial debe incluir también la valoración nutricional e hidroelectrolítica.
En cualquier caso, el tratamiento de la eritrodermia también depende de la causa específica. En el caso de sospecha de que la eritrodermia esté causada por una reacción a un fármaco, se debe proceder a su retirada. De igual modo, si la eritrodermia es una manifestación de un linfoma cutáneo, se debe abordar el tratamiento del linfoma.
En el caso de la eritrodermia psoriásica, los fármacos inmunomoduladores como la ciclosporina y el infliximab podrían ser los medicamentos con un efecto más rápido. Otros tratamientos de primera línea incluyen la acitretina y el metotrexato.
El tratamiento de primera línea en pacientes adultos con dermatitis atópica grave, especialmente si el tratamiento tópico no ha dado resultados, incluye la fototerapia UVB de banda ancha y la inmunosupresión sistémica.
Artículo especializado
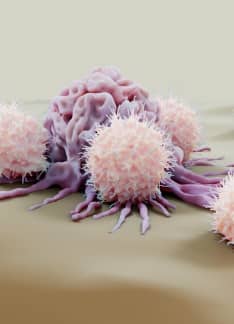
Células NK: ¿Cuál es su función?
Las células natural killer (NK) cumplen un papel fundamental dentro del sistema inmune, protegiendo al cuerpo humano, especialmente de infecciones provocadas por microorganismos y de la proliferación de tumores al limitar su propagación y el daño posterior de los tejidos. Su nombre proviene de la habilidad “natural” que se observó en la década de 1970 de atacar tumores sin necesidad de ser sensibilizado o estimulado previamente, como sí lo requieren otros linfocitos como las células T citotóxicas. A la forma de reaccionar de las células NK se le denominó reactividad citotóxica natural.
¿Qué es la célula NK?
Las células natural killer, células NK o células asesinas naturales forman parte del sistema inmunitario innato, esto es, la primera línea de defensa contra posibles infecciones o agresiones. Este incluye una serie de procesos capaces de activarse de manera rápida y eficaz, aunque con una especificidad limitada.
Estos linfocitos son abundantes en ciertas mucosas y en el intersticio de los capilares pulmonares, mientras que su número es más reducido en los ganglios linfáticos . También han sido identificadas en el tracto gastrointestinal, en el hígado, en el bazo y en la sangre periférica, donde corresponden a un 5-15 % de los linfocitos circulantes.
Los NK se clasifican como uno de los tres grupos de linfocitos, junto con las células T y las B.
Los NK son producidos en la médula ósea y se caracterizan por ser morfológicamente grandes, presentando gránulos en su interior. Se encuadran en la primera línea de defensa frente a un amplio rango de patógenos, proporcionando protección frente a infecciones virales y bacterianas y ayudando a detectar y limitar el desarrollo de tumores cancerígenos.
Su actividad “asesina” está mediada por la producción de citoquinas y su actividad citotóxica, existiendo cuatro subpoblaciones diferenciadas. Poseen diferentes receptores que les permiten interactuar con el resto de las células.
Las células NK requieren al menos de dos señales para activarse. No solo la disminución en la expresión de HLA (antígenos leucocitarios) induce la activación de estas células, sino que también se necesitan las señales de los demás receptores, los cuales participan en la sumatoria de señales que definen la actividad de las células NK.
Una vez activadas, las células natural killer liberan perforinas y granzimas, induciendo la ruptura de la membrana celular de la célula enemiga. Las perforinas son proteínas que se integran en la membrana provocando la formación de poros y su consecuente ruptura. Por su parte, las granzimas entran a la célula e inducen la apoptosis (muerte célula programada).
Para diferenciar las células NK de otros linfocitos se pueden analizar los receptores de membrana. Al contrario que los linfocitos B y T, no presentan receptores BCR ni TCR. En el caso de los NK, las proteínas que se pueden encontrar en su membrana son la CD16 y CD56, cuya proporción varía dependiendo de la subpoblación celular de que se trate.
¿Cuál es la función de la célula NK?
Parece claro que las células NK juegan un papel relevante en la protección frente a procesos infecciosos, tumorales y en otras situaciones como la inmunología reproductiva, tanto en abortos recurrentes como en fallos de implantación.
La función de las células NK se ha podido averiguar gracias a la observación de individuos que presentan deficiencias y niveles reducidos de este tipo de células.
A pesar de presentar un funcionamiento y un número adecuado del resto de linfocitos T y B, padecen infecciones virales recurrentes y tienden a desarrollar infecciones severas, como las causadas por los virus de la varicela zóster y el citomegalovirus, entre otros.
De igual modo, en pacientes con algunos tipos de cáncer, como el de mama y el colorrectal, las alteraciones en las células NK se asocia a un mayor grado de progresión de la patología.
De este modo, las principales funciones de las células Natural Killer son:
Función citotóxica
Es un tipo de reacción inmunitaria en la que una célula o microbio es recubierto por anticuerpos y es destruido por los glóbulos blancos. La función citotóxica es la más reconocida de las células NK y la ejercen sobre células tumorales, células transformadas por virus y células infectadas con bacterias y otros patógenos.
Esta función se lleva a cabo en tres pasos:
Reconocimiento de células diana.
Contacto con células diana y formación de sinapsis inmunológica.
Muerte de la célula diana inducida por las células NK.
Dentro de esta capacidad de citotoxicidad celular, las células NK presentan dos tipos. Por un lado, la que se produce de forma natural y otra mediada por anticuerpos.
De este modo, las células NK pueden reconocer de forma innata alteraciones en las células y activarse con el fin de destruirlas y también reconocer y matar células marcadas por los anticuerpos señaladas como dañinas.
Función secretora de citoquinas
Además de la acción citotóxica, las células NK al activarse tienen la capacidad de secretar diversos tipos de citoquinas −un tipo de proteínas reguladoras− como el factor de necrosis tumoral alfa (TNF-α), interferón gamma (IFN-γ) o el factor estimulante de colonias de granulocitos y monocitos (GM-CSF) que son de gran importancia en la proliferación, diferenciación y activación de otras células y la regulación de la respuesta inmunitaria.
Función antitumoral
Las células NK pueden detectar cambios en la expresión superficial de los antígenos leucocitarios humanos, lo que las cualifica claramente para detectar células que han sufrido una transformación maligna.
La actividad antitumoral de estas células es realmente importante. Los estudios muestran que la baja actividad citotóxica de las células NK se correlaciona con un mayor riesgo de cáncer.
¿Dónde se encuentran las células NK?
Las células NK se encuentran principalmente en la sangre y los tejidos linfáticos, especialmente el bazo. De este modo, este tipo de linfocitos aparece ampliamente distribuido en órganos como la piel, el intestino, el hígado, los pulmones y el útero, entre otros tejidos.
¿Cuánto viven las células NK?
Las células NK viven unos pocos días (2-3), por lo que existe una constante producción de ellas cercana a los 100.000 millones al día. Están circulando constantemente, excepto cuando acuden a tejidos en proceso de inflamación.
Artículo especializado
Estimulación ovárica: ¿En qué consiste?
La estimulación ovárica es un tratamiento médico que tiene el objetivo de estimular los ovarios, alcanzando así el desarrollo de varios folículos maduros que permitan conseguir el número máximo de ovocitos. En general, la estimulación ovárica es el primer tratamiento al que se somete la mujer −en el contexto de la reproducción asistida− permitiendo resolver los trastornos de ovulación que pudieran existir e incrementando la calidad y la cantidad de los óvulos que se pueden generan.
¿Qué es la estimulación ovárica?
La estimulación ovárica consiste en la administración de hormonas femeninas inyectables capaces de inducir el crecimiento folicular múltiple con el objetivo de obtener un mayor número de óvulos viables. Este procedimiento se inicia entre el primer y tercer día de la menstruación.
Las hormonas administradas son gonadotropinas exógenas: la hormona folículo estimulante (FSH) y la hormona luteinizante (LH). Ambas por vía subcutánea y en dosis superiores a las que se producen de manera natural en el organismo. De este modo, el aumento de la concentración plasmática de FSH y LH, afectarán tanto a la cantidad como a la calidad de los ovocitos obtenidos.
En este sentido, el número de ovocitos obtenidos está relacionado con la dosis inicial de gonadotropinas administrada. Aun así, se pueden producir variaciones en función de las características individuales de cada paciente, como pueden ser la edad, los resultados de posibles ciclos previos de estimulación para reproducción asistida y de los datos de la estimación de la reserva ovárica.
La dosis inicial más habitual en pacientes con una expectativa de respuesta normal es de 150-225 unidades internacionales. En cualquier caso, para optimizar la estimulación ovárica se debe encontrar un equilibrio entre el resultado que se desea conseguir con el mínimo riesgo para la paciente, evitando la sobreestimulación ovárica.
¿En qué procesos se aplica la estimulación ovárica?
Cuando tener un hijo no es un proceso fácil y se dan casos de infertilidad y trastornos de la ovulación, muchas parejas se ven obligadas a recurrir a las técnicas de reproducción asistida para lograr el embarazo. Con el fin de incrementar las probabilidades de éxito es necesario someterse a la estimulación ovárica, para aumentar el número de ovocitos que se generan en la ovulación.
La estimulación ovárica suele incluirse en casi todos los tratamientos de fertilidad, siendo especialmente efectivo cuando la edad de la madre es elevada (a partir de los 35 años la función ovárica se ve disminuida), principal factor relacionado con una menor calidad y cantidad de óvulos.
Además, la estimulación ovárica se suele utilizar para obtener un mayor número de ovocitos en casos de donación o cuando la mujer opta por la congelación si desea retrasar la maternidad.
¿En qué consiste la estimulación ovárica natural?
La estimulación ovárica solo es posible mediante la utilización de hormonas de la ovulación y a través de inyecciones. No existe un método más natural. La administración, aunque es mediante inyecciones, es sencilla y no duele.
Inicialmente se utilizaban gonadotropinas menopáusicas urinarias que contenían concentraciones variables de hormona luteinizante y hormona folículo estimulante. Posteriormente se desarrollaron la FSH y LH recombinantes, lo que aportó fármacos con dosis constantes y de mayor disponibilidad.
Por otro lado, la fecundación in vitro natural es aquella en la que no se lleva a cabo una estimulación ovárica, por lo que el número de óvulos disponibles para su posterior extracción será menor.
Tratamiento de la estimulación ovárica
En la actualidad se dispone de un gran arsenal de fármacos inductores de estimulación ovárica, siendo las gonadotropinas (FSH y LH) los más empleados dentro de la técnica de reproducción in vitro.
La individualización del tratamiento de estimulación ovárica permite la predicción de la respuesta ovárica a la acción de las gonadotropinas. Este modelo tiene por objeto conseguir el mejor resultado posible en tasas de embarazo e hijo vivo, equilibrando los riesgos derivados de la intervención farmacológica como la hiperestimulación, así como los riesgos de cancelación del ciclo por baja respuesta.
La respuesta a la estimulación ovárica dependerá de la reserva ovárica, de la variabilidad funcional ovárica mensual y de las características de estimulación que se lleve a cabo. Normalmente se considera deseable una respuesta adecuada para obtener de 5 a 15 ovocitos (alcanzando las mayores tasas de embarazo en torno a los 15 ovocitos), ya que respuestas superiores o inferiores suelen provocar la finalización del tratamiento.
En cualquier caso, la decisión sobre el tipo de estimulación, las gonadotropinas y las dosis dependerá del ginecólogo, en función de las características de la pareja y siempre teniendo en cuenta su opinión.

Artículo especializado
La coenzima Q10 en el embarazo
La coenzima Q10 (CoQ10) es una sustancia presente de forma natural en las células humanas. Entre otras muchas acciones, se relaciona con beneficios para la fertilidad y para diferentes aspectos del embarazo.
Qué es la coenzima Q10
La coenzima Q10 −o ubiquinona, nombre que recibe por estar presente en multitud de tejidos− es un compuesto presente en la mayoría de las células, cuya principal característica es su naturaleza antioxidante que contribuye al crecimiento y mantenimiento celular.
La principal función de la coenzima Q10 en el organismo es promover el crecimiento celular y la protección de las células. Además, son necesarias cantidades adecuadas de CoQ10 para la respiración y obtención de energía a nivel celular. En las células que tienen altos requerimientos de energía es dónde se encuentras las mayores concentraciones de coenzima Q10, incluyendo las células del corazón, hígado y riñón.
En condiciones normales de salud, la CoQ10 no necesita ser suministrada a través de suplementos, ya que el organismo se encarga de sintetizar las cantidades suficientes de esta coenzima. No obstante, uno de los factores que determinan la disminución de los niveles de CoQ10 del organismo es el paso del tiempo. De este modo, el envejecimiento es una de las principales causas de presentar niveles disminuidos de coenzima Q10, haciendo necesario el consumo de suplementos.
Por otro lado, la CoQ10 se encuentra en diferentes alimentos (principalmente carnes, pescados y frutos secos), aunque en cantidades escasas como para aumentar significativamente los niveles de CoQ10 en el organismo.
En el curso de numerosos procesos patológicos, en los que existe una deficiencia de CoQ10, puede beneficiarse de su suplementación, incluyendo enfermedades mitocondriales, fibromialgia, enfermedades cardiovasculares y neurodegenerativas, cáncer, diabetes mellitus e infertilidad, entre otras.
Beneficios de la coenzima Q10: fertilidad y embarazo
Las posibilidades de embarazo disminuyen a medida que aumenta la edad. Esta situación puede estar motivada por diversidad de causas, pero el problema más común es la disminución en la calidad de los óvulos y espermatozoides.
El proceso para iniciar el desarrollo del embrión, una vez producida la fecundación, requiere una gran cantidad de energía, que es suministrada por las mitocondrias dentro de las células. En este sentido, los óvulos y espermatozoides tienen más mitocondrias que cualquier otra célula del cuerpo. En todo el proceso la coenzima Q10 juega un importante papel.
Algunos estudios muestran que la suplementación de coenzima Q10 en mujeres en tratamientos de fertilidad pueden mejorar la tasa de embarazo. De igual modo, la CoQ10 en hombres con infertilidad puede mejorar la motilidad de los espermatozoides, aumentar el número de espermatozoides viables y mejorar la penetración del espermatozoide en el óvulo.
En cualquier caso, la evidencia ofrecida por los estudios realizados hasta la fecha no permite ser concluyentes.
La coenzima Q10 y la preeclampsia
La preeclampsia es una complicación del embarazo que conduce a severas complicaciones a nivel cardiovascular que ponen en peligro las vidas de la madre y el bebé. Tiene un claro componente autoinmune y su principal síntoma es la hipertensión arterial.
En comparación con mujeres no embarazadas y embarazadas sanas, las pacientes con preeclampsia presentan concentraciones plasmáticas de coenzima Q10 significativamente más bajas.
En este sentido, el efecto del estrés oxidativo a nivel cardiovascular puede jugar un papel importante en la aparición de la preeclampsia, incrementando la producción de factores proinflamatorios y vasoconstrictores, los cuales determinan la degeneración vascular y la aparición de hipertensión arterial y proteinuria.
De este modo, la suplementación exógena de CoQ10 en pacientes con alto riesgo de desarrollar esta patología podría tener un efecto preventivo (disminuyendo a la mitad las posibilidades de padecerla).
La coenzima Q10 en la prevención de complicaciones en el embarazo
Existen estudios que han mostrado la efectividad de la CoQ10 en prevenir otras complicaciones, además de la preeclampsia.
Unos niveles adecuados del antioxidante han mostrado la capacidad de mejorar diferentes aspectos de la salud de la mujer embarazada, así como la del bebé.
Algunos de los beneficios asociados al CoQ10 incluyen:
Resultado final del embarazo . Existe una correlación positiva entre los niveles plasmáticos de coenzima Q10 y los resultados finales del embarazo. En los casos en los que el estrés oxidativo puede ocasionar ciertas complicaciones, los niveles de CoQ10 aparecen aumentados, como en la restricción del crecimiento intrauterino y la hipoxia intrauterina, entre otras situaciones.
Diabetes gestacional . En pacientes con diabetes del embarazo se observan incrementos en la concentración plasmática de CoQ10, lo que podría señalar un papel compensatorio para contrarrestar el efecto de estrés oxidativo causado por la hiperglucemia y la resistencia a la insulina.
Estilo de vida saludable durante el embarazo . Unos hábitos saludables que incluyan la realización regular de ejercicio físico, la evitación de tóxicos como el tabaco y el alcohol se relacionan con concentraciones plasmáticas elevadas de antioxidantes, incluyendo la coenzima Q10.
Reducción de marcadores proinflamatorios . La CoQ10 es capaz de reducir los niveles de algunos marcadores proinflamatorios que están asociados a la pérdida del embarazo.
Reducción de gestaciones anormales . Como se considera que la disfunción mitocondrial y el daño del material genético producidos por el estrés oxidativo pueden jugar un importante rol en la aparición de problemas en el embarazo, es posible que la coenzima Q10 contribuya a la prevención de los procesos degenerativos gracias a su cualidad antioxidante.
En cualquier caso, la relación entre unos niveles elevados de CoQ10 durante el embarazo y un mejor pronóstico y evolución del mismo parece claro. Sin embargo, no existen evidencias sólidas sobre la efectividad de su suplementación.
Artículo especializado
Histerosonografía: ¿Qué es y cómo se realiza?
La histerosonografía forma parte integral de la ecografía ginecológica y de las técnicas utilizadas para el estudio de la cavidad endometrial.
¿Qué es la histerosonografía?
La histerosonografía (también denominada sonohisterografía o ecografía de infusión salina) es un procedimiento para la evaluación de la cavidad uterina mediante la introducción de suero salino fisiológico a través del cérvix con ayuda de una cánula. Sirve así para mejorar la visualización del endometrio durante la realización de una ecografía transvaginal.
Se trata de una técnica utilizada para la detección más eficiente de patologías endometriales, incluyendo pólipos, hiperplasias, leiomiomas y cáncer, entre otras. Además, es un procedimiento mínimamente invasivo, de menor duración que una histeroscopia, y que es bien tolerado por la mayoría de las pacientes.
Por otro lado, existen técnicas como la histerosalpingografía, más compleja que la histerosonografía, basadas en la utilización de contraste ecográfico, empleando radiación ionizante, que suele indicarse para evaluar la permeabilidad tubárica de las trompas de Falopio (vital para el correcto desplazamiento del óvulo hasta su implantación en el endometrio) en pacientes con infertilidad.
¿Para qué sirve la prueba de histerosonografía?
Su objetivo principal es visualizar la cavidad endometrial con detalle y sin el uso de radiación ionizante o agentes de contraste radiológico como sucede en otras técnicas.
La prueba está indicada en los siguientes casos:
Sangrado uterino anormal.
Evaluación de la cavidad uterina, especialmente en la sospecha de miomas uterinos, pólipos endometriales y sinequias.
Anomalías endometriales detectadas en la ecografía endovaginal.
Patología uterina benigna.
Infertilidad, especialmente en mujeres con fallo de implantación recurrente en ciclos de fertilización in vitro.
Pérdida recurrente de la gestación.
Visualización dificultosa del endometrio en la ecografía endovaginal convencional.
Qué detecta la histerosonografía
Entre los hallazgos específicos que permite la técnica, los cuales no se podrían encontrar mediante otras técnicas más simples, se encuentran los siguientes:
Pólipos endometriales
Se trata del hallazgo uterino anormal más frecuente. Se asocian con sangrado intermenstrual y reducción en las tasas de implantación en casos de fecundación in vitro, aunque también pueden permanecer asintomáticos.
Hiperplasia endometrial
La hiperplasia endometrial se sospecha cuando existe un endometrio irregular. Se trata de un diagnóstico que debe ser confirmado por el estudio histológico de una muestra de tejido endometrial.
Adherencias/sinequias uterinas
Las adherencias intrauterinas son una causa de amenorrea e infertilidad y podrían ser el resultado de una endometritis o infección pélvica. La histerosonografía es una prueba adecuada para el diagnóstico de adherencias intrauterinas.
Anomalías uterinas congénitas
Las anomalías congénitas uterinas pueden ser causa de abortos recurrentes o infertilidad. La histerosonografía puede proporcionar información precisa sobre anormalidades uterinas y contribuir a su clasificación.
Leiomiomas (fibromas)
Los leiomiomas son tumores de naturaleza benigna que se producen en el miometrio. En función de su ubicación, tamaño y número las repercusiones clínicas variarán, incluyendo los abortos recurrentes, la infertilidad y las complicaciones obstétricas como el parto prematuro.
Factor tubárico
Los factores tubáricos son responsables de aproximadamente un tercio de la infertilidad femenina. El estudio de la permeabilidad tubárica es parte de la investigación que se lleva a cabo cuando existen problemas de fertilidad mediante técnicas basadas en la histerosonografía que incorporan otros medios de contraste.
¿En qué consiste la prueba de histerosonografía?
La prueba se lleva a cabo en el momento de la consulta y con un transductor endovaginal de alta frecuencia.
Tras el estudio ecográfico preliminar, se procede a la colocación de un espéculo que permite la visualización del cuello uterino. Luego se realiza una desinfección del orificio cervical externo y la vagina.
A continuación, se lleva a cabo la colocación de un catéter intracervical por el que se introduce, bajo control ecográfico, el líquido estéril (solución fisiológica) que distiende la cavidad uterina.
Con la técnica de visualización en 2D se evalúa la cavidad uterina durante la introducción del líquido. Por otro lado, la ecografía 3D permite además la captura del volumen del útero en pocos segundos, pudiendo almacenar el conjunto de datos para analizarlo una vez finalizado el procedimiento.
La técnica de histerosonografía es especialmente útil para la visualización de patologías intrauterinas. Además, el empleo de medios de contraste (gel-espuma) basados en soluciones de burbujas de aire y suero fisiológico pueden aumentar la precisión del método diagnóstico. Sin embargo, no es eficaz en la determinación y evaluación de la permeabilidad de las trompas de Falopio.
Efectos adversos y complicaciones de la histerosonografía
Existen situaciones en las que no se puede llevar a cabo la técnica. Entre ellas se incluyen:
Incompetencia cervical.
Estenosis cervical.
Miomas
Sinequias o síntomas que obligan a la finalización la prueba.
En cuanto a los efectos adversos, los más frecuentes suelen ser el dolor pélvico y los síntomas que incluyen sudoración, náuseas, lipotimias y bajadas de tensión. Estos suelen aparecer en menos del 10% de las pacientes y de forma severa en aproximadamente el 1%.
Los efectos adversos suelen ser más frecuentes en mujeres que todavía no han dado a luz y mujeres que ya han pasado la menopausia.
Otras complicaciones poco frecuentes que dificultan la técnica son la salpingitis o inflamación de las trompas de Falopio, la enfermedad inflamatoria pélvica y la peritonitis.
Contraindicaciones
En cuanto a las contraindicaciones que recomiendan no realizar la prueba se encuentran:
El embarazo.
Cáncer en el tracto reproductor.
Historial con infección pélvica documentada.
Infecciones vaginales recurrentes.
Pacientes con patología tubárica.
Pacientes con factores de riesgo, como enfermedades cardiovasculares, hipertensión arterial o ictus, entre otras.
Sangrado vaginal abundante.
Artículo especializado
Saco vitelino: ¿Qué es?
Para el desarrollo del embrión y del feto, que dará lugar al nacimiento de una nueva vida a los 9 meses, se crean una serie de estructuras capaces de proteger y nutrir al feto durante su desarrollo y que se van modificando conforme avanza la gestación. Una de estas estructuras es el saco vitelino.
¿Qué es el saco vitelino?
El saco vitelino (también denominado vesícula vitelina) se trata de una estructura embrionaria con forma de saco o bolsa adjunta al embrión que aparece en las primeras semanas de gestación y que es visible durante las primeras ecografías. Su evolución puede servir como marcador del progreso del embarazo en sus primeras etapas.
Esta estructura tiene el objetivo de transferir nutrientes y oxígeno. Su presencia es fundamental para el desarrollo de la placenta y para establecer una circulación normalizada entre esta y el embrión.
El saco vitelino se encuentra conectado a la abertura umbilical del embrión. Se forma en torno a la cuarta semana de embarazo y está rodeado de una membrana delgada que contiene líquido en su interior y presenta una pared interna rica en vasos sanguíneos.
¿Cuál es la función del saco vitelino?
La principal función del saco vitelino es proporcionar los nutrientes y el oxígeno necesarios para que el embrión se desarrolle. También se encarga de producir las células sanguíneas para la formación de la placenta y las células sexuales que migrarán hacia las gónadas primitivas del embrión para dar lugar al desarrollo de sus órganos sexuales. Además, se encarga de eliminar los desechos metabólicos y el CO 2 , tratándose de una estructura visible en la ecografía dentro del saco gestacional.
Saco vitelino en la ecografía
En el seguimiento médico del embarazo, la vesícula vitelina puede servir, junto a otros elementos e indicadores, como marcador de la correcta evolución del embarazo durante los primeros tres meses.
La ecografía transvaginal muestra el saco gestacional que puede identificarse ya con 2-3 mm de diámetro a las 2-3 semanas de embarazo (4-5 semanas desde la fecha de la última menstruación). El saco vitelino es la primera estructura que puede identificarse en el interior del saco gestacional. Se identifica como una estructura quística redondeada, de pared fina, dentro del saco cuando este alcanza los 6-8 mm, a partir de las 3,5 semanas de embarazo.
El saco vitelino crece a un ritmo de 1 mm por semana hasta alcanzar 6 mm en la semana 10 y disminuye a partir de entonces, no siendo visible ya a las 12-13 semanas. Con 5 semanas de gestación, es posible observar por ecografía la vesícula vitelina dentro del saco gestacional, confirmando de esta manera que hay embrión y que la gestación es evolutiva (de lo contrario, podría suceder que el embrión no se desarrolle, dejando un saco gestacional vacío). El embrión se observa como una estructura de unos 2-3 mm, junto al saco vitelino. La forma y el tamaño desarrollado del saco vitelino son importantes, ya que pueden indicar que existe algún problema en el desarrollo del embarazo.
Después de cumplir con su función de nutrir, oxigenar y recoger los deshechos del embrión, el saco vitelino suele desaparecer hacia la semana 12 de embarazo. Tras ello, la placenta debe haberse desarrollado adecuadamente para asumir esas funciones.
¿Qué pasa si no desaparece el saco vitelino?
En torno a la semana 12 de embarazo el saco vitelino desaparece, pasando a desempeñar sus funciones la placenta, que hasta ese momento estaba en desarrollo.
Efectivamente, el tamaño puede indicar un problema, especialmente cuando el diámetro del saco es superior a 9 mm o inferior a 3 mm después de la quinta semana. De igual modo, si el saco vitelino no desaparece y sigue estando presente después del primer trimestre de embarazo puede ser indicativo de problemas que suelen desencadenar un aborto natural, habitualmente porque el embrión no se ha podido llegar a desarrollar.
Artículo especializado
Analítica hormonal: ¿Cuándo realizarla?
La analítica hormonal es una prueba específica para mujeres en la que se determinan los valores de hormonas reproductivas a partir de un análisis de sangre.
¿Qué son las hormonas femeninas?
Las hormonas son mensajeros químicos que al liberarse producen distintas consecuencias en los órganos y tejidos diana. Más en concreto, las hormonas sexuales femeninas son las encargadas de controlar el ciclo reproductivo y menstrual de la mujer y la aparición de caracteres sexuales, entre otras cuestiones.
El control de los niveles hormonales femeninos está regulado por el eje hipotálamo-hipófisis-ovario.
El hipotálamo y la hipófisis son dos pequeñas áreas situadas en el cerebro que se encargan de regular la mayoría de las hormonas que circulan por el organismo (hormonas hipofisiarias). Además, se encargan de controlar la producción hormonal en los ovarios, cuyas hormonas sexuales liberadas (hormonas ováricas) regulan la función del aparato reproductor femenino, siendo también responsables de la aparición de los caracteres sexuales secundarios de la mujer. En caso de producirse alteraciones hormonales, estas se traducirán en trastornos del ciclo menstrual y fallos en la fertilidad, entre otros. Por ello, el análisis hormonal en sangre es una prueba esencial para valorar la fertilidad femenina.
Hormonas hipofisiarias
Las hormonas hipofisiarias (también llamadas gonadotropinas) más importantes son:
La hormona folículo estimulante (FSH). Actúa sobre el ovario, favoreciendo el desarrollo y la maduración de los folículos ováricos, donde a su vez crecen y maduran los óvulos.
La hormona luteinizante (LH). Se encarga de desencadenar la maduración folicular y la ovulación, lo cual conlleva la formación del cuerpo lúteo (folículo vacío tras la ovulación) y la secreción de progesterona por parte de éste.
La hormona estimulante de la glándula tiroidea (TSH). Ejerce su acción sobre la glándula tiroidea, regulando su actividad.
Prolactina . Durante el embarazo estimula la producción de leche en las glándulas mamarias y la síntesis de progesterona en el cuerpo lúteo.
Hormonas ováricas
Las hormonas previamente nombradas estimularán la liberación, en los ovarios, de las hormonas sexuales, que son:
Estrógenos . El estradiol es una hormona estrogénica liberada por el folículo ovárico en crecimiento que, entre otras funciones, se encarga de activar la liberación de LH e inducir así la ovulación en cada ciclo menstrual. Además, junto a la progesterona, participa en la preparación del endometrio para la implantación embrionaria.
Progesterona . Se trata de una hormona esteroidea liberada principalmente por el cuerpo lúteo y la placenta en caso de embarazo. Actúa durante la segunda fase del ciclo menstrual (fase lútea), preparando al endometrio para la implantación del embrión. También se encarga de mantener intacto el endometrio durante la gestación. Cuando no hay embarazo, el nivel disminuido de progesterona provoca la eliminación por vía vaginal del endometrio (menstruación).
Hormona antimulleriana (AMH). Participa en la formación y desarrollo de los folículos. Permite valorar la reserva ovárica y la fertilidad de la mujer.
¿Cuándo deberías realizar la analítica hormonal?
La analítica de hormonas en sangre se lleva a cabo para evaluar el nivel de las hormonas femeninas encargadas de regular el ciclo ovárico de la mujer. De este modo, permite valorar el potencial de fertilidad de la mujer.
Junto con la ecografía transvaginal, la analítica de las hormonas basales permite definir el estado de la reserva ovárica de la mujer. Esto es de gran ayuda para determinar la cantidad total de ovocitos que tiene en sus ovarios y si ocurre la ovulación.
Las principales hormonas que se analizan dentro de una analítica hormonal en la mujer incluyen:
La hormona folículo estimulante.
La hormona luteinizante.
El estradiol.
La progesterona.
La hormona antimulleriana.
La prolactina.
La TSH.
En cuanto al momento de realizar la analítica, lo ideal es poder llevarla a cabo entre el tercer y quinto día del ciclo menstrual (3 y 5 días después de la menstruación). Durante estos días es cuando las hormonas se encuentran en estado basal y pueden compararse con unos valores de referencia.
Las excepciones son la progesterona, que debería hacerse el día 21 del ciclo para tener constancia de si la ovulación ha tenido lugar y la hormona antimulleriana, que puede realizarse en cualquier momento del ciclo menstrual.
¿Qué valores hormonales son normales?
El correcto funcionamiento del eje hipotálamo-hipófisis-ovarios y sus correspondientes niveles adecuados de hormonas femeninas determinará un ciclo menstrual normal, incluyendo la ovulación y la potencial fecundación e implantación del embrión en el útero.
La analítica hormonal arrojará unos valores para cada hormona femenina. Su comparación con los valores normales permitirá descartar o, en caso de encontrar diferencias respecto a los valores normales, ayudar al diagnóstico de patologías o trastornos que pudieran causar dichas diferencias.
Los valores normales de referencia de las hormonas femeninas son:
FSH . De 3 a 9 mUI/ml indica una buena reserva ovárica (esto es, una cantidad suficiente de folículos para obtener una gestación). Por el contrario, los valores entre 10 y 13 mUI/ml indican una reserva ovárica disminuida. Valores superiores a 13 suelen ser comunes en el inicio de la menopausia.
LH . Los valores normales están entre 2 y 10 mUI/ml. Valores superiores a 20 mUI/ml indican que la ovulación está a punto de producirse. Los valores elevados al inicio del ciclo menstrual pueden estar motivados por situaciones como el síndrome de ovarios poliquísticos.
TSH . Los valores normales se sitúan entre 0,2 y 4,7 mUI/ml. Valores por encima indican hipertiroidismo y por debajo, hipotiroidismo. Ambas alteraciones pueden influir negativamente en la ovulación y la fertilidad.
Estradiol . Los valores al inicio de ciclo deben estar entre 27 pg/ml y 165 pg/ml. Aquellos valores por debajo de los 50 pg/ml muestran una reserva ovárica adecuada, mientras que niveles elevados pueden indicar la presencia de quistes o baja reserva ovárica.
Progesterona . Los valores normales de progesterona el día 21 del ciclo se sitúan entre 5 y 20 ng/ml cuando se ha producido la ovulación con normalidad. El día 3, la progesterona debe ser menor a 1,5 ng/ml.
Prolactina . En mujeres no embarazadas los valores normales se sitúan entre 0 y 20 ng/ml. Valores de prolactina superiores a 30 ng/ml indican que la regulación hormonal puede estar alterada y también la ovulación. En mujeres embarazadas lo normal es unos niveles de 10 a 300 ng/ml.
AMH . La normalidad se sitúa entre 0,7 y 3,5 ng/ml. Niveles inferiores a 0,7 ng/ml indican una baja reserva ovárica. Por el contrario, valores por encima de 3,5 ng/ml pueden indicar una sobreestimulación ovárica producida por el tratamiento de reproducción asistida.
Analítica hormonal en ayunas
La extracción de una muestra de sangre para la analítica hormonal completa femenina se debe realizar en ayunas. La prueba debe realizarse entre el tercer y el quinto día de la regla, si se tienen menstruaciones.
Artículo especializado
Bótox preventivo: ¿Es necesario?
El bótox es un tratamiento estético que, entre otros fines, es utilizado para reducir las arrugas faciales de expresión. También puede ser administrado de forma preventiva, tratando las zonas predispuestas a la aparición de arrugas para que estas no lleguen a darse.
¿Qué es el botox preventivo?
Lo normal suele ser esperar hasta que aparezcan las arrugas para comenzar un tratamiento con bótox . El Botox es uno de los nombres comerciales de la denominada toxina botulínica tipo A, producida por una bacteria, el Clostridium botulinum , que actúa a nivel neurológico produciendo parálisis y relajación muscular por medio del bloqueo de la acetilcolina, el neurotransmisor encargado de comunicar el movimiento.
Sin embargo, el más novedoso tratamiento de bótox preventivo utiliza la toxina botulínica para tratar las arrugas antes de que aparezcan.
Los músculos faciales se contraen constantemente, arrugando la piel. A medida que se pierde elasticidad con el paso de los años, las arrugas dinámicas que solo aparecían con las expresiones de la cara al contraer los músculos, se pueden transformar en arrugas permanentes y profundas. En este sentido, el objetivo del tratamiento con bótox preventivo es suavizar el movimiento de los músculos faciales para reducir la aparición de líneas profundas y arrugas permanentes.
Con el paso del tiempo, el uso recurrente de bótox debilita, de forma controlada, los músculos faciales, ralentizando el proceso por medio del cual las arrugas dinámicas que aparecen con las expresiones se transforman en arrugas estáticas, presentes en reposo.
Qué partes de la cara puedes tratar con el botox preventivo
El bótox se aplica con una aguja muy fina con la que se realizan punciones en las zonas en las que hay más predisposición a la aparición de arrugas a nivel intramuscular o subdérmico, inyectando pequeñas dosis de la toxina.
En el caso del bótox preventivo, se suele aplicar en la zona del entrecejo, la zona situada alrededor de los ojos para la prevención de las “patas de gallo” y la zona central de la frente.
Suele haber bastante coincidencia entre las partes de la cara en las que se utiliza el tratamiento de bótox terapéutico y el preventivo. La diferencia radica en que cuando se pretende prevenir la aparición de estas arrugas se administran dosis menores de la toxina botulínica en comparación con las dosis terapéuticas.
¿A partir de qué edad deberías aplicarte botox preventivo?
No existe una edad universal a partir de la cual esté indicada la aplicación del tratamiento de bótox preventivo.
En cada persona las arrugas comienzan a aparecer a una edad distinta en función de diversos factores. De este modo, los factores genéticos, junto con los hábitos de vida determinarán la edad y el grado de aparición de las arrugas. Entre los hábitos que pueden predisponer a una mayor aparición de arrugas están la alimentación, el hábito tabáquico y la exposición al sol.
En cuanto al tratamiento con bótox, suele ser común esperar a que se hayan instaurado ya arrugas profundas y marcadas para empezar con él. Sin embargo, el concepto de prevención señala una utilización de la aplicación del bótox mucho más temprana, con el fin de atenuar el movimiento de los músculos que producen las arrugas, impidiendo que las líneas de expresión se desarrollen de manera sostensible en el futuro.
En cualquier caso, debe ser el criterio del especialista en Medicina Estética o del Dermatólogo el que determine el momento adecuado y el grado de aplicación de medidas preventivas para evitar la aparición de arrugas y líneas de expresión.
¿Es efectivo el botox preventivo?
Los resultados de efectividad del botox son muy elevados, tratándose de un procedimiento mínimamente invasivo, con gran seguridad y escasos efectos adversos.
A nivel estético, cuando se utiliza el bótox a nivel terapéutico, una vez que las arrugas y líneas de expresión ya están presentes, el efecto del botox consigue una disminución significativa de las líneas de expresión y de las arrugas. Cuando estas últimas son más marcadas, se aconseja que este tratamiento se acompañe de otras técnicas de medicina estética para conseguir mejores resultados.
Pensando en esos casos aparece el botox preventivo, para anticiparse a la instauración de esas arrugas y líneas de expresión profundas. De este modo, el tratamiento a largo plazo con botox ha mostrado la prevención efectiva del desarrollo de arrugas faciales visibles en reposo. La aplicación mantenida en el tiempo de forma preventiva promueve un proceso continuo de relajación muscular con un efecto positivo para el aspecto y salud de la piel.
Bótox preventivo: precio
El precio del tratamiento preventivo de botox a nivel estético varía en función de la cantidad que se debe utilizar y de la extensión que se desea tratar. Además, el coste dependerá de la clínica donde se realice el tratamiento y las ofertas o precios que se ofrezcan en cada una. De manera general, una sesión para la aplicación de botox en un área concreta de la cara (entrecejo, ojos, pómulos, boca, etc.) puede variar entre 150 y 350 euros, aproximadamente.

Artículo especializado
Piel grasa durante el embarazo: ¿Qué es y cómo cuidarla?
Durante el embarazo se producen cambios y modificaciones en el cuerpo de la madre con el fin de favorecer el desarrollo el bebé. De igual modo, algunas hormonas incrementan sus niveles, lo que tiene múltiples repercusiones, como la estimulación de ciertas glándulas y tejidos.
Un ejemplo de ello lo constituye la aparición de piel grasa durante el embarazo, por la estimulación de las glándulas sebáceas de la piel.
¿Qué es la piel grasa?
La piel grasa tiene lugar cuando se produce un exceso de sebo en las glándulas sebáceas. Los poros de la piel están dilatados y la piel se torna más gruesa. La seborrea también puede aparecer en el cuero cabelludo, dando lugar a un pelo más graso.
La grasa y la piel
Las glándulas sebáceas son las encargadas de producir el sebo. Se encuentran en la dermis y desembocan en los folículos pilosos. Las glándulas sebáceas se encuentran mayoritariamente en la cara, el cuero cabelludo, la espalda y el pecho. Aunque en menor cantidad, están también en el resto de la piel.
La función del sebo es impermeabilizar la piel, mantener su pH ácido protector frente a microorganismos y proteger frente al fotoenvejecimiento, gracias a los antioxidantes que están presentes.
Aunque la finalidad del sebo es hidratar y proteger la piel, cuando se produce un exceso de grasa, se favorece el sobrecrecimiento de bacterias y hongos en la epidermis. Esto puede dar lugar a la aparición de dermatitis seborreica en personas predispuesta que se manifiesta en forma de zonas descamativas en surcos nasogenianos, cejas y cuero cabelludo. Además, el exceso de grasa se muestra con zonas brillantes sobre las áreas centrales de la cara. Por otro lado, las mujeres con la piel grasa presentan una mayor predisposición a la aparición de acné debido a la oclusión de las glándulas sebáceas por el exceso de grasa y el sobrecrecimiento posterior de ciertas bacterias.
¿Por qué se produce la piel grasa en el embarazo?
La piel grasa durante el embarazo es un síntoma habitual. La gestación determina que el cuerpo de la mujer embarazada experimente cambios hormonales, vasculares y metabólicos con implicaciones para la piel.
En cualquier caso, es normal que la piel experimente alteraciones que pueden variar de una mujer a otra.
Los cambios en la piel tienen lugar, especialmente, durante las primeras semanas de embarazo. La producción de sebo aumenta debido principalmente al aumento de los niveles hormonales de progesterona y estrógenos.
Si bien el aumento de grasa se localiza en distintas partes de la piel, son más abundantes a nivel del rostro, el pecho y la espalda.
Otro factor que puede contribuir a la aparición de la piel grasa durante el embarazo es la alimentación. De este modo, dietas con un contenido elevado en hidratos de carbono refinados, azúcar, lácteos y productos cárnicos pueden empeorar la piel grasa, mientras que las dietas altas en alimentos vegetales y fibra la mejoran.
Cómo cuidar la piel grasa en el embarazo
El exceso de grasa en la piel tiende a atrapar suciedad y microorganismos en los poros. De este modo, limpiar bien la piel es un elemento fundamental.
Algunas recomendaciones para una correcta limpieza de la piel grasa durante el embarazo incluyen:
Limpieza por la noche y la mañana . El sebo se produce día y noche, por lo que es importante que la limpieza se lleve a cabo por la noche y por la mañana.
Utilizar productos para piel grasa no agresivos . Para la limpieza de la piel deben utilizarse productos formulados para piel grasa, evitando utilizar ingredientes irritantes o abrasivos que agredan la barrera de la piel. La utilización de un jabón agresivo solo promoverá la producción de más sebo.
No utilizar productos con fragancias ni alcohol . Tampoco se recomiendan los exfoliantes de raspado por su efecto irritante para la piel.
Hidratar la piel a diario.
Utilizar protector solar con factor elevado no comedogénico para evitar hiperpigmentaciones hormonales, los denominados melasma o cloasma que son frecuentes en el embarazo.
Si se utiliza maquillaje , preferir los que son a base de agua, no comedogénicos.
¿Cómo cambia la piel y la cara en el embarazo?
Como se ha visto, el aumento de la secreción seborreica que ocurre principalmente por las modificaciones hormonales del embarazo puede dar lugar a la aparición de piel grasa y acné.
Además de la cara grasosa en el embarazo, otra modificación que puede tener lugar con repercusiones sobre la piel y la cara se debe al aumento en la secreción de melanina, el pigmento que da color a la piel. En la cara se puede apreciar con un tono más oscuro o moreno de la piel y la aparición de pecas. En el resto del cuerpo, se puede apreciar especialmente en la línea alba del abdomen o en las areolas de los pechos. También es frecuente que durante el embarazo aparezcan fibromas de péndulo a nivel de cuello y submamarios que suelen desaparecer después del parto. Asimismo, se pueden oscurecer las pecas preexistentes.
Para hacer el seguimiento de todos los cambios experimentados durante el embarazo, Savia pone a tu disposición a los mejores especialistas en Ginecología y Obstetricia .

Artículo especializado
Niacinamida: ¿Para qué sirve?
La niacinamida es una vitamina implicada en múltiples funciones a nivel metabólico y de reparación celular. Entre otras, desempeña diversas acciones que son beneficiosas para la piel.
¿Qué es la niacinamida?
La niacinamida es una de las formas químicas en las que se presenta la vitamina B3. Esta forma hidrosoluble de vitamina B se caracteriza por causar en caso de carencia una enfermedad, la pelagra. Aunque es muy poco habitual en nuestro entorno, puede cursar de manera grave con afectación a diversos niveles, causando dermatitis, diarrea y demencia.
La vitamina B3 está presente en alimentos como frutos secos, carnes, pescados y alimentos de origen vegetal.
La niacinamida es necesaria para el correcto funcionamiento del metabolismo de las grasas y de la glucosa, manteniendo las células sanas y jugando un papel importante en muchas reacciones de oxidorreducción en las que ejerce como antioxidante, entre otras funciones.
En cuanto a la piel, la niacinamida participa en reacciones enzimáticas importantes que contribuyen a mantener la piel en buen estado.
¿Para qué sirve la niacinamida?
La niacinamida es una sustancia que, junto con el resto de formas químicas que constituyen la vitamina B3, juega una función importante en el suministro de energía y la síntesis de nutrientes celulares. También participa en la síntesis y reparación del ADN, así como contrarrestando la oxidación y el envejecimiento celular.
Niacinamida: para qué sirve en la piel
La niacinamida presenta diversidad de aplicaciones para la piel. De este modo, su administración tópica a través de productos cosméticos ha mostrado su eficacia en las siguientes situaciones:
Exceso de pigmentación . La niacinamida obstaculiza el paso de la melanina a las células de la epidermis evitando la formación de manchas.
Acné . Algunos de los efectos de la niacinamida sobre la piel incluyen la capacidad antiinflamatoria, antibacteriana y reductora de la producción de sebo, todos ellos relacionados con la aparición del acné.
Dermatitis . La niacinamida estimula la producción de ceramidas, que pueden contribuir a la mejora de los síntomas de la dermatitis.
Niacinamida y el sol . Uno de los efectos de la niacinamida es la reparación del ADN de las células que ha sido dañado por la exposición a la radiación ultravioleta del sol, por lo que puede ser un agente preventivo del cáncer de piel.
¿Para quién está recomendada la niacinamida?
Como se ha visto, la niacinamida presenta múltiples efectos que pueden ser beneficiosos para la piel, especialmente en personas con características específicas:
Personas con piel seca y necesidades especiales de hidratación. La niacinamida contribuye a reparar la barrera cutánea, aumentando la producción de ceramidas y ácidos grasos.
Personas con piel grasa y acné. La vitamina B3 tiene propiedades seborreguladoras y antiinflamatorias que ayudan a reducir la grasa de la piel y el acné.
Personas con la piel envejecida. Otro efecto de la niacinamida es promover la producción de colágeno, disminuyendo las arrugas y aumentando la elasticidad de la piel. Además, su naturaleza antioxidante protege la piel del daño de los radicales libres y reparar los daños de la luz ultravioleta.
Personas con manchas en la piel. La niacinamida mejora la textura y reduce la hiperpigmentación de la piel.
Personas con tendencia a la irritación de la piel y pieles sensibles por su efecto calmante.
Incorpora la niacinamida en tu rutina de belleza facial
Por todo lo visto, es evidente que la incorporación de la niacinamida como principio activo en cosméticos puede ser beneficiosa para múltiples aspectos de la piel.
Por vía tópica, la niacinamida se aplica en la prevención y el tratamiento de diversas enfermedades cutáneas, como la dermatitis atópica, el acné o las hiperpigmentaciones. Destaca su efecto antioxidante, protege frente a la contaminación de la piel por medio de la polución, es útil frente a los signos del envejecimiento, mejora el tono de la piel y afina los poros.
En cualquier caso, no hay que olvidar que el aporte de nutrientes por medio de la dieta es esencial para mantener un buen estado de salud. Esto incluye el estado de la piel y su aspecto. De nada sirve aplicar un cosmético con niacinamida o cualquier otro componente activo si después la dieta muestra múltiples carencias y desequilibrios.
En algunos casos puede ser recomendable tomar un suplemento de vitaminas del grupo B para subsanar estos desequilibrios. Debe tenerse en cuenta que en estados de estrés se consume más vitaminas B con lo cual sería importante aumentar su aporte mientras duren estas situaciones.
De todos modos, una dieta rica en alimentos de origen vegetal con la inclusión de carnes y pescados asegurarán un aporte adecuado de vitamina B3.
Por otro lado, la aplicación tópica de nicotinamida aumentará en la piel todos sus beneficios.
Savia pone a tu disposición los mejores especialistas en medicina general para valorar tu salud y tus posibles estados carenciales.
Artículo especializado
Asfixia perinatal: ¿Qué la causa?
El aporte de oxígeno y nutrientes durante el embarazo es esencial para el correcto desarrollo del feto y para que el nacimiento tenga lugar de manera óptima. Las interrupciones o la disminución del aporte de oxígeno en momentos próximos al parto pueden dar lugar a complicaciones como la asfixia perinatal.
¿Qué es la asfixia perinatal?
La asfixia perinatal se produce cuando el feto experimenta una falta de oxígeno alrededor del momento del nacimiento. Esta condición puede provocar una hipoxemia o disminución de la cantidad de oxígeno en la sangre fetal, paralelamente a una hipercapnia o aumento del CO 2 con acidosis metabólica significativa.
Además de los daños cerebrales, que pueden conducir a una parálisis cerebral , la asfixia perinatal, para ser diagnosticada como tal, debe provocar una afectación hipóxico-isquémica de al menos otro órgano o sistema.
De este modo, los mecanismos que pueden provocar problemas en el feto son la hipoxemia y la isquemia o disminución de la perfusión de sangre necesaria para mantener la integridad funcional de los tejidos.
¿Qué causa la asfixia perinatal?
La insuficiencia placentaria suele ser la causa más habitual de la asfixia perinatal. Esta situación determina la dificultad para aportar el oxígeno y eliminar el dióxido de carbono de la sangre fetal. También se puede dar un problema en el feto a nivel respiratorio o cardiovascular.
Por otro lado, entre las patologías de la madre que pueden provocar la asfixia perinatal por medio de un aporte insuficiente de sangre y oxígeno a la placenta, se pueden incluir entre otras:
Hipertensión o diabetes pregestacional mal controladas.
Enfermedades pulmonares o cardíacas.
Hipertensión pulmonar.
Anemia.
Infecciones.
La asfixia perinatal también puede acontecer por causas de naturaleza exclusivamente fetal, incluyendo:
Anemia fetal.
Infecciones.
Hídrops.
Malformaciones y problemas cardíacos.
Finalmente, los eventos que pueden provocar una disminución de oxígeno en el feto alrededor del parto capaces de dañar a un feto neurológicamente intacto incluyen:
El desprendimiento prematuro de la placenta.
La ruptura uterina.
El prolapso de cordón umbilical.
El embolismo de líquido amniótico.
La exanguinación fetal por la existencia de vasa previa con vasos fetales desprotegidos.
La hemorragia feto-materna.
Síntomas de la asfixia perinatal
La manifestación de la asfixia perinatal se produce por medio de hipoxemia, hipercapnia y acidosis láctica por una perfusión tisular disminuida. Sin embargo, la identificación de la asfixia perinatal en ocasiones es complicada. Cuando tiene lugar, permitiendo actuar de manera precoz, existe la posibilidad de revertir la situación sin repercusiones para el feto y continuar con el parto de manera segura.
Los síntomas y signos que pueden aparecer dependerán del grado de asfixia que se haya dado en el feto:
En la asfixia perinatal leve el recién nacido puede presentar unos reflejos afectados, junto con anormalidades de comportamiento. Normalmente estos síntomas suelen desaparecer en 24 horas.
En la asfixia perinatal moderada pueden darse reflejos disminuidos, apnea y convulsiones. Se trata de síntomas que suelen remitir en las primeras dos semanas.
En la asfixia perinatal severa la encefalopatía hipóxico-isquémica grave puede determinar síntomas como respiración irregular, perturbación del movimiento ocular y estado de coma, entre otros.
Prevención y tratamiento de la asfixia perinatal
La prevención de la asfixia perinatal incluye todas las medidas de un buen cuidado prenatal y de atención del parto. Los antecedentes perinatales permiten identificar a gran parte de los niños que pueden nacer con asfixia. Algunas pruebas que pueden contribuir a identificar al feto con riesgo de asfixia incluyen la medición de la altura uterina, el análisis de líquido amniótico, los movimientos fetales disminuidos y la frecuencia cardíaca.
En caso de que la frecuencia cardíaca fetal se encuentre alterada intraparto se puede realizar una toma de sangre procedente del cuero cabelludo fetal y medir el pH, cantidad de oxígeno y C0 2 . De esta forma se puede tener una prueba directa de que está teniendo lugar sufrimiento e hipoxia fetal para poder proceder de forma inmediata a la extracción del recién nacido por la vía más rápida (cesárea o vía vaginal en función de la situación fetal en la pelvis materna).
Esto permite estar preparados para llevar a cabo una buena reanimación y a un eventual traslado del recién nacido a la Unidad de Cuidados Intensivos.
La asistencia en las primeras 6 horas de vida del recién nacido con asfixia perinatal es fundamental. Tras la estabilización inicial, se debe proceder a la monitorización de diversas funciones fisiológicas, incluyendo la frecuencia cardiaca, la tensión arterial, la función respiratoria y la temperatura.
Este último aspecto es de especial relevancia ya que, por cada incremento de 1°C en la temperatura del recién nacido, el riesgo de muerte o discapacidad neurológica aumenta de forma significativa. De este modo, el traslado del recién nacido a la unidad neonatal debe producirse con la cuna de transporte apagada, monitorizando durante las primeras horas la temperatura rectal con el objetivo de evitar la hipertermia. Por este motivo, una de las terapias que se emplean para los recién nacidos con hipoxemia severa es la hipotermia.
Por otro lado, cuando se ha producido una agresión hipóxico-isquémica, el cerebro es particularmente vulnerable a otros factores que pueden contribuir al daño del sistema nervioso central. Entre estos factores se encuentran la hipoglucemia, la hipocapnia y la hiper/hipoxia.
Finalmente, junto con la monitorización de las constantes vitales y de los factores comórbidos a través de la analítica, el aspecto clave consiste en establecer si el recién nacido con asfixia perinatal presenta o no encefalopatía aguda.

Artículo especializado
Distocia: tipos y diagnóstico
La distocia o parto distócico forma parte de las complicaciones que se pueden producir durante el alumbramiento. En este caso, relacionadas con la disposición del bebé y el canal y el trabajo de parto.
¿Qué es la distocia?
La distocia o distocias son anomalías en la progresión del trabajo de parto.
Estas anomalías en la progresión del parto suelen afectar a cerca del 20% de los nacimientos. El principal factor de riesgo para que se produzcan es que la mujer sea primípara.
La distocia fetal puede deberse a un tamaño anormalmente grande o una disposición o colocación especial dificultosa para el parto.
Cuando un parto se prolonga o queda detenido por causas como la distocia, una de las posibles soluciones es la práctica de una cesárea de urgencia.
Tipos de distocia
La distocia fetal tiene lugar cuando el feto es demasiado grande para el estrecho superior de la pelvis o su posición es anormal. De este modo, los tipos de distocia que se pueden presentar incluyen:
Desproporción feto-pelviana . Si el trabajo de parto presenta un progreso normal y el peso fetal es inferior a 5 kg, el parto puede continuar con seguridad. Si el progreso es más lento que el esperado en la segunda etapa del trabajo de parto, se debe determinar si se requiere un parto vaginal operatorio instrumental (con fórceps o extractor por vacío).
Presentación del feto con occipucio posterior . Se trata de la presentación anormal más común. El cuello fetal se presenta levemente flexionado, por lo que es mayor el diámetro de la cabeza que debe pasar por el canal de la pelvis. La mayoría de las presentaciones de occipucio posterior requieren un parto vaginal operatorio (instrumental) o una cesárea.
Presentación del feto de frente o de rostro . La cabeza aparece hiperextendida y la posición es designada por el mentón. Cuando el feto no flexiona el cuello y en lugar de presentar la parte posterior de la cabeza presenta la cara, el diámetro de la cabeza es mayor, por lo que el paso a través de la pelvis materna es más difícil. La mayor parte de los partos en presentación de cara pueden transcurrir por vía vaginal. Cuando la barbilla fetal se encuentra en disposición lateral o hacia abajo, la cabeza suele rotar hasta que la barbilla se coloca mirando hacia arriba. La barbilla se apoya en el pubis materno y flexiona, si esto no ocurre, la vía de parto sería una cesárea.
Presentación podálica o de nalgas . Se trata de la segunda presentación anormal más común. Dentro de esta se puede dar la presentación pelviana franca, con las caderas del feto flexionadas y las rodillas extendidas. En la presentación pelviana completa el feto parece estar sentado con las caderas y las rodillas flexionadas. Finalmente, se puede dar la presentación de uno o ambos pies. La presentación podálica puede ser problemática porque la parte de presentación es una mala cuña de dilatación y puede hacer que la cabeza quede atrapada durante el parto y comprima el cordón umbilical, causando hipoxemia fetal.
Distocia de hombros
Se trata de una condición infrecuente en la que el hombro fetal anterior queda atascado detrás de la sínfisis pubiana después de la salida de la cabeza, requiriendo maniobras obstétricas adicionales para producir la expulsión fetal tras la salida de la cabeza.
Los riesgos de lesiones del plexo braquial o fracturas óseas, así como la mortalidad neonatal aumentan. Para la madre, puede determinar la aparición de hemorragia posparto, lesiones perineales y del esfínter, separación de la sínfisis del pubis y neuropatía cutánea femoral lateral asociada con la hiperflexión de las piernas.
Los factores de riesgo para que se produzca la distocia de hombros incluyen:
Tamaño grande del feto.
Obesidad o diabetes materna.
Distocia de hombro en embarazos anteriores.
Trabajo de parto rápido o prolongado.
Una vez identificada la distocia de hombro deben ponerse en práctica varias maniobras para desencajar el hombro, incluyendo la hiperflexión de los muslos de la mujer, la compresión suprapúbica para rotar y desencajar el hombro y la introducción de una mano en la cara posterior de la vagina para flexionar el hombro fetal para rotar al feto en la dirección que resulte más sencilla. La última maniobra sería colocar a la madre en posición de cuadripedia (siempre y cuando las extremidades inferiores no se encuentren bajo los efectos de la anestesia epidural).
Cuando las maniobras resultan ineficaces, se revierten los movimientos del trabajo de parto, recolocando la cabeza en la vagina o el útero para proceder a una cesárea.
Causas de la distocia
Las principales causas de la aparición de distocia incluyen:
Disminución de la contractilidad del útero . Se trata de la causa principal de la prolongación o la detención del parto en la fase de dilatación.
Desproporción céfalo-pelviana . En este caso, existen dificultades para que la cabeza fetal atraviese la pelvis materna. Habitualmente, se asocian a una mala presentación de la cabeza fetal. También puede producirse por deformaciones en la pelvis materna.
Anillo de Bandl . Se produce una obstrucción debida a la formación de un anillo muscular grueso entre las partes superior e inferior del útero.
Obesidad materna . La obesidad de la madre se relaciona con duraciones más largas del periodo de dilatación.
Diagnóstico de la distocia
El diagnóstico de una distocia se lleva a cabo mediante el examen y la respuesta al trabajo de parto.
Para ello, la monitorización del parto se lleva a cabo mediante el registro cardiotocográfico, técnicas ecográficas y tacto vaginal.
La desproporción feto-pelviana se puede anticipar a partir de las estimaciones clínicas prenatales de las dimensiones pélvicas y la presencia de un trabajo de parto prolongado.
En cualquier caso, determinadas presentaciones anómalas del feto durante el parto son difíciles de diagnosticar hasta que la dilación no se ha completado.
Finalmente, el tratamiento o resolución de las distocias tiene como finalidad que el parto tenga lugar con el menor perjuicio posible tanto para el feto como para la madre. Principalmente, se utilizan maniobras físicas de reposicionamiento del feto, la elección de un parto vaginal operatorio instrumental o el parto por cesárea.
Artículo especializado
Tensión baja en el embarazo: síntomas y recomendaciones
Aunque son más comunes los casos de hipertensión, un síntoma también habitual que puede afectar a muchas mujeres durante el embarazo son las bajadas de tensión arterial. La hipotensión en el embarazo suele ser más común durante las primeras semanas, aunque los episodios pueden aparecer a lo largo de toda la gestación.
¿Por qué se producen bajadas de tensión en el embarazo?
La hipotensión se puede producir por diferentes causas. Cuando tiene lugar una bajada de tensión durante el embarazo, normalmente responde a la nueva condición fisiológica determinada por la gestación.
Debido a que la sangre debe abarcar un mayor recorrido −ahora circula también hacia el feto− el sistema circulatorio de la mujer se ve obligado a funcionar más deprisa para cubrir las necesidades del bebé. Y esto hace que la presión sanguínea baje. En cuanto esta situación se estabilice y se produzcan las adaptaciones necesarias, como la formación de una mayor cantidad de sangre, la hipotensión irá remitiendo.
Otra de las causas de la hipotensión durante el embarazo es la presión que ejerce el útero sobre la aorta y vena cava. En este sentido, las recomendaciones señalan que las mujeres embarazadas no deben dormir tumbadas boca arriba, sino recostadas sobre el lado izquierdo.
¿Qué provoca la hipotensión en el embarazo?
Es bastante habitual que las mujeres sufran bajadas de tensión en el embarazo. Especialmente durante las primeras semanas de gestación, la tensión baja puede producirse de forma puntual o prolongarse hasta el final del embarazo.
Son diversos los factores que favorecen la hipotensión en el embarazo. Como ya se ha dicho, el sistema circulatorio se amplía según se va desarrollando el feto, con lo que disminuye la presión que ejerce la sangre sobre las paredes de arterias y vasos sanguíneos.
Por otro lado, durante el embarazo se producen en el organismo de las mujeres el aumento de los niveles de determinadas hormonas con efectos vasodilatadores que también contribuyen a que la tensión arterial disminuya. La progesterona es una de ellas, especialmente, durante el primer trimestre del embarazo.
También pueden confluir ciertos factores ajenos al embarazo. Entre ellos destacan la tendencia de la mujer a padecer hipotensión o bajadas de tensión arterial (previas al embarazo). También la tendencia a padecer anemia.
De entrada, la tensión baja durante el embarazo no supone un riesgo relevante para el progreso del embarazo. Sin embargo, debe ser el médico el que determine el alcance de esta situación y el posible tratamiento para su resolución.
Síntomas de tensión baja en el embarazo
Los síntomas de tensión baja durante el embarazo no son muy específicos y pueden confundirse con síntomas debidos al propio embarazo o a otras patologías. Entre ellos, se incluyen:
Mareos y desmayos.
Sensación de cansancio y debilidad.
Somnolencia y dificultad de concentración.
Visión borrosa ocasional.
Tensión baja y pulsaciones altas en el embarazo
Cuando la tensión es baja, el corazón se activa para compensar esa situación y late a una mayor velocidad, por lo aumentan las pulsaciones.
Por otro lado, conforme avanza el embarazo, el organismo de la madre se va adaptando a la nueva situación. Entre estas adaptaciones se incluye la producción de más sangre. Este incremento del volumen sanguíneo contribuye a la aparición de ciertos síntomas habituales durante el embarazo, entre los que destacan el dolor de cabeza, la aparición de hemorroides, la retención de líquidos y la hinchazón de pies y manos, entre otros. También se puede producir un aumento de la frecuencia cardíaca de la madre, lo que se puede traducir en la aparición de palpitaciones y taquicardias.
Recomendaciones en caso de tensión baja
Cuando se dan situaciones de hipotensión durante el embarazo se pueden llevar a cabo algunas acciones sencillas para intentar contrarrestar sus efectos. Algunas de ellas incluyen:
Levantarse con precaución y de forma lenta, evitando la hipotensión ortostática que se puede producir al ponerse de pie o al incorporarse de la cama.
Mantener una alimentación saludable rica en alimentos vegetales, frutas y verduras, junto con una correcta hidratación. Esta última aumenta el volumen de la sangre disminuyendo el riesgo de hipotensión.
Realizar comidas de forma frecuente que no sean muy abundantes.
La práctica de ejercicio físico acorde a las circunstancias individuales y al momento del embarazo favorece la circulación y al correcto funcionamiento del sistema cardiovascular.
Prestar especial atención a los posibles desmayos para que no se produzcan problemas por los golpes y caídas.
No tomar ningún medicamento, excepto si ha sido prescrito por el médico.
Otras recomendaciones incluyen el empleo de medias de compresión y la aplicación de agua fría en las extremidades inferiores.
Para valorar los problemas de tensión arterial Savia pone a tu disposición a los mejores especialistas en cardiología .

Artículo especializado
Estreñimiento en el embarazo: cómo solucionarlo
Una de cada tres mujeres sufre estreñimiento −o constipación− durante el embarazo. Se trata de una situación “normal”, con unas bases fisiológicas que lo justifican.
Sólo en el 10% de los casos se dan determinadas circunstancias que adquieren una relevancia suficiente que requiere de un tratamiento más consistente. Se incluyen aquí los casos en los que están presentes hemorroides, fístulas o desgarros, o cuando los días sin defecar son muy numerosos.
Causas del estreñimiento en el embarazo
Durante el proceso del embarazo se dan una serie de factores que promueven la aparición del estreñimiento.
Puede estar relacionado con una disminución en la velocidad de tránsito a lo largo del tracto gastrointestinal, debido a una reducción de la motilidad, lo que puede determinar una mayor absorción de líquidos y electrolitos.
Estas modificaciones vienen dadas, principalmente, por los cambios hormonales que tienen lugar durante el embarazo. En este sentido, el aumento de los niveles de progesterona podría causar alteraciones en la motilidad intestinal provocando la debilidad de la fuerza propulsora de las heces. Por otro lado, la disminución en los niveles de otra hormona, la motilina, hace disminuir el movimiento del estómago y del intestino.
Otros factores que pueden contribuir a la aparición de constipación durante el embarazo incluyen:
La disminución de la ingesta de fibra en la dieta.
La utilización de suplementos de hierro.
Una disminución en la ingesta de líquidos.
El aumento del estrés típico del embarazo.
La aparición de hemorroides.
El aumento de tamaño del útero.
Síntomas de estreñimiento en el embarazo
Los síntomas de estreñimiento aparecen en 1/3 de las embarazadas. Suele ser más común en mujeres que ya han dado a luz alguna vez más que en primíparas.
Dentro de los síntomas que definen el diagnóstico del estreñimiento (presencia de 2 o más síntomas, en los últimos 6 meses) se encuentran:
Menos de 3 defecaciones por semana.
Esfuerzo en más del 25% de las defecaciones.
Utilización de maniobras manuales (digitación) en más del 25% de las defecaciones.
Sensación de evacuación incompleta en más del 25% de las defecaciones.
Sensación de obstrucción o bloqueo ano‐rectal en más del 25% de las defecaciones.
No presentar deposiciones blandas o líquidas.
No cumplir con criterios de síndrome de intestino irritable.
Cómo solucionar o aliviar el estreñimiento en embarazadas
El estreñimiento se suele considerar una situación normal e inherente al embarazo. De este modo, no se trata de una patología, sino de una consecuencia de los cambios fisiológicos que conlleva el embarazo. En ocasiones se trata, simplemente, de unos hábitos higiénico‐dietéticos inadecuados.
En cualquier caso, el tratamiento debe ser lo más natural posible, utilizando los fármacos para los casos en los que realmente sean necesarios.
Muchas veces suele ser suficiente con una alimentación correcta con un aporte adecuado de fibra y una ingesta de líquidos suficiente. La ingesta de líquidos debe realizarse mayoritariamente durante las comidas, fuera de ellas no tiene tanto efecto.
Además, también es importante mantener unos hábitos saludables, incluyendo el desempeño de actividad física regular, como caminar.
Tratamiento farmacológico
Dentro de los tratamientos farmacológicos para el estreñimiento durante el embarazo se incluyen:
Laxantes incrementadores de volumen.
Laxantes osmóticos.
Laxantes emolientes o surfactantes.
Laxantes estimulantes.
Enemas y lavados retrógados.
Siempre debe ser el especialista en ginecología el encargado en indicar el tratamiento más adecuado en cada caso.
Hábitos importantes para el estreñimiento en el embarazo
Durante el embarazo son habituales las situaciones tanto de diarrea como de estreñimiento. Para solucionarlas, se deben poner en marcha medidas generales como los cambios dietéticos.
Recomendaciones generales para evitar el estreñimiento durante el embarazo
La mayoría de las recomendaciones para evitar el estreñimiento en mujeres embarazadas son las mismas que para la población general, incluyendo:
Una ingesta de agua y líquidos suficiente (8 vasos al día, principalmente agua).
Un consumo fibra de 20‐35 g/día, a través de una dieta rica en alimentos de origen vegetal (verduras, frutas, legumbres, frutos secos, etc.).
Actividad física regular (caminar, natación, bicicleta fija, yoga, etc.).
Unos correctos hábitos intestinales. Destinar el tiempo necesario para defecar, intentando evacuar al levantarse o después de las comidas (aprovechando el reflejo gastro‐cólico). Defecar en cuanto aparece la necesidad y no posponerlo. Una maniobra que puede ayudar a la defecación es la elevación de los pies sobre un altillo o escalón mientras se está sentado en el inodoro. Dicha maniobra corrige el ángulo rectal y favorece el paso del bolo fecal.
Artículo especializado
Triple screening: ¿En qué consiste?
A lo largo del embarazo son muchas las pruebas médicas que se deben llevar a cabo para controlar que el desarrollo del feto y el estado de salud de la madre y el bebé sean óptimos. Entre ellas, las pruebas de screening o cribado sirven para valorar el riesgo de que exista un trastorno o patología en todas las mujeres embarazadas. Un ejemplo es la prueba del triple screening.
¿Qué es el triple screening?
El triple screening o cribado combinado del primer trimestre forma parte de las pruebas médicas que se llevan a cabo durante el embarazo y consiste en la estimación del riesgo de padecer tres síndromes causados por anomalías cromosómicas (síndrome de Down, Edwards y Patau). Para ello se llevan a cabo dos técnicas no invasivas: una extracción de sangre materna y una ecografía.
La estimación del riesgo se calcula a partir de la combinación de diferentes parámetros obtenidos con las pruebas anteriores: los niveles sanguíneos de determinadas hormonas, junto con determinados marcadores ecográficos, además de la edad de la madre.
Cuando el resultado de las pruebas determina un riesgo elevado, se debe proceder con otro tipo de pruebas. De este modo, para poder establecer un diagnóstico prenatal inequívoco de la presencia de anomalías genéticas, se requiere la obtención de material biológico del feto mediante técnicas invasivas como la amniocentesis o la biopsia corial . Al contrario que las pruebas de screening no invasivas, las pruebas diagnósticas conllevan cierto riesgo de pérdida gestacional.
Por otro lado, cuando el riesgo del triple screening es intermedio, se puede realizar una prueba no invasiva para el feto que consiste en el análisis de su ADN en sangre materna . Con esta técnica, se analizan los cromosomas responsables de los síndromes de Down, de Edwards y de Patau, además de los cromosomas sexuales.
¿Qué detecta el triple screening?
La prueba del triple screening del primer trimestre permite hacer una estimación del riesgo de que el feto esté afectado por 3 síndromes cromosómicos o trisomías:
Síndrome de Down (trisomía 21).
Síndrome de Edwards (trisomía 18).
Síndrome de Patau (trisomía 13).
Este riesgo se calcula en función de la edad materna, los marcadores ecográficos y los niveles bioquímicos en sangre materna en el primer trimestre.
¿En qué consiste el triple screening?
Además de la edad de la madre, el triple screening incluye diversas pruebas:
Análisis de sangre . La extracción de sangre se realiza en el tercer mes de embarazo, generalmente entre las semanas 9 y 11. Principalmente, se utiliza para valorar dos marcadores bioquímicos presentes en la sangre materna: una fracción de la hormona del embarazo (beta-hCG libre) y los valores de la proteína placentaria asociada al embarazo (PAPP-A).
Ecografía fetal . La ecografía se debe realizar entre las semanas 11 y 14 de gestación. En ella se lleva a cabo un estudio anatómico del feto y se procede a datar con exactitud la gestación midiendo la longitud céfalo-nalga fetal. En cuanto al marcador ecográfico por excelencia relacionado con las trisomías 21, 18 y 13, se trata de la traslucencia nucal . Éste es un espacio situado en la parte posterior de la cabeza del feto, en proximidad al cuello. En caso de síndrome de Down suele haber una mayor cantidad de fluido en ese espacio. Además, las malformaciones cardíacas también pueden dar aumento de acúmulo de líquido en la región nucal del feto.
Cómo interpretar los resultados del triple screening
La estimación del riesgo de los síndromes cromosómicos en el feto (trisomias 21, 18 y 13) se lleva a cabo gracias a un software de cálculo de riesgo que tiene en cuenta, en primer lugar, el riesgo inherente de la edad materna, junto con el resto de parámetros. De este modo, se incluyen en el programa informático los diferentes valores:
Longitud céfalo-nalga del feto.
Traslucencia nucal.
La analítica materna. Se lleva a cabo una ponderación de los valores bioquímicos en función del peso materno, la etnia o la concurrencia de patologías como la diabetes mellitus.
Cuando se trata de una gestación gemelar bicorial (cada feto tiene su placenta) las estimaciones de riesgo son independientes para cada feto. En caso de gestación gemelar monocorial, se lleva a cabo una única estimación de riesgo calculado a partir de la media de la traslucencia nucal de cada feto.
El resultado final de la prueba se interpreta como de alto riesgo o como gestación de alto riesgo cuando este es superior a 1/250 para los tres síndromes analizados (trisomía 21, 18 o 13).
Cuando el resultado de la prueba es de alto riesgo, se ofrecerá la opción a los padres de llevar a cabo una prueba diagnóstica.
En cualquier caso, una prueba diagnóstica que permita la confirmación o exclusión con certeza de una anomalía genética pasa ineludiblemente por llevar a cabo una técnica invasiva que permita la obtención de material biológico sobre el que realizar el estudio genético. Las técnicas invasivas más empleadas son la biopsia corial y la amniocentesis .
La elección del procedimiento técnico a realizar debe hacerse en función de las características de cada caso y dependerá, especialmente, de la edad gestacional en la que se realice la prueba invasiva.
Artículo especializado
Foliculitis: qué la causa y mejor tratamiento
La piel es la primera barrera del organismo frente a los agentes externos y las infecciones cutáneas, uno de los motivos más frecuentes de consulta dermatológica. Los principales factores de riesgo son el deterioro de la integridad de la piel, la falta de higiene, la humedad y las inmunodeficiencias.
¿Qué es la foliculitis?
La foliculitis es una afección cutánea caracterizada por la inflamación de los folículos pilosos. Se trata de una afección frecuente que suele estar causada por una infección bacteriana. En ocasiones, también puede estar causada por hongos y virus.
En primera instancia se manifiestan como pequeños bultos rojos o espinillas alrededor de los folículos pilosos.
En el peor de los casos, la infección puede propagarse y dar lugar a la aparición de úlceras. Las infecciones más graves también pueden causar la pérdida permanente del cabello y la aparición de cicatrices.
Los síntomas que suelen acompañar a la foliculitis incluyen:
Aparición de pequeños bultos rojos o espinillas con la cabeza blanquecina en los folículos pilosos.
Formación de ampollas con pus.
Picor.
Dolor y sensibilidad en la piel.
¿Qué causa la foliculitis?
El principal agente causante de las infecciones de los folículos pilosos es Staphyilococcus aureus , aunque también pueden producirse por Streptococcus pyogenes , Pseudomonas aeruginosa y Klebsiella spp ., entre otros.
Existen varios factores predisponentes entre los que se encuentran diferentes patologías:
Obesidad
Diabetes mellitus.
Sudoración abundante o hiperhidrosis.
Alteraciones de la inmunidad.
Dermatitis atópica.
Depilación y afeitado.
La humedad y la oclusión.
Las dermatosis previas.
Clínicamente se trata de lesiones entorno a pelos situados en la cara, el cuello, las axilas o los glúteos. Su evolución puede pasar por diferentes estadios:
Foliculitis . Pápula-vesícula con base eritematosa que afecta al folículo piloso superficial.
Forúnculo . Nódulos eritematosos pustulosos dolorosos que se extienden a la dermis profunda.
Ántrax . Placas eritematosas calientes y dolorosas que afectan al tejido celular subcutáneo circundante.
El diagnóstico es clínico. Se recomienda el estudio microbiológico cuando las lesiones presentan una mala evolución o son atípicas.
La evolución de las infecciones bacterianas depende de varios factores:
La patogenicidad de la bacteria.
La existencia de una puerta de acceso para el microorganismo.
La capacidad defensiva del huésped contra la invasión bacteriana.
Un hecho importante y que hay que tener en cuenta es la existencia de portadores sanos de estafilococos. La localización más habitual son las fosas nasales y existe un riesgo de autoinoculación y la posibilidad de infección a otros individuos del entorno que sean susceptibles.
Tipos de foliculitis
Las infecciones del folículo pilosos o pilosebáceo se pueden clasificar en:
Foliculitis por cocos grampositivos (estafilococos y estreptococos).
Foliculitis superficial .
Foliculitis profundas . Incluyen las sicosis estafilocócicas, forúnculos, ántrax, orzuelos y seudofoliculitis de la barba.
Foliculitis por Pseudomonas aeruginosa .
Foliculitis por otros bacilos gramnegativos .
Foliculitis por hongos
Foliculitis superficial
En la foliculitis superficial la presentación clínica es en forma de pápulas eritematosas perifoliculares, sobre las que se desarrollan pústulas blanco-amarillentas, centradas por un pelo y rodeadas por un halo inflamatorio.
Al desecarse la pústula se forma una costra que al desprenderse no deja cicatriz. Se observa, con mayor frecuencia, en la cara, cuero cabelludo, extremidades y axilas.
Foliculitis profundas
En este tipo de foliculitis se ve afectado el folículo en su profundidad. Incluye las siguientes entidades:
Sicosis de la barba . Se inicia como una foliculitis superficial en el área de la barba y zonas adyacentes del cuello, que se extiende con el afeitado. La localización más habitual es el labio superior y el mentón.
Forúnculo . Se produce una inflamación folicular con perifoliculitis, más frecuente en zonas de piel hirsuta de individuos predispuestos. Se manifiesta con uno o más nódulos eritematosos, calientes, dolorosos, de hasta 1 o 2 cm de diámetro centrados por una pústula o zona necrótica. Puede haber fiebre y alteración del estado general.
Ántrax . Se forma como resultado de la fusión de varios forúnculos. Se manifiesta en forma de un nódulo o placa inflamatoria, que contiene diferentes folículos, a través de los cuales se libera pus al comprimirlo. La afectación sistémica es habitual, así como la asociación a enfermedades subyacentes. Suelen dejar una cicatriz violácea. Se trata de una infección grave, que sin tratamiento ocasiona una elevada mortalidad y deja cicatrices importantes.
Orzuelo . Es una foliculitis de las pestañas, con perifoliculitis producida por S. aureus. Se manifiesta como una lesión única, nodular, inflamatoria, con edema palpebral y una pústula en su superficie. Habitualmente se curan de forma espontánea, aunque mejoran con mayor rapidez con calor local y la aplicación de antibióticos tópicos.
Tratamiento de la foliculitis
En la foliculitis superficial el tratamiento se llevará a cabo con jabones que respeten el pH ácido de la piel, antisépticos locales como la clorhexidina y antibióticos tópicos como la mupirocina, eritromicina, clindamicina o ácido fusídico. En los casos muy extensos o cuando el tratamiento tópico no resuelva el cuadro, se puede recurrir a un tratamiento antibiótico oral con amoxicilina-ácido clavulánico, clindamicina, levofloxacino, cefalexina o cefuroxima.
Es recomendable llevar a cabo un cultivo con antibiograma para indagar sobre las resistencias específicas de los microorganismos causantes a los antibióticos.
El tratamiento de las foliculitis profundas incluye la evitación del afeitado o la depilación de las zonas afectadas y la aplicación de antisépticos, mupirocina y antibióticos sistémicos.
En los forúnculos el tratamiento tópico suele ser suficiente. Pueden aplicarse fomentos con soluciones antisépticas o cremas antibióticas con ácido fusídico, mupirocina o gentamicina.
En el ántrax, a diferencia de los forúnculos, siempre se requiere un tratamiento antibiótico sistémico e inmediato, asociado al drenaje quirúrgico de la lesión.

Artículo especializado
Erisipela: síntomas y causas
La erisipela forma parte de las infecciones y enfermedades de afectación dérmica que pueden ser causadas por bacterias. Estas son capaces de sortear la barrera de la piel accediendo a través de heridas o erosiones cutáneas y provocar así la infección.
¿Qué es la erisipela?
La erisipela es una infección bacteriana de la piel causada principalmente por bacterias de la especie Streptococcus pyogenes y en menor medida por Staphylococcus aureus .
Se caracteriza por la presencia de signos de inflamación aguda en la piel, además de:
Eritema.
Edema.
Calor.
Dolor localizado.
A menudo, se asocia a síntomas sistémicos de fiebre, malestar y escalofríos.
La infección afecta de forma difusa a la dermis y a la parte superficial del tejido celular subcutáneo. Su localización preferente incluye las piernas, el área del centro de la cara y las orejas.
Puede afectar a pacientes de cualquier edad, pero es más frecuente en niños menores de 3 años y personas mayores de sesenta años. En cuanto a la distribución por sexos, en general predomina en mujeres, aunque cuando afecta a edades tempranas suele ser más común en varones.
¿Es contagiosa la erisipela?
La erisipela no es una enfermedad contagiosa convencional, por lo que no se transmite por contagio de persona a persona. Tiene lugar cuando las bacterias que colonizan el cuerpo sin causar problemas penetran a través de la piel por alguna entrada atípica, como una herida, una picadura de insecto, una úlcera venosa crónica o cualquier otra irregularidad que se haya producido en la piel.
¿Qué tratamientos hay para la erisipela?
El diagnóstico de la enfermedad se produce tras la evaluación clínica y la observación de las lesiones de la piel, junto con un cultivo de la lesión para poder identificar los microorganismos causantes de la infección.
En cuanto al tratamiento, la erisipela no complicada puede ser un proceso autolimitado que se resuelva sin tratamiento farmacológico entre siete y diez días. Sin embargo, cuando no se establece ningún tratamiento y evoluciona hasta la celulitis, puede dar lugar a una bacteriemia con diseminación a distintos órganos o complicaciones locales, incluyendo los abscesos, la tromboflebitis o la fascitis necrotizante.
De este modo, el tratamiento antibiótico precoz puede contribuir a la prevención de las complicaciones y produce mejoría del estado general en las primeras 24-48 horas. La mejora de las lesiones cutáneas se produce de forma más tardía.
Tratamiento local
La inmovilización y elevación de la zona afectada por la infección (especialmente cuando la zona afectada está en las piernas) disminuye el edema y la hinchazón localizada. Las compresas frías de suero salino fisiológico estéril pueden mejoran el dolor local y tienen un efecto astringente cuando se han producido ampollas. En la mayoría de los casos no complicados es suficiente el tratamiento antibiótico tópico con mupirocina.
Terapia antibiótica sistémica
Es recomendable la instauración de un tratamiento antibiótico inicial que puede ser modificado posteriormente según la evolución de la infección y siempre teniendo en cuenta los resultados del estudio microbiológico. El antibiótico utilizado suele ser penicilina, amoxicilina, ácido clavulánico, azitromicina o clindamicina.
En los casos graves puede ser necesaria la administración de los antibióticos por vía endovenosa, para una actuación más rápida y eficaz.
Con tratamiento adecuado el pronóstico es bueno, siendo raro que las bacterias pasen a la sangre (bacteriemia) y puedan afectar a otros órganos, como las articulaciones, los huesos o las válvulas del corazón. Sin embargo, en casos excepcionales, especialmente en personas con algún grado de inmunodepresión, niños pequeños y personas de edad avanzada la erisipela puede seguir un curso fatal a pesar de la terapia.
Causas y prevención de la erisipela
Las bacterias causantes de la erisipela, como el Staphylococcus aureus pueden estar presentes en las vías respiratorias altas de muchas personas sanas de forma asintomática, especialmente en niños. Suele ser común que en estos pacientes el microorganismo acceda de forma inadvertida a través de cualquier pequeña herida de la piel causando la infección.
En condiciones normales, la piel proporciona la protección adecuada frente a la entrada de bacterias. Cuando se produce una pérdida de la integridad de la epidermis, por una herida o por causa de una dermatosis previa que curse con una erosión cutánea, se puede facilitar el acceso a microorganismos causantes de infecciones. Un ejemplo de ello lo constituyen la tiña con afectación interdigital de los pies, que proporciona una vía de entrada para la erisipela de las piernas o la onicomicosis , la infección por hongos de las uñas que puede facilitar la entrada del agente causante de la erisipela.
En cuanto a los factores de riesgo para la aparición de erisipela, se pueden incluir:
La presencia de linfedema crónico.
Adicción a drogas por vía parenteral.
Alcoholismo.
Diabetes mellitus.
Cirrosis hepática.
Malnutrición.
Neutropenia.
Insuficiencia renal.
Síndromes y estados de inmunodeficiencia.
De este modo, la prevención de la erisipela debe contemplar todos los factores de riesgo. El pie de atleta o las llagas y heridas en las piernas deben ser tratadas para evitar que se conviertan en la puerta de entrada de la infección bacteriana.
Mantener un tratamiento adecuado en caso de diabetes y otras patologías como el alcoholismo es un factor a considerar para la prevención de la erisipela.
También puede ser recomendable extremar los hábitos higiénicos, manteniendo la piel limpia, seca e hidratada.
Artículo especializado
Prurito del nadador: ¿Qué es?
Dentro de las dermatitis que pueden ser provocadas por parásitos se incluye el prurito del nadador, que se produce al contactar en el agua con larvas vivas de un tipo de gusano plano.
¿Qué es el prurito del nadador?
El prurito del nadador −o picazón del nadador, dermatitis cercarial o esquistosómica− es una reacción alérgica de la piel a las cercarias, larvas de un parásito presente en las aves acuáticas.
Puede presentarse después de ir a nadar y es más frecuente en lagos y estanques de agua dulce, aunque también se puede producir en agua salada.
¿Qué causa el prurito del nadador?
Los parásitos responsables de la reacción alérgica, los esquistosomas, están muy difundidos en las aves acuáticas de todo el mundo, por lo que los casos de prurito del nadador se pueden dar de forma global en cualquier región geográfica.
Las cercarias son larvas de diferentes platelmintos, los esquistosomas se encuentran en la sangre de las aves.
El parásito se desarrolla en ambientes acuáticos en los que están presentes ciertas especies de caracoles que actúan como huéspedes intermediarios. Los huéspedes definitivos están constituidos por aves acuáticas (gansos, patos y gaviotas, entre otros) y pequeños mamíferos (como castores y ratas de campo).
Las larvas del parásito llegan al agua a partir de los excrementos de los huéspedes. Los seres humanos son contagiados accidentalmente por la cercaria, ya que no forman parte de su ciclo vital.
El parásito presente en el agua es atraído por la temperatura corporal humana y, aunque puede penetrar en la piel, acaba muriendo. Al mismo tiempo se genera la reacción alérgica que da lugar al prurito del nadador.
El prurito del nadador no es contagioso entre personas.
Síntomas y tratamiento del prurito del nadador
El prurito del nadador es una alergia, por lo que existe una fase inicial en la que se entra en contacto con el parásito y se produce la sensibilización que dará lugar a la reacción en posteriores contactos.
En los contactos con el parásito posteriores a la sensibilización aparecerá la dermatitis, cuyo síntoma principal es el picor o prurito en la piel . Este puede variar en su intensidad y aumenta con exposiciones posteriores.
El prurito del nadador produce una serie de manifestaciones que aparecen paulatinamente en el tiempo:
Cuando se produce el contacto con el parásito, aparece el picor, que también puede ir acompañado de hormigueo y quemazón.
Posteriormente puede aparecer en el lugar de contacto una mancha de 1 o 2 milímetros.
Transcurridas unas 10-15 horas tiene lugar una erupción cutánea con ronchas y pápulas rojizas.
Cuando ha transcurrido una semana desde el contacto desaparecen las pápulas, quedando una pequeña marca roja.
El rascado hace que se incrementen los síntomas. Cuando esto sucede, se libera más histamina, con lo que crece el picor. Además, las lesiones pueden empeorar cuando se produce una infección por bacterias.
Factores de riesgo y prevención del prurito del nadador
Parece ser que la liberación de cercarias es mayor por la mañana y en zonas donde las temperaturas son cálidas. De este modo, los casos de prurito del nadador suelen darse en la época estival y más comúnmente en regiones meridionales.
Cuanto mayor sea el tiempo de exposición en aguas infestada con la cercaria, mayor será el riesgo de contraer el prurito del nadador.
Algunas personas son más sensibles al prurito del nadador que otras, y este suele afectar con mayor frecuencia a los niños, ya que suelen permanecer más tiempo en las aguas poco profundas cerca de donde se encuentran los caracoles que actúan como huéspedes intermediarios.
No es común que se produzcan complicaciones en el prurito del nadador. En el caso de que el picor obligue al afectado a un rascado intenso, se pueden producir sobreinfecciones bacterianas en la zona de piel afectada.
La prevención del prurito del nadador debe contemplar algunas recomendaciones simples:
Elegir los lugares para el baño que presenten las condiciones higiénicas adecuadas. Esto incluye evitar el baño en playas, embalses o ríos contaminados y en zonas pantanosas donde suela haber caracoles. Nadar en zonas donde el agua tenga mayor profundidad.
Si existen instalaciones para ello, ducharse después de salir del agua en playas y embalses y secarse bien con la toalla.
No dar de comer a las aves en zonas de playa o de baño.
El protector solar resistente al agua podría tener un efecto protector frente al parásito.
Tratamiento del prurito del nadador
El prurito del nadador no suele tener complicaciones y desaparece por sí solo en una semana. De este modo, se pueden emplear antihistamínicos para controlar el picor y cremas calmantes de la piel.
En cualquier caso, el Dermatólogo establecerá el tratamiento más adecuado en cada caso.
 Savia
Savia