Artículos Especializados

Artículo especializado
Para Qué Sirve la Citología
Actualmente, hay varias pruebas sencillas que pueden detectar precozmente el cáncer . Entre ellas, la citología, también conocida como prueba de Papanicolau , es la técnica más utilizada para la detección precoz de cáncer de cuello uterino. Es sencilla, barata, poco invasiva y permite analizar las células del cuello del útero (cérvix).
El cáncer de cuello del útero es la tercera neoplasia más frecuente en las mujeres. El cribado universal de las mujeres sanas mediante la citología cervical ha demostrado ampliamente su eficacia, ya que, desde su aplicación, se ha conseguido reducir en un 70-80% la incidencia y mortalidad por cáncer de cuello del útero. Además, la detección de lesiones precancerosas evita un tratamiento muy eficaz y evita la progresión a un carcinoma invasor.
¿En qué consiste?
Esta prueba la realiza el ginecólogo en su consulta, no hace falta que la paciente esté ingresada, porque es un procedimiento muy sencillo que apenas requiere de unos minutos. En posición ginecológica, el médico introduce en la vagina un espéculo que permite abrir la cavidad vaginal y visualizar completamente el cérvix. Las molestias son mínimas o nulas, sobre todo en manos expertas y si la mujer está tranquila y relajada. Se recogen tres tomas: del interior del cuello, del exterior del cuello, y del fondo de la vagina.
Las pequeñas muestras de tejido del cuello del útero son analizadas en el laboratorio, con el fin de detectar la presencia de células anormales o cancerosas .
Por lo tanto, es ideal para diagnosticar a tiempo anomalías en las células o paredes del cuello del útero. Si se detecta el cáncer de cuello uterino en etapas tempranas, permite realizar un tratamiento precoz y eficaz.
La entrega del resultado puede tardar entre tres y ocho días, cuando el resultado requiere de una segunda lectura, la entrega puede tardar hasta dos semanas.
Cómo prepararme para la prueba de Papanicolau
Se recomienda no tener relaciones sexuales 48 horas previas a la toma, que la menstruación haya finalizado entre cuatro o cinco días antes, no realizarse lavados vaginales ni utilizar tratamientos tópicos en la última semana antes de la prueba (óvulos, espermicidas o cremas vaginales).
¿Para qué sirve?
Se utiliza como detección precoz para el diagnóstico del cáncer de cuello del útero en fases incipientes. Es la forma más efectiva de detectar el Virus del Papiloma Humano (VPH), principal causante del cáncer del cuello uterino. Hay que saber que, en sí misma no es una prueba diagnóstica. Cuando los resultados son positivos o se observan células anormales, se debe realizar una biopsia para confirmar la existencia o no de un cáncer de cuello de útero.
Esta prueba es específica para el cáncer del cuello del útero y no puede diagnosticar otros cánceres ginecológicos. También puede ser de utilidad para diagnósticas la existencia de infecciones vaginales.
¿Cada cuánto debo realizarme una citología?
Durante los primeros años de vida sexual se observa una elevada incidencia de infección por el VPH ( Virus del Papiloma Humano) , pero la mayoría de estas infecciones son transitorias y desaparecen solas. Las mujeres mayores de 30 años experimentan una clara disminución de la prevalencia de la infección por VPH, pero las infecciones suelen ser más persistentes y no desaparecen con tanta espontaneidad, lo que explica el mayor riesgo e incidencia de lesiones precursoras de cáncer a partir de esta edad.
Todas las mujeres sexualmente activas o mayores de 21 años, aunque no tengan relaciones sexuales , deberían hacerse la citología, pero las diferentes asociaciones médicas no se ponen de acuerdo al 100%. En España, cada sociedad médica propone una periodicidad distinta:
Según el PAPPS (Programa de Actividades Preventivas y de Promoción de la salud) de la SEMFYC (Sociedad Española de Medicina Familiar y Comunitaria): se debe realizar entre los 35-65 años. Primero una prueba anual, luego cada dos años y, finalmente, cada cinco.
Según la SEGO (Sociedad Española de Ginecología y Obstetricia): la primera citología se debería hacer a los 25 años y se repetirá cada 3-5 años hasta los 65 años.
Se debe aplicar el cribado a todas las mujeres que han iniciado su actividad sexual y tienen entre los 25 y 65 años . En los protocolos de cribado puede realizarse la citología junto o no a un test de detección del VPH (Virus del Papiloma Humano). Ampliamos aquí las recomendaciones de la SEGO:
Mujeres menores de 25 años: no es necesario hacer la citología.
Mujeres entre los 25-30 años: se recomienda realizar la prueba de Papanicolau cada tres años.
Mujeres entre los 30 y 65 años: se recomienda realizar la prueba de Papanicolau cada cinco años.
Mujeres mayores de 65 años: s e finalizará el cribado siempre que se cumpla un cribado previo adecuado y negativo.
En mujeres inmunodeprimidas, donde el VPH (Virus del Papiloma Humano) puede infectarlas de manera más agresiva, deben realizarse una citología anual a partir de los 21 años y un test del VPH más citología a partir de los 30 años.

Artículo especializado
Por Qué los Hombres Temen a la Vasectomía
Los hombres tienen serias dudas antes de someterse a la vasectomía, y es normal, dado que se trata de una intervención quirúrgica y una decisión en principio irreversible. Sin embargo, a lgunas de las dudas ante esta intervención pueden ser infundadas . Vamos a tratar de disiparlas.
En qué consiste
Existen diferentes métodos anticonceptivos que permiten disfrutar del placer que se obtiene cuando se mantienen relaciones sexuales sin tener que preocuparse por el riesgo de un embarazo no deseado. Son diversas las opciones de las que se disponen para evitar el embarazo, como los métodos barrera (preservativo, DIU, diafragma), los anticonceptivos orales y los quirúrgicos, que son los más definitivos. Estos métodos son la ligadura de trompas en el caso de la mujer y la vasectomía en el caso del hombre.
El método quirúrgico anticonceptivo masculino por excelencia es la vasectomía. Esta intervención quirúrgica consiste en cortar y sellar los conductos deferentes del hombre. El hombre tiene dos conductos deferentes, uno para cada testículo, y estos tubos son los encargados de transportar los espermatozoides desde los testículos hasta los conductos de la eyaculación.
Intervención sencilla y rápida
La intervención quirúrgica es muy sencilla y se lleva a cabo de manera ambulatoria bajo anestesia local. La intervención suele durar una media hora, si no se produce ninguna complicación. La técnica consiste en realizar una única incisión, muy pequeña, en la zona central del escroto, la bolsa de piel donde están alojados los testículos. A través de esta mínima abertura se accede al conducto deferente de cada lado. Cuando se ha localizado se secciona el conducto, se atan los extremos y se sellan mediante el bisturí eléctrico. De esta manera se bloquea el paso de los espermatozoides, que se producirán en los testículos pero que no llegaran a los conductos eyaculadores porque se habrá cerrado el paso.
Qué pasa después…
El postoperatorio es muy rápido, cuestión de horas, y los pacientes se van de alta el mismo día de la intervención . Se colocan unas gasas sobre la herida y se aconseja llevar un suspensorio o un calzoncillo ajustado para que haga compresión y evitar que se produzca un hematoma. Los hematomas son las complicaciones más habituales de esta intervención, dado que la piel del escroto es muy laxa y apenas hay musculatura que haga compresión para contener el hematoma si se produce. En general, los hematomas se reabsorben por sí mismos y con compresión y analgesia es suficiente.
Es importante para el éxito de la vasectomía que, tras la intervención, se tengan varias eyaculaciones para vaciar el contenido de espermatozoides remanentes que ya estén en los conductos eyaculadores. Durante dos meses todavía se deberán emplear otros métodos anticonceptivos para evitar el embarazo. Tras estos dos meses se realizará un seminograma (prueba para evaluar la calidad del semen) para asegurarnos del éxito de la intervención quirúrgica. En el seminograma el recuento de los espermatozoides en el eyaculado debe ser de cero.
Desterrar ideas falsas
La vasectomía en ningún momento afecta a la eyaculación , es decir, tras la intervención quirúrgica la persona intervenida seguirá teniendo eyaculado cuando mantenga relaciones sexuales o se masturbe. El principal componente líquido del esperma procede las secreciones de la próstata y las vesículas seminales. Es decir, en la eyaculación habrá esperma, pero en ningún momento habrá espermatozoides pues habremos cortado el acceso de estas células al semen.
La vasectomía tampoco afecta a los niveles de testosterona , que está producida por las células de Leydig ubicadas en los testículos y esta producción hormonal se vierte en la sangre, no en el esperma, de manera que los niveles de hormonas sexuales no disminuyen. Para que esto ocurriese, debería realizarse una castración, quirúrgica o química.
Se ha de ser muy consciente de que, a pesar de ser un método anticonceptivo, la vasectomía es solamente eso, un método para evitar el embarazo , pero se sigue siendo igual de vulnerable a contraer enfermedades de transmisión sexual si no se toman las medidas de protección adecuadas, como el preservativo.
Definitivo pero reversible
La vasectomía se considera un método anticonceptivo definitivo . Sin embargo, la intervención se podría revertir quirúrgicamente en ciertos casos . La intervención contraria a la vasectomía se denomina vasovasostomía y consiste en volver a abrir, localizar ambos extremos de cada conducto deferente, recanalizarlos (volver a hacerlos permeables) y volver a unirlos. A diferencia de la vasectomía, que es muy sencilla y barata, la vasovasostomía es una técnica de microcirugía muy compleja y costosa y, pese a todo, no se puede asegurar que vaya a haber concepción tras ella. La tasa de éxito de esta intervención es de un 55% si se lleva a cabo en menos de 10 años desde la vasectomía, mientras que si la intervención se realiza tras más de 10 años después de la intervención las posibilidades de éxito caen a un 25%.
Pasar por un quirófano siempre supone un riesgo y someterse a esta intervención, pese a la vasovasostomía, es un principio un paso irreversible, por lo que se tiene que estar muy seguro antes de someterse a ella. Si te lo estás planteando lo mejor es ponerse en contacto con un urólogo para que despeje las dudas que puedas tener.
Artículo especializado
Factores de Riesgo de la Tuberculosis
Puede ser que al oír la palabra tuberculosis nos suene a enfermedad lejana y propia del pasado, pero desgraciadamente no es así, sino que es un problema serio, generalizado y muy actual .
La tuberculosis, llamada antiguamente “tisis”, es una infección bacteriana contagiosa que compromete principalmente a los pulmones, pero que puede propagarse a otros órganos.
La especie de bacteria más importante y representativa causante de la tuberculosis en humanos es el Mycobacterium tuberculosis o también llamado Bacilo de Koch (en honor al científico que la descubrió, Robert Koch, en 1882). Como curiosidad, otra bacteria del mismo grupo, llamada Mycobacterium bovis , fue en algún momento del pasado una causa importante de tuberculosis transmitida por vía digestiva, tras la ingesta leche no pasteurizada, procedente de vacas tuberculosas infectadas por este germen. Incluso en la actualidad, causa un pequeño porcentaje de casos en todo el mundo.
¿Cómo se contagia?
La enfermedad se contagia por vía aérea mediante partículas en suspensión en el aire , o núcleos de gotitas, cuando las personas con enfermedad activa estornudan, hablan o escupen. La inhalación de una sola de las bacterias puede causar la infección. La forma extrapulmonar no es contagiosa. Cabe destacar que los niños eliminan escasos bacilos a través de las secreciones respiratorias, por lo que no suelen transmitir la infección. La tuberculosis no es una enfermedad hereditaria.
Enfermedad muy extendida
La tuberculosis está presente en todo el mundo. En 2016, 10,4 millones de personas enfermaron de tuberculosis, siendo el 56% de ellos varones, el 34% mujeres y el 10% niños.
Es la segunda causa de muerte a nivel global y la primera entre las enfermedades infecciosas . Más del 95% de las muertes se producen en países de recursos deficitarios. En concreto, siete países acaparan el 64% de la mortalidad total: encabeza esta triste lista la India, seguida de Indonesia, China, Filipinas, Pakistán, Nigeria y Sudáfrica.
Factores de riesgo
Una persona infectada no siempre enferma. Los principales factores de riesgo que predisponen a desarrollar la enfermedad tuberculosa son:
Personas con el sistema inmunitario (defensas) comprometido por la toma de medicamentos inmunosupresores, abuso de drogas o que padecen SIDA.
Senilidad.
Desnutrición.
Alcoholismo.
Pobreza.
Personas con contactos frecuentes, prolongados o intensos en espacios cerrados y relativamente pequeños (número de habitantes elevado=hacinamiento de los hogares).
Fumadores.
Personal sanitario, en zonas geográficas de alto riesgo.
Personas afectas de diabetes mellitus, linfoma de Hodgkin, enfermedad renal terminal o enfermedad pulmonar crónica.
Estados deficitarios de vitamina D.
Signos y síntomas
Los síntomas clásicos de la neumonía tuberculosa incluyen la tos crónica con esputo sanguinolento, febrícula, cansancio, pérdida de apetito, malestar general, sudores nocturnos y pérdida de peso. Como secuela, la tuberculosis pulmonar puede formar cavidades en el pulmón.
La infección de otros órganos causa una amplia variedad de cuadros clínicos tales como:
Pleuritis tuberculosa.
Tuberculosis del sistema nervioso central (cerebro, medula espinal o meninges).
Tuberculosis cardiovascular: puede provocar como secuela una pericarditis constrictiva.
Tuberculosis ocular.
Tuberculosis genitourinaria: causa habitual de piuria estéril (presencia de leucocitos, que son las células de defensa, sin germen visible, en orina). Puede causar secuela de esterilidad masculina (por afectación de los epidídimos testiculares) o femenina (por afectación de las trompas de Falopio).
Tuberculosis ganglionar: compromete las cadenas ganglionares cervicales y supraclaviculares. Produce hinchazón de los ganglios linfáticos.
Tuberculosis osteoarticular (osteoartritis y osteomielitis).
Tuberculosis miliar: generalizada, por diseminación sanguínea del bacilo.
¿SABÍAS QUE…?
Algunas veces los bacilos pueden permanecer viables y latentes , sin manifestación de síntomas, durante muchos años en el organismo humano (generando la llamada infección latente tuberculosa).
Diagnóstico
Debido a la gran cantidad de formas clínicas diferentes que pueden llegar a afectar a la práctica totalidad de órganos del cuerpo humano, es una enfermedad que compete a todas las especialidades de la medicina.
El diagnóstico se basa en la detección del germen en cualquier muestra del tracto respiratorio (tuberculosis pulmonar) o fuera de él (tuberculosis extrapulmonar), mediante las siguientes pruebas:
Prueba de la tuberculina cutánea (intradermoreacción) mediante la técnica de Mantoux: consiste en la inoculación subcutánea del reactivo PPD (Derivado Proteico Purificado). Su positividad sólo implica contacto, no infección. Si ha existido contacto previamente con el bacilo se producirá una reacción de induración cutánea en la zona de inoculación que se valorará tras el paso de 72 horas.
Radiología simple (generalmente torácica) y TC torácica.
Analítica sanguínea.
Examen al microscopio y cultivo microbiológico de los fluidos corporales en medio de Lowestein-Jensen: se consideran las pruebas Gold Estandard del diagnóstico.
Nuevas técnicas modernas como el diagnóstico molecular y también el método MODS (Microscopic observation drug susceptibility).
Tratamiento
El tratamiento de la tuberculosis es complicado y requiere largos periodos de sometimiento a antibioticoterapia . En los últimos años la tuberculosis ha experimentado una creciente resistencia a los antibióticos habitualmente utilizados.
Fármacos de primera línea: isoniacida, rifampicina, pirazinamida, etambutol, estreptomicina, etc.
Fármacos de segunda línea: cicloserina, etionamida, ciprofloxacino, etc.
Prevención
Como medida de prevención, en algunos países se ha sometido a la población (principalmente infantil) a vacunación con la vacuna BCG (Bacilo de Calmette-Guérin), desarrollada en el Instituto Pasteur (Francia), a principios del siglo XX. La vacunación sistemática a los recién nacidos en España se abandonó en el año 1980 (1974 en Cataluña), manteniéndose actualmente sólo en el País Vasco.
La vacuna BCG no reduce el riesgo de infección. Disminuye el riesgo de progresión de infección tuberculosa latente a tuberculosis activa, especialmente la forma diseminada o la afección del sistema nervioso central en niños.
OTRAS MEDIDAS PREVENTIVAS
Vida sana e higiénica.
Alimentación equilibrada y variada.
Ventilación adecuada de los hogares.
Protección al toser con pañuelos desechables y lavado frecuente de manos.
Aislamiento de enfermos con neumonía activa tuberculosa durante dos semanas después de haber iniciado el tratamiento.
Utilización de mascarillas en zonas comunes.
No fumar y no consumir alcohol en exceso.
Pronóstico
La tuberculosis es curable, pero es necesario un diagnóstico temprano (acudir inmediatamente al médico) ya que es una enfermedad grave si no se sigue el tratamiento adecuado. Si se trata correctamente, la tuberculosis causada por cepas sensibles a los fármacos se cura prácticamente en todos los casos, pero sin tratamiento el 50 a 65% de los pacientes pueden morir en un plazo de cinco años.
Es indispensable no abandonar el tratamiento porque, con ello, se favorece la recaída y el empeoramiento clínico rápido, así como la proliferación de resistencias del bacilo a los medicamentos.

Artículo especializado
En Qué Consiste la Tripofobia
El mundo de las fobias es realmente curioso. ¿Sabías que hay personas que pueden sentir pánico ante la imagen de un panal de abejas, un traje de lunares o una foto llena de burbujas? Estamos hablando de un trastorno llamado tripofobia, que consiste en la repulsión y ansiedad ante la observación de patrones de pequeños agujeros que se encuentran juntos.
¿A qué tienen miedo?
La palabra tripofobia deriva del vocablo griego trypo, que significa «agujero» o «perforación». Fobia significa «miedo irracional».
La tripofobia es el miedo a imágenes con un patrón de orificios, rectángulos o bultos pequeños muy juntos que generan un contraste. En otras palabras, sería una fobia al patrón repetitivo, miedo irracional o repulsión al mirar o estar cerca de figuras geométricas muy juntas. A pesar de que la tripofobia la padecen muchas personas, todavía su diagnóstico no es oficial, y no se recoge todavía en el DSM-V (manual diagnóstico y estadístico de los trastornos mentales), el que se considera como la Biblia de la psiquiatría.
A quienes sufren tripofobia les genera repulsión y una ansiedad significativa el hecho de observar patrones de pequeños agujeros que se encuentran juntos. Panales, trajes de lunares, las múltiples burbujas de la espuma en el baño, hormigueros, ciertos hongos o los frutos del loto. Incluso, sin ir más lejos, si aumentamos la visión de nuestra piel nos encontramos ante miles de poros que siguen este patrón de pequeños orificios aglomerados. Si el trastorno es muy intenso, los afectados incluso pueden mostrar repulsión a fotos que muestren este tipo de estructuras geométricas repetitivas.
Un poco de historia
Los primeros investigadores de esta entidad fueron los científicos Arnold Wilkins y Geoff Cole. Además de investigar este trastorno, acuñaron su nombre. Sus estudios, en 2005, intentaron probar que la tripofobia es repulsión que no se basa en un miedo cultural aprendido. En un estudio, identificaron reacciones tripofóbicas en un 16% de los sujetos que participaron, por lo tanto, tampoco es una situación tan infrecuente.
En 2010, una encuesta hecha por un grupo de servicios financieros para un programa de mercadotecnia citó la tripofobia, el temor de los agujeros o grupos de agujeros como el segundo mayor temor , detrás del miedo a los objetos de madera (xilofobia).
En febrero de 2013, la revista Psychological Science publicó el estudio de Geoff Cole, experto en ciencias de la visión realizado en la prestigiosa Universidad de Essex que demostraba que la tripofobia no es una fobia condicionada culturalmente.
Entonces, ¿por qué podemos desarrollar miedo a los patrones geométricos?
Muchas de las fobias que conocemos tienen su origen en una mala experiencia muy traumática, o bien aprendida o recibida por herencia cultural.
Con la tripofobia, esto no es exactamente así. Parece que la tripofobia puede ser un mecanismo evolutivo natural de defensa que alerta a nuestro cerebro. Es decir, la persona siente repulsión y se pone nerviosa al observar un patrón similar al de peligrosos animales venenosos que viven en nuestro planeta; como si fuera una señal de alarma para no acercarse. Es, por lo tanto, un miedo ancestral. Seguramente, hace cientos o miles de años, este “mecanismo de alerta” salvó la vida a muchos de nuestros antepasados.
Muchos de los animales más letales del planeta como, por ejemplo, la cobra real ( Ophiophagus hannah ), diversas arañas, el escorpión muerte acechante ( Leiurus quinquestriatus ), la rana punta de flecha, el pulpo de anillos azules, el caracol cono de mármol o algunos escorpiones, tienen en su piel patrones repetitivos de figuras geométricas.
Síntomas
Los síntomas de una fobia son muy heterogéneos y varían según la intensidad de la aversión o miedo de la persona que la padece.
Algunos de sus síntomas son cosquilleos, comezón o picazón en el cuerpo, ansiedad, incluso náuseas. Esta fobia puede estar relacionada con el miedo a los parásitos o a las infecciones.
Podemos encontrar una gran variedad de síntomas , como los siguientes:
Ansiedad
Palpitaciones
Repulsión o asco
Sensación de opresión en el pecho
Mareo
Hormigueo en las extremidades
Sensación de debilidad
Desmayo
Náuseas o vómitos
Sensación de falta de aire
Sudoración
Temblores
¿Tiene cura?
Como todas las fobias, la tripofobia tiene cura. Su abordaje puede ser desde varios puntos de vista y terapias. Siempre se debe acudir a un profesional especializado (psicólogo clínico), para que, tras la evaluación y diagnóstico, elabora una estrategia de tratamiento que se adapte lo mejor posible a la persona que padece el trastorno.
Hay varios tipos de terapias y tratamientos para tratar la tripofobia:
Terapia de exposición
Consiste en exponerse a imágenes tripofóbicas, que cumplan con las características de lo que produce el malestar.
Este tipo de exposición suele ser muy efectiva. Se aplica de forma gradual, aumentando la intensidad del estímulo, comenzando desde lo que provoca una menor ansiedad, hasta lo que provoca la ansiedad más intensa.
Terapia de desensibilización sistemática
Es menos intrusiva que la terapia de exposición y requiere de más tiempo y esfuerzo.
Habitualmente, a través de la imaginación, el psicoterapeuta irá introduciendo al paciente en sus miedos, paulatinamente, anotando la frecuencia e intensidad de sus síntomas. Sesión tras sesión se va dando un paso más, hasta que la intensidad de los síntomas va reduciéndose.
Finalmente, esta terapia concluye con la exposición del paciente al estímulo que más ansiedad le causaba. Ya pudiendo afrontarlo sin que se dispare su ansiedad y angustia.
Tratamiento no convencional
La práctica de yoga o meditación o, la acupuntura, pueden ser prácticas eficaces para disminuir los niveles de ansiedad y acompañar a las terapias psicológicas.
Tratamiento farmacológico
Aunque no son el tratamiento de primera línea ni el más eficaz para el tratamiento de las fobias, los fármacos ayudan a disminuir los síntomas producidos por la ansiedad. Los medicamentos que se suelen administrar son los ansiolíticos y antidepresivos.
Se recurre al tratamiento farmacológico cuando la fobia es tremendamente angustiante en el día a día de la persona que la padece, cuando los síntomas son incontrolables e interfieren de una forma significativa en su vida diaria.

Artículo especializado
Diagnóstico y Tratamiento del Vitíligo
Muchos sabéis qué es el vitíligo por la visibilidad que le han dado algunas marcas de ropa al utilizar como modelos a personas con esta enfermedad. Afecta alrededor de ojos y boca, sobre todo, provocando decoloración de ciertas zonas. ¿Os suena, verdad?
El vitíligo es una enfermedad autoinmunitaria , es decir, en la que el organismo causa daño a sus propias células. Y en este caso, las células atacadas son las responsables del color de la piel, los melanocitos. Por ello, se produce esta decoloración de la piel, con el comprensible problema estético que puede conllevar, e impacto sobre la autoimagen y la calidad de vida.
¿Dónde aparece?
El vitíligo suele afectar a zonas bastante características . Es típica la afectación alrededor de los ojos y la boca, los dedos de las manos, o las zonas genitales. Cuando se produce en áreas con pelo como las cejas o el cuero cabelludo puede producir mechones blancos decolorados de cabello. En algunas personas afecta a todo el cuerpo, llegando incluso a perder la pigmentación normal casi por completo.
¿No se conoce su causa? ¿Qué teorías hay?
Sobre el vitíligo, se sabe desde hace mucho tiempo que la enfermedad se produce por un mecanismo de autoinmunidad . Además, tiene tendencia a asociarse con otras enfermedades de este tipo, como ciertos tipos de diabetes, el síndrome de Addison (fallo de las glándulas suprarrenales) o las enfermedades autoinmunes del tiroides. Se sabe también que no es una enfermedad contagiosa, y que existen casos hereditarios. No es posible saber el pronóstico de un paciente con vitíligo. Algunos pueden sufrirlo durante un tiempo y repigmentar su piel espontáneamente. En otros, puede ser progresivo y decolorar la piel hasta el punto de afectarla enteramente y perder completamente la pigmentación.
¿Qué problemas comporta para la salud?
Sobre todo, produce impacto sobre la imagen y la calidad de vida. Las personas con vitíligo sufren aislamiento social, y en ciertas culturas se les considera personas a excluir. Lo cierto es que el vitíligo no es contagioso, y permite llevar una vida normal. Como la piel afectada está desprotegida, deben protegerla del sol porque se quema con facilidad y puede desarrollar más fácilmente un cáncer.
¿Qué pruebas se hacen cuando se diagnostica?
En general, un dermatólogo puede diagnosticarlo sin necesidad de prueb as . Suele solicitarse una analítica de sangre para descartar trastornos inmunológicos, del tiroides o del páncreas que, como hemos dicho, pueden acompañar al vitíligo. Debe distinguirse de las infecciones por hongos, y de otros trastornos de la pigmentación de la piel como el piebaldismo o los mosaicismos pigmentarios.
¿Existen tratamientos?
Hoy en día, no podemos asegurar una cura para el vitíligo. Existen muchas opciones de tratamiento, y la eficacia puede ser variable para cada paciente . Algunos pueden frenar su enfermedad, pero en otros es progresiva y el tratamiento fracasa.
Los tratamientos tópicos incluyen cremas como el tacrolimus o pimecrolimus, que tienen un efecto sobre las células que destruyen a los melanocitos. Suelen aplicarse por la noche durante periodos largos de tiempo. También se han empleado medicamentos que estimulan la pigmentación como las pseudocatalasas o derivados de plantas como el Piper nigrum o el Polypodium leucotomus . Ninguno de ellos ha demostrado su eficacia en ensayos clínicos rigurosos.
Un tratamiento sobre el que hay estudios de eficacia sólidos desde hace tiempo es la fototerapia. Consisten en exponer la piel de forma controlada a diferentes fuentes de luz, como el ultravioleta A o el ultravioleta B de banda estrecha. Suelen administrarse en los servicios de dermatología de los hospitales.
Existe también la posibilidad de estimular la pigmentación mediante diversos tipos de injertos de piel o cultivos de melanocitos, pero se trata de terapias experimentales con poca disponibilidad.
En muchos casos, un buen maquillaje que incluya una protección solar alta es un buen tratamiento para el vitíligo.
En casos muy seleccionados, cuando la despigmentación es tan extensa, puede recurrirse a la despigmentación total de la piel con una sustancia química llamada hidroquinona. De esta manera, se elimina la pigmentación de las pocas áreas que la conservan, y el paciente puede agradecer el resultado estético final. Sin embargo, esta opción deja al paciente completamente desprotegido frente a la luz solar, con un elevado riesgo de cáncer de piel. Además, la piel puede volver a tener tendencia a repigmentarse en algunas áreas, con lo cual el problema nunca está completamente solucionado.
El vitíligo sigue siendo una enfermedad con un tratamiento muy limitado . Es importante dejarse aconsejar por dermatólogos sobre su terapia, y no caer en la trampa de remedios milagrosos anunciados por Internet sin base científica y que, en la mayoría de los casos, constituyen un fraude.
Artículo especializado
Descubre los Efectos de la Testosterona
Es la principal hormona sexual masculina y en el hombre juega un papel clave en el desarrollo de sus tejidos reproductivos, como los testículos y la próstata, y también en la promoción de los caracteres sexuales secundarios como, por ejemplo, el incremento de la masa muscular y ósea y en el crecimiento del pelo corporal. Además, es esencial para la salud y el bienestar, además de la prevención de la osteoporosis. En caso de déficit de la misma o en determinadas situaciones médicas se puede utilizar como tratamiento, siempre tras la aprobación de un médico.
Sobre esta hormona…
La testosterona es una hormona esteroidea sexual del grupo de los andrógenos (formado por la testosterona, la androsterona y la andostrendiona). Se produce principalmente en los testículos y en menor cantidad en los ovarios. Asimismo, las glándulas suprarrenales también segregan pequeñas cantidades de esta hormona. Es la p rincipal hormona sexual masculina , así como un esteroide anabolizante.
La testosterona está producida por unas células específicas de los testículos que se denomina células de Leydig. La producción hormonal de testosterona está regulada por una serie de activaciones hormonales cuya primera fase se da en el hipotálamo, que mediante la hormona GnRH activa la hipófisis, una glándula ubicada en el cerebro y que regula la producción de la gran mayoría de hormonas del organismo. La hipófisis, a su vez, produce un aumento de la hormona LH, que activa las células de Leydig para que estas produzcan testosterona. Una vez que los niveles de testosterona en sangre son los adecuados es la misma hormona la que frena la producción de las hormonas GnRH y LH para que cese la producción de testosterona.
Sus efectos
La testosterona tiene dos tipos de efectos :
Androgénicos, que tienen que ver con la diferenciación sexual a nivel de órganos y la aparición de los caracteres sexuales secundarios.
Anabólicos, relacionados con la formación de masa muscular y ósea.
La testosterona empieza a ejercer su función ya a nivel fetal, de manera que los genitales se virilizan, se forman el pene, la próstata y las vesículas seminales. En la adolescencia , los niveles de testosterona aumentan y hace que se den los cambios propios de la pubertad:
Aparición de vello púbico, axilar y facial
Producción de espermatozoides
Aumento del tamaño del pene
Incremento del deseo sexual y del número de erecciones
Crecimiento y maduración ósea
Proliferación de las glándulas sebáceas, lo cual puede causar acné
Disminución de la grasa subcutánea
Cambios en la voz y protrusión de la nuez
Cambios en la composición del sudor
Otros efectos de la testosterona en la edad adulta , cuando el desarrollo sexual físico ya se ha dado, son:
Aumento de la energía tanto física como mental
Mantenimiento de la masa muscular y aumento de las fibras contráctiles
Reducción de la grasa corporal
Estimula la formación de glóbulos rojos
Regula en parte la agregación de las plaquetas
Permite el desarrollo normal de los espermatozoides
Como tratamiento
La testosterona se utiliza como tratamiento en aquellos pacientes que, por la causa que sea, presentan unos niveles bajos de testosterona que conllevan problemas de infertilidad . La testosterona se puede administrar inyectada, mediante parches transdérmicos, geles o vía oral. Hoy en día, la testosterona se emplea también para otras situaciones clínicas:
Terapia hormonal para hombres transexuales (mujer a hombre).
Ciertos casos de disfunción eréctil.
Falta de deseo sexual.
Corrección de la osteoporosis.
Tratamiento para niños con déficit de crecimiento.
La testosterona y variaciones químicas de la misma se han utilizado como anabolizantes , es decir, como sustancias que aumentan la masa muscular, la fuerza y la resistencia. La testosterona tiene un efecto directo sobre las fibras musculares, logran que se hagan más grandes y que se recuperen con mayor facilidad cuando se produce una rotura muscular, de manera que se crean nuevas fibras musculares. De este modo la musculatura va aumentando. Asimismo, la testosterona tiene un efecto sobre la grasa subcutánea, de manera que la reduce.
Testosterona y deporte
Pese a que esto pueda parecer algo deseable, la testosterona y otros anabolizantes esteroideos están prohibidos en la práctica deportiva y se consideran dopaje . Es sabido que en muchos gimnasios algunas personas utilizan testosterona de manera ilegal para aumentar su masa muscular. Inicialmente esto da resultados visibles, pero al poco tiempo se frena la producción de testosterona del propio cuerpo y para seguir viendo resultados de crecimiento de la masa muscular se deben administrar mayores dosis de testosterona. Asimismo, esta testosterona externa tiene efectos nocivos sobre el organismo:
Frena el crecimiento óseo de forma prematura en personas en crecimiento.
Produce atrofia testicular y disminución de los niveles de esperma.
Aumenta las cifras globales de colesterol, con descenso del tipo HDL.
Afecta al sistema inmunitario con una bajada de defensas.
Predispone a la diabetes por cambios en el metabolismo de la glucosa.
Provoca cambios en la personalidad y el carácter: agresividad, euforia exagerada, trastornos del sueño, ansiedad, paranoia, alucinaciones.
Así pues, la testosterona, como todas las hormonas, es necesaria para nuestra salud y solamente en caso de déficit de la misma o en determinadas situaciones médicas se puede utilizar como tratamiento , siempre tras la aprobación de un facultativo. En ningún momento se debe tomar testosterona o anabolizantes por uno mismo para aumentar la masa muscular.
Artículo especializado
Qué Debes Saber Sobre el TAC
Poco suele interesar saber qué es o cómo funciona hasta que no nos han de realizar uno. Pues bien, si es tu caso, te diremos que mediante las imágenes de un TAC se pueden analizar diferentes estructuras del organismo , lo que permite el diagnóstico de fracturas óseas, hemorragias internas, tumores o infecciones en órganos internos. Sin esta tecnología no podríamos realizar muchos de los diagnósticos de certeza que hoy en día realizamos. Asimismo, permite estudiar la forma de las vértebras de la columna, los discos intervertebrales y la médula espinal.
¿Qué es?
Una tomografía axial computarizada, llamada habitualmente TAC o escáner, es una prueba diagnóstica que emplea la tecnología de los rayos X asociada a un sistema informático que se encarga de procesar las imágenes generadas y que permite, de ese modo, obtener una serie de imágenes que son secciones, es decir, imágenes radiológicas a diferentes planos de profundidad, de las estructuras que se están estudiando. Asimismo, si es preciso, la tecnología informática permite recrear una imagen tridimensional conformada a partir de estas secciones. De hecho, la palabra tomografía deriva del griego y significa literalmente “imágenes de cortes”.
En algunos casos, al realizar la prueba, se puede utilizar un contraste yodado . Se trata de un líquido que se introduce por la vena y que se aprecia en las imágenes, lo cual permite estudiar mejor ciertas estructuras, como los vasos sanguíneos o las cavidades cerebrales con líquido cefalorraquídeo.
¿Qué permite explorar?
El TAC permite explorar diferentes estructuras del organismo :
Cerebro y cráneo.
Senos paranasales.
Dental.
Columna cervical, dorsal y lumbar.
Tórax (mediastino, pulmones, corazón).
Abdominal (hígado, vías biliares, bazo, páncreas, grandes vasos).
Urológico (riñones, uréteres, vejiga, próstata).
Ginecológico (útero, ovarios).
El TAC es una prueba de imagen que no es dolorosa, que dura menos de un minuto y que proporciona imágenes de gran calidad y precisión . En caso de que se tenga que poner contraste puede durar un poco más, dado que se tiene que coger una vía venosa para poder poner el contraste. Si se tiene que utilizar contraste se debe acudir a la prueba en ayunas. En otras ocasiones, para estudiar estructuras digestivas, sobre todo, puede que se tenga que tomar un contraste vía oral o mediante un enema anal. En caso de utilizar contraste la prueba la exploración puede durar un poco más. Siempre debe de informarse al equipo médico de los antecedentes de alergia a contrastes radiológicos.
¿Cómo se realiza?
La exploración se lleva a cabo con el paciente estirado sobre una camilla que se desplaza mecánicamente guiada por el técnico radiólogo. De esta manera se hace avanzar el cuerpo del paciente a través del tomógrafo, que tiene la forma de un aro que rodea al paciente. A medida que se avanza se van realizando las radiografías seriadas que luego el ordenador recompondrá. La persona a la que se le realiza el TAC tiene que estar relajada e inmóvil. En todo momento el paciente es supervisado por los técnicos de radiología, que se comunican con el paciente por un sistema de megafonía, indicando cuándo tiene que aguantar la respiración mientras se realiza la captación de las imágenes.
El TAC, al igual que las radiografías, supone una exposición a rayos X , pero mayor, dado que a efectos prácticos es como realizar muchas radiografías. La unidad de medición de la radiación es el milisievert (mSv). Los diferentes tejidos del cuerpo son más o menos sensibles a estas radiaciones. Mientras que una radiografía de tórax o de abdomen supone una exposición de unos 0,1 y 7 mSv, un TAC conlleva una radiación superior, de 7 y 10 mSV respectivamente. La radiación se acumula y puede causar daño en los tejidos a largo plazo, de manera que es muy importante que el TAC se realice cuando sea realmente preciso y no como una prueba rutinaria.
¿Es seguro?
Se tiene que tomar especial precaución con las mujeres embarazadas . Si el TAC es craneal o torácico no existe ningún problema. Si la exploración supone irradiar la cavidad abdominal o la pelvis y, por lo tanto, el feto, se debe valorar la posibilidad de realizar otro tipo de exploración, como una resonancia magnética o una ecografía.
Asimismo, debido a que los niños son más sensibles a la radiación , se les debe someter a un TAC solamente si dicha prueba fuese esencial para poder llegar a un diagnóstico de certeza. No se les debe realizar estudios por TAC de manera seriada a menos que sea estrictamente necesario para el seguimiento de una enfermedad en concreto.
El TAC es, por lo tanto, una prueba esencialmente sencilla, segura y rápida que nos permite obtener mucha información y facilita el diagnóstico. De todos modos, no siempre es la mejor opción como prueba de imagen, así que tendrá que ser el médico quien determine la pertinencia o no de la realización de una exploración que no está exenta de riesgos, tanto por la radicación como por el contraste.

Artículo especializado
El Vegetarianismo Más que una Moda
Cada vez más personas apuestan por adoptar estilos de vida saludables y tener así una mejor calidad de vida. Paralelamente a esta tendencia, el vegetarianismo ha ido resurgiendo y teniendo una presencia al alza a nivel mundial. Aglutina valores que no son meramente nutricionales, sino que también introduce aspectos culturales, sociales y medioambientales .
Un poco de historia…
Desde los inicios de la Humanidad el hombre ha necesitado buscar fuentes alimentarias para su propia evolución como especie mediante la recolección de raíces, frutos, especies marinas e incluso con suerte cazando algún que otro animal. Se fue desarrollando, así, una alimentación omnívora que le permitió desenvolverse e ir descubriendo nuevos alimentos y formas de consumirlos.
La evidencia sugiere que los fundadores de la dieta no basada en carne vienen de la antigua India en el siglo VI a.C., vinculada en gran medida a dos religiones: hinduismo y budismo. No comer carne no era una cuestión de gustos, sino que estaba asociado a fundamentos filosóficos y a la necesidad del respeto por la vida animal.
También en el antiguo Japón hubo prohibiciones en el consumo de carne de animales salvajes, siguiendo una dieta a base de legumbres y verduras, y muy ocasionalmente pescado, durante unos 1200 años en el periodo Nara, y luego se cambió con el emperador Meji. Asimismo, el famoso Pitágoras fue uno de los primeros filósofos occidentales que promovió un estilo de vida vegetariano. Y así con el paso del tiempo numerosos personajes históricos, revolucionarios y hombres célebres han impulsado en la sociedad dicha tendencia a introducir nuevas preocupaciones asociadas a los recursos que se utilizan para el consumo humano y con ello valores que abarcan aspectos éticos, morales y medioambientales.
En qué consiste
El estilo de vida vegetariano promueve una forma de alimentarse en la que no tiene cabida ningún alimento de origen animal, apuesta por infligir siempre el menor daño posible al entorno y excluir a los animales del negocio productivo . Todo lo que se consume tiene que venir de la tierra. Su alimentación se basa principalmente en vegetales, frutas, semillas, cereales integrales, legumbres, productos y derivados de la soja y gluten. Sin embargo, los vegetarianos no sólo rechazan los alimentos de origen animal, sino cualquier producto o material procedente de animales. Asimismo, no existe una única dieta vegetariana, sino que todo depende de qué alimentos se consuman :
Veganismo : seguido por los vegetarianos estrictos. No consumen ningún alimento de origen animal, ni derivados lácteos , leche o miel .
Ovolácteovegetarianismo : incluyen huevos y lácteos en su alimentación. Es la dieta vegetariana más seguida en occidente.
Ovogetarianismo/lactovegetarianismo : únicamente consumen huevos o lácteos respectivamente, como alimentos de origen animal.
Crudivorismo : es una dieta que puede considerarse vegana, ya que únicamente consumen alimentos crudos y no procesados. En este caso, la alimentación se basa en frutas, verduras, frutos secos, semillas, cereales y legumbres germinados. Pueden existir casos en los que se incluyan lácteos no pasteurizados y carne y pescados crudos.
Frugivorismo : basada en frutas, frutos secos y semillas. Incluye aquellos frutos que se clasifican como verduras, como el tomate o el aguacate . El resto de vegetales están excluidos.
Otras dietas vegetarianas : existen personas que se autodenominan vegetarianas pese a consumir pescado o marisco, lo cual es un error conceptual ya que por definición el pescado no entra dentro de los preceptos del vegetarianismo.
Evitar carencias
A diferencia de lo que mucha gente cree, ser vegetariano no es sinónimo de comer saludable ni estar sano . Independientemente de la dieta vegetariana que se practique ante todo se debe asegurar una alimentación variada, equilibrada y, muy importante, planificada por un especialista en nutrición que preste especial atención a los nutrientes esenciales que se ven limitados para no crear deficiencias y a largo plazo implicar el estado de salud.
Las personas que sigan dietas vegetarianas deben enfocarse en incluir correctamente los siguientes nutrientes para poder cubrir adecuadamente sus necesidades nutricionales:
Proteínas: al no contar con proteínas de origen animal, éstas deben ser sustituidas por otras de origen vegetal que cumplan una función similar, como las legumbres, la soja, la quínoa, los frutos secos o el tempeh. Cabe mencionar que la proteína de origen vegetal no es de alto valor biológico (como la animal), y suele tener aminoácidos limitantes, distintos dependiendo del alimento. Por ello se recomienda la combinación de distintas fuentes vegetales en una misma comida, para garantizar el aporte de todos los aminoácidos esenciales.
Combinaciones de alimentos para mejorar la calidad del aporte proteico:
Legumbres + cereales integrales = Garbanzos con espinacas y arroz.
Legumbres o cereales + frutos secos = Salteado de quínoa con verduras y piñones.
Legumbres o cereales + productos de soja o seitán = Ensalada de lentejas con tofu.
Hierro: reemplazable por verduras de hoja verde (espinacas, acelgas, lombarda, perejil, brócoli) y legumbres. Hay que tener en cuenta que el hierro que contienen se absorbe en menor cantidad. Un medio ácido mejora la absorción por lo que se recomienda tomarlos junto a alimentos ricos en vitamina C.
Vitamina B12 : en personas que practican el veganismo durante varios años seguidos sin lácteos ni huevos, se recomienda tomar alimentos enriquecidos en esta vitamina y suplementarla mediante un complejo semanal de vitamina B12 con un aporte de 2000 microgramos.
Calcio : en las dietas veganas donde no se incluyen lácteos, podemos obtener este nutriente de verduras de hoja verde como el brócoli y las espinacas, así como de las judías blancas, col rizada garbanzos, soja y sus derivados como el tofu, y bebidas vegetales enriquecidas en calcio. Junto al calcio debemos asegurarnos la presencia de vitamina D. En una dieta vegetariana su principal ingesta proviene de bebidas enriquecidas con esta vitamina. Pero la mejor forma de no tener deficiencia es mediante una exposición de 15-20 minutos diarios al sol.
Zinc : es importante para el crecimiento de los niños y reforzar el sistema inmune. Este mineral se encuentra en: leche, quesos, yogur, huevo (especialmente en la yema), hojuelas de avena, cebada en grano entero, soja, cereales del desayuno fortificados, germen de trigo y tofu.
Ácidos grasos Omega 3 : las dietas vegetarianas son generalmente ricas en ácidos grasos omega 6 y pueden contener cantidades insuficientes de ácidos grasos omega 3. Se tendrá en cuenta incluir las fuentes de origen vegetal: semillas lino, chía, amapola, aceite de linaza y de soja.

Artículo especializado
Qué Debes Saber Sobre la Urticaria
Cuando la piel pica y se llena de ronchas seguramente estamos ante una urticaria. En la mayoría de casos, una urticaria no es una enfermedad alérgica y tiene un buen tratamiento si es diagnosticada por el especialista adecuado, generalmente el dermatólogo.
¿Cómo es la erupción de la urticaria?
La urticaria se caracteriza por ronchas o habones que son evanescentes , es decir, que van cambiando de lugar con las horas, y no son fijos. Afecta más a hombres que a mujeres , generalmente en la edad media de la vida. Los habones son rojos, con bordes muy nítidos, y sin descamación o ampollas en la superficie de la piel. Pican intensamente. Algunos pacientes con urticaria (sobre todo las formas agudas) presentan además angioedema, una hinchazón de zonas como la boca, las palmas, las plantas o los párpados. En pocos casos el angioedema puede afectar al interior de la boca o el aparato respiratorio, provocando ahogo, ronquera o dificultad para respirar.
La urticaria crónica, que puede durar meses o incluso años, es una enfermedad tremendamente invalidante. El paciente puede sufrir continuamente brotes de ronchas y picor, que interfieren con el sueño y alteran la vida diaria. Además, el carácter impredecible de los brotes hace que el paciente viva en un estado de incertidumbre continuo, pendiente de la posibilidad de tener un episodio.
Tipos de urticarias
Urticarias agudas y crónicas
La urticaria aguda es aquella en la que ha habido un episodio aislado, o varios episodios durante poco tiempo. En la urticaria crónica, el paciente tiene que haber sufrido brotes de habones al menos durante seis semanas. En la mayoría de los casos, los brotes de urticaria pueden durar unos cinco años y desaparecer, aunque hay pacientes en los que no desaparecen y los pueden tener toda la vida, con el problema que comportan.
Urticarias espontáneas
En las urticarias espontáneas, más de la mitad de los pacientes tienen fenómenos de autoinmunidad, es decir, una inflamación de la propia piel provocada por su propio sistema inmunitario. Los episodios aparecen sin ningún desencadenante claro, aunque algunos pacientes los relacionan con cambios de tiempo o estrés.
Urticarias inducibles
Algunos pacientes tienen urticarias llamadas físicas o inducibles, en las que los brotes están relacionados con el frío, la exposición al sol o a la luz, la presión o el roce, el calor, el sudor, e baño o el ejercicio físico. En estos casos, la urticaria puede inducirse con pruebas, como exponer el paciente a un cubito de hielo (urticaria por frío) o a diversas fuentes de luz (urticaria solar). El tratamiento es similar al de las urticarias espontáneas, pero debe incluir en muchos casos evitar el desencadenante. Por ejemplo, las personas con urticaria por frío deben abrigarse, y las personas con urticaria solar deben utilizar fotoprotectores especiales.
¿Cómo se trata?
La mayoría de las urticarias se tratan primero con antihistamínicos no sedantes, a dosis que pueden ir desde una a cuatro pastillas al día. Si no se controlan con estos medicamentos, la siguiente opción de tratamiento es el omalizumab, un bloqueador de la inmunoglobulina E que se administra en los hospitales en forma de inyección. Una alternativa son inmunosupresores (medicamentos que actúan sobre las células del sistema inmunitario) como la ciclosporina, que puede usarse cortos periodos de tiempo, debido a su posible efecto tóxico sobre el riñón. Los corticoides orales no suelen usarse para la urticaria, y si se emplean sólo debe ser durante un periodo muy corto de tiempo, nunca para el tratamiento a largo plazo.
¿Hay algunos alimentos o medicamentos que deban evitarse?
Respecto a la dieta, no parece ser útil eliminar alimentos , aunque es aconsejable no comer conservas o comidas que lleven gran cantidad de colorantes o aditivos, o alimentos muy fermentados , como el queso curado. En cualquier caso, hay que dejarse aconsejar por el dermatólogo y el alergólogo. Sí es importante no tomar antiinflamatorios, codeína (contenida en algunos jarabes para la tos) o aspirina, ya que pueden empeorar la urticaria.
¿Hay algo que se deba modificar en el estilo de vida?
Hay urticarias que empeoran con el estrés, por lo que se recomienda llevar una vida ordenada en cuanto a pautas de sueño y horas de las comidas , dormir lo suficiente y hacer una dieta saludable. Durante los brotes de urticaria es recomendable hacer reposo físico hasta que está controlado el brote.

Artículo especializado
Control del Ácido Úrico
¿En una analítica te ha salido el ácido úrico elevado y te han aconsejado controlar tu alimentación? Te explicamos cuáles pueden ser los motivos y cuáles son los alimentos cuyo consumo sería aconsejable moderar .
¿Qué es el ácido úrico?
El ácido úrico es una sustancia química orgánica que se produce en el organismo humano como producto metabólico final de la degradación de las purinas, eliminándose por la orina (70% del total) y a través del intestino (30% restante). Las purinas son unas moléculas que forman parte de la estructura del material genético (ADN/ARN) presente en las células de nuestro cuerpo y en los alimentos que ingerimos.
Por tanto, el ácido úrico puede estar alto debido a factores endógenos (el propio cuerpo lo fabrica a nivel de hígado, músculos, intestinos, riñones…) o factores exógenos (a través de la alimentación).
La hiperuricemia
De una forma general, el rango de valor normal en sangre es 1-7g/dL. La hiperuricemia es el aumento de ácido úrico o urato en sangre por encima de este valor, y puede producirse por:
Aumento de la producción de ácido úrico : por enfermedades genéticas, por causa desconocida o idiopática, por dieta rica en alimentos que contienen abundantes purinas, por casos de leucemia, mieloma múltiple, psoriasis extensas, anemias hemolíticas o tratamiento quimioterápico de tumores malignos, así como, también, por consumo excesivo de alcohol…
Disminución de su excreción (eliminación) renal: más frecuente, por existencia de enfermedades tipo insuficiencia renal, diabetes insípida, hipotiroidismo…
ALIMENTOS RICOS EN PURINAS
Contenido muy alto : vísceras, patés, embutidos, pescado azul, marisco…
Contenido alto: carnes rojas y de caza, habas, lentejas.
Contenido moderado contenido : carnes blancas, legumbres no nombradas anteriormente (garbanzos, judías blancas…), coliflor, espárragos, espinacas y setas.
Contenido bajo: lácteos, el resto de verduras no nombradas anteriormente, tubérculos, raíces, fruta…
¿SABÍAS QUE…?
El consumo excesivo de alcohol produce , de hecho, un aumento de ácido úrico en sangre por ambos mecanismos, ya que por su culpa no sólo aumenta la producción del mismo, sino que disminuye también su eliminación por el riñón.
Síntomas, diagnóstico y tratamiento de la hiperuricemia
La hiperuricemia generalmente es asintomática , pero cuando el ácido úrico se deposita en los tejidos aparece la gota.
En caso de hallar niveles elevados de ácido úrico en sangre, hay que intentar descubrir su causa y para ello es necesario determinar el ácido úrico en orina para saber si es por sobreproducción o por defecto de excreción.
Comprend e tres vías de actuación :
Modificación de la dieta: cabe destacar que este apartado no tiene un papel fundamental porque es necesaria una dieta muy pobre en purinas para conseguir descensos moderados de los niveles de ácido úrico. La restricción estricta de las purinas de la dieta puede descender tan sólo unos pocos milígramos los niveles de ácido úrico. No obstante, el control de la dieta, el consejo de reducción de peso en pacientes obesos, el consejo de ingerir abundantes líquidos a lo largo del día y el consejo de no ingerir bebidas alcohólicas formarán parte del tratamiento siempre.
Práctica de ejercicio físico regular.
Fármacos: bien mediante medicamentos que inhiben la producción de ácido úrico endógeno (por ejemplo, alopurinol – Zyloric ®), o bien medicamentos que aumentan su eliminación por la orina (probenecid, sulfinpirazona…).
La gota
La gota es la enfermedad debida a la deposición de cristales de las sales de ácido úrico en y alrededor de las articulaciones (gota articular), en diversos órganos (gota visceral) y, finalmente, estos cristales también pueden formar cálculos en las vías urinarias (litiasis úrica).
La gota afecta al 1-2% de la población general en algún momento de la vida, en mayor medida a hombres que a mujeres (8:1) y principalmente en edades medias de la vida (después de los 30 años).
Factores de riesgo de la gota
Hiperuricemia crónica : es el factor de riesgo más importante en el padecimiento de gota. Ahora bien, no todos los pacientes con hiperuricemia padecerán gota, sólo la padecerá un pequeño porcentaje (uno de cada cinco). Incluso, en algunas ocasiones, existen episodios de gota con niveles de ácido úrico en sangre normal.
Edad : el riesgo de padecerla aumenta con la edad.
Determinados estilos de vida y dietas poco saludables (obesidad, alcoholismo…): es frecuente que las personas que padecen gota sean obesas y tengan, además, diabetes y/o hipertensión arterial. La gota es más común en sociedades opulentas, debido a una dieta rica en proteínas, grasas y alcohol.
Signos y síntomas de la gota
Gota articular :
En la crisis de gota aguda típica, que suele comenzar por la noche, el síntoma primordial es el dolor, que puede presentarse de forma aguda e intensa, junto con inflamación (enrojecimiento e hinchazón) de la articulación. Es una artritis por depósito de microcristales. Las articulaciones habitualmente afectadas son: la articulación metatarso-falángica del dedo gordo del pie (y en este caso recibe el nombre de podagra), las rodillas, los tobillos, hombros o el empeine de los pies, entre otras localizaciones.
En la gota crónica, después de una larga evolución de la enfermedad, se producen los denominados “tofos gotosos”, que son unos nódulos indoloros situados debajo de la piel, que se forman por depósito lento de ácido úrico en los mismos, por lo que van aumentando de tamaño progresivamente. Tienden a desaparecer poco a poco cuando la enfermedad está bien controlada.
Gota visceral:
Nefropatía aguda úrica: por obstrucción de los túbulos del riñón por culpa de los cristales de ácido úrico, provocando una intensa inflamación y, secundariamente, insuficiencia renal aguda.
Litiasis (piedras en el riñón):
La litiasis úrica consiste en la formación de cálculos de ácido úrico, que pueden obstruir las vías urinaria, provocando intenso dolor (cólico nefrítico). Sólo suponen el 5-10% del total de cálculos renales.
Diagnóstico y tratamiento
Se diagnostica por la clínica típica. En algunas ocasiones será necesario el análisis del líquido sinovial (líquido intraarticular), obtenido por punción de la articulación, para analizarlo y diferenciar la artritis gotosa de otros tipos de artritis, como puede ser la infecciosa, por ejemplo. En cuanto al tratamiento:
Fármacos antiinflamatorios no esteroideos (AINE): son los medicamentos más usados para el tratamiento de la crisis de gota aguda. También son analgésicos (calman el dolor).
Fármaco Colchicina : también usado frecuentemente en la crisis aguda, pero presenta efectos secundarios molestos como, por ejemplo, diarrea.
El mismo tratamiento anteriormente mencionado para la hiperuricemia (dieta, control de peso, abstinencia en el consumo de alcohol, alopurinol, diuréticos…).

Artículo especializado
Cómo Prevenir la Caída de Cabello
Después de lavarse el pelo, peinarse, al quitarse el abrigo… ver demasiados cabellos que ya no están en nuestra cabeza y han pasado a formar parte del cepillo, la ducha o la ropa… es una situación que inquieta. En los hombres está más aceptado, pero cuando pasa en la mujer suele generar mucha angustia. En cualquier caso, unos y otros buscan soluciones .
Causas de la caída de pelo
La alopecia no es un proceso con una sola causa. En la mayoría de los casos, l a caída del cabello es un acontecimiento normal, que ocurre con la edad , y comienza en los hombres a partir de los 20 años, y en las mujeres a partir de la menopausia. Depende, sobre todo, de factores genéticos. Sin embargo, además de este tipo de alopecia, la más común, que llamamos “androgenética”, existen otros tipos de alopecia, de hecho, una larga lista, de los cuales vamos a enumerar los más comunes. Lo más habitual es clasificarlas según su carácter cicatricial (que provoca pérdida permanente del pelo por un proceso de inflamación que deja cicatriz) y no cicatricial (la pérdida de pelo se produce por otros problemas y puede ser reversible).
Alopecia cicatricial y no cicatricial
Las alopecias cicatriciales pueden estar causadas, en primer lugar, por heridas o traumatismos en el cuero cabelludo. También pueden ser secundarias a la radioterapia para el cáncer, y a diversas enfermedades de la piel como el lupus, el liquen plano, la alopecia frontal fibrosante, ciertas foliculitis (inflamaciones del pelo) o los tumores.
Las alopecias no cicatriciales incluyen sobre todo la ya mencionada alopecia androgenética, la alopecia areata (de la cual hablaremos de forma más específica), y los llamados efluvios.
¿Cómo distinguirlas?
Para distinguir los dos tipos de alopecia, clasificarlas correctamente y poder iniciar el tratamiento más adecuado, los dermatólogos tenemos varias técnicas . Muchas de ellas pueden ser clasificadas sólo con un buen conocimiento de la tricología, y hay técnicas de laboratorio como el tricograma (examen de los pelos) y la biopsia de la piel del cuero cabelludo. En algunos casos, pueden solicitarse pruebas en una analítica de sangre para confirmar algunos tipos de alopecia asociadas con enfermedades internas.
¿Qué es la alopecia areata?
Se trata de una caída de pelo súbito, en áreas redondas , que pueden ser pocas o múltiples e incluso afectar a todo el pelo del cuerpo. En algunos casos puede llegar a acabar en una alopecia universal (pérdida de todo el pelo). Se clasifica como una alopecia no cicatricial, en la que hay un proceso de ataque del órgano del pelo por unas células del sistema inmunitario llamados linfocitos. No se sabe la causa, aunque se ha atribuido en muchos casos a acontecimientos estresantes como la muerte de un familiar o un desastre natural.
¿Qué son los efluvios?
Los efluvios son alteraciones del ciclo del pelo debidos a múltiples causas. Por ejemplo, un proceso grave como un ingreso en la UCI por un coma puede provocar un efluvio (caída total del pelo) en la fase anágena del ciclo del pelo. En cambio, otros cambios en el organismo como un embarazo suelen provocar efluvios en la fase de telógeno, que se manifiesta meses después del parto. También se habla de efluvios estacionales (caídas de pelo que la mayoría de las personas tienen en la época de otoño) y asociados al estrés y la ansiedad. Los efluvios son siempre reversibles.
¿Existen tratamientos eficaces para la caída del pelo?
Lo más importante es tener un buen diagnóstico de la alopecia , realizada por un especialista en dermatología, la especialidad médica que engloba la tricología (estudio del pelo). A partir de un buen diagnóstico se tendrá un tratamiento adecuado. Por ejemplo, no se trata igual una alopecia areata que una alopecia causada por un lupus. En muchos casos, la caída del pelo es un proceso fisiológico y el tratamiento es menos eficaz. Es importante no automedicarse con vitaminas que en la mayoría de los casos no tienen efecto sobre el pelo.
¿Qué tratamientos hay para las alopecias?
La alopecia más frecuente, la androgenética , habitual en hombres y mujeres, se trata con dos fármacos muy eficaces: el primer se aplica en loción y es el minoxidil, en concentraciones entre el 2 % y el 5 %. El segundo es el finasteride oral (en pastillas). Este último es eficaz y seguro en hombres, pero menos eficaz en las mujeres.
Las alopecias cicatriciales pueden necesitar tratamiento con corticoides, antiinflamatorios, antibióticos o immunosupresores en función del tipo y la gravedad.
La alopecia areata se trata frecuentemente con corticoides en lociones o infiltrados (inyectados en la piel).
Los efluvios se recuperan bien, pero es conveniente estimular la recuperación del cabello, que será más rápida utilizando minoxidil u otros medicamentos prescritos por el dermatólogo.
¿Se puede prevenir la caída del pelo?
Para tener un buen cabello no hace falta tomar suplementos de vitaminas ni aplicarlas en champús o lociones . Basta con seguir una dieta equilibrada, evitar tóxicos como el tabaco, y controlar la posibilidad de tener enfermedades que debilitan el pelo , como las alteraciones de la glándula tiroides. Para prevenir la alopecia areata puede ser útil recurrir a técnicas de reducción y control del estrés.
En el caso de la alopecia androgenética, sobre todo la de los hombres que empieza en la juventud, puede prevenirse la pérdida comenzando a tomar el finasteride en pastillas, siempre bajo prescripción médica y a las dosis adecuadas.

Artículo especializado
10 Recetas para Ser Más Positivo
El pensamiento positivo vende y no porque funcione, sino porque nos recuerda que nuestra vida puede mejorar con tan sólo empezar a pensarlo. Desde los libros tan vendidos de autoayuda, hasta las frases hechas y “retuiteadas”, ejemplifican que la cultura occidental actual vive bajo la opresión del optimismo permanente que transmite que hay que tener un buen estado de ánimo y pensamientos positivos para poder actuar correctamente; pero la realidad es que el comportamiento es independiente y no requiere de pensamientos y un estado anímico alto para poder ejecutarse.
Pasa a la práctica
En otras culturas, estar deprimido no tiene relación con dejar de ir a trabajar o dejar de hacer cosas, sin embargo, en la nuestra, como en la mayoría de los países desarrollados, hemos aprendido que estar desanimado es justificación suficiente para no continuar. Con ello quiero decir que el verdadero pensamiento positivo tiene mucho más que ver con comportarse positivamente que con limitarse a pensar bien; por ello, en este artículo queremos ofrecer unos consejos prácticos , tangibles y al alcance de todos para que, mediante el comportamiento, consigas ser más positivo:
Duerme lo suficiente : mientras dormimos, el cuerpo libera sustancias químicas que ayudan a mitigar las preocupaciones, los malos recuerdos, la tensión, la irritabilidad y además, reducen el estrés. Y es que las personas que no duermen bien o no las suficientes horas pierden parte de su capacidad para tener una mente positiva porque no realizan el “reset” diario que este proceso supone.
¡Desacelera! : cuanto más rápido haces las cosas, menos disfrutas del momento y menos cosas positivas puedes percibir. Así que baja revoluciones, ves más lento y disfruta de los aspectos positivos, que habitualmente pasan desapercibidos, por dejarnos llevar por el ritmo acelerado de la vida.
Rodéate de gente positiva : como los bostezos, el optimismo también es contagioso, así que procura rodearte de compañías positivas y evita, dentro de lo posible, a las personas pesimistas, notarás que resulta muy beneficioso para tu estado de ánimo y para enfocar el mundo con una actitud positiva.
Fake it you feel it (simula ser feliz hasta que lo seas): este es el lema de alcohólicos anónimos, que anima a sus miembros a aparentar fortaleza y paz hasta que ambos sentimientos sean reales. Los sentimientos dependen de las acciones, por ello si quieres sentir diferente, tienes que hacer algo diferente. Numerosas investigaciones demuestran que sólo con sonreír, nuestro estado de ánimo cambia.
Cuida tu lenguaje no verbal: prueba a ser positivo con los hombros agachados y la cabeza mirando hacia abajo y seguramente te resulte bastante complicado, y es que el lenguaje corporal tiene mucha influencia sobre el estado de ánimo. Así que toma consciencia de recolocarte cada mañana y salir al mundo, poniéndote bien recto, con los hombros hacia atrás, pecho y barbilla altos y los brazos extendidos.
Practica ejercicio : los expertos aseguran que hacer ejercicio es igual de bueno que tomar antidepresivos para mejorar el estado de ánimo y ser más positivo. Media hora al día de actividad física generan tal cantidad de endorfinas que lo convierten en el mejor antídoto contra la tristeza y el estrés.
Compra un poco de felicidad : gasta tu dinero en experiencias y no en cosas. Aprende a invertir dinero aquello que te haga feliz como estar en contacto con la familia, los amigos, mejorar la salud y el bienestar, viajar, formarte, resolver conflictos domésticos o de pareja… Recuerda que se positivo depende de lo que haces y no de lo que tienes o piensas.
Practica la resiliencia: este concepto que es originario de la física y la ingeniería hace referencia a la capacidad de la materia para volver a su forma original tras someterse a una presión elevada y en las personas se aplica de igual forma. Aprende de las circunstancias adversas y sobreponte a los traumas, sentirás que sales fortalecido y con una mirada más positiva.
Descubre el gris: evita el pensamiento polarizado, es decir, el todo o nada. Las cosas no son sólo blancas o negras; entre ambos extremos hay muchos matices de gris. Intenta hacer una lista con todos los resultados que pueden darse entre ambas opciones y verás que la situación no es tan dramática como creías. El optimismo reside en rescatar la parte buena de todas las opciones y no solo de la mejor.
Líbrate de la negatividad : limita y corrige los estímulos que recibes diariamente para poder enfocarte positivamente a lo largo de la jornada. Si ves o escuchas las noticias tres veces al día lo normal es que te sientas negativo porque todo lo que captas por los sentidos influye directamente en el estado de ánimo.
Recuerda que lo importante no es si ves el vaso medio lleno o medio vacío. Lo importante es si lo estás llenando o vaciando . Los sentimientos y el positivismo dependen de las acciones y no a la inversa.
Artículo especializado
Cómo Actuamos ante el Sarampión
En nuestro medio, gracias a la vacunación, es una enfermedad prácticamente erradicada . Sin embargo, por desgracia, el sarampión sigue siendo a nivel mundial una de las principales causas de muerte en niños pequeños. Se estima que durante el año 2016 murieron casi 90.000 personas a causa de una infección por sarampión, de las cuales la gran mayoría era menor de cinco años.
Enfermedad grave
El sarampión es una enfermedad vírica muy grave y altamente contagiosa . La vacuna para prevenir la infección por este virus se introdujo en 1963, lo cual ayudó a disminuir las graves epidemias de sarampión que se producían de manera periódica cada dos o tres años que podían llegar a causar la muerte de hasta 2,6 millones de personas al año.
Los programas de vacunación generalizados han influido radicalmente en la reducción de las muertes por sarampión. Del año 2000 al 2016 la vacunación programada ha evitado 20,4 millones de muertes y se ha reducido la mortalidad en un 84%.
Por qué se produce
El agente causante es un paramixovirus, del género morbillivirus, cuyo único huésped, es decir, el organismo dentro del cual el virus se puede reproducir, es el ser humano. Habitualmente se transmite mediante el contacto directo con el paciente infectado o bien por el aire , a través de las gotas microscópicas de saliva que producimos al hablar. El virus coloniza e infecta las vías respiratorias y desde ahí se propaga al resto del organismo. El virus presente en el aire o sobre superficies infectadas se mantiene activo y, por lo tanto, contagioso durante periodos de hasta dos horas. Una persona infectada puede transmitir la infección a otros desde cuatro días antes hasta cuatro días tras la aparición de la erupción cutánea.
Cómo se manifiesta
El primer signo de la infección por el sarampión suele ser la aparición de fiebre elevada, que se inicia alrededor de unos 10-12 días tras haber estado expuestos al virus y que suele durar una semana aproximadamente. Asimismo, en esta primera fase el paciente puede tener síntomas como mucosidad nasal, tos, ojos llorosos y enrojecidos, así como lesiones blancuzcas en la cara interior de las mejillas y la mucosa oral que son características de esta enfermedad.
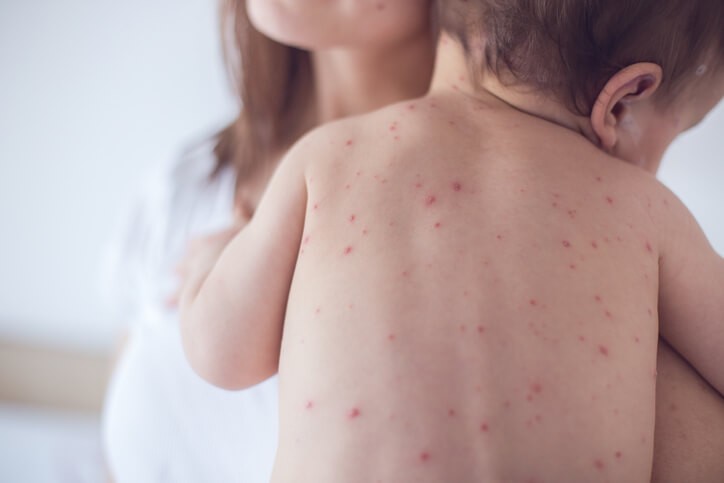
No es hasta al cabo de varios días que aparece la erupción cutánea típica de la enfermedad . Son unas manchitas con un cierto relieve, de color rojizo y que desaparecen al presionarlas con el dedo. La erupción se presenta habitualmente en la cara, la nuca, el cuello, el pecho, la espalada, el abdomen, brazos y manos y, finalmente, se extiende a las extremidades inferiores. En general sigue este patrón de extensión, es decir, va de cabeza hacia los pies. La duración de la erupción cutánea es de aproximadamente una semana y luego desaparece. Entre que se entra en contacto con el virus y aparecen las lesiones cutáneas puede pasar una media de dos semanas. La erupción puede causar un cierto picor, no es dolorosa, y a medida que avanza la enfermedad la coloración de las lesiones se torna marronosa y la piel puede descamarse.
¿Puede complicarse?
La mayoría de las muertes, que en nuestro medio no se suelen dar, se deben a complicaciones de la infección, sobre todo en pacientes menores de cinco años y mayores de 30 años. Las complicaciones más graves son la ceguera, la encefalitis (una infección del sistema nervioso central con edema cerebral), una diarrea copiosa que puede causar deshidratación, otitis o neumonías. Estas complicaciones se dan con mayor frecuencia en niños malnutridos, en aquellos con un aporte deficiente de vitamina A o con un sistema inmunitario debilitado por cualquier causa. La infección también puede provocar complicaciones graves en embarazadas y puede provocar un aborto o un parto prematuro.
¿Existe tratamiento?
Por desgracia, no existe ningún tratamiento específico contra el virus del sarampión . Sí se pueden tratar, sin embargo, las complicaciones derivadas de su infección. Los niños diagnosticados de sarampión deben recibir dos dosis de vitamina A para restaurar los niveles de vitamina A, que durante la infección suelen ser bajos incluso en los niños sin problemas de malnutrición. Unos niveles correctos de vitamina A son útiles para prevenir las complicaciones oculares del sarampión y han demostrado reducir a la mortalidad las tasas de mortalidad por esta enfermedad.
La vacunación
La vacunación sistemática de los niños contra el sarampión es una estrategia de salud pública esencial para reducir la mortalidad mundial por esta infección vírica . La vacuna contra el sarampión es segura, eficaz y barata, y está incluida dentro de nuestro calendario vacunal. La vacuna contra el sarampión se administra conjuntamente con la vacuna de la rubéola y la parotiditis, en la vacuna llamada triple vírica. La vacunación contra el sarampión se administra en dos dosis, una primera a los doce meses de vida y una segunda a los tres años, dado que aproximadamente un 15% de los niños vacunados no adquieren la inmunidad con la primera dosis. La vacuna triple vírica está formada por virus atenuados y contiene proteína de huevo y trazas de antibióticos, con lo cual hay que tenerlo en cuenta por posibles alergias. Si se tiene que poner otra vacuna atenuada, debe ponerse o simultáneamente o con cuatro semanas mínimo de diferencia, nunca menos tiempo.
Así pues, el sarampión es una enfermedad que vemos poco en gran parte gracias a las campañas de vacunación que se llevan a cabo, evitando así una enfermedad que puede tener complicaciones graves y potencialmente mortales. En caso de sospechar que se puede haber contagiado de esta enfermedad y tener dudas de si se han recibido las dosis adecuadas de vacunación es importante acudir cuanto antes a un servicio de urgencias.

Artículo especializado
Causas y Tratamientos de la Pérdida de Peso
Si bien es cierto que muchas personas luchan para frenar su aumento de peso a lo largo de los años o en un momento concreto de su vida, también existe otra situación contraria en la que alguien puede experimentar una disminución de peso involuntaria y de forma gradual o repentina . Esta situación no es inusual en adultos ya que representa el 1,3-3% de los pacientes hospitalizados en Medicina Interna y el 13% de las personas mayores en consulta ambulatoria.
¿Qué se conoce como pérdida de peso involuntaria?
Cuando una persona no está realizando ninguna dieta de pérdida de peso ni ha experimentado fluctuaciones importantes de peso previamente y, sin causa aparente, pierde el 5% de su peso corporal normal en un período de seis a 12 meses o en un período inferior, se considera que dicha pérdida es clínicamente importante ya que se asocia con un incremento de la morbimortalidad.
Si es tu caso, te recomendamos acudir a tu médico para que realice las pruebas diagnósticas adecuadas para valorar su etiología y actuar en base a sus causas. No obstante, a continuación, te detallamos más información acerca de los principales factores que pueden provocar una disminución de peso y sus posibles tratamientos.
Causas de la pérdida de peso
Ante una disminución de peso relevante, debemos plantearnos qué factor o factores influyen en ella ya que en la mayoría de los casos no hay una única causa. Las principales causas son:
Orgánica.
Psiquiátrica.
Farmacológica.
Idiopática (de causa desconocida).
Psicosocial (cuando la ingesta dietética es inadecuada, deben investigarse factores como la falta de recursos económicos para obtener alimentos).
Fisiológica debidas al envejecimiento (sequedad de boca, pérdida de piezas dentarias, alteración del gusto, etc.)
En la siguiente tabla se recogen de forma más específica estas causas y algunas de sus enfermedades asociadas :
Orgánica
Enfermedades gastrointestinales: malabsorción intestinal, celiaquía, enfermedad de Crohn, úlceras pépticas, otras patologías que cursen con diarreas crónicas.
Neoplasias: gastrointestinales, hepáticas, renales.
Enfermedades infecciosas crónicas: VIH, tuberculosis, virus de hepatitis C, infecciones pancreáticas y pulmonares.
Enfermedades pulmonares: EPOC (enfermedad pulmonar obstructiva crónica).
Enfermedades neurológicas: Parkinson, ACV (accidente cerebrovascular), ictus, ELA (esclerosis lateral amiotrófica).
Enfermedades endocrinas: hipertiroidismo, alteraciones de las glándulas suprarrenales, diabetes mellitus.
Enfermedades cardíacas: insuficiencia cardíaca grado III-IV.
Enfermedades renales: insuficiencia renal aguda.
Psiquiátrica
Depresión.
Estrés agudo.
Ansiedad.
Fase maníaca del trastorno bipolar.
Psicosis paranoide.
Anorexia nerviosa.
Farmacológica
Uso de drogas de forma crónica: alcohol, marihuana, opiáceos anfetaminas, cocaína.
Fármacos: anticomiciales, uso excesivo de laxantes, quimioterapia, antipsicóticos, antitiroideos, hipoglucemiantes e insulinas, fármacos utilizados en insuficiencia cardíaca y Parkinson, algunos productos de herboristería.
Manejo diagnóstico de la pérdida de peso
Para conocer los factores que pueden estar condicionando la pérdida de peso, es muy importante que el especialista realice una correcta anamnesis del caso para conocer el historial de la persona y hacer las pruebas diagnósticas oportunas que permitan realizar un correcto diagnóstico y, en base a éste, pactar un tratamiento adecuado
El abordaje diagnóstico inicial se debe hacer en Atención Primaria (AP) con el objetivo de determinar si existe alguna patología orgánica grave o si la causa es psicológica o de causa desconocida .
En todo caso, el diagnóstico debe comprender los siguientes aspectos:
Anamnesis detallada : en ella, se deben recoger datos como el historial de peso y sus fluctuaciones en de los últimos años así como la intencionalidad de perder peso o dietas hechas anteriormente.
También se debe realizar una valoración del estado nutricional a través de un registro de ingestas y de actividad física habitual , así como evaluar si existe una pérdida del apetito y la causa que la ha originado. En la mayoría de las veces, hay asociados estados de depresión (debido a la pérdida de familiares, rupturas sentimentales, etc.), ansiedad o estrés que comportan una pérdida de apetito. En estos casos el médico debe derivar al paciente al psicólogo o psiquiatra para que establezca un tratamiento que restaure la normalidad psicológica y la persona pueda recuperar su peso habitual.
En esta anamnesis también es importante tener en cuenta las características de dos grupos de población con situaciones especiales:
En las personas mayores es muy frecuente el deterioro cognitivo y la depresión , así como un uso crónico de medicación. Además se deben tener en cuenta los aspectos psicosociales (falta de recursos económicos) y fisiológicos (dificultad para tragar, falta de piezas dentales, etc.) que pueden conllevar una alimentación deficitaria
Durante la adolescencia, se pueden desarrollan trastornos del comportamiento alimentario (anorexia, bulimia, etc.) que pueden dar lugar a una pérdida excesiva y descontrolada de peso. En estos casos es imprescindible el abordaje psicológico para su tratamiento.
Analítica básica incluyendo: bioquímica de sangre con glucosa, función renal y hepática, electrolitos e iones calcio y fósforo, reactantes inespecíficos (proteína C reactiva y velocidad de sedimentación globular), lactato deshidrogenasa, albúmina, TSH, serología para VIH, test de sangre oculta en heces y bioquímica de orina.
Exploraciones generales : estado general de la persona (incluyendo sensaciones de cansancio o astenia), y exploración de piel y otros órganos: sistema ocular, otorrino, cavidad oral, tiroides, estado cardiopulmonar, abdominal, neurológico, músculoesquelético y exploración de mama o próstata si fuera necesario
Pruebas complementarias (mediante aparatos de diagnóstico por imagen): radiografía de tórax, ecografía abdominal, tomografía computarizada (TC) torácica, abdominal o craneal, colonoscopia, endoscopia, mamografía,
Tratamiento de la pérdida de peso
El tratamiento a seguir debe ser prescrito en base a la causa que ha originado la disminución de peso , por lo que se puede considerar que la terapia puede ser farmacológica, psicológica o nutricional.
Si la causa es desconocida o el peso es consecuencia de un mal estado de nutrición sin causa psicológica ni orgánica, podemos llevar a cabo una alimentación hipercalórica que nos permita restaurar un peso saludable.
¿Cuáles son las bases de una alimentación para ganar peso de forma saludable?
Estructurar la ingesta de alimentos en diferentes tomas durante el día según el apetito de cada persona.
No es necesario que en cada comida principal haya mucho volumen o cantidad de comida en el plato: lo importante es comer alimentos saludables con elevada densidad calórica como las grasas saludables presentes en frutos secos, aceite de oliva o aguacate.
Evitar alimentos hipercalóricos poco saludables: productos de bollería, postres azucarados, alimentos precocinados con grasas saturadas (pizzas, empanadas, etc.), patatas chips, refrescos azucarados, etc.
Consumir alimentos vegetales como frutas y verduras, que deberían estar presentes cinco veces al día.
Realizar una adecuada ingesta de proteínas (en torno a los 1.2 gr de proteínas/Kg de peso corporal) ya sea de origen animal (pescados, carnes, huevo) como de origen vegetal (lentejas, garbanzos, alubias, etc.)
Incluir cereales integrales y féculas en la mayoría de ingestas del día: pan integral, copos de avena, arroz integral, pasta, quinoa, patata o boniato.
Tomar los lácteos enteros (leche, yogures y quesos).
Enriquecer los platos con frutas desecadas, frutos secos, aguacate, aceite de oliva, leche en polvo (en purés), aceitunas, pan rallado o huevo rallado.
Se puede beber, además de agua, batidos de frutas enteras con leche.
Por último, y no menos importante, es indispensable llevar a cabo unos hábitos de ejercicio físico que nos permitan mantener una adecuada proporción de masa muscular y masa grasa. Por ello es necesario combinar actividades aeróbicas con ejercicios de fuerza muscular correctamente pautados por un profesional de la actividad física.
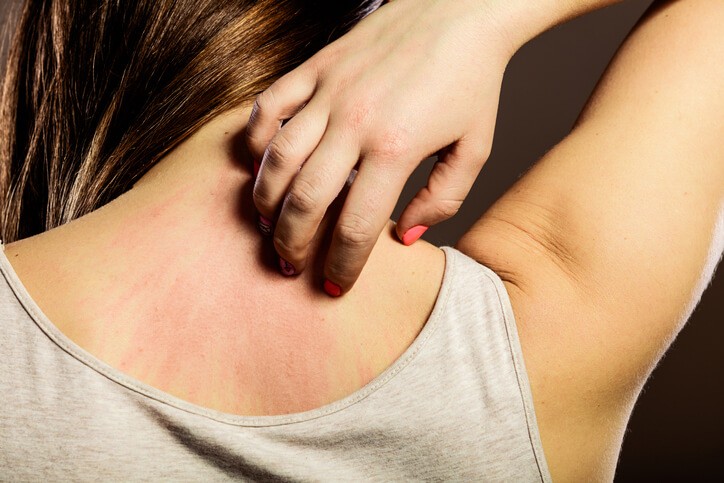
Artículo especializado
Causas y Tratamientos del Picor
El picor no sólo aparece como resultado de problemas de la piel, sino que también es un síntoma de alteraciones en otros órganos . Puede afectar mucho a la calidad de vida y, sobre todo, provocar alteraciones del sueño y del ánimo. Además, puede ser el síntoma único de enfermedades del riñón, del hígado o de la sangre, y permitir el diagnóstico precoz de éstas. El especialista indicado para estudiar el picor es el dermatólogo .
Prurito causado por enfermedades de la piel
Existen muchas enfermedades de la piel que se acompañan de prurito, ya que muchos procesos en los que hay inflamación conducen a la liberación de sustancias en la epidermis y la dermis que activan los receptores del picor. Además, el picor conduce irremediablemente al rascado, que a su vez provoca más inflamación y más picor . Este círculo vicioso de picor-rascado debe controlarse y romperse para solucionar el problema.
La enfermedad por antonomasia que provoca prurito es el eccema o dermatitis , y la más importante dentro de este grupo es la dermatitis atópica. Es un proceso propio de las personas de naturaleza alérgica, que se acompaña de defectos en la hidratación de la piel, y una sensibilidad de la misma ante el contacto con la sequedad y los irritantes externos. Otro tipo de eccema es la dermatitis de contacto alérgica, que puede venir causada por el contacto con innumerables sustancias, y siempre provoca brotes de picor y dermatitis. Debe estudiarse mediante unas pruebas de alergia especiales llamadas pruebas epicutáneas, o pruebas del parche. Otro eccema frecuente es el provocado simplemente por la piel seca, el llamado eccema asteatósico. Puede ser el resultado de un exceso de ducha o de jabón, que destruye la capa de grasa protectora de la piel, y aumenta el picor. Es especialmente frecuente en personas de edad avanzada, y en invierno.
Las urticarias también provocan intenso picor, y la mayoría de ellas no son resultado de un proceso alérgico, por lo que cansar al paciente con pruebas de alergia no suele ser una buena estrategia para estudiarlas. En muchos casos, pueden estar provocadas por fenómenos de autoinmunidad (una reacción en la que las propias defensas de la piel -el sistema inmunológico- reacciona contra el propio organismo).
Otras enfermedades dermatológicas que provocan picor en la piel pueden ser infecciones como el impétigo y la sarna.
En todas estas enfermedades el prurito se acompaña de signos en la piel que pueden permitir fácilmente el diagnóstico al dermatólogo, mediante la simple exploración o ayudándose de una biopsia o una analítica en sangre.
Prurito causado por otras enfermedades de otros órganos
El picor puede ser el síntoma de una enfermedad del riñón o el hígado . Las personas con mal funcionamiento de estos órganos acumulan diversas toxinas y sustancias que provocan picor. Es especialmente molesto en los pacientes con insuficiencia renal, sobre todo en los sometidos a diálisis (una máquina a la que deben conectarse varias veces a la semana para depurar su sangre). En las personas que padecen una enfermedad del hígado o las vías biliares, el aumento de sustancias como la bilirrubina también provoca picor. Lo mismo ocurre en aquellos que desarrollan cirrosis, una enfermedad del hígado.
Los pacientes con alteraciones de la sangre, como los que tienen una baja cantidad de hierro o una anemia, pueden manifestar el picor como el síntoma inicial. Lo mismo es aplicable a los enfermos de la glándula tiroides, o los diabéticos.
¿PICOR SIN MOTIVO?
En algunos pacientes, el picor es inexplicable a pesar de haber agotado todas las posibilidades de diagnóstico, y no puede atribuirse a ninguna enfermedad. Hay que tener mucho cuidado con este síntoma, porque puede ser psicógeno (es decir, provocado por una alteración del ánimo, como una depresión) o puede estar provocado por una enfermedad oculta que no “ha dado todavía la cara”, como los linfomas (cáncer de los ganglios linfáticos). Ante cualquier picor inexplicable, el médico debe seguir visitando al paciente, intentar controlar el picor con medicación, y reexplorarlo o volver a solicitar pruebas para seguir descartando enfermedades ocultas.
¿Cómo se trata el picor?
En primer lugar, debe tratarse la enfermedad causante, una vez identificada . El picor como síntoma puede tratarse con cremas y con medicamentos en pastillas.
En muchas ocasiones, se aplican cremas hidratantes que contienen sustancias contra el picor como la urea o el polidocanol.
En otros casos, hay que utilizar los corticoides en crema, aunque es muy importante que sean prescritos por un médico, con una potencia y una forma farmacéutica adecuada, y nunca deben aplicarse durante periodos largos de tiempo, ya que provocan atrofia de la piel y otros problemas.
En caso de emplear la medicación por vía oral (en pastillas), los antihistamínicos son los medicamentos más empleados. Bloquen la acción de la histamina, una sustancia del organismo implicada en la producción del prurito. Existen varios tipos de antihistamínicos, algunos más sedantes y otros más selectivos, que provocan menos sueño. Nunca deben emplearse los antihistamínicos en crema, porque son poco eficaces y provocan con frecuencia alergias de contacto.
Existen otro tipo de medicamentos capaces de mejorar el picor, como ciertos antidepresivos y otros fármacos que pueden emplearse para la depresión o la ansiedad. Son el tratamiento a emplear en las personas que tienen un prurito psicógeno.
Además, algunas enfermedades que cursan con picor pueden tratarse con fototerapia, un tipo de tratamiento con rayos ultravioleta que se realiza en los servicios de dermatología de los hospitales. No se emplean en general los rayos UVA que la gente utiliza para broncearse, sino otro tipo de radiación llamada ultravioleta B de banda estrecha. Como la exposición a radiación ultravioleta puede provocar cáncer de piel, estos tratamientos deben de hacerse de forma controlada y siempre bajo supervisión médica.

Artículo especializado
Calidad de Vida de las Personas que Llevan Prótesis
Los ojos, los brazos, las manos, las piernas, el pabellón auditivo, la mama o las articulaciones pueden ser reemplazados por prótesis. El objetivo principal es que la prótesis cumpla las mismas funciones que la parte faltante o sustituida . Cuando la indicación de la prótesis está establecida y, a pesar de ser una cirugía complicada, su colocación va a suponer un cambio espectacular en la calidad de vida del paciente.
Una prótesis es un instrumento diseñado para reemplazar una parte faltante o enferma del cuerpo o para sustituir una parte del cuerpo con la finalidad de mejorar su función. Como curiosidad, diremos que la palabra prótesis procede del griego y se traduciría por “poner antes”. Es decir, sustituye una parte dañada por un artilugio que contacta con la parte sana. La filosofía es retirar la parte dañada y conectar la prótesis con la parte sana.
Tipos de prótesis
Prótesis ortopédicas : en nuestro medio, afortunadamente, la gran mayoría de prótesis son colocadas para reemplazar articulaciones artrósicas, sobre todo caderas y rodillas. Serían, pues, prótesis ortopédicas que reemplazan un miembro o una articulación del cuerpo, cumpliendo casi la misma función que un miembro natural, sea una pierna, un brazo, un pie, una rodilla, una mano, etc.
Prótesis estéticas: su finalidad es devolver el aspecto físico a una persona tras una amputación, por ejemplo, de una mama afecta de cáncer de mama o de un ojo tras un accidente de tráfico.
Prótesis funcionales : son las empleadas para sustituir amputaciones ya sean traumáticas o por enfermedades metabólicas o por agenesias de nacimiento. En el entorno laboral son, desgraciadamente, frecuentes tras atrapamientos de extremidades en maquinarias industriales.
¿Prótesis u ortesis?
Antes de continuar vamos a incidir en un punto: ¿es lo mismo una prótesis que una ortesis? La respuesta es “no”. Es frecuente utilizar ambos nombres como sinónimos, sin embargo, siendo puristas, no son equivalentes. Una ortesis no sustituye ni total ni parcialmente a un miembro, sino que es un dispositivo que se aplica externamente al cuerpo mejorando su estructura o función. Por ejemplo, una ortesis sería una plantilla, cuya finalidad es la de mejorar el apoyo podal y la marcha. Otro ejemplo sería un corsé, cuyo objetivo sería corregir desviaciones de la columna vertebral. ¿Podríamos llamar ortesis a un recambio de la articulación de la rodilla? La respuesta es “no” y ya sabemos por qué: porque en este caso se habría sustituido a la rodilla artrósica por una articulación nueva o prótesis total de rodilla. ¿Y qué sería un collarín cervical? Clarísimamente una ortesis. ¿Aprecias la diferencia? En adelante ya sabremos diferenciar los dos conceptos claramente.
¿SABÍAS QUE…
La primera prótesis fue encontrada en una momia egipcia en el año 300 a.C. Sus materiales han ido evolucionando a lo largo del tiempo, siendo inicialmente de madera y actualmente de titanio. Hoy en día existen innumerables prótesis comercializadas de cualquier estructura anatómica : prótesis auditivas, prótesis oculares, prótesis sexuales, prótesis dentales, etc.
Prótesis articulares
La primera cirugía de reemplazo de rodilla se realizó en 1968. Han cambiado mucho las técnicas quirúrgicas y los materiales empleados desde entonces. El reemplazo total de rodilla es considerado como uno de los procedimientos más exitosos de la medicina en la actualidad . Su indicación no es sólo la artrosis severa, también se emplea como tratamiento definitivo en enfermedades reumáticas y osteodegenerativas.
La edad media de los pacientes sometidos a una cirugía de reemplazo total de rodilla o cadera oscila entre los 50 y los 80 años pudiendo realizarse en pacientes más jóvenes afectos de patología reumática severa, sobre todo.
No existen contraindicaciones absolutas para la colocación de una prótesis articular. Sin embargo, debe valorarse el riesgo quirúrgico en pacientes comprometidos . Asimismo, el paciente debe ser conocedor de las posibles complicaciones que pueden aparecer tras la cirugía y antes de someterse a la misma. Es importante recordar que tras la cirugía el paciente deberá someterse a un tratamiento rehabilitador que comienza a las 24 horas de salir de quirófano. La finalidad perseguida es restablecer el movimiento articular y desempeñar las actividades cotidianas normales.
¿Qué aporta una prótesis?
En más del 90% de casos el paciente experimenta una reducción drástica del dolor y una mejoría significativa en su actividad cotidiana (vuelve a realizar actividades que no realizaba desde hacía tiempo debido al dolor). Recordemos que entra en quirófano con una rodilla afecta de artrosis severa y sale del mismo con una rodilla de titanio.
¿Hay algún inconveniente?
Ya hemos mencionado la posibilidad de complicaciones post-quirúrgicas (las más frecuentes son la infección de la herida o la aparición de un problema vascular). El gran inconveniente sería que la prótesis articular tiene una fecha de caducidad, es decir, también se desgasta como el hueso original . Por ello se recomienda recambio de prótesis cuando el material se deteriora. Por eso, cuanto más tarde se coloque la primera prótesis menos recambios tendrá que sufrir el paciente.
La actividad excesiva o el exceso de peso pueden agravar el desgaste normal de una prótesis, por ello se desaconsejan la práctica de actividades de alto impacto como correr o saltar con frecuencia. Ello no quiere decir que la persona portadora de una prótesis no pueda disfrutar de las siguientes actividades con toda normalidad: caminar, nadar, conducir, senderismo, bicicleta, baile, yoga, gimnasia o cualquier deporte de bajo impacto. ¿Y qué ocurre si la prótesis se desgasta? Ningún problema. Podemos colocar un nuevo recambio.

Artículo especializado
Prevención y Cura de la Salmonelosis
Cuando empieza a hacer calor es cuando volvemos a escuchar o leer sobre las advertencias para evitar la salmonelosis. Y es que esta infección de origen alimentario está causada por la bacteria salmonella, cuya multiplicación es más rápida cuanta más alta es la temperatura ambiental.
Esta bacteria puede habitar en el intestino de los animales y humanos y cuando es expulsada a través de las heces, si el ambiente es el adecuado, puede contaminar el alimento por su gran capacidad de multiplicarse, algo que hace más rápidamente si hace más calor. Sin embargo, la salmonella es sensible al calor y si la temperatura de cocción del alimento supera los 70ºC, muere por calentamiento. Debemos tener en cuenta, además, que el contagio por salmonella no sólo se da en alimentos , también puede darse a través de animales domésticos, especialmente en aves y réptiles (tortugas) si después se tocarlos nos ponemos los dedos en la boca.
¿Qué síntomas da la salmonelosis?
La salmonella apenas altera el color, el sabor, ni la textura del alimento, y no se reconoce por ningún cambio de sabor . Por este motivo, sabremos si nos hemos infectado por los síntomas que se manifestarán entre las 6-72 horas tras haber ingerido un alimento infectado.
Los síntomas suelen durar de dos a siete días, aparecer de forma brusca y se caracterizan por fiebre, náuseas, vómitos, diarrea que puede ser acuosa o sanguinolenta y dolor abdominal. En la mayoría de los casos la infección suele ser leve y se autolimita de forma espontánea, de forma que uno se recupera sin necesidad de tratamiento. En algunos casos, la enfermedad puede ser más grave e incluso precisar hospitalización por la deshidratación causada y ser necesario la toma de antibióticos. Los más susceptibles en este caso suelen ser niños, ancianos y personas con las defensas bajas.
¿En qué alimentos se puede encontrar la salmonella?
Los alimentos que tienen mayor probabilidad de estar contaminados son:
Huevos frescos o crudos. Algunos huevos pueden contener salmonella si la gallina está infectada y produce el huevo antes de que se forme la cáscara. Por eso, aunque la cáscara no tenga ningún defecto puede ser un foco de infección si se consume crudo o poco cocido.
Carnes, especialmente las aves (pollo, gallina, pavo…) y carnes picadas (hamburguesas, salchichas, albóndigas…). Durante el despiece del animal las heces pueden contaminar la carne. Los mariscos también pueden estar contaminados si se crían en agua contaminada.
Lácteos no pasteurizados (leche cruda, queso crudo…)
Frutas y verduras. Algunos alimentos frescos, como frutas y verduras, pueden contaminarse con agua contaminada con salmonella durante el regado del campo o en el lavado durante el procesamiento. También puede ocurrir en la cocina si entran en contacto con jugos de carnes y aves crudas, produciéndose lo que se conoce como contaminación cruzada.
¿Qué medidas higiénicas podemos tomar para prevenir la salmonelosis?
Lavarse las manos con frecuencia y en especial antes de iniciar la manipulación y después de tocar los alimentos crudos, para evitar la contaminación cruzada.
Utilizar utensilios limpios y lavarlos cada vez que se empleen tanto para la elaboración de alimentos crudos como para los alimentos ya cocinados, evitando así el contacto de unos con otros.
Desinfectar las superficies y los utensilios después de haberlos utilizado en la manipulación de alimentos crudos.
Lavar los vegetales y las frutas, y usar desinfectante alimentario, especialmente en los vegetales crudos para la preparación de ensaladas.
Cocinar los alimentos asegurándose de que el interior del alimento alcanza una temperatura mayor a los 70ºC, ya que así se destruyen los gérmenes patógenos y la salmonella. Evitar que tanto los huevos como las carnes de ave y las carnes picadas queden poco hechos en su interior o crudos.
Se aconseja, una vez cocinados los alimentos, mantenerlos en el frigorífico o en el congelador, nunca a temperatura ambiente.
SOBRE EL HUEVO
Mención aparte requiere el huevo. Para hacer un buen uso y evitar posibles infecciones se aconseja :
Evitar adquirir los huevos sucios o rotos.
Si no lo podemos comprobar porque están envasados, escogeremos siempre, una vez abierto el envase, los limpios y sin defectos y desecharemos los que tengan la cáscara con algún signo de suciedad o defecto.
Para preparaciones que contienen el huevo crudo (helados caseros, cremas, mayonesa o salsas) utilizaremos el huevo pasteurizado, y para otras preparaciones nos aseguraremos de que está bien cocido y no queda crudo (tortilla, huevo cocido, huevo duro…).
Los huevos siempre se deben guardar en el frigorífico y nunca deben estar a temperatura ambiente.
¿Qué comer si ha contraído la salmonelosis hasta que la infección haya desaparecido?
Si tenemos diarrea y vómitos existe riesgo de deshidratación. Es necesario rehidratar y reponer líquidos bebiendo abundante agua, agua de limón, agua de arroz y zanahoria, caldos desgrasados y, en niños, se puede utilizar, aconsejado por el médico, una solución de rehidratación oral con electrolitos. La diarrea es la forma natural en que el cuerpo expulsa la infección y, mientras dure, no se aconseja comer alimentos sólidos ni leche ya que empeora el cuadro.
Cuando cesen los vómitos y la diarrea se puede empezar a consumir alimentos sólidos y seguir una dieta blanda con alimentos de fácil digestión.
Esta dieta terapéutica está indicada cuando necesitamos que el aparato digestivo trabaje lo mínimo, para facilitar su recuperación.
¿Qué alimentos incluye la dieta terapéutica?
Cereales refinados: pasta, pan tostado o del día anterior, arroz, cuscús hervidos.
Féculas: patata hervida o al vapor.
Carnes blancas: pollo y pavo. Pescado blanco: merluza, rape, gallo… a la plancha, hervido o al vapor (con muy poco aceite).
Huevos: inicialmente sólo la clara. En el caso de buena tolerancia y si la dieta debe realizarse muchos días también puede incluir la yema, pero sólo hervida o en tortilla francesa.
Lácteos naturales y poco grasos: yogur natural (sin azúcar ni edulcorantes). En el caso de buena tolerancia y si la dieta debe realizarse muchos días también puede incluir queso fresco o requesón.
Fruta: compotas sin azúcar o fruta cocida o asada como la manzana o el plátano maduro.
Grasas: pequeñas cantidades de aceite de oliva o aguacate.
Bebidas: agua, agua de limón, agua de arroz y zanahoria, caldos desgrasados.
Verduras cocidas o en forma de puré: excluiremos siempre las crucíferas (nunca crudas).
Caldo vegetal colado (sin fibras).
Legumbres: nunca enteras, sino en puré o pasadas por el chino para eliminar la piel. Debe probarse primero la tolerancia con una pequeña cantidad y en el caso de ser bien toleradas tomar sólo una cantidad moderada.
¿Qué alimentos excluye?
Cereales integrales, galletas y bollería.
Carnes rojas, fibrosas y embutidos. Pescados azules y mariscos.
Lácteos: leche, quesos curados, postres lácteos azucarados tipo flan, natilla, etc. (contiene muchos azucares y grasas).
Vegetales crudos o crucíferas: brócoli, coliflor, puerro, coles… (aunque sean cocidos).
Fruta cruda, excepto el plátano muy maduro.
Legumbres: ninguna legumbre entera.
Bebidas: café, té, alcohol, zumos, refrescos.
Otros: chocolate, dulces, frituras en general, salsas, snacks, picantes, encurtidos, vinagre, alimentos azucarados, alimentos muy especiados, tabaco…
Artículo especializado
Qué Debes Saber sobre la Quimioterapia
Hablar de quimioterapia implica hacerlo de cáncer y eso, lo sabemos, no resulta agradable. Sin embargo, si pensamos en la quimioterapia como una de las terapias que salva vidas, ya que se utiliza para destruir y prevenir el crecimiento, multiplicación y diseminación de las células malignas y/o cancerosas , sin duda vale la pena saber más. Y más si tenemos en cuenta que abarca una amplia variedad de estrategias y abordajes terapéuticos que, a menudo, generan confusión en el paciente por la dificultad en su comprensión o por falta de información específica proporcionada. Vayamos por partes…
¿A qué nos referimos cuando hablamos de quimioterapia?
La quimioterapia es un amplio conjunto de fármacos que se emplean en medicina como tratamiento del cáncer. Tiene como principal objetivo combatir las células de organismo que presentan un anormal crecimiento, bien sea destruyéndolas o controlando su crecimiento. Es en este momento de división celular incontrolada cuando la quimioterapia produce la destrucción de las células cancerosas para evitar que éstas continúen multiplicándose .
La duración y frecuencia de cada tipo de quimioterapia dependen del tipo de cáncer a tratar, de los objetivos del tratamiento, de los fármacos usados y de la tolerancia y respuesta del paciente al tratamiento.
¿Cuáles son los principales objetivos al realizar el tratamiento?
En función de los objetivos pretendidos para el tratamiento de cada tipo de cáncer, los fármacos quimioterápicos pueden administrarse de diferentes maneras, lo que se conoce como estrategias quimioterápicas .
Por ello, es habitual que, en función del tipo de patología oncológica, se intente disminuir el tamaño del tumor antes de realizar una intervención quirúrgica (quimioterapia neoadyuvante), curar o eliminar la diseminación del cáncer para evitar recaídas futuras (quimioterapia adyuvante) o controlar los síntomas con la intención de mejorar la supervivencia y la calidad de vida del paciente (quimioterapia paliativa).
El abordaje de estas estrategias quimioterápicas suele ser multidisciplinario . Además del oncólogo, el cirujano y el radioterapeuta, suelen participar otros médicos de diferentes especialidades, farmacéuticos químicos, psicólogos, personal de enfermería o nutricionistas.
¿Cuáles son las principales vías de administración de estos fármacos?
La quimioterapia puede administrarse diariamente, cada semana o cada mes, mediante ciclos, que alternan la administración de fármacos con períodos de descanso. Esto permite al organismo volver a fabricar células sanas y recuperarse del efecto de la medicación. Existen diferentes vías de administración:
Oral : en cápsulas, pastillas, granulados y otras soluciones bebibles.
Inyectada : intravenosa o intraarterial, intramuscular, subcutánea o intratecal (en la médula).
Tópica : sobre la piel u otras mucosas.
La administración intravenosa es el método más común de administración de la quimioterapia, puesto que permite una rápida entrada en el sistema circulatorio. El torrente sanguíneo se encarga de transportarla por todo el organismo y la mayoría de fármacos son fácilmente absorbidos en un menor tiempo y con una mayor velocidad.
¿Cuáles son los principales efectos secundarios que se pueden producir y por qué?
En farmacología, ningún tipo de tratamiento con medicamentos se libra de producir algún tipo de efecto secundario sobre el organismo a pesar de que la gran mayoría de fármacos van dirigidos sobre unos receptores celulares concretos.
Desafortunadamente, el inconveniente principal es que la actuación de estos fármacos no discrimina entre las células sanas y las cancerosas. Por tanto, la acción de estos fármacos sobre las células sanas es la que produce los efectos secundarios. Por lo anterior, cabe esperar que los órganos y tejidos del cuerpo humano que más afectados por el tratamiento quimioterápico sean aquéllos que se encuentran en constante multiplicación celular, es decir, los que continuamente se están regenerando.
Por ello, los efectos secundarios más frecuentes se van a evidenciar sobre: el cabello, que crece continuamente durante toda la vida; la piel, la mucosa oral y gastrointestinal, que se renuevan rápida y constantemente; o la médula ósea, un tipo de tejido esponjoso que se encuentra en el interior de algunos de los principales huesos del organismo en donde se desarrollan todas las células sanguíneas. Es importante recordar que casi todos los efectos secundarios de la quimioterapia son temporales.
¿SIEMPRE HAY EFECTOS SECUNDARIOS?
Estos efectos secundarios no siempre se producen . Su aparición depende del tipo de tratamiento, de las dosis farmacológicas utilizadas, de la vía de administración y de cómo reaccione cada paciente, entre otros múltiples factores. El hecho de no presentar efectos secundarios no es sinónimo de que el tratamiento no esté funcionando.
El tratamiento contra el cáncer no es sólo la quimioterapia…
Además de la cirugía, la radioterapia, la quimioterapia y otras estrategias farmacoterapéuticas que pueden llevarse a cabo, la batalla contra el cáncer tiene un importante componente psicosocial de la persona afectada. Un buen estado anímico y una actitud mental positiva contribuyen de manera efectiva a un mejor pronóstico de la enfermedad. Asimismo, igual de trascendental es intentar mantener un ejercicio físico suave y diario como caminar, junto con una dieta sana y equilibrada para mejorar el bienestar del organismo.
 Savia
Savia