Artículos Especializados

Artículo especializado
Serología: ¿Qué es y para qué sirve?
Cuando existe una sospecha de una infección, existen diferentes métodos para identificarla. Por un lado, están los métodos directos: los cultivos de sangre u orina (hemocultivos y urocultivos). Con estos métodos podemos identificar directamente el agente causal de la infección la muestra (sangre u orina, por ejemplo).
Por otro lado, están los métodos indirectos, como la serología: se basan en demostrar que nuestro sistema inmune se ha visto expuesto al agente causal de la infección.
A continuación, revisaremos en que consiste esta prueba.
¿Qué es una serología?
Una serología, prueba serológica o test serológico consiste en la identificación en el suero de la sangre de los anticuerpos específicos encargados de neutralizar a un agente infeccioso.
Cuando nuestro sistema inmune se ve expuesto a un agente infeccioso, este sintetiza un tipo de proteína llamada inmunoglobulina o anticuerpo , que es específica para este tipo de microorganismo.
Una serología permite determinar estos anticuerpos que indican de manera indirecta que nuestro cuerpo ha estado en contacto con el agente infeccioso.
Existen diferentes tipos de inmunoglobulinas, sin embargo, las que más se utilizan con fines diagnósticos son la IgM y la IgG:
La inmunoglobulina M (IgM) suele indicar infección activa; nuestro organismo se ha visto expuesto de manera reciente a dicho microorganismo.
La inmunoglobulina G (IgG) suele indicar infección crónica; nuestro organismo se ha visto expuesto a una infección en un momento determinado y posteriormente recuerda esta exposición para poder generar una respuesta inmune eficaz en el futuro. Suele indicar protección duradera contra un microorganismo.
Cuando tenemos positivizad de las dos de manera simultánea, suele indicar que nuestro organismo está combatiendo la infección de manera satisfactoria, luchando contra la infección activa y generando anticuerpos para generar una respuesta inmune eficaz en el futuro.
Además, los test serológicos también son útiles para averiguar si nuestro cuerpo ha generado respuesta inmune eficaz a diferentes tipos de vacunas.
Serología covid
La serología puede servir para ver si el paciente ha hecho una respuesta eficaz a la vacuna.
En este caso, se detecta un tipo de anticuerpo específico denominado anti-spike. El virus SARS-CoV-2 tiene varias proteínas, aunque con la vacuna solamente inoculamos una parte denominada SPIKE. Por lo tanto, se trataría de determinar las inmunoglobulinas anti-Spike de tipo IgG que como se indicó anteriormente, indican protección.
Otro caso es la detección de anticuerpos que producen las defensas del organismo frente al virus SARS-CoV-2. Este tipo de pruebas inmunológicas sirven para saber si una persona ha pasado la infección por el virus y, de este modo, evalúa la inmunidad frente a la COVID-19.
Para la realización del test serológico es necesaria una muestra de sangre, suero o plasma. Para los test rápidos es suficiente con unas gotas de sangre obtenidas mediante punción en un dedo.
Para llevar a cabo la prueba, se deposita la sangre en la zona donde están los reactivos que provocan un cambio de color indicativos de la presencia de anticuerpos.
¿Cuándo es necesaria una prueba de serología?
Las pruebas serológicas se utilizan, principalmente, con fines diagnósticos, ya que muestran una visión de la respuesta inmune, relacionada directamente con la reacción ante un microorganismo. También se pueden utilizar en estudios epidemiológicos.
Por otro lado, pueden indicar el estado de inmunidad de una población en su conjunto. Esto es útil, por ejemplo, para poner en marcha las campañas de vacunación.
En definitiva, una prueba serológica puede estar indicada para saber si se está sufriendo un proceso infeccioso ahora o en el pasado o para comprobar el estado de vacunación con respecto a alguna enfermedad infecciosa específica. Estas pruebas tienen especial relevancia en situaciones como el embarazo , ya que es conveniente identificar la presencia de infecciones que pueden ser contraproducentes para el feto, como el VIH, la hepatitis, la sífilis o la rubeola, entre otras.
Es importante indicar que una serología negativa no excluye de manera definitiva la infección por un microrganismo. En ocasiones, el organismo tarda un tiempo determinado en generar este tipo de proteínas. De este modo, ante la sospecha de una infección por el virus de la inmunodeficiencia humana (VIH), un resultado negativo no excluye la infección, siendo necesaria una nueva determinación a los 4 meses para verificar este diagnóstico. Este espacio temporal es conocido como periodo ventana.
Cómo se obtienen e interpretan los resultados de una prueba serológica
Para la elaboración de un test serológico es necesaria la extracción de una muestra de sangre. A continuación, se centrifuga la sangre para la obtención del suero sanguíneo.
Una vez obtenido el suero, se pueden utilizar diversas técnicas para detectar la presencia de anticuerpos. Las más utilizadas son:
ELISA (ensayo de inmuno absorción ligado a enzima). Se trata de una prueba basada en la detección de los enlaces que se producen entre antígeno (microorganismo) y anticuerpo (sistema inmunitario). Es una enzima la que permite cuantificar la formación de estos enlaces. Se trata de una técnica que se debe llevar a cabo en un laboratorio microbiológico, ya que requiere de material y personal capacitado para su realización e interpretación. El ensayo puede durar varias horas en dar resultados. Esta prueba es capaz de determinar el nivel de anticuerpos, es decir, el resultado es cuantitativo.
Pruebas de flujo lateral o inmunocromatografía . Se trata de dispositivos o kits inmediatos desarrollados para detectar la presencia de los anticuerpos en una muestra.
Cuando se aplica la muestra de sangre (unas gotas) y el anticuerpo que se quiere detectar está presente, aparece una línea de color que indica el resultado positivo. Si no ha habido reacción aparece otra banda de color. No es necesario analizar los resultados en un laboratorio. El resultado es cualitativo (es decir, se tienen anticuerpos o no se tienen, pero no es capaz de determinar la cantidad) y se puede obtener en unos 15-20 minutos.
Qué retos tiene la prueba serológica
Las pruebas serológicas tienen el reto constante de aumentar su fiabilidad y poder detectar el mayor número posible de agentes infecciosos a partir de una única muestra de sangre.
Por último, los avances producidos a partir de la investigación llevada a cabo como consecuencia de la pandemia de la COVID-19 ha supuesto que se dispongan de test serológicos rápidos que muestran los resultados en pocos minutos y que presentan una gran fiabilidad.
Artículo especializado
Incompatibilidad de Rh: ¿Qué es?
La isoinmunización tiene lugar cuando los glóbulos rojos fetales heredan algún antígeno del padre diferente a los de la madre. De este modo, cuando acceden a la circulación materna, se forman anticuerpos específicos contra ellos.
El caso más habitual de isoinmunización es el antígeno D del factor Rh .
¿Qué es la incompatibilidad Rh y qué la causa?
La incompatibilidad Rh es una de las posibles complicaciones que tienen lugar durante el embarazo . Se trata de un problema que tiene lugar cuando una mujer embarazada tiene glóbulos rojos con Rh negativo y el feto −heredado del padre− Rh positivo.
Debido a que, en el transcurso del embarazo, los glóbulos rojos del feto pueden pasar a la sangre materna a través de la placenta, el sistema inmunitario de esta reaccionará frente a las células fetales Rh positivas.
Los anticuerpos creados por la madre podrán atravesar la placenta hacia el feto, destruyendo los glóbulos rojos del bebé.
La mayoría de las isoinmunizaciones se producen por la circulación de sangre fetal en la madre, las cuales pueden producirse antes o durante el parto. Sin embargo, también se producen durante un aborto y embarazo ectópico, entre otros. También puede suceder durante algunos procedimientos obstétricos como la biopsia corial , amniocentesis, funiculocentesis, o la extracción manual de placenta. Solo en casos excepcionales se produce la inmunización por recibir sangre incompatible.
Con un simple análisis de sangre puedes averiguar tu grupo sanguíneo y el factor Rh.
Reserva ya
¿Qué problemas puede causar la incompatibilidad Rh?
La incompatibilidad Rh puede causar trastornos que pueden ir de leves a mortales. La principal consecuencia es la destrucción de glóbulos rojos que puede determinar una anemia en el bebé. Dependiendo del grado de destrucción de hematíes la anemia variará desde una forma leve que cursa con ictericia (piel y esclerótica de los ojos amarillas), hasta una forma grave.
Otros problemas que pueden aparecer en el feto incluyen:
La disminución de la síntesis de albumina en el hígado, que puede dar lugar al desarrollo de hydrops y anasarca.
La disminución de glóbulos rojos provoca una reducción en el transporte de oxígeno con un aumento de la frecuencia cardiaca. Si no se compensa puede desencadenar una insuficiencia cardiaca congestiva.
La acumulación de bilirrubina en sangre puede determinar su acúmulo en los tejidos nerviosos causando kernícterus y signos de disfunción cerebral que van acompañados de letargo e hipotonía.
Acumulación de líquido o hidropesía fetal.
Síntomas de la incompatibilidad del factor Rh
Cuando los anticuerpos de la madre atacan a los glóbulos rojos del feto estos se descomponen, produciendo bilirrubina. Esto hace que aparezca la ictericia y el bebé se ponga amarillo.
Por el contrario, en la madre no suele aparecer ningún síntoma.
En el bebé los síntomas pueden variar en cada embarazo y niño. Los síntomas y signos más habituales incluyen:
Ictericia.
Palidez debida a la anemia.
Taquicardia y taquipnea.
Hepatomegalia (hígado de gran tamaño), esplenomegalia (bazo aumentado) y cardiomegalia (corazón grande).
Puede aparecer líquido acumulado en el estómago, los pulmones o el cuero cabelludo. Se trata de signos de eritroblastosis fetal que cursa con edema grave.
¿Cómo se trata la incompatibilidad del Rh?
La prevención de la incompatibilidad del Rh es sencilla gracias a la administración de la “vacuna anti Rh” con inmunoglobulina anti-D. En mujeres que tienen sangre Rh negativa se les administra una inyección de anticuerpos Rh en diversas situaciones:
A las 28 semanas de embarazo.
Dentro de las 72 horas posteriores al parto de un bebé que tiene sangre Rh positiva. También después de un aborto (espontáneo o voluntario).
Tras cualquier tipo de sangrado vaginal durante el embarazo.
Después de una amniocentesis o de una biopsia corial.
En ocasiones, se necesitan inyecciones adicionales cuando entran grandes cantidades de sangre del feto en el torrente sanguíneo de la madre.
En cuanto al tratamiento una vez que la incompatibilidad se ha materializado, dependerá del embarazo y de la gravedad de la afección. En el caso de anemia fetal leve puede no ser necesario ningún tratamiento.
Por otro lado, el tratamiento antenatal tiene como objetivo disminuir la cantidad de anticuerpos maternos y mejorar la anemia fetal, evitando las complicaciones:
Transfusión intrauterina de sangre. Este procedimiento tiene como objetivo aumentar los glóbulos rojos en el feto, por medio de la inyección en la vena umbilical de sangre del grupo 0, Rh negativo.
Utilización de corticoides, plasmaféresis materna y la administración de inmunoglobulina inyectada para reducir la cantidad de anticuerpos en la madre.
El tratamiento posnatal consiste en la administración de una transfusión al recién nacido si la anemia fuera importante y la prevención del daño derivado del aumento de la bilirrubina en sangre, mediante fototerapia o, si fuera necesario, mediante el recambio de toda su sangre.
En los casos en los que sea necesario, se puede proceder a provocar el parto de forma prematura.

Artículo especializado
Desprendimiento de la placenta: síntomas y causas
El desprendimiento de la placenta en el curso de un embarazo es una afección grave que se suele producir en el último trimestre y que afecta a cerca del 1% de las gestaciones.
¿Qué es el desprendimiento de placenta?
El desprendimiento de placenta −también conocida como “abruptio placentae” o desprendimiento prematuro de placenta normoinserta− se define como la separación prematura parcial o completa de la placenta normalmente insertada antes del inicio del parto, lo que da lugar a un síndrome hemorrágico. Normalmente aparece de manera repentina.
El desprendimiento de placenta forma parte de las posibles complicaciones del embarazo . En este caso, se trata de una complicación grave, ya que la placenta es la vía de alimentación y suministro de oxígeno para el feto.
El desprendimiento de placenta puede poner en peligro a la madre y al bebé.
¿Por qué se produce el desprendimiento de placenta?
No se conoce con exactitud la causa del desprendimiento de la placenta. Sin embargo, es conocido que la causa inmediata del desprendimiento tiene lugar cuando se produce la rotura en la zona donde de los vasos sanguíneos de la madre se unen a los del feto. De este modo, la hemorragia producida provoca que se despegue el útero de la placenta.
Por otro lado, son numerosos los factores que se pueden relacionar con la aparición de la enfermedad:
Traumatismo abdominal . La incidencia del desprendimiento placentario tras un trauma o accidente es variable y depende, principalmente, de las características del trauma y su severidad.
Exceso de volumen de líquido amniótico . Se relaciona con eventos adversos que incluyen el nacimiento pretérmino, anomalías fetales y mayor riesgo de desprendimiento.
Hipertensión crónica . Las mujeres con hipertensión tienen un riesgo 5 veces mayor de desprendimiento de placenta grave.
Cuando aparece con características graves, como daño en los órganos, el riesgo de desprendimiento de placenta puede aumentar significativamente.
Gestación múltiple . Cuando va unida a un exceso de líquido amniótico puede llevar a un mayor riesgo de desprendimiento placentario.
Rotura prematura de membranas . Cuando se produce y la latencia con el parto supera las 24 horas, existe un mayor riesgo de desarrollar desprendimiento placentario.
Infecciones intrauterinas . Las infecciones, principalmente la corioamnionitis, incrementan el riesgo de desprendimiento.
Malformación uterina . El útero no permite una implantación estable de la placenta. Es el caso del útero bicorne, sinequias uterinas o leiomiomas, entre otras.
Antecedentes de desprendimiento en embarazos anteriores.
Síntomas de un posible desprendimiento de placenta
Los síntomas más significativos asociados al desprendimiento placentario incluyen:
Hemorragia vaginal . En algunos casos el desprendimiento se puede producir sin sangrado visible. En los casos en los que el desprendimiento placentario se desarrolla lentamente (desprendimiento crónico), el sangrado es ligero e intermitente. La hemorragia se puede ver agravada por la coagulación intravascular diseminada . Se trata de un proceso en el que los factores sanguíneos responsables de la coagulación y de restablecer el equilibrio en caso de pérdida hemática son empleados y agotados de forma indiscriminada en pequeños vasos sanguíneos, impidiendo de esta forma que se pongan en marcha los mecanismos de taponamiento en los grandes vasos uterinos.
Dolor abdominal y de espalda de comienzo repentino.
Rigidez y contracciones uterinas . Existe un signo clínico muy característico del desprendimiento de placenta que es la hipertonicidad uterina, también llamada “útero de Couvelaire”.
Factores de riesgo a evitar
Los factores evitables que pueden aumentar el riesgo de sufrir un desprendimiento prematuro de placenta son:
Hipertensión arterial . Tanto si se trata de una hipertensión crónica como inducida por el embarazo (preeclampsia o hipertensión gestacional).
Edad de la madre . El riesgo aumenta si la madre es mayor de 35 años o menor de 20.
Tabaquismo . Se trata de un factor de riesgo modificable cuya asociación ha podido ser bien documentada.
Déficit de ácido fólico . Este promueve la disfunción endotelial, incluyendo la de los vasos placentarios, constituyendo un mayor riesgo de desprendimiento.
Consumo de cocaína y otras drogas . La cocaína puede atravesar fácilmente la placenta y la barrera hematoencefálica fetal, produciendo vasoconstricción, que es el principal mecanismo causante del daño fetal y placentario.
¿Cómo se diagnostica el desprendimiento de placenta?
El diagnóstico del desprendimiento de placenta está basado en las manifestaciones clínicas.
En cualquier caso, existen ciertas pruebas que pueden ayudar al diagnóstico:
Cardiotocografía . Permite evaluar la situación del feto y verificar si hay contracciones en el útero.
Ecografía . Su utilidad es limitada por su baja sensibilidad: puede detectar aproximadamente la mitad de las abrupciones placentarias. El hallazgo más frecuente durante la ecografía es la bradicardia fetal como consecuencia de la hipoxia sufrida.
Análisis de sangre . Una analítica permitirá comprobar la presencia de anemia, situación habitual frente a pérdidas importantes de sangre.
Ante la sospecha de un desprendimiento prematuro de placenta el médico puede recomendar la hospitalizada para valorar su alcance.
Tratamiento
El tratamiento estará condicionado por el estado materno y fetal, el grado de desprendimiento placentario y la edad gestacional en el momento del diagnóstico.
En el caso de desprendimiento prematuro de placenta no grave en embarazos de menos de 34 semanas se esperará hasta la semana 37-38 para inducir el parto (si la situación de la madre y del feto así lo aconsejan).
Artículo especializado
Urocultivo: tipos y resultados
El cultivo de orina −también llamada urocultivo− suele incluirse en el análisis rutinario de orina. Se trata de una prueba indicada cuando existe o se sospecha la presencia de una infección de orina, siendo capaz de identificar la presencia de bacterias.
¿Qué es el urocultivo?
El urocultivo es una prueba diagnóstica que permite confirmar la presencia de una infección urinaria. Se lleva a cabo en el laboratorio de microbiología, a partir de una muestra de orina para detectar los microorganismos causantes de la infección.
Esta prueba se solicita en el caso de que el uroanálisis esté alterado, siendo capaz de identificar la bacteria causante de la infección (en el caso de que el agente causante sea una bacteria) así como testar la sensibilidad del microorganismo a diferentes antibióticos, para así poder ofrecer una terapia dirigida.
Las cistitis, pielonefritis y uretritis son algunas de las infecciones más comunes. El agente más frecuente es la bacteria Escherichia coli .
El urocultivo suele incluirse en el análisis rutinario de orina. En especial, el médico puede recomendar la realización de urocultivo cuando el paciente presenta síntomas de infección urinaria producida por bacterias, incluyendo:
Uroanálisis alterado.
Cuando con un tratamiento antibiótico empírico (sin conocer el patógeno causante) la sintomatología urinaria no se resuelve.
Antes de un procedimiento urológico.
Dolor o escozor al orinar .
Orina oscura o con olor fuerte.
Secreción vaginal o peneana.
Enrojecimiento en la región genital.
Fiebre persistente de origen no identificado.
Ganas de orinar repetitivas.
Cómo se realiza un urocultivo
Antes de realizar la recogida de la orina, es recomendable realizar un lavado con agua y jabón de los genitales. El recipiente donde se recolectará la orina debe ser estéril.
El paciente debe recoger una muestra de la primera orina de la mañana, en un bote especial para ello. Con esa muestra se llevará a cabo el análisis de orina, incluyendo el urocultivo. Se recomienda dejar caer algunas gotas previas antes de su recogida.
A partir de la muestra de orina pueden utilizarse distintos análisis específicos según el medio nutritivo donde crecerán las bacterias presentes, si es el caso.
Cada medio está compuesto por los nutrientes específicos que cada microorganismo necesita. De este modo, se permite el aislamiento y el recuento de las bacterias más habituales que producen infección de orina.
Los resultados se verán alterados si el paciente ha comenzado a tomar antibióticos antes de la recogida de la muestra, llevando a un resultado falsamente negativo.
Tipos de urocultivo
La técnica de recogida de la muestra de orina puede diferir en cuanto a si se hace mediante la recogida por micción fisiológica, o a través de la obtención de la muestra de orina por un catéter o sonda que porte el paciente.
Resultados
Los resultados del urocultivo pueden tardar en obtenerse entre 3 y 7 días, incluso menos tiempo en el caso de que la presencia de bacterias sea muy significativa.
Urocultivo positivo
Un resultado positivo del urocultivo determina la presencia de uno o varios microorganismos diferentes que son los responsables de la infección. Se considera un cultivo positivo cuando existe un recuento de bacterias de 10 6 ufc/mL (unidades formadoras de colonias por mililitro).
Un resultado positivo no siempre indica la necesidad de tratamiento, siendo necesarios únicamente antibióticos en determinados casos.
Resultados con menos de 10 6 unidades formadoras de colonias por mililitro en determinadas ocasiones, como es los casos de los varones (al tener mayor longitud del conducto prostático, las posibilidades de contaminación de la muestra son menores), habría que tomarlos en consideración.
Antes de establecer el tratamiento adecuado puede ser conveniente la realización de un antibiograma para medir la sensibilidad-resistencia de las bacterias presentes en la orina a los antibióticos habitualmente utilizados para optimizar el tratamiento. Es principalmente solicitado en el caso de que el tratamiento empírico no sea efectivo.
Los gérmenes identificados con más frecuencia son:
Escherichia Coli.
Proteus mirabilis.
Klebsiella Pneumoniae.
Staphylococcus saprophyticus.
Urocultivo negativo
En el examen de laboratorio no se observa en la muestra ningún crecimiento de colonias bacterianas en la orina, por lo que se puede afirmar que no existe una infección bacteriana activa.
Preguntas frecuentes
¿Qué pasa cuando la orina está contaminada?
Cuando la piel y la zona de los genitales no están limpios en el cultivo de orina pueden crecer varios tipos de bacterias diferentes y se suele considerar que se ha producido una contaminación. El cultivo se desecha, porque no se puede determinar si la bacteria procede del interior o del exterior del tracto urinario.
¿Qué es un urocultivo con antibiograma de disco?
Se trata de un urocultivo que incluye pruebas de sensibilidad de la bacteria presente en la orina a una batería de antibióticos. De este modo, se averigua qué antibiótico concreto es más efectivo para eliminar la bacteria.
¿Qué sucede si no se trata la infección de orina?
Si la infección del tracto urinario diagnosticada mediante el urocultivo y la clínica del paciente no es tratada, puede progresar e infectar los riñones y llegar a la circulación, dando lugar a una sepsis que puede poner en peligro la vida del paciente. Estos casos suelen darse con mayor frecuencia en niños pequeños y personas mayores.
¿Qué otros parámetros del análisis de orina pueden indicar la presencia de una infección del tracto urinario?
La presencia de leucocitos en la orina podría ser indicativo de la presencia de una infección del tracto urinario.

Artículo especializado
Sangrado de implantación
La implantación es el proceso por el cual el óvulo fecundado −el embrión− inicia el camino para su desarrollo, para lo cual anida en las paredes del útero, donde puede recibir los nutrientes esenciales para su desarrollo. En algunos casos, durante esta fase el embrión rompe pequeños vasos sanguíneos que irrigan el endometrio y se produce una pequeña hemorragia. Se trata del sangrado de implantación.
¿Qué es el sangrado de implantación?
Uno de los signos más universales que indican que una mujer está embarazada es la interrupción de la menstruación. Sin embargo, algunas veces tiene lugar entre los 7 y los 14 días posteriores a la fecundación, un sangrado similar a la regla. Se trata del sangrado de implantación. De hecho, en ocasiones es confundido con la menstruación, demorando de esta forma el diagnóstico de embarazo.
Suele ser un acontecimiento que pasa inadvertido, ya que la mujer desconoce que se haya producido la fecundación y en ningún caso relaciona la pequeña hemorragia con un embarazo. Por el contrario, en pacientes sometidas a tratamientos de fertilidad , esta situación se suele percibir con mayor alarma ya que sí son conscientes de cuándo ha tenido lugar la fecundación.
La pequeña pérdida de sangre que se produce tiene lugar cuando el embrión se adhiere a la pared del útero para su desarrollo. Esta no debe suponer ningún problema, ni para el propio embrión ni para la mujer.
Sangrados durante la gestación
Además del sangrado de implantación, durante la gestación se puede producir otro tipo de sangrados, en algunos casos provocados por situaciones que pueden ser graves. Es el caso de situaciones que pueden provocar el aborto o el desarrollo de un embarazo ectópico . En los casos leves el origen de la hemorragia puede ser una infección, los cambios hormonales que sufre la gestante o un pequeño sangrado posterior a las relaciones sexuales.
Sea por una causa o por otra, ante cualquier tipo de hemorragia o sangrado vaginal que se produzca durante el primer trimestre o en el resto del embarazo, es recomendable acudir de inmediato a urgencias. En los casos en los que una hemorragia durante el primer trimestre es una amenaza de aborto, se suele producir de forma abundante y se acompaña de dolor abdominal.
¿Cuándo se produce y cuánto dura el sangrado de implantación?
La hemorragia que se produce durante la implantación del embrión puede aparecer entre siete y catorce días después de la fecundación. La pérdida de sangre que se produce puede alargarse entre tres y seis días.
De este modo, cuando tiene lugar un sangrado vaginal con anterioridad a la fecha estimada de la siguiente regla, esto es, un sangrado entre periodos menstruales naturales, podría tratarse de un sangrado de implantación.
¿Qué se siente cuando se produce la implantación?
En la mayoría de los casos, la implantación del embrión en el útero pasa totalmente desapercibida sin provocar ningún síntoma ni signo. En los casos en los que tiene lugar el sangrado de implantación, se trata de una consecuencia normal relacionada con el proceso de inicio de un embarazo. Aparece, aproximadamente, en una de cada tres mujeres gestantes y no se trata de ninguna situación anormal o patológica, por lo que no añade ningún riesgo al embarazo. En algunos casos puede ir acompañado de dolores leves de tipo menstrual.
Su presentación no es homogénea y puede haber variaciones entre unas mujeres y otras. De igual modo, que haya aparecido sangrado de implantación en un embarazo anterior no garantiza que se vuelva a repetir en gestaciones posteriores.
Diferencias entre el sangrado de implantación y la regla
El sangrado de implantación tiene lugar en los primeros días transcurridos desde la fecundación, cuando la mujer todavía desconoce que pueda estar embarazada. De este modo, es frecuente confundir el sangrado de implantación con una menstruación adelantada, si bien este dura menos tiempo y suele ser menos abundante. También suele ser un tipo de sangrado con una coloración más oscura.
¿Qué hacer ante un sangrado por implantación?
En el caso de que aparezca un sangrado de las características descritas que no sea incompatible con haberse quedado embarazada, lo recomendable es que se realice un test de embarazo. En el caso de dar positivo, se debería consultar con el ginecólogo para iniciar el control de la gestación.
De igual modo, si el sangrado tiene lugar en una mujer en tratamiento para inducir la ovulación, tras haberse sometido a una inseminación artificial o una fecundación in vitro, es recomendable que se ponga en contacto con su médico.
Artículo especializado
Diafragma anticonceptivo
Dentro de la variedad de métodos anticonceptivos disponibles para evitar o prevenir el embarazo existen varios grupos que incluyen los método quirúrgicos, intrauterinos, hormonales y los métodos de barrera. Dentro de estos últimos se encuentra el diafragma anticonceptivo, de utilización femenina.
¿Qué es el diafragma anticonceptivo?
El diafragma es un método anticonceptivo de barrera de uso femenino. Al contrario de lo que ocurre con el método de barrera utilizado por el hombre, el preservativo, el diafragma no confiere protección contra las enfermedades de transmisión sexual.
El diafragma consiste en un capuchón flexible de látex o silicona, que debe colocarse en la vagina, tapando el cuello del útero para impedir la entrada del semen dentro del útero y reducir la posibilidad de que se produzca el embarazo tras el coito.
Debe colocarse antes de cualquier contacto sexual. Es de uso individual y para potenciar su efectividad, se debe utilizar junto a una crema espermicida.
El diafragma es reutilizable, aunque se recomienda examinarlo con regularidad para identificar posibles roturas y renovarlo al menos cada año.
No se trata de un método anticonceptivo infalible, ya que su efectividad se cifra en el 92-96% de los casos, según la Organización Mundial de la Salud. De este modo, de 4 a 8 mujeres de cada 100 que lo utilizaran durante un año se quedarían embarazadas. Esta efectividad podría ser todavía menor si se producen errores en su utilización.
¿Quién puede utilizar el diafragma?
El diafragma puede ser utilizado por todas las mujeres, con algunas excepciones como:
Mujeres con prolapso uterino o con pérdida del tono muscular en la vagina.
Mujeres que acaban de dar a luz.
Cuando existe una infección vaginal.
Mujeres que han padecido un síndrome de shock tóxico.
En el caso de mujeres alérgicas al látex se pueden utilizar diafragmas de silicona.
Beneficios y desventajas del diafragma anticonceptivo
La utilización del diafragma ofrece beneficios y desventajas que deben ser sopesados en cada caso. Entre sus principales ventajas destacan:
La ausencia de efectos adversos.
Su colocación se produce antes de la relación sexual y no la interrumpe.
No se nota durante las relaciones sexuales.
En cuanto a sus desventajas, hay que destacar:
Uno de sus principales inconvenientes es su relativa baja efectividad.
Para asegurar el tamaño adecuado puede ser necesaria la evaluación médica.
Su utilización correcta precisa de cierto adiestramiento.
No se puede utilizar en el transcurso de la menstruación.
No protege frente a las enfermedades de transmisión sexual.
Existe un riesgo de infecciones si se deja colocado mucho tiempo.
Se debe acompañar su uso de cremas espermicidas.
Resta espontaneidad a las relaciones sexuales, puesto que el diafragma debe ser colocado con cierta antelación. Especialmente, cuando se está comenzando a utilizar y requiere de mayor tiempo para una correcta colocación.
¿Cuánto tiempo se puede usar el diafragma?
El diafragma anticonceptivo debe colocarse con anterioridad al acto sexual. La antelación máxima recomendable se sitúa en 4 horas.
Una vez concluido el acto sexual, no se debe retirar hasta pasadas un mínimo de 6 horas. En cualquier caso, no se deben superar las 24 horas sin retirarlo, ya que se incrementa el riesgo de infección.
Cuando se tienen varias relaciones sexuales seguidas no es preciso extraer el diafragma. Simplemente hay que aplicar la crema espermicida en la vagina antes de cada relación sexual vaginal.
¿Cómo se coloca el diafragma?
Antes de empezar a utilizar el diafragma, es recomendable acudir al ginecólogo para que realice una exploración ginecológica con el fin de identificar la talla de diafragma más adecuada. En esta visita el ginecólogo ofrecerá las indicaciones oportunas para su correcta colocación y uso.
Una breve descripción de cómo colocar el diafragma anticonceptivo incluiría:
Antes de la colocación del diafragma es necesaria una adecuada higiene de manos.
Una vez lavadas las manos, se aplicará la crema espermicida, extendiéndola por todo el diafragma, incluyendo las dos caras y los bordes.
A continuación, la mujer debe situarse en una posición cómoda, por ejemplo, tumbada en la cama y con las piernas separadas.
Seguidamente, deberá separarse con la mano los labios de la vulva, apretando sobre el aro del diafragma con la otra mano, doblándolo e introduciéndolo dentro de la vagina hasta donde pueda llegar.
Finalmente, debe comprobar con los dedos que la colocación es correcta y que el cuello uterino ha quedado cubierto por el diafragma.
Para proceder a la extracción del diafragma, se debe introducir el dedo dentro de la vagina para engancharlo por encima del aro y, de este modo, tirar hacia abajo y extraerlo hacia afuera.
Cuando se haya extraído se debe proceder a su lavado con jabón neutro y agua. Una vez secado al aire, se debe guardar en una caja protectora.
Es recomendable no utilizar desinfectantes, ni agentes químicos agresivos. Tampoco se recomiendan aplicar métodos de calor como el hervido.
Artículo especializado
Dishidrosis en las manos: ¿Por qué aparece?
La dermatitis o lesiones eccematosas en las manos son afecciones bastante frecuentes. Se han descrito varios subtipos de dermatitis de manos, uno de ellos es la dishidrosis.
¿Qué es la dishidrosis?
La dishidrosis palmo-plantar, eczema dishidrótico o dermatitis eccematosa dishidrótica es un tipo especial de dermatitis no contagiosa que afecta a las zonas laterales de dedos de manos, palmas y plantas. En la literatura anglosajona se denomina a esta entidad pompholyx.
La inflamación que se produce en la piel de pies y manos se caracteriza por la aparición de pequeñas ampollas llenas de líquido que se acompañan de picor intenso.
Suele presentar episodios de exacerbación y otros de remisión de carácter estacional, con una mayor frecuencia en primavera y verano.
Los pacientes con dishidrosis sudan más y presentan una mayor sensibilidad a ciertos metales como el níquel, cobalto y cromo.
Normalmente, la dermatitis desaparece espontáneamente al cabo de 2 a 3 semanas. El intervalo entre brotes puede de ser de semanas a meses.
En algunos casos, pueden aparecer complicaciones con la aparición de pústulas y enrojecimiento de la piel que puede ser indicativo de una infección.
El dermatólogo deberá diferenciar la dishidrosis de otras afecciones de la piel como la dermatitis de contacto alérgica y la dermatitis irritativa por contacto.
¿Qué causa la dishidrosis en las manos?
Las causas de la dishidrosis no son del todo conocidas, aunque se sabe que no se trata de una afección contagiosa.
Por otro lado, existen ciertos factores que se relacionan con la aparición de la enfermedad, incluyendo:
La dermatitis atópica y otras patologías alérgicas.
La alergia a sustancias, medicamentos y metales.
El estrés.
El calor y la sudoración.
Las infecciones de la piel causadas por bacterias u hongos. Por ejemplo, los pacientes con tinea pedis tienen 3 veces mayor riesgo de presentar dishidrosis.
Los cambios hormonales del embarazo.
La dishidrosis suele aparecer sobre todo en menores de 40 años y es algo más prevalente en mujeres.
Tratamiento de la dishidrosis
No existe una cura definitiva para la dishidrosis, ya que su causa es desconocida, pero sí existen tratamientos que permiten controlar los brotes.
El principal tratamiento para la dishidrosis palmar consiste en la aplicación tópica de corticoides de alta potencia durante 1-2 semanas. En algunos casos se pueden aplicar apósitos húmedos para secar las ampollas.
Cuando la afectación de la piel es intensa se pueden prescribir corticoides orales y cuando concurre una infección bacteriana, se pueden prescribir antibióticos.
También puede ayudar a controlar la enfermedad la evitación del contacto con sustancias irritantes. En algunos casos se puede recomendar la utilización de guantes (mejor de vinilo que de látex). Otra opción sería utilizar guantes de algodón por dentro de los guantes habituales sobre todo en la cocina para evitar el contacto directo con detergentes y vegetales o cítricos que pueden agravar la enfermedad.
Para ayudar a paliar la sequedad de la piel pueden ser útiles las cremas emolientes y las cremas hidratantes entre los brotes.
Otros tratamientos pueden incluir:
Los antihistamínicos orales para calmar el picor de las ampollas.
La fototerapia (PUVA y UVB).
En casos muy graves pueden ser necesarios tratamientos inmunosupresores por vía oral.
Si existe una tinea pedis concomitante (hongos interdigitales) será necesario añadirle al tratamiento antifúngicos.
El dermatólogo valorará en cada caso el tratamiento más adecuado.
Síntomas de la dishidrosis en las manos
Suele ser habitual la aparición brusca de vesículas pequeñas con contenido líquido, aunque en ocasiones pueden aparecer ampollas grandes. Las lesiones pueden ocasionar picor.
Cuando la enfermedad se cronifica, la piel de las palmas de las manos y las plantas de los pies se descaman y se agrietan. Además, la piel adquiere una textura gruesa.
La enfermedad suele empezar entre los dedos y luego extenderse a las palmas. También puede aparecer en la planta y los laterales de los pies, si bien no es normal que afecte a la vez a las manos y los pies.
En definitiva, los síntomas más característicos de la dishidrosis incluyen:
Aparición de pequeñas vesículas con líquido que van acompañadas de picor intenso. En ocasiones las vesículas confluyen.
Descamación de la piel.
Erosiones y fisuras en la piel que pueden ser dolorosas.
Irritación y engrosamiento de la piel.
Cuando existe rascado por el picor puede producirse una infección de la piel con supuración, formación de costras e inflamación.
Recomendaciones en casos de dishidrosis
Cuando se tiene un brote de dishidrosis existe una serie de consejos que pueden ser útiles para controlar su manifestación:
Acudir al dermatólogo para que establezca el tratamiento más adecuado.
Llevar a cabo una higiene cuidadosa de las manos, evitando jabones agresivos y temperaturas extremas. Secar con cuidado.
Hidratar las manos de manera frecuente con cremas hidratantes o emolientes sin perfume.
Intentar no rascarse.
Utilizar guantes y evitar el contacto con sustancias irritantes y metales.
En el caso de que se vean afectados los pies, vigilar su higiene e hidratación y utilizar calcetines de algodón.
Realizar actividades anti estresantes.
Artículo especializado
Dermatitis exfoliativa
La dermatitis exfoliativa es una patología poco común que se manifiesta por medio de un estado inflamatorio de la piel, con disfunciones en la barrera cutánea y a nivel metabólico. Puede presentarse al nacer o puede desarrollarse de forma aguda o insidiosa, debido a la progresión de una patología que ya estaba presente.
Aunque existe una amplia gama de enfermedades que se asocian con la dermatitis exfoliativa, la gran mayoría de los casos son el resultado de dermatosis preexistentes y crónicas. Es importante conocerla porque puede tratarse de una urgencia médica que precise hospitalización y tratamiento inmediato para evitar la deshidratación y la sobreinfección por bacterias y hongos que pueden llevar a la muerte.
¿Qué es la dermatitis exfoliativa?
La dermatitis exfoliativa o eritrodermia exfoliativa es una afección inflamatoria cutánea que se presenta con piel eritematosa extensa y descamación, que afecta a más del 90% de la superficie corporal.
La edad en la que aparece la dermatitis exfoliativa está directamente relacionada con la causa. La mayor parte de los casos se describen en promedio a partir de los 50 años de edad, si bien existen casos infantiles y neonatales.
Su principal manifestación es debida a la alteración del recambio celular epidérmico rápido. Las causas son desconocidas, aunque se presenta con más frecuencia en el contexto de trastornos cutáneos preexistentes, como dermatitis atópica, dermatitis de contacto, dermatitis seborreica y psoriasis, entre otras.
También puede aparecer con mayor probabilidad en el transcurso de tratamientos con algunos fármacos como antibióticos, barbitúricos y antiepilépticos, entre otros. Finalmente, esta afección cutánea puede aparecer asociada a determinados tipos de cáncer, como linfomas, micosis fungoide, leucemia y, en menor medida, adenocarcinomas.
¿Qué produce la dermatitis?
La eritrodermia puede ser consecuencia de diversos procesos patológicos de diferente naturaleza, incluyendo las siguientes categorías causales:
Patologías y síndromes congénitos.
Enfermedades infecciosas.
Patologías inflamatorias e inmunitarias.
Enfermedades neoplásicas.
Causas iatrogénicas o debidas a algunos tratamientos farmacológicos.
Causas idiopáticas, o de causa desconocida.
En muchos casos, la eritrodermia es consecuencia del agravamiento de dermatosis preexistentes, como sucede con la psoriasis, la dermatitis atópica grave o la dermatitis seborreica del neonato.
En la eritrodermia psoriásica la causa puede ser la propia enfermedad de la piel o la retirada repentina de fármacos corticosteroides potentes tópicos u orales que formaban parte del tratamiento.
Por otro lado, las erupciones de eritrodermia relacionadas con la toma de medicamentos suelen estar causadas por anticonvulsivantes, antibióticos y barbitúricos.
¿Qué es la dermatitis exfoliativa neonatal?
La eritrodermia neonatal es una patología poco habitual. Al igual que su cede en los casos en los que afecta a los adultos, sus causas pueden dividirse en:
Inflamatorias (dermatitis atópica, psoriasis, dermatitis seborreica, etc.).
Infecciosas (síndrome de la piel escaldada por estafilococos, candidiasis, etc.).
Inducidas por fármacos.
Genodermatosis e inmunodeficiencias primarias, como el síndrome de Omenn, el síndrome de Di George y el síndrome de Wiskott-Aldrich.
Los pacientes neonatos están en riesgo de pérdida de líquidos, lo que les lleva a situaciones de hipernatremia, deshidratación, hipotermia y aumento del riesgo de infecciones.
Los casos de eritrodermia congénita pueden presentarse junto con una diversidad de características clínicas cutáneas y extracutáneas al nacer o que pueden aparecer más adelante.
En otros casos, como la eritrodermia por dermatitis atópica, la presentación es más tardía, usualmente cuando ya han cumplido, al menos, un mes de vida.
Síntomas de la dermatitis exfoliativa
La eritrodermia es una enfermedad grave que en ocasiones puede llegar a comprometer la vida del paciente. En ella se pueden diferenciar dos presentaciones o fases:
Aguda . Por ejemplo, debido a una infección o a un medicamento. Se caracteriza por presentar un eritema intenso, de inicio súbito, acompañado de malestar general y descamación fina.
Crónica . Su evolución es más gradual debido a la progresión de una patología primaria subyacente, incluyendo dermatosis y neoplasias malignas. En esta fase el paciente presenta descamación más abundante y gruesa. Existe un aumento del grosor de la piel y se acentúan los pliegues. Se puede dar una alopecia generalizada y a nivel de las uñas, un aumento de su grosor con una posterior rotura.
Los signos y síntomas asociados a la enfermedad pueden ofrecer pistas sobre la causa que provoca la eritrodermia. Además de piel eritematosa y descamación, otros síntomas que se pueden dar incluyen:
Malestar general.
Fiebre y escalofríos.
Prurito
Edema (principalmente en miembros inferiores).
Linfadenopatías generalizadas.
¿Cómo curar la dermatitis exfoliativa?
La eritrodermia es una urgencia dermatológica, por lo que los casos más graves requieren de ingreso hospitalario.
El abordaje terapéutico debería incluir, en primer lugar, la interrupción de cualquier tratamiento farmacológico que resulte innecesario y un examen adecuado dirigido a excluir cualquier tipo de malignidad como causa de la dermatitis.
Inicialmente, el tratamiento de todos los tipos de eritrodermia es muy similar, aunque no se haya podido llegar a identificar las causas. Para llegar al diagnóstico se realizará una biopsia cutánea y una analítica sanguínea completa. En los casos más graves será necesario monitorizar al paciente en unidades de cuidados intensivos y reponer los líquidos perdidos a través de la piel con sueros intravenosos.
Es importante controlar la temperatura ambiental ya que los pacientes presentan el deterioro de las funciones de control de la temperatura corporal para evitar el enfriamiento o el sobrecalentamiento.
La función de barrera de la piel deteriorada por la enfermedad puede mejorarse mediante baños coloides y compresas húmedas sobre una superficie que no supere una cuarta parte del cuerpo, así como la aplicación de cremas emolientes y corticosteroides tópicos de baja potencia. Así mismo, deberán tratarse las sobreinfecciones por bacterias y hongos con antibióticos y antifúngicos.
Por otro lado, los antihistamínicos con efecto sedante intramusculares o intravenosos pueden disminuir el prurito previniendo de esta forma infecciones cutáneas provocadas por el rascado, además de mitigar la ansiedad del paciente.
Finalmente, el tratamiento estará condicionado por la enfermedad o la causa subyacente de la dermatitis exfoliativa, si es que esta ha podido ser identificada.
Artículo especializado
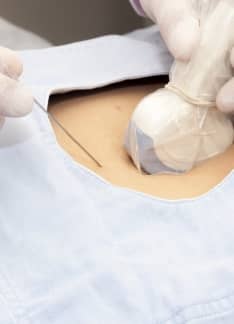
Cordocentesis o funiculocentesis: ¿Qué es y qué detecta?
Cuando durante un embarazo existe el riesgo de que el feto desarrolle determinados problemas, puede estar indicada la realización de una cordocentesis, especialmente si otras pruebas llevadas a cabo no han aportado una información concluyente.
¿Qué es la cordocentesis?
La cordocentesis, funiculocentesis o muestra sanguínea percutánea del cordón umbilical es un procedimiento invasivo por medio del cual se extrae sangre del cordón umbilical del feto. Se trata de una prueba de diagnóstico prenatal indicada en casos específicos, como en la sospecha de anemia fetal o en determinadas situaciones graves en las que pueden estar presentes alteraciones en los cromosomas fetales.
La sangre obtenida a través de la cordocentesis también puede usarse potencialmente para otro tipo de estudios genéticos, para administrar al feto determinados tratamientos si se consideran necesarios o recibir una transfusión de sangre.
¿Para qué sirve la cordocentesis?
La utilidad de la cordocentesis viene dada por todas las pruebas que se pueden llevar a cabo a partir de la sangre y el material genético del feto. De este modo, puede servir para confirmar afecciones sanguíneas como anemia y trombocitopenia, anomalías genéticas como el síndrome de Down o enfermedades infecciosas como la rubeola, toxoplasmosis o citomegalovirus, entre otras.
Por otro lado, también sirve como vía de acceso para realizar algunos tratamientos dentro del útero.
La prueba suele realizarse a partir de las 20 semanas de gestación, cuando el cordón umbilical ya se ha desarrollado.
En definitiva, las indicaciones de la cordocentesis incluyen:
Estudios genéticos.
Cuando se ha llevado a cabo una amniocentesis, puede servir para confirmar los resultados si la muestra de líquido amniótico es insuficiente o la amniocentesis ha indicado la presencia de alteraciones genéticas como el mosaicismo.
La presencia de anomalías fetales observadas por medio de una ecografía.
Hidrops fetal o presencia de acúmulo de líquido en el cuerpo del feto.
Crecimiento anómalo del feto y disminución de la cantidad de líquido amniótico.
¿Cuándo se tiene que hacer la cordocentesis?
La cordocentesis generalmente se realiza tras descartar otras pruebas. De este modo, no se trata de la prueba de primera elección debido a que conlleva un mayor riesgo de complicaciones para el bebé que otros procedimientos.
Debe ser el ginecólogo el que determine si es necesario realizar la prueba en el caso de que no sea posible realizar otras opciones o estas no han aportado suficiente información. De este modo, suele realizarse cuando la información de diagnóstico no puede obtenerse a través de ecografía o amniocentesis , o si los resultados de estas pruebas no fueron concluyentes.
En cualquier caso, debe realizarse después de las 20 semanas de embarazo.
Procedimiento y riesgos de la cordocentesis
La cordocentesis es un tipo de procedimiento invasivo realizado de forma ambulatoria que consiste en la punción en el cordón umbilical para la obtención de una muestra directa de sangre del feto para su posterior análisis.
La punción del cordón umbilical fetal es dirigida por ecografía y se lleva a cabo por medio de la punción en el abdomen de la embarazada con una aguja delgada hasta llegar a través de la pared abdominal al interior del útero y de la bolsa de líquido amniótico donde está el feto. Se accede al cordón umbilical cerca de la inserción con la placenta para evitar el riesgo de movimientos del feto. Se punciona la vena del cordón con la aguja para la obtención de la sangre. Se suelen extraer unos 3-5 mililitros de sangre fetal.
Al igual que otros procedimientos, esta prueba conlleva riesgos tanto para la madre como para el feto.
El aborto espontáneo es el principal riesgo de la cordocentesis, con uno o dos abortos espontáneos por cada 100 procedimientos.
Otros posibles riesgos de cordocentesis que se pueden dar incluyen:
Sangrado y hematoma de cordón.
Bradicardia fetal.
Infecciones.
Hemorragia.
Rotura prematura de membranas.
Riesgo de parto prematuro.
Punción accidental de partes fetales. Este riesgo se minimiza realizando la punción cerca de la inserción placentaria.
Otro riesgo importante es el de la inmunización de las madres con grupo sanguíneo Rh negativo cuyos fetos sean Rh positivo. Por ello es imperativo administrar vacunación frente al Rh −conocida como gammaglobulina anti-D− en todas las madres negativas a las que se les realice una prueba invasiva en el plazo de las 48-72 horas siguientes. La inmunización puede dar lugar a cuadros de anemia fetal en gestaciones posteriores.
Funiculocentesis, amniocentesis y biopsia corial
Las tres principales pruebas invasivas para el diagnóstico fetal son la amniocentesis, la biopsia corial y la cordocentesis o funiculocentesis. Todas ellas permiten la obtención de material fetal para llevar a cabo el estudio de los cromosomas del feto o cariotipo.
La amniocentesis consiste en la obtención de una pequeña cantidad de líquido amniótico a partir de la introducción de una aguja a través de la pared abdominal de la madre. Permite la realización del cariotipo fetal.
La biopsia corial consiste en la obtención de una pequeña muestra de tejido placentario. Se puede realizar por vía transabdominal o transvaginal.
La funiculocentesis permite la obtención de sangre fetal cuando existen dudas sobre los resultados genéticos obtenidos mediante amniocentesis o biopsia corial.

Artículo especializado
Embarazo críptico: ¿Qué es?
¿Qué es el embarazo críptico?
El embarazo críptico o embarazo silencioso o negado responde a la situación en la que una mujer está embarazada, pero ella lo desconoce hasta que el mismo está muy avanzado o el parto es ya inminente.
Evidentemente, se trata de casos excepcionales que se suelen dar en mujeres con distintos problemas, incluyendo las menstruaciones irregulares, el sobrepeso y la obesidad y otros problemas de salud.
Cuando un embarazo críptico se produce la mujer no llega a experimentar o no reconoce los síntomas y signos típicos comunes durante la gestación, incluyendo la amenorrea, náuseas y vómitos o el incremento del volumen abdominal. En muchos casos tampoco el médico ni los familiares son capaces de detectarlos.
Las causas no son del todo conocidas y en él pueden intervenir condicionantes psicológicos de negación por parte de la madre a la hora de aceptar el embarazo. Esto puede condicionar la aparición e identificación por parte de la madre de los síntomas del embarazo.
En Savia ponemos a tu disposición los mejores especialistas en Psicología .
Riesgos del embarazo críptico
Los riesgos del embarazo críptico son evidentes, tanto para la madre como para el bebé. Cuando la mujer no es consciente de que está embarazada no existe ninguna precaución ni control sobre la evolución del embarazo ni recibe la atención médica prenatal necesaria .
De este modo, la situación de la madre en el momento del embarazo, así como la evolución del feto no pueden ser evaluadas y no se dispone de información por parte de los médicos sobre posibles estados carenciales, complicaciones o anomalías.
En consecuencia, los bebés que nacen de un embarazo críptico tienen más riesgo de presentar problemas de salud, incluyendo el nacimiento prematuro y un peso bajo al nacer.
De igual modo, las complicaciones prenatales para la madre como la diabetes gestacional, la hipertensión o la preeclampsia pueden pasar desapercibidas y pueden poner en riesgo la salud de la madre.
Finalmente, cuando la madre no es consciente de que está embarazada, es posible que tenga comportamientos de riesgo como fumar, beber alcohol u otros tóxicos lo que puede afectar de forma negativa a la salud y el desarrollo del bebé.
Cómo detectar y evitar un embarazo críptico
Los embarazos crípticos son casos excepcionales que no suelen darse de forma habitual. En el momento en el que aparezcan molestias o cambios en la menstruación o en otros aspectos de la salud de la mujer en edad reproductiva y con relaciones sexuales activas se debería someter a una revisión por parte del ginecólogo .
En cualquier caso, a medida que el embarazo críptico avanza existen más posibilidades de que sea detectado.
Síntomas del embarazo críptico
Los síntomas y signos que tienen lugar durante el embarazo −incluso durante las fases más tempranas− son muy evidentes y característicos, por lo que cuesta creer que una mujer no sea capaz de identificarlos. Por todo ello, en el embarazo críptico la parte psicológica juega un papel muy relevante.
Pruebas de embarazo negativas
Finalmente, las pruebas de embarazo se basan en la detección de la hormona gonadotropina coriónica humana en la orina. Esta hormona aumenta su concentración en el momento de la concepción. A partir de las 12 semanas de embarazo disminuye sus niveles, llegando incluso a negativizarse.
Además de que suelen ser escasas las madres con embarazos crípticos que se realizan un test de embarazo, en ocasiones estos dan negativo debido a que este está ya avanzado y los niveles de gonadotropina coriónica han disminuido.
Artículo especializado
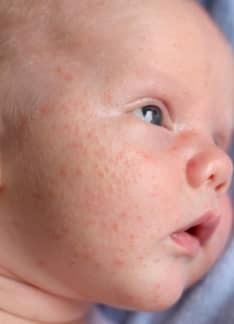
Queratosis pilaris: síntomas y tratamiento
La queratosis es una afección de la piel en la que se produce un engrosamiento de la capa externa de la piel o capa córnea. Uno de los tipos de queratosis que se pueden dar es la queratosis pilaris o pilar.
¿Qué es la queratosis pilaris?
La queratosis pilaris es una afección cutánea infantil y juvenil benigna consistente en la presencia de pápulas de un tamaño inferior a 1 cm de diámetro que se sitúan alrededor del folículo piloso y que se agrupan en placas de consistencia áspera.
Se produce por la formación de tapones de queratina en el interior de los folículos pilosos que dan lugar a la aparición de los granos.
En niños suele afectar a la zona de las mejillas. En adolescentes y adultos jóvenes afectan sobre todo a zonas cutáneas de brazos, muslos y zona glútea.
La causa de la queratosis pilaris no es bien conocida. En ocasiones aparece asociada a fototipos de piel oscura y a la presencia de dermatitis atópica. También se asocia con patologías como la obesidad, la diabetes, la insuficiencia renal, el síndrome de Down, y con diversos trastornos hereditarios como la ictiosis vulgar, entre otros.
Finalmente, el tratamiento con algunos fármacos determina un mayor riesgo de queratosis pilaris. Entre ellos se encuentran los corticoides sistémicos y el litio.
Síntomas de la queratosis pilaris
El diagnóstico de la queratosis pilaris se debe llevar a cabo mediante la historia clínica y una adecuada exploración física.
Entre los síntomas más destacables destacan la aparición de las pústulas que pueden tener implicaciones negativas de índole estético, especialmente, cuando las lesiones aparecen en zonas más expuestas como el rostro. Estas suelen desaparecer sin ninguna lesión residual, aunque en ocasiones pueden dejar cicatriz, especialmente las que aparecen en la cara.
Normalmente, la queratosis mejora en las épocas de calor y tiende a empeorar con el frío y una menor humedad ambiental.
Otros síntomas que pueden aparecer incluyen:
Aspereza y sequedad cutánea . En ocasiones se compara el aspecto que presenta la piel con el del papel de lija.
Picor o prurito. Se puede dar en algunos casos minoritarios.
Tratamiento de la queratosis pilaris
El tratamiento suele consistir en la combinación de varios principios activos con el fin de ablandar los acúmulos de queratina que se producen en las pústulas. En cualquier caso, las lesiones no desaparecen de forma inmediata, por lo que el tratamiento puede alargarse durante períodos de varios meses.
Algunos de los tratamientos para la queratosis pilar pueden incluir:
Lociones emolientes.
Cremas exfoliantes con agentes queratolíticos.
Principios activos antiirritantes, antiinflamatorios y que aceleren el proceso de cicatrización.
Corticoides de baja o media intensidad de uso tópico.
Cremas con retinoides, como el tazaroteno.
¿Qué empeora la queratosis pilaris?
En general la queratosis pilar empeora con el frío y una mayor sequedad del ambiente. También puede empeorar con cosméticos y tratamientos agresivos para la piel.
Por el contrario, el correcto cuidado de la piel, incluyendo una buena higiene e hidratación pueden ayudar a mejorar los síntomas de la queratosis pilaris, así como sucede con la mayoría de afecciones de la piel.
Consejos para cuidar la piel con queratosis pilaris
Los hábitos de higiene y mantener una adecuada humedad en la piel son las claves para cuidar la piel con queratosis pilaris.
En lo relativo a propiciar los cuidados necesarios para conseguir una adecuada humedad e hidratación de la piel, es recomendable:
Limitar el tiempo de ducha (no más de 10-15 minutos).
Utilizar agua tibia, evitando el uso de agua excesivamente caliente.
No secar la piel en exceso, ni frotar enérgicamente con la toalla.
Utilizar cremas hidratantes por todo el cuerpo tras el baño.
En cuanto a las cremas hidratantes son preferibles las lociones emolientes que incluyan ingredientes que humecten la piel y creen una película protectora.
Por último, ante cualquier síntoma o sospecha, siempre es importante acudir al dermatólogo para que podamos encontrar la mejor respuesta a los problemas de la piel de manera rápida.

Artículo especializado
Estrés en el embarazo: cómo evitarlo
Las circunstancias que rodean a la vida fetal y perinatal pueden tener consecuencias sobre la salud del feto y de la madre. En este sentido, los altos niveles de estrés durante el embarazo pueden ser uno de los elementos con repercusión sobre la salud maternoinfantil.
¿Por qué se produce estrés durante el embarazo?
El embarazo es un proceso fisiológico para el que la mujer está perfectamente preparada. Sin embargo, este puede suponer una sobrecarga y una importante fuente de estrés y ansiedad para la madre.
El estrés específico del embarazo está relacionado con las circunstancias que envuelven a todo el proceso, incluyendo los potenciales problemas médicos, la salud del recién nacido, los cambios que el embarazo suponen en las relaciones sociales de la madre y en su aspecto físico y el miedo al parto, entre otras.
Además, en ocasiones existe un estrés psicológico derivado de las presiones sociales, problemas económicos, discriminación o violencia a los que está sujeta la madre y que pueden producir un aumento en la probabilidad de resultados adversos en el embarazo.
Finalmente, el conocimiento existente sobre los efectos nocivos que tiene el estrés de la madre sobre la salud del feto lleva a muchas mujeres a sentirse obligadas a permanecer felices y serenas durante todo el embarazo. Cuando esto no sucede, se sienten culpables y estresadas.
En cualquier caso, no todo el estrés materno parece ser perjudicial, sino que depende de su intensidad y duración. De este modo, el estrés intermitente leve o moderado, podría favorecer el desarrollo saludable del feto, mientras que estados de estrés más graves y prolongados se asociarían con resultados adversos.
En definitiva, la aparición del estrés durante el embarazo es muy variable y puede verse influido y fomentando por multitud de circunstancias. Algunas de ellas pueden incluir:
Las circunstancias socioculturales y familiares de la madre.
La edad de la madre. En la actualidad es frecuente que existan embarazos después de los 35 años e incluso de los 40.
Una mayor frecuencia de embarazos por técnicas de reproducción asistida. Estas pueden ocasionar labilidad emocional grave por la gran carga hormonal que contienen los fármacos empleados para lograr la estimulación ovárica.
Las propias pruebas y controles de diagnóstico prenatal (bioquímicas, ecográficas, etc.) pueden constituir un generador de estrés.
Aumento de los niveles de cortisol
La exposición a elevados niveles de estrés psicológico durante el embarazo se traduce en el organismo en cambios neuroendocrinos debidos a la activación del eje hipotalámico-pituitario-adrenal. Esta tiene como principal consecuencia el aumento de los niveles de cortisol −la hormona del estrés− que en origen tiene como objetivo que el organismo pueda hacer frente a los estímulos estresantes.
Efectos del estrés en el embarazo
El estrés del embarazo ha sido relacionado con una mayor prevalencia de ansiedad en la madre durante el embarazo, un mayor aumento de peso corporal durante y después del embarazo, mayores tasas de cesáreas no planificadas, bajo peso del feto al nacer y mayor incidencia de embarazos de riesgo y partos prematuros.
Efectos del estrés sobre la madre
Entre las alteraciones maternas con las que se relaciona la exposición a elevados niveles de estrés durante el embarazo destacan:
Un mayor riesgo de depresión posparto, que puede afectar al 10-15% de las mujeres después de dar a luz.
Preeclampsia.
Diabetes gestacional.
Retraso en la producción de leche materna.
Efectos del estrés sobre el bebé
En cuanto a la salud infantil, unos niveles elevados de estrés prenatal se relacionan con un mayor riesgo de:
Bajo peso al nacer.
Parto prematuro.
Alteración del desarrollo neonatal.
Afectación del neurodesarrollo infantil.
De este modo, los estudios muestran un posible vínculo deficiente en la relación madre-hijo, así como un menor neurodesarrollo infantil. De igual modo, existe una relación negativa entre el estrés del embarazo y los niveles de neurodesarrollo cognitivos y motores en los primeros meses de vida. Estas disfunciones neuromotoras en edades tempranas se asocian con problemas posteriores en el comportamiento y con un menor rendimiento académico.
Síntomas de estrés en el embarazo
La evaluación del estrés específico del embarazo se puede llevar a cabo por medio de cuestionarios en los cuales las mujeres embarazadas responden a una serie de preguntas relacionadas con las preocupaciones específicas del embarazo. Los cuestionarios son evaluados e interpretados posteriormente por un profesional de la Psicología.
El estrés durante el embarazo puede dar lugar a la aparición de síntomas como episodios de ansiedad, modificaciones notables en el estado de ánimo de la madre y aumento de peso.
Control del estrés en el embarazo
Es importante que los casos de estrés en el embarazo puedan ser identificados por los profesionales de la salud encargados del seguimiento médico, incluyendo el especialista en Ginecología y Obstetricia o la matrona.
Cuando se identifica un caso, se puede contar con la intervención de un psicólogo. Los profesionales de la Psicología tienen las herramientas para, mediante la aplicación de terapias psicológicas, reducir los niveles de estrés específico del embarazo.
Una de las intervenciones basadas en la evidencia que ha mostrado una alta eficacia en el control del estrés durante el embarazo es la terapia cognitivo conductual . La psicoterapia aplicada al control del estrés incluye diversas etapas, entre las que destacan las de afrontamiento, relajación muscular profunda, técnicas de desactivación y técnicas de asertividad.
Dentro del manejo del estrés en el embarazo ocupan un papel relevante el mantenimiento de unos hábitos dietéticos adecuados, la realización de ejercicio moderado de forma regular y las técnicas de meditación entre las que cabe destacar el “Mindfulness”.
En el caso de que el médico lo considere oportuno, se puede optar por un tratamiento farmacológico para reducir los niveles de estrés y ansiedad que sea compatible con el embarazo.
Para el tratamiento del estrés y la ansiedad Savia pone a tu disposición los mejores psicólogos .

Artículo especializado
Útero miomatoso
Se estima que una de cada cuatro mujeres desarrollará algún mioma a lo largo de su vida, siendo máxima su incidencia en las edades cercanas a la menopausia. Aunque se trata de acontecimientos asintomáticos, pueden causar síntomas en el 30% de las mujeres diagnosticadas de miomas uterinos.
Su prevalencia ha aumentado en los últimos tiempos por la tendencia a retrasar el embarazo, lo que expone a muchas mujeres a presentar miomas uterinos en el momento de la concepción. También influye en el aumento de casos la mayor capacidad de diagnóstico gracias a la utilización sistemática de la ecografía transvaginal.
¿Qué es el útero miomatoso?
El útero miomatoso es un útero afectado por la aparición de miomas . El mioma o fibroma uterino, es un tipo de tumoración benigna que se forma en las paredes del útero por fibras musculares lisas. Derivan del miometrio o capa muscular del útero y presentan una abundante matriz extracelular rodeados de tejido conectivo y fibras musculares comprimidas.
Se trata de los tumores sólidos más frecuentes de la pelvis de la mujer. Mayoritariamente aparecen de forma múltiple, aunque también pueden ser únicos.
Los miomas se pueden clasificar según su localización en el miometrio en subserosos (localizados en la superficie uterina, deformando la serosa), intramurales (situados en el espesor de la pared muscular, sin relación con la serosa ni la mucosa), transmurales (son miomas en el espesor de la pared muscular que deforman la serosa y la mucosa endometrial) y submucosos (se desarrollan bajo el endometrio desplazándolo en su crecimiento). Más de la mitad son subserosos, un 40% intramurales y un 5% submucosos.
Causas del útero miomatoso
Las causas del útero miomatoso y la aparición de miomas no son del todo conocidas. Sin embargo, se ha detectado una relación directa con las hormonas femeninas, condicionando el desarrollo y crecimiento de los miomas, por eso se suelen dar en mujeres en edad fértil. Cuando aparece la menopausia el tamaño disminuye debido a que los niveles hormonales también disminuyen.
Además de los estrógenos y la progesterona, ciertas citocinas y factores de crecimiento relacionados con la fibrosis y la formación de vasos sanguíneos parecen estar implicados en el desarrollo de los miomas.
Por último, parece existir cierta predisposición genética a desarrollar miomas.
En cuanto a los factores que pueden influir en la aparición y evolución de los miomas se pueden incluir:
La raza . Las mujeres afroamericanas tienen una mayor prevalencia de miomas uterinos en comparación con las asiáticas y las caucásicas.
Agregación familiar . La miomatosis uterina familiar es factor de riesgo para la aparición de miomas, cuyo comportamiento es diferente a los no familiares.
Características reproductivas . La menarquia precoz (por debajo de los 10 años) se ha relacionado con la aparición de miomas. Por otro lado, la frecuencia de miomas es menor en las mujeres que ya han sido gestantes (a mayor número de gestaciones mayor es el efecto protector), mujeres que han tenido una maternidad temprana y cuando existe un corto intervalo desde la última gestación. No obstante, las pacientes con miomatosis uterina previa que quedan gestantes suelen experimentar un crecimiento significativo de los miomas preexistentes debido al estatus hormonal propio del embarazo.
Tratamientos hormonales . La respuesta de los miomas al estímulo hormonal varía en función de dosis, vía de administración, sustancia y tiempo de administración.
Otros factores . El tabaco parece reducir la aparición de miomas. Por el contrario, la hipertensión, la obesidad y la diabetes mellitus se asocian con un aumento del riesgo en el desarrollo de miomas. En cuanto a factores nutricionales, las dietas ricas en vitamina A y un consumo elevado de carnes rojas parecen aumentar el riesgo de miomas.
Síntomas del útero miomatoso
La mayoría de los miomas del útero no ocasionan síntomas. La aparición de estos se relaciona con el tamaño de los miomas, su número y emplazamiento, siendo los más sintomáticos los que se localizan en la cavidad interna del útero.
Cuando las pacientes con miomas presentan manifestaciones clínicas, las más frecuentes son las alteraciones de la menstruación, especialmente el sangrado menstrual abundante o hipermenorrea.
Otros síntomas del útero miomatoso son:
Cambios menstruales en su duración, frecuencia y cantidad de sangrado.
Presión pélvica y dolor, especialmente con miomas de gran tamaño de localización intramural o subserosa.
Anemia ferropénica debido al exceso de sangrado.
Aumento del perímetro del abdomen en caso de miomas grandes.
Aumento de peso.
Complicaciones en embarazo y parto.
Compresión de vejiga y recto en el caso de miomas de gran tamaño.
Ganas de orinar con mayor frecuencia.
Lumbalgia y dolor de pelvis.
Aumento de probabilidades de aborto o parto prematuro.
Molestias en las relaciones sexuales.
Además, pueden contribuir a un problema de infertilidad, si bien es excepcional que se trate de su única causa.
El tratamiento de los miomas que producen síntomas inicialmente está enfocado a la reducción de los mismos (tratamientos con bloqueantes hormonales, analgésicos para el dolor, etc.). En el caso de que no sean suficientes, se podría optar al tratamiento quirúrgico. Este variará en función de si la paciente desea tener hijos o no. En el primer caso, se procederá a la extirpación de los miomas, mientras que en el segundo se podría optar por la extirpación uterina (histerectomía). Existe la posibilidad de que vuelvan a aparecer los miomas tras su extirpación.
En el caso de miomas de tipo asintomático no se requiere seguimiento ni tratamiento específico, especialmente en pacientes próximas a la menopausia.
La detección de los miomas se puede dar con un examen pélvico manual del ginecólogo o una ecografía pélvica.
Miomas malignos
Los leiomiosarcomas uterinos son tumores malignos del útero compuestos completamente por músculo liso. Aproximadamente, una de cada 10.000 mujeres con miomas presentará un tumor maligno.
Su crecimiento suele ser rápido, por lo que habrá de tenerse en cuenta en pacientes posmenopáusicas, ya que la edad media de las mujeres con leiomiosarcoma es de 50-55 años.
Útero miomatoso en la menopausia
Aunque es frecuente que los miomas se desarrollen en la edad fértil, pueden persistir durante y después de la menopausia.
La mayoría de las mujeres, debido a la disminución de estrógenos que acompaña a la menopausia, experimentan la disminución del tamaño de los miomas.
En pacientes con terapia sustitutoria hormonal es necesario un seguimiento periódico para determinar si sus miomas están aumentando de tamaño. De ser así, podría estar indicada la suspensión del tratamiento.

Artículo especializado
Dermografismo: causas y tratamiento
El dermografismo es una de las formas de urticaria más frecuente. Su nombre hace referencia al efecto parecido a «escribir sobre la piel» que se da al rascarla, con la aparición de lesiones lineales.
¿Qué es el dermografismo?
El dermografismo consiste en la aparición de marcas o ronchas en la zona de la piel en la que se ha rascado o arañado previamente. Se trata de una susceptibilidad exagerada a la aparición de erupciones en la piel cuando existe un estímulo como el rascado.
Las erupciones también pueden aparecer cuando se somete a la piel a estímulos de contacto intensos como un secado vigoroso tras el baño. En ocasiones, las lesiones cutáneas que aparecen al ser rascadas dan lugar a la aparición de muchas más.
En general las lesiones son muy superficiales pero pueden extenderse y hacerse más profundas.
El dermografismo puede aparecer a cualquier edad, siendo más frecuente en adultos jóvenes. El inicio suele ser gradual y no suele estar asociado a ninguna patología, aunque ocasionalmente, pueden presentar una afectación tiroidea.
La duración del dermografismo se puede alargar durante años. Lo normal es que se produzca una reducción progresiva de las lesiones de la piel después de uno o dos años desde la aparición del dermografismo.
Puede aparecer de forma aislada, si bien en ocasiones acompaña a otras formas de urticaria, como las que se desencadenan por estímulos externos como el frío o la presión o el ejercicio físico.
Tipos de dermografismo
El dermografismo se puede clasificar en:
Dermografismo simple . Las lesiones que se producen tras rascar la piel son asintomáticas, desapareciendo en unos minutos.
Dermografismo sintomático . Se trata de casos menos frecuentes en los que las lesiones pruriginosas pueden persistir más de una hora.
¿Qué causa el dermografismo?
La histamina es el mediador químico liberado en la piel en los casos de dermografismo, junto a otras sustancias relacionadas con el sistema inmune como ciertos anticuerpos. Se han observado casos en los que el dermografismo es desencadenado por la alergia a algún medicamento, por la concurrencia de determinadas infecciones o la presencia de parásitos intestinales.
Suele ser más frecuente en pacientes atópicos, pudiendo ser desencadenado por acciones sencillas tales como arañazos, fricción con la ropa u objetos sólidos. Esta afección cutánea puede exacerbarse con el frío, el agua caliente y el ejercicio, especialmente si existen áreas de contacto como en el judo, el rugby, etc.
En el dermografismo pueden participar causas emocionales. Los brotes de prurito y la aparición de erupciones tras el rascado pueden tener lugar en forma de brotes, relacionados a su vez con situaciones de preocupación excesiva o estrés.
Síntomas habituales del dermografismo
Los síntomas del dermografismo incluyen las erupciones de la piel tras el rascado y el prurito o picor intenso. Esta sintomatología suele empeorar cuando se dan condiciones de calor, el uso de prendas de vestir ajustadas que oprimen alguna parte del cuerpo, permanecer largo tiempo sentados en asientos incómodos, cuando se realizan gestos o actos de contacto como aplaudir, etc.
Para realizar el diagnóstico el dermatólogo solo tiene que rascar con algún objeto no punzante, como un bolígrafo, la superficie anterior del antebrazo del paciente. Cuando existe dermografismo, se producirá la aparición de las erupciones en los siguientes 5-10 minutos en una intensidad que puede ser variable.
Cómo tratar el dermografismo
El principal tratamiento para el dermografismo consiste en la administración de fármacos antihistamínicos. Para los casos en los que el paciente presente prurito y éste interfiera en sus actividades cotidianas, los antihistamínicos H1 de primera y segunda generación como la hidroxicina y la cetirizina han demostrado ser eficaces para tratar este síntoma y reducir el número de lesiones en la piel, por lo que constituyen los medicamentos de primera elección. El tratamiento debe prolongarse durante varios meses en la mayor parte de pacientes con síntomas.
Además, deben evitarse los baños o duchas excesivamente calientes, que el chorro de agua salga a demasiada presión, el secado del cuerpo vigoroso y la utilización de ropa ajustada o gruesa.
Cuando no existen síntomas el dermografismo no precisa de ningún tratamiento, simplemente intentar evitar los desencadenantes conocidos que pueden exacerbarlo.
A nivel preventivo es útil la utilización diaria de emolientes, especialmente cuando la piel está muy seca.
Gestionar bien el estrés también puede ayudar a reducir la liberación de histamina por parte de los mastocitos de la piel y reducir el dermografismo.

Artículo especializado
Hiperestesia: ¿Qué es y cómo tratarla?
Hiperestesia significa literalmente “aumento de percepción sensitiva” y se utiliza para describir el síntoma que aparece ante el aumento de la sensibilidad a un estímulo, incluyendo las sensaciones dolorosas. Más específicamente, suele utilizarse para referirse a una mayor sensibilidad de la piel, incluyendo reacciones dolorosas al tacto y a la temperatura. Es por ello que muchos pacientes acuden al Dermatólogo para encontrar las causas y la manera de hacer frente a la hiperestesia.
¿Qué es la hiperestesia?
La hiperestesia es un síntoma en el que se produce un trastorno de la percepción y una distorsión sensorial por el aumento de la intensidad de las sensaciones. De este modo, incluso los estímulos de baja intensidad como el roce de la ropa sobre la piel se perciben de forma anormalmente intensa.
En general, las personas que padecen hiperestesia experimentan la mayoría de sensaciones desagradables a través del tacto, aunque existen casos en que también se ven afectados los sentidos de la vista y la audición.
Hiperestesia: causas y tratamiento
El sistema nervioso es el encargado de regular la capacidad de percepción, tanto el central como el periférico. De este modo, un estímulo da lugar a la generación de una sensación que puede estar distorsionada por diferentes motivos.
La hiperestesia se incluye como síntoma común dentro del dolor neuropático , es decir, el dolor causado por una lesión o enfermedad del sistema somatosensorial.
Los tipos más frecuentes de hiperestesia son la alodinia y la hiperalgesia . La alodinia consiste en la aparición de dolor por un estímulo que en condiciones normales no provocaría una respuesta dolorosa (como sentir dolor a una caricia).
Por otro lado, la hiperalgesia es una respuesta dolorosa exagerada a un estímulo que generalmente causa dolor (como el dolor desproporcionado en la piel por un pequeño pellizco o un pinchazo).
Los síntomas de dolor neuropático, incluida la hiperestesia, se desarrollan por causa de una enfermedad o lesión del sistema nervioso que provoca un funcionamiento anormal del sistema somatosensorial. De este modo, las causas de la hiperestesia se pueden clasificar anatómicamente como de afectación central o periférica.
En la afectación central, las patologías causantes pueden incluir:
Esclerosis múltiple.
Mielopatías.
Accidentes
Diversas infecciones
Etc.
Las patologías que pueden causar una afectación periférica que provoque a su vez hiperestesia incluyen:
Diabetes mellitus.
Hipotiroidismo.
Sarcoidosis.
Síndrome de Sjogren.
VIH y otras infecciones.
Traumas
Tratamientos farmacológicos como la quimioterapia, estatinas, inmunosupresores y antibióticos.
Tóxicos como el alcohol y los metales
Deficiencias de vitaminas del grupo
El tratamiento de la hiperestesia y otros síntomas de dolor neuropático en muchas ocasiones es un desafío difícil de afrontar. En cualquier caso, los mejores resultados se pueden lograr mediante un enfoque multidisciplinar. De este modo, un equipo de diferentes profesionales de la salud podría tratar las causas subyacentes, administrar los fármacos pertinentes, abordar las deficiencias funcionales, las manifestaciones físicas y brindar servicios de salud mental, si fuera necesario.
Para la neuropatía periférica, las causas tratables más comunes son la diabetes mellitus, el hipotiroidismo y las deficiencias nutricionales.
En cuanto al tratamiento farmacológico, algunos medicamentos pueden ser útiles para tratar las causas centrales y periféricas de la hiperestesia. De las opciones farmacológicas disponibles, los antidepresivos y los fármacos antiepilépticos son los más utilizados.
Hiperestesia cutánea
Como se ha dicho, la hiperestesia es un aumento de la sensibilidad que afecta principalmente a la piel. De este modo, la hipersensibilidad en la piel al tacto y también un aumento de la sensibilidad en zonas específicas como la sensibilidad en la cara al tacto son síntomas característicos.
La sensibilidad de la piel se cataloga como superficial y viene determinada por la información que perciben los receptores que hay a nivel cutáneo. Esta se contrapone a la sensibilidad de los órganos internos; y la propioceptiva, encargada de informar sobre los miembros, actitudes y movimientos corporales.
En Savia ponemos a tu disposición los mejores especialistas en Dermatología .
Detección de la hiperestesia
Para la detección y diagnóstico de la hiperestesia se debe realizar una historia completa que, en la mayoría de los casos, debería ser suficiente.
Para indagar en las posibles causas, se debería realizar un examen neurológico completo además de un examen físico general. El primer paso debe ser determinar si la causa es periférica o central. Es esencial diagnosticar con precisión la causa de la hiperestesia para poder establecer el tratamiento adecuado.
Pruebas médicas
Dentro de las pruebas médicas de rutina necesarias para el estudio de una hiperestesia periférica, debería incluirse un análisis de sangre que incluyera:
Hemograma
Parámetros metabólicos.
Glucosa en
Velocidad de sedimentación
Hormonas
Vitamina
Además, en base a la sospecha clínica:
Hemoglobina A1c (HbA1c).
Anticuerpos del
Hormonas hepáticas.
Anticuerpos de
Enfermedades venéreas.
Enzima convertidora de angiotensina (ECA).
Otras pruebas que se pueden llevar a cabo incluyen el análisis de orina, pruebas para descartar síndromes paraneoplásicos, trastornos inflamatorios del sistema nervioso central y neuropatías, entre otras. Finalmente, se pueden llevar a cabo análisis del líquido cefalorraquídeo y pruebas genéticas.
En cuanto a las pruebas de diagnóstico por imagen, por lo general, no son necesarias para diagnosticar la hiperestesia, pero ayudan a diagnosticar afecciones específicas. De este modo, la tomografía computarizada y la resonancia magnética pueden ser útiles para diagnosticar la compresión de la raíz nerviosa, hernia de disco, mielopatía y tumores en el cerebro o la médula espinal.
Otra prueba que pueden ser útil es la electromiografía para identificar el tipo de neuropatía.
Hiperestesia y Covid
La COVID-19 provoca síntomas principalmente relacionados con el tracto respiratorio (incluyendo tos, problemas pulmonares y respiratorios, pérdida del olfato y del gusto, etc.). Sin embargo, la COVID-19 también puede causar daños y manifestaciones en otros órganos y sistemas del organismo, como los riñones, el sistema cardiovascular y el sistema nervioso central.
Además, se han podido documentar manifestaciones cutáneas asociadas a la COVID-19 − incluyendo la aparición de hiperestesia cutánea en pacientes que han padecido la infección por SARS-CoV-2, especialmente con la variante Ómicron− si bien no ha podido ser del todo demostrado que la infección sea la causa directa del aumento de sensibilidad.

Artículo especializado
Adipsia: ¿Qué hacer si no tengo sed?
El agua es la bebida principal por excelencia, necesaria para la vida y fundamental para realizar prácticamente todas las funciones del organismo. Por ejemplo, proporciona volumen sanguíneo, disuelve sustancias y tiene un papel clave tanto en el mantenimiento de la temperatura corporal como en la excreción de sustancias a través de la orina.
La equilibrio hídrico hace referencia al mecanismo de homeostasis que regula la ingesta de agua y su excreción (a través de la respiración, el sudor, las heces y la orina). El agua ingerida permite la renovación del agua corporal reemplazando así las pérdidas de líquido. Cuando disminuye el agua celular, se desencadena el mecanismo de sed. La hormona antidiurética (ADH) también conocida como vasopresina es liberada al torrente sanguíneo y transportada a los riñones. Eso comporta un aumento de la reabsorción del agua conservando el agua en el cuerpo y evitando la excreción de agua por la orina. Por otra parte, frente a un exceso de agua corporal, la secreción de ADH disminuye y la reabsorción de agua en los riñones también. De esa forma, se excreta un mayor volumen de orina diluida eliminando así el agua.
Podemos distinguir entre dos tipos de sed según su causa:
Sed osmótica : aparece cuando hay un aumento en la concentración de sales fuera de las células gracias a la ingesta de una comida con alto contenido en sal.
Sed hipovolémica : aparece al disminuir el volumen de sangre (pérdida de agua e iones). Por ejemplo, al realizar ejercicio físico intenso, al perder agua a través de la sudoración, etc.
¿Qué es la adipsia?
La adipsia es la ausencia de la sensación de sed, incluso cuando el organismo requiere hidratación. A veces aparece como síntoma asociado a enfermedades como la diabetes insípida o la hipernatremia (alta concentración de sodio en sangre) o como efecto secundario de un fármaco. La hipodipsia se conoce como la disminución parcial de la sensación de sed.
Este problema médico puede aparecer a causa de:
Anomalías congénitas del cerebro
Lesión cerebral que afecta al hipotálamo
Accidente cerebrovascular
Origen psiquiátrico. En este caso, hablaríamos de adipsia psicógena .
¿Qué consecuencias conlleva sufrir adipsia?
El riesgo de la falta de sed es precisamente no alcanzar las necesidades mínimas de agua, provocando un estado de deshidratación . La deshidratación leve o moderada suele cursar con boca seca (xerostomía), orina de color oscuro, debilidad, dolor de cabeza, pérdida de apetito, calambres musculares y apatía, entre otros. En cambio, cuando la deshidratación pasa a estado grave, suele incluir signos como irritabilidad, ojos hundidos, aumento de la frecuencia cardíaca, mareos, delirio, inconsciencia y puede incluso ocasionar un daño cerebral permanente.
En general, el grupo de personas más vulnerables a padecer deshidratación incluyen bebés, niños y ancianos así como las mujeres embarazadas.
¿Cómo saber si tengo Adipsia?
Una de las alarmas más evidentes es dejar de sentir la sensación de sed de manera repentina. Unos niveles muy bajos de vasopresina en sangre puede ser indicador de adipsia. Ante una sospecha de padecer adipsia, es preferible acudir al médico.
¿Qué pasa si tomo agua y no tengo sed?
No solamente no pasa nada si no que es necesario hacerlo en caso de sufrir adipsia. Será la única manera de evitar las consecuencias ya mencionadas anteriormente y asegurar que el organismo recibe las cantidades necesarias de líquido.
Los requerimientos de agua dependen de varios factores tales como el clima, la actividad física, el tipo de dieta, la temperatura ambiental, etc. Sin embargo, la recomendación para adultos suele ser entre 2 y 2,5 litros diarios, que pueden provenir de:
El agua presente en toda clase de líquidos y bebidas: agua, leche, caldos, infusiones, etc. Esto supondría aproximadamente el 70-80%.
Del agua presente en alimentos, principalmente frutas y verduras, aunque otros alimentos como la carne, el pescado y los huevos, también contienen un porcentaje elevado de agua. El agua que obtenemos a través de la comida supone el 20-30% restante.
Durante el embarazo aumentan los requerimientos hídricos. Un consumo óptimo de líquido ayudará a prevenir infecciones urinarias y estreñimiento. Asimismo, durante la lactancia materna es preciso aumentar la ingesta de agua para compensar las pérdidas a través de la leche.
Normalmente, los requerimientos de agua son alcanzados gracias a la propia sensación de sed, pero en aquellas personas que no notan esa necesidad es imprescindible inculcarles el hábito de beber y cumplir con una rutina de consumo de líquidos.
Técnicas operantes para la adquisición de la conducta de beber agua:
Llevar un registro de agua. El simple hecho de monitorizar el consumo de agua, aunque sea ir tachando una lista o coloreando una celda de una tabla, funciona como refuerzo positivo.
Ponerse alarmas o recordatorios para acordarse de beber. Hoy en día existen varias app específicas para ello.
Beber un vaso de agua en ayunas diariamente.
Beber un vaso antes de cada comida.
Tener siempre a mano una botella de agua individual.
La adipsia es un problema médico muy inusual del cual no hay un tratamiento farmacológico. La única manera de evitar sus complicaciones es aprender a consumir líquidos de manera pautada, adaptando la cantidad según factores como el clima o la realización de ejercicio físico. Como ya hemos visto, el agua debería ser la bebida principal de nuestra dieta, evitando el consumo regular de otras bebidas no saludables como refrescos, zumos y alcohol.

Artículo especializado
Amaxofobia: miedo a conducir
Abrir la puerta, sentarse y ajustar el asiento, revisar los espejos y arrancar. Algo que para muchos puede ser una simple rutina mañanera, puede ser un mundo para muchas personas. Y es que cada vez somos más personas al volante y esto puede llegar a dar mucho miedo.
La amaxofobia o miedo a conducir, es considerada una fobia situacional, pero es muy común que se manifieste en personas propensas a la ansiedad, personas con la necesidad de tenerlo todo bajo control o aquellas con baja autoestima.
¿Qué es la amaxofobia?
La amaxofobia es el miedo o aprensión a conducir un vehículo. Puede ser tanto al hecho de conducir en general o en situaciones concretas que se dan durante la conducción, como rotondas, atascos o conducir de noche.
Y no es solo cosa de conductores noveles. Según las estadísticas, el 30% de los conductores presentarán este miedo en algún momento. Otra cuestión es durante cuánto tiempo los acompañe en sus viajes.
El origen de la amaxofobia puede darse desde los primeros momentos en los que nos ponemos al volante como consecuencia de no saber conducir, en este caso se habla de amaxofobia primaria . Pero también se puede generar como consecuencia de una mala experiencia al volante o un accidente de tráfico, denominándose amaxofobia secundaria .
¿Cómo saber si tienes amaxofobia?
¿Soy incapaz de conducir de noche? ¿Siento como se me acelera el corazón solo con pensar en que tengo que coger el coche? ¿Me da miedo tener que arrancar o aparcar cuesta arriba? Existen muchas preguntas que pueden ayudarte a identificar si sufres de esta fobia específica.
Normalmente, las personas que tienen miedo a conducir tratarán de evitar coger el coche, aunque las alternativas en el transporte les incremente considerablemente el tiempo de viaje. Tienen tendencia a limitarse a hacer aquellos trayectos que han podido revisar previamente o que han podido aprenderse de memoria. Por otro lado, el hecho de conducir puede suponer una carga cognitiva tan elevada que al bajarse del vehículo pueden sentir un grado de agotamiento anormal.
Además, algunos de los síntomas que pueden acompañar a la amaxofobia y que pueden ayudar a identificarla incluyen −además de la sensación de ansiedad− sudoración, rigidez, taquicardia, problemas gastrointestinales y dificultades para dormir el día anterior a un trayecto, si este ha sido planificado.
¿Cómo ayudar a una persona con amaxofobia?
Como ya hemos visto, sufrir amaxofobia es algo que le puede suceder a cualquiera. Si conoces a alguien que tenga miedo a conducir es importante que se sienta apoyado. Al fin y al cabo, conducir conlleva riesgos, aunque sean mínimos.
Te ofrecemos una serie de consejos que pueden ayudar a la hora de gestionar este miedo:
Escucha cuales son las preocupaciones que le generan el miedo al conducir. El hecho de sentirse escuchados, sin juicio, ayudará a que se relajen.
Apóyale si decide buscar alternativas que impliquen no coger el coche. O ofrécete si te es posible.
No les des indicaciones a menos que lo hayáis hablado previamente. Si das indicaciones trata de que sean específicas.
Evita decir “cuidado” o “mira”. Solo conseguirás que se pongan más nerviosos.
Cuando el miedo a conducir es grave es recomendable acudir al psicólogo. Las taquicardias, la sensación de falta de aire o los temblores dificultan la conducción del vehículo por lo que es necesario aprender a gestionar estas situaciones antes de tratar de retomar la conducción.
Afrontamiento progresivo
La intervención recomendada para superar el miedo a conducir es la terapia psicológica, donde el terapeuta analiza las situaciones, pensamientos y síntomas físicos que contribuyen al miedo a conducir para luego exponernos a él de forma progresiva.
El afrontamiento progresivo consiste en exponernos gradualmente a aquello que nos genera rechazo. Con el apoyo del terapeuta y, dependiendo del caso, una autoescuela. Se le ofrece al paciente una exposición planificada, donde se tenga en cuenta aquello que le preocupa y los síntomas que presente.
Para empezar esta intervención se escogen aquellas situaciones menos estresantes. Conforme se van superando las sensaciones de incomodidad se procede a enfrentar las situaciones que producen un mayor rechazo por parte del paciente. Debe ser un trabajo continuo, ya que la ansiedad es difícil de doblegar.
La terapia para la amaxofobia normalmente tiene un componente que se realiza en grupo, donde cada persona pueda exponer su experiencia y aprender de otros. Pero es importante que exista un componente individualizado a la hora de exponernos.
La terapia psicológica grupal (o individual) consiste en la exposición por parte del psicoterapeuta a las ideas disfuncionales que pueden ayudar a entender la naturaleza de la fobia a conducir. En ella se manejan conceptos como el estrés postraumático y exponen estrategias para afrontar el problema, incluyendo:
Técnicas de relajación.
Focalización de la atención o mindfulness.
Manejo de los pensamientos negativos y los sentimientos de culpa.
Afrontamiento gradual de la amaxofobia.
La exposición a conducir, inicialmente puede ser simplemente subirnos al coche y encender el motor, para posteriormente conducir en un circuito cerrado o con un coche de autoescuela. De este modo, dependiendo del caso, será necesario la colaboración entre el psicólogo y un profesional de la conducción.
Es importante abordar cuanto antes esta fobia, pues lo normal es que cada vez sean más incapacitantes para las personas que las sufren, ya que cada vez habrá más situaciones que den miedo y cada vez nos costará más enfrentarlas.
¿Qué causa el miedo a conducir?
Existen multitud de causas para el miedo a conducir. Podemos haber tenido un accidente que nos impactase demasiado, una situación al volante de la que se haya derivado un ataque de ansiedad o incluso haberlo generado por experiencias que hemos escuchado de otras personas.
Lo realmente llamativo de esta fobia es que se trata de un miedo exagerado, pues las personas que las sufren suelen magnificar los riesgos e infravalorar sus propias capacidades, en este caso a la hora de conducir.
En cualquier caso, es necesario aclarar que la amaxofobia no depende de la pericia a la hora de conducir de la persona afectada, sino de un conjunto de sensaciones de peligro. Es normal que un conductor novato o alguien que no conduce desde hace tiempo sienta aprensión y cierto miedo a la hora de conducir. Lo que decidirá que padezcamos de amaxofobia es que no nos expongamos a estos miedos con éxito.
Artículo especializado
Hepatitis infantil: cómo detectarla
Se conoce cómo hepatitis al proceso inflamatorio del hígado, producido por respuesta inmunológica de causa multifactorial. Este órgano es esencial porque desempeña múltiples funciones que ayudan al adecuado funcionamiento del metabolismo, entre ellas se encuentran:
Producción de bilis, colesterol, proteínas transportadoras de grasas y factores
Almacenamiento y liberación de glucosa. Depuración de fármacos y sustancias nocivas.
Regulación de la coagulación sanguínea.
Compensación de la bilirrubina en sangre.
La hepatitis determina que muchas de las funciones de este órgano vital se vean afectadas. Las manifestaciones clínicas que aparecen pueden variar desde una forma asintomática con detección por analítica rutinaria , sintomatología inespecífica, hasta forma fulminante con fallo hepático.
Causas de hepatitis
La principal causa de hepatitis en niños es viral, siendo los virus hepatotropos (VHA, VHB, VHC, VHD, VHE) los más frecuentes. En menor medida están los virus que causan enfermedad sistémica con afectación hepática que suele resolverse en varias semanas sin evolución a la cronicidad. Entre ellos se encuentran los citomegalovirus, Epstein Bar , varicela, herpes simple, enterovirus, parvovirus B19, adenovirus y rubéola.
Otras causas menos frecuentes son las toxicológicas por sustancias de empleo común por adolescentes como ácido retinoico para el acné, contraceptivos orales, alcohol y anfetaminas, o fármacos hepatotóxicos como analgésicos, antibióticos, antifúngicos y antiepilépticos, entre otros. La hepatitis también puede estar causada por enfermedades autoinmunitarias que dañan el hígado.
¿Cómo detectar la hepatitis en niños?
Tras el contagio o período de incubación asintomática, se distinguen tres fases clínicas denominadas, pre Ictérica, ictérica y post ictérica, en función de la coloración amarillenta que toma la piel y que distingue cada una de las fases. Los síntomas generales que se pueden desarrollar en cada una de ellas son los siguientes:
Fiebre.
Dolor de cabeza.
Dolor
Vómitos.
Diarrea o estreñimiento
Pérdida de apetito.
Fatiga.
Orina oscura.
Heces blanquecinas.
Ictericia muy leve casi imperceptible.
Hepatomegalia (aumento del tamaño del hígado) y esplenomegalia (aumento del tamaño del bazo).
Astenia.
Dolor muscular.
Lesiones en piel (sobre todo en hepatitis B).
La complicación más temida de la hepatitis aguda viral es la hepatitis fulminante, que cursa con necrosis hepatocelular masiva y disfunción grave. Aparece como una enfermedad hepática de pocas semanas de evolución, en la que podría estar indicado el trasplante hepático.
El diagnóstico de la enfermedad se lleva a cabo con un detallado examen físico. La confirmación se realiza con la determinación de transaminasas séricas que, en el caso de infección por virus hepatotropos, suelen estar muy elevadas. De forma transitoria, se observan neutropenia, linfopenia y, posteriormente, linfocitosis relativa. No es infrecuente la hipergammaglobulinemia y, en formas graves, puede haber prolongación del tiempo de protrombina e incluso hipoglucemia.
En Savia ponemos a tu disposición los mejores especialistas en Pediatría .
Principales tipos de hepatitis virales
Hepatitis A
La hepatitis A es la más frecuente en la infancia, casi siempre benigna y autolimitada. En los últimos años ha disminuido significativamente debido a las mejoras sanitarias generales.
La transmisión es por vía fecal-oral, de persona a persona, por la ingestión de alimentos y agua contaminada. Se ve favorecida por la mala higiene y con frecuencia se relaciona con un bajo nivel socio-económico.
Hepatitis B
Se trata, principalmente, de una enfermedad de transmisión sexual. Sin embargo, la hepatitis b infantil puede haberse transmitido de madre a hijo durante el embarazo y el parto o por contacto sangre-sangre.
La mayor parte de los casos de infección son asintomáticos y otras veces cursa con un cuadro poco específico de fiebre (ocasional), malestar general, cansancio, anorexia, vómitos, dolor abdominal e ictericia que en niños es aún menos frecuente. En un porcentaje muy bajo están los casos que pueden tener un curso fulminante con fallo hepático agudo, que de no recurrir al trasplante conduce a la muerte en muchas ocasiones.
La mejor manera de controlar la infección es mediante la vacunación, implantada de manera universal en nuestro país.
Hepatitis C
La enfermedad infantil es infrecuente, sin embargo, desde la vacunación universal de la hepatitis B, la hepatitis C es la principal causa de hepatitis crónica en la infancia. En la actualidad la transmisión principal es la que se produce durante el parto en madres infectadas (suele ser asintomática) y en segundo lugar, la transmisión en inmudeprimidos, grandes cirugías, hemodiálisis y uso de drogas por vía parenteral.
El método de diagnóstico definitivo de la infección es la detección del virus en el suero. No existe vacuna para este virus, pero sí tratamiento farmacológico con antivirales.
Otras hepatitis
Otras menos habituales, especialmente en los niños, son la hepatitis D (o delta), de transmisión sanguínea y que sólo afecta a los que ya sufren una hepatitis por virus B, agravando su evolución, y la hepatitis E, que se contagia como la provocada por el virus A y que no suele hacerse crónica.
¿Qué debe comer un niño con hepatitis?
La hepatitis puede afectar la absorción de nutrientes e influir sobre el apetito, provocando pérdida de peso, reducción de las reservas de energía y dificultando la recuperación del paciente. La alimentación no sufre grandes modificaciones hasta que la hepatitis no se encuentra en un estado avanzado. Antes de esto no hay necesidad de hacer modificación alimentaria. Una dieta saludable es fundamental para el bienestar físico y mental del paciente con hepatitis ya que influye directamente en su calidad de vida. Unos hábitos alimentarios saludables ayudan a mantener el balance de líquidos y electrolitos en el organismo y a disminuir la sobrecarga de trabajo del hígado.
La dieta hepatoprotectora se caracteriza por ser una alimentación de fácil digestión en la cual se deberían evitar los siguientes alimentos:
Aguacate, frutos secos, galletas, chocolate,
Pescados como salmón, atún, trucha, sardinas y
Carnes rojas ricas en grasa, tocino, embutidos (salchicha, chorizos, mortadela, jamón, etc.).
Mantequilla, margarina, manteca y crema de leche.
Alimentos industrializados, precocinados y confeccionados con azúcar
Refrescos, zumos, leche entera, quesos grasos y yogures con azúcar.
Salsas como ketchup, mayonesa, mostaza, salsa inglesa, de soja, y
Finalmente, deben evitarse sustancias que podrían dañar al hígado, incluyendo las bebidas alcohólicas y medicamentos como el paracetamol.
 Savia
Savia