Artículos Especializados

Artículo especializado
Cómo Controlar los Ataques de Ansiedad o Pánico
Los ataques de pánico, también llamados crisis de angustia, se enmarcan en los conocidos como trastornos de la ansiedad ya que aparecen como síntoma en muchos de ellos. Por lo tanto, antes de empezar a hablar sobre ellos vamos a definir qué queremos decir cuando hablamos de ansiedad.
Sobre la ansiedad…
La ansiedad es un estado subjetivo , por lo tanto, una vivencia de malestar, tensión, incomodidad y alarma que hace que uno se sienta molesto. Al sentirse de esta manera, la respuesta más típica es la de intentar evitar esta sensación de alguna manera. La diferencia principal entre ansiedad, miedo y fobia es que en el caso de la ansiedad el estímulo desencadenante es interno, difuso, subjetivamente peligroso e inexistente fuera de la realidad interna de la persona . Esto hace especialmente delicado el manejo de este estado ya que resulta más fácil huir de la presencia de una araña que de las propias ideas.
En los principales manuales de psicopatología se describen tres aéreas de afectación:
Psicológica : ideas pesimistas, preocupación, temor, fallos en la memoria y la atención.
Conductual, motora o relacional: irritabilidad, temblores, tensión familiar y ambiental, discusiones, etc.
Risiológica o somática: hiperactivación vegetativa.
Cabe matizar que estas tres áreas no se activan por igual en todas las personas, sino que cada cual tiene su particular vivencia y experiencia de la ansiedad y por ello se hace indispensable tratar cada caso con suma atención e interés.
Hablemos de las crisis de angustia o ataques de pánico
Una crisis de angustia es la aparición aislada y temporal de un malestar o miedo intenso al que le acompañan una serie de síntomas psicológicos y somáticos. Normalmente, el ataque de pánico se inicia de forma brusca y habitualmente alcanza su máxima expresión en menos de 10 minutos , acompañándose a menudo de una sensación de peligro de muerte inminente y de una urgente necesidad de escapar. Los síntomas más frecuentes son: aturdimiento, nerviosismo, taquicardia, palpitaciones, sudoración, sensación de ahogo, molestias abdominales, mareos, miedo a volverse loco, sensación de irrealidad, despersonalización, miedo a morir, etc.
La persona que padece un ataque de pánico se muestra aterrorizado y queda muy fatigado tras la crisis.
Los manuales diagnósticos coinciden en que existen tres tipos de crisis de angustia:
Inesperadas: sin desencadenante aparente.
Situacionales: aparecen después de exponerse a alguna situación o estímulo que las desencadena.
Predispuestas situacionalmente: pueden aparecer al exponerse a alguna señal que recuerde algún estimulo desencadenante, lo que puede ser consciente o inconsciente y, por lo tanto, a veces dicho estímulo es difícil de identificar.
Como curiosidad, cabe señalar que este tipo de crisis pueden darse incluso cuando la persona está dormida.
Tratamientos eficaces
Es muy importante tener en cuenta que los ataques de pánico pueden formar parte de cuadros sintomáticos diversos. Por lo tanto, lo más importante es que se haga un buen diagnóstico y que se determine, en primer lugar, de qué tipo de trastorno de la ansiedad estamos hablando. Una vez hecho este paso, son diversos los tratamientos que han demostrado su eficacia. De manera general, podemos nombrar algunos, aunque insistimos en que para que el tratamiento sea eficaz primero se habrá de hacer un buen diagnóstico.
Los tratamientos farmacológicos más utilizados son los antidepresivos y las benzodiacepinas . Por otro lado, en el campo de la psicoterapia , numerosas escuelas han mostrado su eficacia. Cabe destacar los tratamientos de índole cognitivo-conductual combinados con técnicas de control de la respiración . También son eficaces a más largo plazo tratamientos psicoanalíticos enfocados a proveer experiencias emocionales de toma de conciencia de los propios conflictos internos en el marco de la relación con el terapeuta que pueden progresivamente ayudar al paciente a fortalecer sus recursos personales.
¿Cómo actuar si presenciamos o vivimos un ataque de pánico?
Los ataques de pánico son un síntoma de que existe un trastorno de la ansiedad . Por eso, si los hemos padecido o tenemos a alguien cercano que los padece es importante que nos pongamos o recomendemos a la persona que lo padece ponerse en tratamiento.
En el momento en el que sucede lo más importante es tener en mente su naturaleza transitoria, aceptarlo sin resistencia , adoptar una postura cómoda y hacer respiraciones abdominales. Estas generalidades las podemos usar con nosotros mismos si somos “la víctima” o podemos ayudar a la persona que lo padece atendiéndola e invitándola a que las aplique. Es importante en esos momentos no minimizar su vivencia con comentarios del tipo “esto no es nada”, “se te pasará”, “tranquilízate”, etc. ya que esto puede tener el efecto contrario. La persona que padece este ataque necesita sentirse entendida, acompañada y contenida. Por lo tanto, hay que preguntarle qué necesita e intentar atender aquellas necesidades que pueda expresar con una actitud compasiva de escucha y atención . Si la situación nos desborda podemos llamar a un médico o acompañarla al hospital o servicio de urgencias ambulatorias más cercanas.
Artículo especializado
Biopsia: Qué Debes Saber
Una biopsia es un procedimiento médico mediante el cual se extrae una muestra de tejido o células del organismo para su posterior estudio mediante microscopio. Este estudio permite establecer el diagnóstico de la lesión a estudiar, por ejemplo, si se trata de un tumor y si éste es benigno o maligno. También se utiliza para el diagnóstico de enfermedades, como las de origen autoinmune (enfermedad de Crohn, enfermedades reumatológicas).
La biopsia se puede aplicar a cualquier parte del cuerpo , tanto en la superficie (biopsia de piel) como en el interior de los órganos (biopsia de colon), si bien en función de la anatomía de la zona a biopsiar, el tamaño y accesibilidad de la lesión y el riesgo (dificultad del procedimiento) puede variar su indicación. Por ejemplo, en determinadas localizaciones como el tronco cerebral, la biopsia puede suponer un gran riesgo y presentar una gran dificultad de realización.
Tipos de biopsia
Para obtener la muestra de tejido o células existen diferentes tipos de biopsia, las cuales pueden variar en función de la zona anatómica y el tipo de muestra que se requiera.
Biopsia por raspado : consiste en la obtención de una capa superficial de células mediante un utensilio similar a una cuchilla. Se indica en las lesiones cutáneas y ginecológicas (cérvix).
Biopsia en sacabocados o con Punch: se realiza con un cilindro hueco de bordes afilados que toma una muestra circular de piel de pocos milímetros de diámetro. Se utiliza en dermatología para lesiones cutáneas.
Biopsia escisional: con el uso del bisturí se obtiene toda la lesión junto con la piel. Se indica para estudio de lesiones cutáneas o de ganglios aumentados de tamaño.
Biopsia endoscópica: extracción de una muestra de tejido mediante una pinza que se introduce a través del endoscopio. El endoscopio es un tubo flexible con una cámara en la punta que permite visualizar la lesión y tomar muestras directamente. Esta técnica se emplea sobre todo en las lesiones gastrointestinales (estómago, colon).
Biopsia por punción: mediante esta técnica la obtención de tejido es a través de la inserción de una aguja.
Con aspiración con aguja fina (PAAF): se utiliza una aguja de fino calibre (similar a las de un análisis de sangre) y se extrae una cantidad de líquido que contiene las células de la zona a estudiar. El problema principal es que la muestra obtenida puede ser insuficiente.
Biopsia con aguja gruesa (BAG): se diferencia de la anterior en que se utiliza una aguja hueca y de calibre más grande con lo cual se pueden obtener cilindros de tejido (no sólo células). Requiere de anestesia local. Tiene mayor rendimiento diagnóstico que la PAAF.
Este tipo de biopsias se indican generalmente para el estudio de lesiones de mama, de hígado o de tiroides.
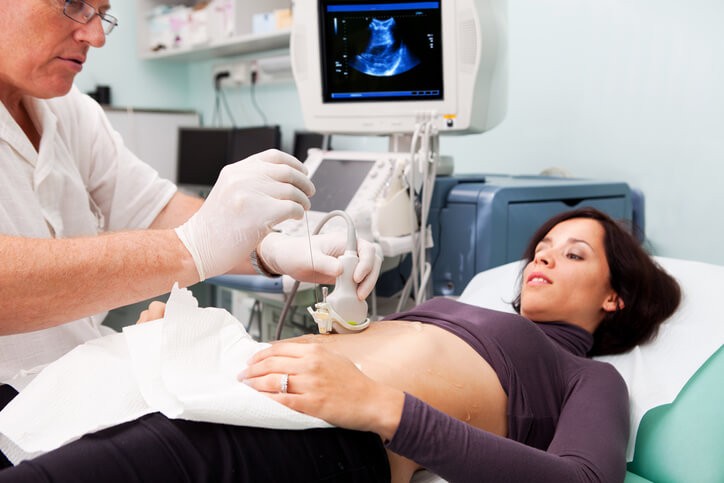
Biopsia dirigida por imagen : cualquier tipo de biopsia en la que se utiliza una técnica de imagen (ecografía, RM…) para identificar la lesión y asegurar que la extracción de la muestra se hace en la zona correcta. Es la forma habitual de realización de biopsia en los tumores de próstata.
Biopsia quirúrgica: implica la resección de la lesión en quirúrgica por el cirujano. Generalmente hay una localización y marcaje previo de la lesión mediante técnicas de imagen, colocándose un marcador (“arpón”), en la imagen obtenida.
¿Cuándo se solicita?
Una biopsia está indicada en el proceso diagnóstico para establecer la naturaleza de una lesión (tumor, reacción inflamatoria, etc.) o para el diagnóstico de enfermedades, especialmente de origen inflamatorio o autoinmunes como la enfermedad inflamatoria intestinal, pénfigo, lupus, etc.
¿Qué es importante saber?
Para optimizar los resultados de la biopsia se deben tener en cuenta varios factores:
La muestra tiene que ser suficiente (tener un tamaño mínimo) y ser, en la medida de lo posible representativa. En algunos casos, si esto no se cumple, puede ser necesario repetir la prueba.
La conservación y el procesamiento de la muestra deben ser adecuados siguiendo un protocolo establecido.
Algunas biopsias son más complicadas de analizar y además precisan de tinciones especiales o determinaciones genéticas más complejas. Por ello, también el tiempo de entrega de los resultados puede variar.
La anatomía patológica (rama de la medicina) que se encarga del estudio de las biopsias es muy complicada. No es infrecuente que una biopsia tenga un diagnóstico diferente tras ser valorada por dos patólogos y que se requieran revisiones para confirmar el diagnóstico.
Nuevos tipos de biopsia y aplicaciones
La biopsia líquida es una nueva técnica que permite un nuevo enfoque en la biopsia tumoral clásica.
Se basa en la detección de fragmentos tumorales en líquidos corporales (sangre, orina, saliva o líquido cefalorraquídeo), evitando la punción del tejido.
Los tumores pueden extenderse a otras zonas del cuerpo (metástasis) lo que da lugar a liberación de material genético en el organismo. La detección de este material genético permite realizar el seguimiento y determinar mutaciones específicas para un tratamiento dirigido en algunos tipos de tumores.
De momento, la biopsia es una práctica con limitaciones , pero prometedora. Donde se está utilizando es en el cáncer colorrectal metastásico.

Artículo especializado
Trucos Para Superar Airosa la Menopausia
Sofocos, disminución de la libido, irritabilidad… ninguna mujer querría pasar por eso y, de hecho, no siempre se experimentan todos los síntomas ni de la misma manera. Pero todas, antes o después, llegaremos a la menopausia. Por tanto, en lugar de lamentarnos, tratemos de aceptarla y conocerla. Cuanto más sepamos sobre los cambios que vamos a experimentar en la menopausia, mejor podremos afrontarlos y combatirlos.
Cese de la menstruación
La menopausia es un proceso biológico , como lo fue la adolescencia, etapa de transición entre dos estados hormonales distintos que tendrá efectos físicos y emocionales variados en cada mujer. Se produce cuando cesa la función ovárica en la mujer, algo que sucede alrededor de los 50 años . La consecuencia del fallo ovárico es la desaparición de las reglas, pero a nivel fisiológico afecta desde dos puntos de vista: por un lado, el ovario agotado deja de producir óvulos, con lo que finaliza la edad reproductiva y, por otro, deja de fabricar estrógenos, y es ese déficit de estrógenos el responsable de toda la sintomatología de la menopausia.
Síntomas
Hay mujeres que no refieren ningún síntoma, y el tránsito a ese “nuevo estado hormonal” se produce progresivamente. Pero la mayoría experimenta algunos cambios que se pueden clasificar según sean:
Síntomas vasomotores : es el síntoma más popular y más llamativo, formado por un cuadro agudo de vasodilatación cutánea, con sensación de calor que viene del interior del cuerpo, ascendiendo del abdomen o tórax a la cara, con rubor y sudoración en ocasiones. Son los llamados sofocos, y pueden darse antes de que desaparezca la menstruación, cuando las reglas se retrasan, y permanecer durante un periodo variable. Frecuentemente son más intensos el primer año y van decreciendo en intensidad de forma progresiva.
Síntomas locales : son más progresivos pero que tarde o temprano todas las mujeres los acusan. A nivel de la mucosa vulvar y vaginal el déficit estrogénico tiene como consecuencia adelgazamiento y deshidratación, lo cual provoca atrofia, sequedad, pérdida de elasticidad y, por lo tanto, dolor o molestia con las relaciones sexuales y picor. Esta atrofia afecta a todo el sistema genitourinario provocando también síntomas urinarios, más propensión a cistitis, disminución de la capacidad vesical con lo que aumenta la frecuencia urinaria o se han de levantar por la noche a orinar, y si hay tendencia a la incontinencia urinaria con los esfuerzos ésta se acentúa, igual que si había un poquito de prolapso de la vejiga o el útero, al debilitarse los tejidos también suele empeorar.
Síntomas generales : algunos más evidentes, como cambios de humor o del estado de ánimo, con tendencia a la irritabilidad, ansiedad o depresión. Disminución de la líbido, alteraciones del sueño… Por suerte, no afectan a todas las menopáusicas.
Otros no tan palpables, pero que afectan silenciosamente : en el momento en que dejamos de tener estrógenos se acelera el proceso de descalcificación progresiva del hueso que lo debilita y aumenta el riesgo de fractura, se llama osteoporosis. Y simultáneamente dejamos de beneficiarnos del efecto protector que tenían los estrógenos sobre el sistema cardiovascular equiparándonos a los hombres en incidencia de infarto, angina, hipertensión…
Suena muy poco glamuroso visto así, y ninguna de nosotras quisiera tener que pasar a ese nuevo estado. Pero hay que asumirlo como una nueva etapa y centrarnos en todo lo que podemos hacer para sobrellevarlo de la manera más digna y saludable posible y encararlo positivamente.
Trucos para llevarlo lo mejor posible
Estas son mis recomendaciones generales para todas las mujeres postmenopáusicas, y las premenopáusicas, que todavía tienen más margen de maniobra para anticiparse a los cambios:
Evita el sobrepeso : al entrar en la menopausia el metabolismo se organiza diferente y es muy frecuente ganar algo de peso, así que deberemos vigilar más que nunca nuestra dieta y nuestros hábitos para mantener un peso adecuado. De esta manera contribuimos a mantener a raya los problemas cardiovasculares y evitaremos la sobrecarga de las articulaciones aliviando o evitando los dolores articulares, que son frecuentes en las menopáusicas.
Dieta adecuada: más que nunca debemos ser cuidadosas con lo que comemos, favorecer un aporte adecuado de calcio con lácteos, cereales, frutos secos y semillas para evitar la osteoporosis. Disminuir la ingesta de grasas animales para contrarrestar el aumento inevitable de los niveles de colesterol que conlleva la edad y evitar el sobrepeso. No abusar de la sal, que será un factor de riesgo más de hipertensión, y asegurarnos un aporte suficiente de vitaminas.
Ejercicio físico : previene la hipertensión y la diabetes, y es importante para mantener la forma física, la densidad de los huesos y bajar los niveles de colesterol “malo”. Nos ayudará a evitar ese incremento de peso muchas veces inherente a este estado hormonal nuevo. Además, en la postmenopausia cambia la distribución de la grasa corporal asemejándonos más al patrón masculino: la grasa se acumula más en el abdomen y cintura, y menos en caderas y nalgas… ¡No queremos eso!, y la única forma de mantener la línea femenina será haciendo algo de ejercicio físico.
Ejercita también la musculatura del suelo pélvico: los ejercicios de Kegel o los abdominales hipopresivos son el tratamiento de la incontinencia urinaria de esfuerzo leve que puede empezar a manifestarse en esta fase.
Tomar el sol , sin excesos: las radiaciones solares son nocivas, pero para el mantenimiento de la densidad ósea es necesaria la vitamina D que obtenemos de la luz solar. Se recomiendan 15 minutos diarios, que mejor si los hacemos coincidir un paseo al aire libre, que nos hará segregar endorfinas para combatir la tendencia a la ansiedad y depresión, más frecuente en la menopausia.
Hidratación : bebe suficiente líquido para mantener una buena función renal y contrarrestar la sequedad de la piel y las mucosas que tarde o temprano todas notaremos. Y también incide en la hidratación vaginal, pues la atrofia que conlleva la menopausia provoca dolor con las relaciones sexuales, y con la disminución de la líbido que, a menudo, se asocia suman un “pack” que favorecerá la reducción de la cantidad y calidad de las relaciones y a empeorar la atrofia (las mujeres que mantienen una vida sexual activa y frecuente se atrofian mucho menos). Para mejorar este aspecto hay variedad de cremas y aceites hidratantes y lubricantes que se convertirán en esenciales.
Mantén un buen estado de ánimo : el cataclismo hormonal pasa factura y puedes estar más irritable, susceptible, decaída, con baja autoestima… Es importante hablarlo con tu familia, que ellos sepan cómo te sientes favorece empatizar y comprender. El ejercicio, pasar tiempo al aire libre, tener vida social, mantener costumbres saludables en definitiva, te hará sentir mejor.
Y sin lugar a dudas evita hábitos no saludables : tabaco, alcohol y cafeína en exceso no ayudan y contribuyen a la osteoporosis y a los sofocos.
Estos consejos deberían ser norma universal para todas nosotras , pero hay veces que no es suficiente y hace falta un tratamiento médico. A ese respecto me gustaría romper una lanza a favor del desprestigiado tratamiento hormonal: no se puede recomendar en todos los casos, pero hay mujeres que lo necesitan y se pueden beneficiar mucho de sus efectos. Si tu ginecólogo lo recomienda no lo rechaces sin tener la información necesaria.
Sobre el tratamiento hormonal sustitutivo
En la década de los 90 se puso de moda la administración de hormonas a todas las mujeres menopáusicas como si fuese el elixir de la eterna juventud, y se vio que, en función del contexto, dosis y duración del tratamiento, aumentaba el riesgo de sufrir cáncer de mama, de ovario, tromboembolismos… en las mujeres tratadas más de 10 años. Ante este hecho nos pasamos al extremo contrario y se dejó de tratar a muchas mujeres a las que les hacía falta. Y los extremos nunca son buenos.
Este tratamiento consiste en administrar los estrógenos (y progesterona si es necesaria) que nuestros ovarios han dejado de fabricar, y es el único tratamiento altamente efectivo para paliar los sofocos, además de contribuir al mantenimiento de la masa ósea, la líbido y la salud cardiovascular.
La recomendación actual es que hay que tratar a las mujeres con menopausia precoz y a todas aquellas a las que los síntomas de la menopausia merman su calidad de vida, siempre bajo control médico , a la mínima dosis efectiva y por un tiempo limitado. Con esas consideraciones este tratamiento es seguro y beneficioso.
Otro nivel en el que los estrógenos son altamente efectivos es si se aplican de forma tópica vaginal para pacientes con atrofia. En este caso el efecto es local, la absorción sistémica prácticamente nula y, por tanto, muy seguros. No todas las pacientes sufren el mismo grado de atrofia ni les afecta de la misma manera, pero para las que las cremas hidratantes no las conforten suficientemente, los tratamientos con pomadas de estrógenos y el láser son la alternativa.
En su lugar…
Existen tratamientos fitoterápicos como las isoflavonas de soja, la cimicífuga racemosa, el trébol rojo, la salvia o el lúpulo, de los que no existe suficiente evidencia científica sobre su efecto en el manejo de los síntomas de la menopausia, pero pueden ser una alternativa para las mujeres que no quieren o no pueden tomar el tratamiento hormonal, ofreciendo un alivio leve en la frecuencia y/o intensidad de los sofocos por lo que pueden resultar útiles en algunas ocasiones.

Artículo especializado
Arritmia: Qué Debes Saber
El corazón de una persona con un ritmo cardiaco regular y cuya frecuencia cardiaca sea de 70 latidos por minuto (lpm) late 100.800 veces en un día. Esta cifra variará en función de las actividades que se realicen a lo largo del día, pero también de otras circunstancias, como veremos, dando lugar a lo que se conoce como arritmias. Pero lo que es evidente es que nuestro corazón late constantemente y sin parar día a día.
¿Qué puede causar una arritmia?
La frecuencia cardiaca es variable ya que depende de distintas circunstancias, tanto internas como externas. Un susto, un hecho inesperado … pueden provocar un sobresalto que acelera de manera repentina y transitoria el corazón, pero una enfermedad también puede ser el origen de este cambio de ritmo cardiaco. El origen de los cambios de la frecuencia cardiaca puede ser múltiple y algunos podrá controlarlos el propio organismo, mientras que otros requerirán de actuaciones externas como el uso de fármacos o de cirugía.
Diagnóstico
El diagnóstico de una arritmia puede hacerse con un simple electrocardiograma en reposo, aunque a veces es necesario realizar otro tipo de pruebas diagnósticas como pruebas de esfuerzo , sobre todo recomendadas en personas deportistas. La práctica de actividad física comporta una exigencia física a la que el corazón puede no estar adaptado, hacer una prueba en la que se esté monitorizando constantemente los cambios del ritmo, ayudará a controlar lo que puede suceder durante la realización de las diferentes modalidades deportivas. Tras su hallazgo, pueden requerirse otras pruebas como un ecocardiograma para valorar de manera más concreta la patología existente y llegar a un diagnóstico.
Tipos de arritmias
Las arritmias pueden dividirse según el ritmo cardiaco ya que existen las arritmias lentas y las rápidas , que como indican su nombre van a tener velocidades de latido cardíaco completamente diferentes.
Arritmias lentas o bradicardias
Las arritmias lentas son las que se conocen como bradicardia s y la frecuencia suele situarse por debajo de 60 lpm en reposo , que es el que se considera el límite bajo, aunque existen circunstancias en las que este ritmo más lento es normal. En deportistas o en momentos de relajación y descanso, nuestro pulso puede enlentecerse y no estamos sufriendo ninguna arritmia patológica. La bradicardia del deportista no es más que una adaptación a la carga de entrenamiento que se realiza de forma regular, y uno de los ejemplos más conocidos es el de Miguel Induráin , ciclista que en los años 90 fue campeón hasta en cinco ocasiones del Tour de Francia, de manera consecutiva. Este ciclista tenía un latido cardiaco en reposo, para él normal, de 28 lpm y nunca en su larga carrera deportiva tuvo problemas cardiacos por esta razón.
Cuando la bradicardia se acompaña de síntomas como mareos o pérdida de conocimiento , si que será necesario acudir al especialista, el cardiólogo, para que haga una valoración del cuadro y determinar el tipo de tratamiento que pueda necesitarse. En aquellos casos en los que la bradicardia afecta de manera importante a la vida del paciente, impidiendo que pueda desarrollar una vida normal y ocasionando trastornos en su salud, el tratamiento será el implante de un marcapasos . Este dispositivo, que se coloca en el pecho del paciente, es el encargado de mantener un ritmo estable, impidiendo que las pulsaciones bajen por debajo de la frecuencia establecida y evitando así síncopes y otros síntomas asociados.
Taquicardias
Por otro lado, cuando la frecuencia cardiaca se sitúa por encima de 100 lpm en reposo , se habla de taquicardia . Las personas que las sufren en la mayoría de ocasiones notan cómo su corazón se acelera. Puede ser transitorio o de manera continuada durante un periodo de tiempo más o menos largo. Esta sensación es realmente incómoda e, incluso, puede acompañarse de una sensación de disnea (falta de aire) y cierta molestia o dolor que genera angustia. El tratamiento puede ser farmacológico o quirúrgico . En aquellas ocasiones en las que el tratamiento no sea el quirúrgico, los fármacos serán el tratamiento de elección, fármacos antiarrítmicos que controlarán la aparición de los cambios de latido cardiaco.
Respecto a la intervención quirúrgica, la técnica es la denominada “ ablación por radiofrecuencia ”. Con el paciente sedado pero consciente, se introduce un catéter por vía femoral hasta el corazón, constantemente monitorizado. En un primer momento se realiza un estudio electrofisiológico, que provoca la aparición de la arritmia, de modo que puede comprobarse la localización y dónde debe hacerse la ablación. Una vez realizada la intervención, el paciente queda en observación unas horas y tras éstas, si no hay complicaciones, se le da el alta hospitalaria.
Esta es, en la actualidad, una técnica ampliamente utilizada por los especialistas y que da resultados muy positivos.
Fibrilación auricular
Entre las arritmias rápidas la más frecuente es la fibrilación auricular , mientras que la más maligna por ocasionar una muerte súbita es la fibrilación ventricular . En este último caso, debido al elevado riesgo de muerte, una de las recomendaciones es la implantación de un desfibrilador automático. Este dispositivo es muy parecido a un desfibrilador externo, monitoriza de manera constante el latido cardiaco del enfermo y en el momento en el que detecta un cambio que puede ocasionar una fibrilación, produce una descarga para revertir el ritmo anómalo.
Artículo especializado
Cómo Evitar la Aterosclerosis
La mejor manera de evitar la ateroesclerosis es la prevención, es decir, evitando la aparición de lesiones en la pared arterial o frenando su progresión. Para ello, es importante seguir unos hábitos de vida saludables y llevar un control de los factores de riesgo si existen.
¿Qué es?
La aterosclerosis es una enfermedad inflamatoria crónica que afecta a las arterias de mediano y gran calibre (como la aorta) y cuya característica fundamental es la aparición de lesiones en la pared arterial (que se conocen como placa de ateroma). El término arterioesclerosis hace referencia únicamente al engrosamiento y endurecimiento de las paredes de las arterias, independientemente de su tamaño y de su causa. La ateroesclerosis es un tipo de arterioesclerosis debido a acúmulo de sustancias en la pared interna de las arterias, sobre todo lípidos, tejido fibroso y células inflamatorias. La progresión de estas placas produce una obstrucción progresiva de la luz arterial que puede ser total (trombosis) o parcial. La aparición de las placas de ateroma puede ocasionar la obstrucción directa del riego sanguíneo a órganos cercanos. También puede producirse la ruptura de la placa y esto provoca la formación de un trombo que se desprende y produce la obstrucción de vasos sanguíneos de órganos como el corazón o el cerebro, lo que se conoce como embolia.
¿Dónde y cuándo se produce?
La aterosclerosis puede afectar a todo el árbol vascular, pero es mucho más habitual que se produzca en el corazón (irrigado por las arterias coronarias), el cerebro (arterias carótidas, vertebrales y cerebrales) y las extremidades inferiores (arterias iliacas y femorales). El inicio de la aterosclerosis se da en la juventud, aunque no se hace evidente hasta edades avanzadas que es cuando se manifiesta en forma de lo que se conoce como enfermedad cardiovascular.
¿Por qué?
Los factores de riesgo identificados en la progresión de la ateroesclerosis incluyen el tabaquismo , la hiperlipidemia (exceso de grasa en la sangre), la diabetes, la hipertensión arterial, la obesidad , el sedentarismo y el estrés. Existen otros factores modificables como son la edad avanzada, el sexo y la herencia. Aunque aparece en ambos sexos, en los hombres lo hace 10 años antes que en las mujeres.
¿Cómo se presenta?
La ateroesclerosis se manifiesta en forma de enfermedad cardiovascular . Y ésta puede afectar a diferentes órganos, pero sobre todo es predominante en el corazón: cardiopatía isquémica, insuficiencia cardiaca; en el cerebro: embolia cerebral; y en grandes vasos: aneurisma (dilatación) de la aorta, arterias de las piernas (vasculopatía periférica).
En los países desarrollados, las enfermedades cardiovasculares son la primera causa de mortalidad , especialmente en varones. En las primeras etapas, es decir, cuando todavía la placa de ateroma es pequeña y no existe ruptura de la misma ni obstrucción del vaso sanguíneo no da ningún síntoma.
Los síntomas, que son consecuencia como decíamos de la obstrucción total o parcial vascular del territorio del cuerpo irrigado, variarán en función del órgano afectado:
La obstrucción de las arterias de las extremidades inferiores puede dar lugar a claudicación intermitente, que se caracteriza por la presencia de dolor muscular en las pantorrillas, desencadenado por la marcha y que obliga al paciente a pararse durante un momento, hasta que le deja de doler, por eso se llama «la enfermedad de los escaparates».
En grandes vasos, como la aorta, favorece el desarrollo de aneurismas , es decir, dilataciones de la pared arterial que pueden provocar la muerte por ruptura.
En el corazón, la obstrucción de las arterias coronarias da lugar a infarto de miocardio , angina de pecho o insuficiencia cardiaca.
Cuando la obstrucción afecta a las arterias cerebrales pueden aparecer desde ataques de isquemia cerebral transitoria, hasta un accidente cerebrovascular agudo o ictus , con secuelas más o menos permanentes.
Cuando la obstrucción afecta a las arterias renales, puede facilitarse el desarrollo de insuficiencia renal o aparecer hipertensión, que en este caso sería secundaria a la insuficiencia renal.
¿Cómo detectarla?
Generalmente, la enfermedad ateroesclerótica se diagnostica en fases tardías cuando aparecen sus consecuencias, es decir, las manifestaciones clínicas de la enfermedad cardiovascular.
En estos casos, se realiza el estudio del órgano afectado, por ejemplo, en caso de un infarto se realiza una coronariografía para ver el estado del árbol vascular y se ven las arterias tapadas por placas de ateroma.
Así, el diagnóstico de la enfermedad aterosclerótica cuando presenta manifestaciones clínicas es relativamente sencillo, siendo mucho más complicado diagnosticarla en fases tempranas. Es decir, ya existe daño en la pared arterial pero no se manifiesta clínicamente. El diagnóstico precoz es interesante ya que evitaría o disminuiría la enfermedad cardiovascular.
Por ello, se recomienda realizar chequeos a partir de cierta edad (40 años) , sobre todo en pacientes con antecedentes familiares de enfermedad cardiovascular y/o que presentan factores de riesgo pero que todavía no han sufrido ningún síntoma. De manera que el médico pueda calcular el riesgo del paciente de enfermedad vascular, realizar una analítica para detectar niveles de triglicéridos y colesterol y si es necesario pruebas de imagen, como un ecodoppler de las arterias que permita ver las paredes arteriales y el grado de afectación
¿Cómo prevenirla y tratarla?
La prevención es la mejor manera de evitar la aterosclerosis. Para ello, es importante seguir unos hábitos de vida saludables y llevar un control de los factores de riesgo si existen. Las medidas dirigidas a la población general para reducir el riesgo cardiovascular que provoca la ateroesclerosis incluyen:
Dieta saludable: reducir la ingesta total de grasas (<30%) y especialmente de grasas saturadas (<10%). Disminuir el consumo de azúcar refinado. Potenciar el consumo de verduras, pescado, fruta, aceite de oliva virgen, cereales integrales y legumbres.
Abandono del tabaquismo.
Limitar/disminuir el consumo de alcohol.
Realizar actividad física: se recomiendan 30 minutos de actividad física diaria (simplemente caminar a buen paso).
Control de la presión arterial. Si se es hipertenso: control y medicación por el médico.
Perder peso en caso de sobrepeso.
Control y tratamiento del colesterol en sangre si está elevado.
Control de la glucemia (azúcar en sangre) y si se es diabético, control estricto de la enfermedad.
Tratamientos específicos en determinados grupos de pacientes: antiagregantes,
Hacer exámenes periódicos de salud (chequeos) desde los 40-50 años, especialmente en aquellas personas con antecedentes familiares de enfermedades causadas por ateroesclerosis.
En estos chequeos se presta una importancia especial al estudio de los factores de riesgo cardiovascular. Los datos de un chequeo vascular permiten calcular el riesgo cardiovascular y la edad vascular de cada persona. Por ejemplo, un fumador importante de 40 años de edad biológica puede tener una edad vascular de 60-65 años por tener una ateroesclerosis propia de personas de esta edad secundaria al tabaquismo.

Artículo especializado
Manual de Uso de las Lentes de Contacto
El uso de lentes de contacto está muy extendido. Es una alternativa cómoda a las gafas que aporta calidad de vida y comodidad a los usuarios y permiten facilitar el ejercicio de la mayoría de deportes. Sin embargo, a veces se cometen auténticas barbaridades con ellas: se guardan en agua a falta del líquido apropiado, se dejan puestas por la noche por olvido… las anécdotas con las lentillas son muchas. El problema viene cuando de la anécdota se pasa a la infección. Y es que no hay que olvidar que las lentes de contacto son un producto sanitario y, como tal, su uso es seguro si se cumplen unas medidas que repasaremos a continuación.
Para un uso seguro, no olvides…
Lavarte las manos antes de colocártelas en los ojos.
Lubricarlas y limpiarlas en la solución, no con agua. Las lentes de contacto se limpian usando sólo los líquidos especialmente formulados para ello, evitando el uso de agua corriente del grifo, el agua oxigenada o el alcohol, entre otros ejemplos, ya que no desinfectan y pueden provocar lesiones oculares.
Utilízalas dentro del tiempo adecuado, generalmente entre ocho y nueve horas al día. No es aconsejable su uso permanente durante días, de lo contrario se es propenso a caer en alguna infección. Si son de uso diario, deben ser retiradas antes de dormir.
Guárdalas en un estuche apropiado rellenado con una solución estéril adecuada y propuesta por el fabricante.
Renuévalas según las especificaciones del fabricante. Por ejemplo, las mensuales una vez al mes y las semanales una vez a la semana. Si se trata de lentes de contacto rígidas, podrían durar entre dos y tres años.
Las lentes de contacto blandas desechables se pueden rasgar, así que manipúlalas con suavidad. Si se rompe o rasga alguna lente, deséchala.
Nunca compartas tus lentes de contacto, no sólo porque pueden propagarse bacterias de una persona a otra, sino también porque las lentes están adaptadas y graduadas para tu visión y tu ojo.
Qué y cómo son
Las lentes de contacto (también conocidas como lentillas) son unas lentes correctoras o cosméticas que se colocan en el ojo, concretamente sobre la capa lagrimal que cuida y lubrica la córnea. Las lentillas de colores se han convertido en una moda habitual en la vida cotidiana actual, las cuales no sólo se utilizan con el aumento necesario, sino que, además, pueden elegirse con el color deseado.
Hay dos tipos principales de lentes de contacto: duras y blandas .
Las lentes de contacto blandas son la elección preferida entre la mayoría de usuarios de lentes de contacto y se comercializan en diversas versiones (de uso desechable diario, semanal o mensual, de uso prolongado, bifocales o multifocales…).
Las lentes de contacto duras más comúnmente utilizadas hoy en día son las lentes de contacto rígidas y permeables al gas (RGP por sus siglas en inglés). Están hechas de plástico y otros materiales como la silicona o fluoropolímeros. Éstas mantienen su forma, sin embargo, permiten un libre flujo de oxígeno a través suyo entre el ambiente externo y la córnea. Los RGPs pueden ser la mejor opción cuando la córnea tiene el astigmatismo suficiente para cambiar su forma (la córnea tiene la forma de un huevo en lugar de una naranja).
Cuándo puede haber problemas
Los portadores de lentes de contacto pueden sufrir irritación ocular por diversas causas :
Mecánicas: por roce constante con la superficie del ojo.
Hipóxicas: por falta de permeabilidad al oxígeno.
Químicas.
Infecciosas: bacterianas, víricas…
Inmunológicas (por ejemplo, alergia).
Signos y síntomas de que algo no va bien
Las lentes de contacto contribuyen decisivamente en la aparición de infecciones oculares (conjuntivitis, que pueden ser, principalmente, bacterianas y víricas) y también en la aparición de ulceraciones corneales.
El enrojecimiento del ojo y la blefaritis (inflamación de los párpados) son formas frecuentes de expresión de muchas enfermedades oculares. Puede apreciarse escozor, picor, sensación de cuerpo extraño y lagrimeo en cualquier proceso inflamatorio de la superficie ocular, así como secreción mucosa (blanquecina) o purulenta (amarillo-verdosa) si existe conjuntivitis vírica o bacteriana asociada, respectivamente. El dolor es mínimo y la agudeza visual apenas disminuye
Las queratitis, inflamaciones corneales, pueden ser de gravedad variable: desde una afectación epitelial superficial leve hasta una úlcera que puede progresar a la perforación. Producen intenso dolor (sobre todo con el parpadeo) ojo rojo, sensación e cuerpo extraño en el ojo, lagrimeo, fotofobia (hipersensibilidad a la luz) y visión borrosa (por pérdida de la transparencia corneal). A diferencia de otros procesos como pueden ser, por ejemplo, la uveítis o el glaucoma agudo, las molestias de la queratitis cesan con la instilación de colirio anestésico.
Exploración del ojo afectado
El método ideal es la lámpara de hendidura. Otro método es el uso del colirio de fluoresceína, que permite detectar la presencia de defectos en la superficie epitelial conjuntival y corneal. Tras aplicar la fluoresceína se debe examinar el ojo teñido con luz de Wood o con una luz convencional (filtro casero de papel de celofán azul oscuro en la bombilla). Sólo las zonas teñidas de la superficie ocular que son inmóviles representan úlceras, ya que las secreciones también aparecen teñidas.
Tratamiento
En aquellos casos en los que el ojo se encuentre irritado y rojo se deberá instaurar tratamiento adecuado según la causa que lo haya provocado y se deberá recomendar no volver a ponerse las lentes de contacto hasta la completa resolución del cuadro.
Las lentes de contacto no pueden ser utilizadas en una persona con una infección ocular activa.
En el caso de las conjuntivitis bacterianas se aconsejará la aplicación de colirios antibióticos varias veces al día y la aplicación de pomada antibiótica al acostarse.
En el caso de las conjuntivitis víricas no hay tratamiento específico, y se utilizan igualmente colirios antibióticos tópicos de amplio espectro para prevenir la infección secundaria.
En el caso de las queratitis, si se ha demostrado la existencia de lesión epitelial mediante la fluoresceína, debe taparse el ojo y proceder a dilatar la pupila con colirios de atropina. También se aplican antibióticos tópicos para la prevención de la infección secundaria y pueden usarse pomadas epitelizantes.
En todos los casos se lavarán los ojos con suero fisiólogico previo a la aplicación de colirios. Precaución con el uso de corticoides tópicos (colirios de corticoide): pueden provocar catarata y glaucoma. No deberían utilizarse estos medicamentos sin supervisión por especialista en oftalmología.
En el caso de uso de lentes de contacto en los problemas de ametropía (miopía-hipermetropía, astigmatismo), cabe destacar que se puede intentar corregir un astigmatismo irregular con lentes de contacto, pero no serán tan eficaces como en las hipermetropías o las miopías. Las lentes de contacto bifocales o multifocales permiten la visión próxima y lejana con la misma lente y son habitualmente usadas para la corrección de la presbicia o “vista cansada”.
¿TAMBIÉN PARA NIÑOS?
En la edad pediátrica, las lentes de contacto acostumbran a utilizarse cuando el niño tiene el criterio y la habilidad suficiente como para poder manipularlas adecuadamente, lo que ocurre, por lo general, hacia los 10 años . Sólo en casos muy especiales, como son la extirpación de cristalino), la ausencia de iris o las altas miopías o hipermetropías que afectan a un solo ojo, se prescribirán lentes de contacto en edades mucho más precoces, incluso en el primer año de vida. En todos estos casos, ello aumentará la calidad de visión y serán los padres los que deberán manipularlas y hacerse cargo de su higiene escrupulosa. Y es que en los primeros años de vida, no está indicada la cirugía refractiva para el tratamiento definitivo de las ametropías importantes. Una alternativa a las lentes son las gafas, normalmente mejor aceptadas por los niños si el ambiente familiar es favorable y acepta su colocación. Un aspecto importante que debe tener en cuenta el oftalmólogo y/o el pediatra es el hecho de informar a la familia de que las gafas de seguridad, habitualmente usadas por los niños, no constituyen ningún riesgo, sino más bien un medio de protección en caso de traumatismo.
Artículo especializado
Diferencias Entre las Bacterias Intestinales Buenas y Malas
El cuerpo humano presenta una gran superficie cutánea y mucosa por la que entra en contacto con el medio ambiente . En esta superficie existen diversos sectores (piel, intestino, boca y vagina), donde residen microorganismos con diferentes características de humedad, temperatura, pH y disponibilidad de nutrientes.
La flora humana es el conjunto de gérmenes que conviven con el huésped (humano) en estado normal, sin causarle enfermedad. Su composición es característica para la especie humana, tanto en los gérmenes que la componen como en su número y distribución en el organismo.
Actualmente, se sabe que el intestino del recién nacido no es estéril antes del parto, así pues, el traspaso microbiano madre-hijo empieza en el vientre materno y continúa inmediatamente después del nacimiento a través del parto vaginal. Inicialmente, diversos géneros de aerobios colonizan el tubo digestivo, sobre todo enterobacterias tipo Escherichia coli y también diversas especies del género Lactobacillus . Estas consumen el oxígeno del ambiente y progresivamente se establece un microsistema en el que hay un predominio abrumador de especies anaeróbicas, sobre todo Bacteroides, Clostridia, Eubacteria y Bifidobacterias . A los dos años de edad, la flora establecida es ya prácticamente definitiva, en tanto que suele ser muy estable a lo largo de la vida del individuo.
Dos tipos de flora
Flora basal: es la característica de cada sector del organismo y está constituida por gérmenes que siempre están presentes en ese sector. Por ejemplo: Staphylococcus epidermidis en la piel o E. coli en el intestino.
Flora transitoria: es variable de un ser humano a otro y está compuesta por gérmenes que colonizan en forma intermitente un determinado sector. Esta flora transitoria puede incluir bacterias potencialmente patógenas para el propio individuo u otras personas que entran en contacto con él.
Microbiota intestinal
Antiguamente conocida como flora intestinal, se trata de un complejo ecosistema lleno de microbios beneficiosos para la salud. Lleva a cabo diversas funciones a nivel metabólico, fisiológico y a nivel de sistema inmunológico. Cada individuo alberga 100.000 millones de microorganismos de 400 especies, en su mayoría bacterianas. Más del 95% vive en el tracto digestivo , sobre todo en el colon.
Recientemente, se ha observado que ésta tiene un papel muy importante en la aparición de muchas enfermedades. Se ha visto que muchas dolencias presentan un desequilibrio en la composición de la microbiota intestinal , conocida como disbiosis intestinal .
Funciones
Uno de los principales mecanismos a través del cual influye en el organismo son las interacciones con el sistema inmunitario. La presencia de la flora establece:
Un correcto desarrollo de la mucosa intestinal.
Interviene en el metabolismo de sustancias como el ácido fólico, biotina, vitaminas B12, K y E.
Favorece la producción de IgA y contribuye a la inmunotolerancia. Es un importante estímulo antigénico.
Interviene en el ciclo enterohepático de drogas como el Cloranfenicol.
Tiene efecto de barrera, impidiendo el establecimiento de otras bacterias, potencialmente patógenas.
Segrega bacteriocinas, sustancias que son tóxicas para bacterias de otros géneros.
Interviene en infecciones oportunistas o endógenas.
¿Cómo ayudamos a reforzar nuestra flora?
La influencia de la dieta en la composición de la microbiota intestinal es el factor más determinante sobre el que podemos intervenir. También durante las primeras fases de la colonización: gestación, lactancia y primeros alimentos sólidos que ingiere el recién nacido. Los cambios en la dieta pueden explicar el 57% de la variación total de la estructura de la microbiota intestinal.
Es importante llevar una dieta equilibrada y variada ya que cuando estamos comiendo, a la vez también lo hacen los miles de microorganismos que habitan nuestro intestino , para así, llevar a cabo sus funciones.
Se ha visto que las personas que siguen una alimentación basada en cereales refinados, pobre en fibra y en alimentos fermentados, y con un gran abuso de aditivos y endulzantes (edulcorantes), sufren las consecuencias en la composición de la microbiota intestinal, comprometiendo la diversidad y variabilidad de especies, en comparación con los que siguen una dieta rica en fibra, con cereales integrales , etc.
Uno de los factores para evitar la disbiosis intestinal es seguir una alimentación equilibrada rica en alimentos vegetales , alimentos fermentados, etc. Se ha visto que los hábitos alimentarios a largo plazo tienen un papel determinante en la composición y estructura de la microbiota intestinal. Añadiendo alimentos con efecto pre y probiótico se puede modular en positivo la microbiota intestinal aportando múltiples beneficios a nuestro organismo.
Probióticos y prebióticos
Numerosas evidencias científicas han demostrado que determinadas cepas bacterianas pueden aportar beneficios concretos a la salud. Con ello se ha introducido un nuevo concepto:
Los probióticos son microorganismos vivos que, ingeridos en cantidades adecuadas, producen efectos beneficiosos para la salud.
Los prebióticos son ingredientes de la comida no digeribles que promueven selectivamente el crecimiento y la actividad de un número limitado de especies bacterianas. Suelen ser hidratos de carbono no digeribles que después de su tránsito por el intestino delgado, llegan al colon prácticamente sin modificación alguna. Las bacterias de la flora autóctona poseen enzimas metabólicas adecuadas para consumir estos hidratos de carbono teniendo la oportunidad de proliferar de modo selectivo gracias al aporte de energía específico que consiguen de dichos sustratos.
A diferencia de los probióticos, la mayoría de los prebióticos son utilizados como ingredientes de alimentos en galletas, cereales, chocolates, productos de untar y productos lácteos. La industria los oferta como productos saludables induciendo a pensar que dichos productos enriquecidos con prebióticos son beneficiosos para la microbiota intestinal, y esto no es así. Los microorganismos que albergamos y, en general, el ser humano, necesitan alimentarse de alimentos de verdad para su normal nutrición y funcionamiento.
Artículo especializado
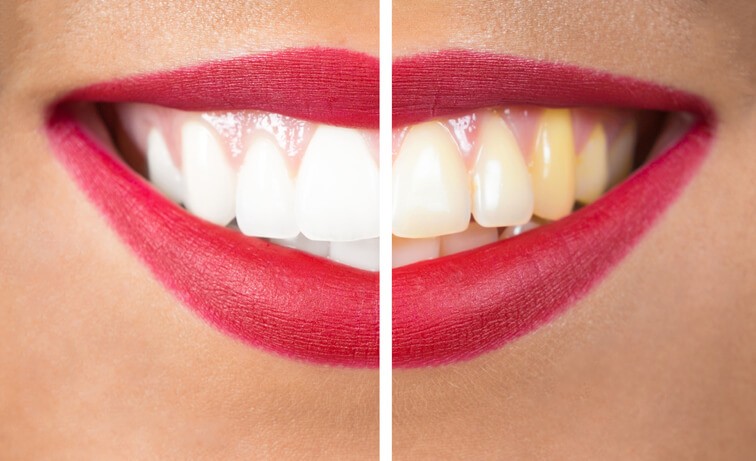
El Blanqueamiento Dental, ¿Puede Ser Perjudicial?
¿Quién no ha envidiado, en alguna ocasión, la dentadura absolutamente blanca de algún famoso o de la persona que nos está hablando? El blanqueamiento dental es un tratamiento con finalidad estética que persigue la obtención de un tono más blanco (los odontólogos hablamos de bajar o reducir el tono de blanco). Este procedimiento permite eliminar la gran mayoría de manchas depositadas en el esmalte dental debidas a causas externas. Pero no podemos olvidar que ni todas las manchas son tratables ni todos los pacientes son candidatos a realizarse un blanqueamiento. Veamos por qué.
Causas de las manchas dentales
Causas externas: las principales causas externas del oscurecimiento dental serían la ingesta de determinados alimentos y bebidas, o el contacto con agentes pigmentarios, como té, café, tabaco, mate, vino, bebidas de cola y exceso de uso de colutorio con clorhexidina (antiséptico de uso frecuente presente en colutorios y pastas dentífricas).
Causas internas: en general, las manchas provocadas por causas internas son las más difíciles de tratar y las que peores resultados obtienen con un blanqueamiento. En la mayoría de casos deben buscarse otras alternativas terapéuticas, como podría ser la colocación de carillas estéticas en el sector anterior de la boca (expuesto durante la sonrisa). Pueden afectar a los dientes antes de la erupción (en el embarazo o antes de los seis meses de vida) y son debidas fundamentalmente a determinados tratamientos (tetraciclinas), a alteraciones congénitas de la calidad del esmalte (hipoplasia) o al depósito de flúor. Tras la erupción de los dientes las causas internas más frecuentes son las consecuencias de un traumatismo dental y el desgaste del esmalte (propio del envejecimiento de la pieza dentaria).
El proceso de blanqueamiento
Nuestro papel como odontólogos consiste en averiguar la posible causa, así como el tiempo de evolución y la expectativa que tiene el paciente. Debemos realizar una exploración exhaustiva de la calidad del esmalte y de la sensibilidad dental que nos influirán en la decisión terapéutica a tomar. A continuación, exponemos las diferentes posibilidades terapéuticas posibles y siempre pensando en la persona que tenemos sentada en nuestro sillón dental en ese momento.
Bajo las premisas de que no todos los pacientes son candidatos ni todos obtendrán el mismo efecto blanqueante, ni que la duración del efecto es de por vida, no debemos crear falsas expectativas. El tratamiento de elección es blanqueamiento externo mixto por ser el que consigue mejores resultados. Debemos tener presente la severidad y extensión de las manchas a tratar y la persistencia de los hábitos mencionados (café, té, tabaco…). Por otro lado, y para asegurarnos de obtener el resultado perseguido, debemos partir de una boca impecable por lo que antes de realizar el blanqueamiento recomendamos una higiene dental o tartrectomía .
Facilitaremos a continuación una pincelada de los diferentes tipos de tratamientos de blanqueamiento disponibles en la actualidad:
Blanqueamiento externo: es el tratamiento más habitual. Se realiza sobre dientes vitales o sanos . Consiste en la aplicación de sustancias activas en la superficie dental, y puede ser realizado en consulta o en el domicilio.
El tratamiento mixto efectuado inicialmente por un odontólogo en consulta y después continuado por el paciente en el domicilio es el que mejor resultado ofrece. Consiste en una sesión (de aproximadamente una hora de duración) con exposición a una determinada luz (láser, plasma, luz fría..) sobre la arcada dental donde se ha colocado previamente una sustancia química (normalmente peróxido de hidrógeno al 35 %) sustentada con una férula acrílica de soporte.
¿Pero por qué debemos colocar peróxido en la superficie dental antes de exponerla al láser? Porque penetrará en el tejido dental y fragmentará las moléculas de los depósitos de pigmento oscuro dando lugar a moléculas más pequeñas e incoloras.
Tras esta sesión, se continúa con el tratamiento domiciliario (supervisado por el odontólogo), de dos semanas de duración y con una duración de 40 minutos diarios (normalmente se realiza por la noche). Consiste en la colocación de una férul a acrílica hecha a medida y peróxido de carbamida o peróxido de hidrógeno en concentraciones variables.
Otra posibilidad de blanqueamiento externo es el domiciliario exclusivo mediante la aplicación de “Geles blanqueadores ” (de peróxido de hidrógeno o de peróxido de carbamida) adquiridos en la farmacia sin receta médica y en forma de kit. Estos geles presentan una baja concentración de peróxido por lo que su efectividad es muy limitada en comparación con los tratamientos profesionales.
Blanqueamiento interno: se realiza sobre dientes no vitales , es decir, que ya tienen realizado un tratamiento de conducto o endodoncia. Consiste en la aplicación del producto blanqueador en el interior de la cavidad dental (en la cámara pulpar). Se puede complementar este tratamiento con el blanqueamiento externo. Habitualmente se utiliza una solución de perborato de sodio o de peróxido de carbamida que persigue un efecto de aclaramiento de la estructura dental (en este caso desde el interior del diente).
PASTAS BLANQUEADORAS, ¿SÍ O NO?
Tras cualquier tipo de blanqueamiento (tanto externo como interno) se recomienda el uso de las llamadas “pastas blanqueadoras” como complemento y mantenimiento del blanqueamiento realizado. Pueden contener sustancias abrasivas suaves como sílice, pirofosfatos, óxido de aluminio, peróxido de hidrógeno, peróxido de carbamida o bicarbonato de sodio. Su efectividad está relacionada con el hábito de uso y la disminución del consumo de aquellos alimentos o bebidas que generan coloraciones o manchas extrínsecas .
Hay que tener en cuenta que si se utilizan de forma exclusiva no conducirán a un blanqueamiento dental, pero como complemento al blanqueamiento profesional pueden hacer más duradero el efecto.
Debemos tener en cuenta…
Conviene mencionar algunas advertencias respecto al tratamiento de blanqueamiento.
El abuso de este tipo de tratamientos, tanto de láser como de peróxido de carbamida o de hidrógeno puede ocasionar cambios histológicos en la calidad de esmalte , dentina y pulpa que podría traducirse en una hipersensibilidad extrema dental.
El éxito del tratamiento va a depender también de la corrección de hábitos del paciente. En grandes fumadores, consumidores de más de tres tazas de café al día, bebedores de zumo de cítricos o personas con mala higiene dental no vamos a obtener grandes cambios de tonalidad con el tratamiento. Así mismo la duración del efecto blanqueador se acortará.
En pacientes bruxistas (rechinan los dientes) o con gran desgaste dental puede aumentar su sensibilidad tras el tratamiento por lo que deberían valorarse otras alternativas terapéuticas como serían las carillas estéticas.
La duración del efecto blanqueador puede prolongarse hasta los 12-24 meses en caso de tratamiento combinado pero los domiciliarios suelen durar menos de tres meses.
A largo plazo podemos encontrar posibles efectos adversos como pueden ser la reabsorción o destrucción de las raíces de los dientes, la destrucción de las capas prismáticas de los dientes o la pulpitis crónica que conllevará a la necesidad de tratamiento endodóntico para disminuir su sensibilidad.
Es normal, sin embargo, que en el curso del tratamiento blanqueante se produzca cierta hipersensibilidad transitoria reversible al poco tiempo de finalizar el tratamiento. Si en algunos casos la sensibilidad es mayor, se suele aconsejar el uso de geles blanqueadores que contengan flúor y nitrato potásico en su formulación. Los casos de sensibilidad extrema que obligan a utilizar analgesia o a finalizar el blanqueamiento son infrecuentes.
PASO A PASO SI TE PLANTEAS UN BLANQUEAMIENTO
En general la secuencia deseable sería la siguiente:
Es fundamental una visita al odontólogo antes de realizar un tratamiento de blanqueamiento dental para que nos indique la técnica más adecuada en nuestro caso.
Se aconseja una tartrectomía previa al tratamiento (higiene dental mediante ultrasonidos llevada a cabo por el higienista dental)
Si eres candidato no dudes en que el blanqueamiento dental mixto te ofrecerá resultados más espectaculares y duraderos.
Si no modificas tus hábitos de cepillado dental e ingesta tu tono anterior volverá a aparecer tras el efecto del blanqueamiento inicial.
No se recomiendan blanqueamientos de repetición.

Artículo especializado
Cómo Evitar la Migraña
Seguro que conocemos a alguien que sufre migraña. Y lo sabemos porque ese dolor de cabeza (crisis) es recurrente y se repite cada cierto tiempo . El inicio de la crisis se asocia a muy diferentes factores que son llamados desencadenantes. En principio, si se evitan estos factores puede ser que la crisis no se desencadene. Pero no todos los factores son controlables.
Migraña o cefalea
Para empezar, explicaremos las diferencias entre migraña y cefalea.
La migraña es un dolor de cabeza que se caracteriza por presentarse de forma episódica pero brusca con fases totalmente asintomáticas entre las crisis. Es decir, cuando finaliza la crisis migrañosa la persona está totalmente recuperada hasta que se presenta la siguiente crisis.
La cefalea es, sin embargo, un dolor de cabeza menos invalidante. Su intensidad y duración suele ser más leve. Se presenta, característicamente, en determinadas circunstancias como estrés, alteraciones del sueño, horarios irregulares en las comidas, consumo elevado de cafeína, sedentarismo, cambios en el ciclo menstrual, etc.
¿Qué debemos saber de la migraña?
El dolor de cabeza de la migraña se instaura progresivamente , aunque en ocasiones avisa con la llamada aura. La forma de presentación puede variar, aunque normalmente se limita sólo a un lado de la cabeza y es de tipo pulsátil (como si te estuvieran golpeando con un martillo). Su intensidad suele ser moderada o grave (impide continuar con la actividad cotidiana) y mejora en reposo y con ayuda de medicación.
Normalmente se acompaña de otros síntomas asociados como náuseas, vómitos, fotofobia (intolerancia a la luz) o fonofobia (intolerancia a los ruidos). ¿Y qué es el aura? Es un cortejo de síntomas que puede presentarse antes de que se instaure la crisis migrañosa y, a modo de aviso. No todas las crisis migrañosas se acompañan de aura (hablaríamos de migraña con o sin aura). Sólo una tercera parte de las personas que sufren migraña suelen tener auras. Asimismo, una misma persona puede padecer episodios de migraña común (o sin aura) y episodios de migraña con aura, de forma totalmente arbitraria.
Sobre el aura
¿Cuáles son los síntomas característicos del aura de la migraña?
Aura visual : es la más frecuente, con diferencia (el 90% de auras). La persona que la sufre nota destellos luminosos ubicados en el centro de su campo visual que se van desplazando provocando fatiga ocular.
Aura sensitiva : suele comenzar con hormigueos en la punta de los dedos de una mano y van ascendiendo hasta el hombro pudiendo prolongarse hasta la cara. En otras ocasiones aparecen en la comisura de la boca y lengua.
Aura motora : sería el caso, por ejemplo, de un temblor espontáneo en el párpado.
Existen otros tipos de auras, pero son muy poco frecuentes. Cuando una persona tiene aura suele ser muy similar en todos sus episodios. Estos síntomas que se presentan en el aura son totalmente reversibles (desaparecen al comenzar la crisis de migraña). El tiempo que pasa entre el aura y el inicio de la crisis migrañosa es inferior a una hora en la mayoría de casos. O sea, se trataría de un preaviso que anunciaría la aparición de dolor de cabeza de forma inmediata . En otras situaciones el aura y la crisis se presentan a la vez, aunque es menos frecuente.
¿Debemos tomar medicación al iniciar el aura? El aura no se debe tratar por ser síntoma autolimitado (generalmente dura menos de una hora). Sí debemos tomar analgésicos cuando comienza el dolor de la migraña.
¿Por qué se produce?
El inicio de la crisis se asocia a factores muy diferentes que son llamados desencadenantes . En principio si evitamos estos factores puede ser que la crisis no se desencadene. Pero no todos los factores son controlables.
Entre los desencadenantes encontramos aquellas situaciones que suponen un cambio brusco o un estímulo físico intenso . Podríamos citar: estrés, ansiedad, períodos premenstrual y menstrual, anovulatorios, período tras un descanso prolongado (fin de semana, vacaciones), ingesta de alcohol, quesos y comidas ricas en nitritos, cambios atmosféricos, altitud elevada, ayuno prolongado, fatiga, exceso o déficit de sueño, algunos medicamentos: anovulatorios, nitroglicerina, estrógenos…
¿Cómo se llega al diagnóstico de migraña?
El diagnóstico es clínico (por los síntomas que manifiesta la persona). Es importante un buen interrogatorio del dolor (síntomas, duración y la forma de presentación). En ocasiones, se recurre a la realización de alguna prueba diagnóstica para despistaje, sobre todo cuando detectamos algún signo de alarma.
Estos síntomas y una exploración neurológica normal permiten el diagnóstico de migraña , para el que no es necesario hacer una prueba de imagen, tipo escáner o resonancia. Casi un tercio de los pacientes experimentan, antes del dolor, el aura. Si aparece, permiten asegurar el diagnóstico de migraña.
Desgraciadamente, muchos pacientes aún siguen sin diagnosticarse y pasan un auténtico calvario. Algunos tardan en diagnosticarse una media de dos años y después de haber acudido a una media de cinco médicos, como demuestran estudios recientes en Europa y EEUU. Y, sin buen diagnóstico, es muy difícil indicar un tratamiento correcto .
¿Por qué las mujeres lo sufren más?
Por dos motivos principales. Porque algunos factores genéticos sabemos que van ligados al cromosoma X . El otro factor t iene que ver con los cambios hormonales , concretamente con las fluctuaciones de estrógenos, que experimenta la mujer debido a su ciclo menstrual. Sabemos que estas fluctuaciones son uno de los desencadenantes más potentes de las migrañas. De hecho, antes de tener la menstruación la migraña es igual de frecuente en varones que en mujeres y con la llegada de la menopausia los dolores mejoran e incluso pueden desaparecer.

Artículo especializado
Cómo Dectectar El Astigmatismo Infantil
Más del 95% de la población presenta algún grado de astigmatismo, pero sólo es significativo cuando ocasiona problemas de visión. Te explicamos más sobre el astigmatismo.
¿Qué es?
El astigmatismo puede presentarse aislado o asociado a hipermetropía o miopía (situación que recibe el nombre de “astigmatismo compuesto”). Los astigmatismos cursan con una agudeza visual relativamente baja , especialmente los asociados a miopía, y con síntomas de astenopia visual (cansancio visual): ojos enrojecidos después de la lectura, parpadeo constante, dolores de cabeza, bajo rendimiento escolar, etc.
El astigmatismo es un defecto ocular que se caracteriza porque existe una refracción diferente entre dos meridianos oculares, lo que impide el enfoque claro de los objetos. Generalmente se debe a una alteración en la curvatura anterior de la córnea . La superficie de la córnea debe ser simétrica y regular en sus curvaturas, y de no ser así se produce el astigmatismo.
Causas y síntomas
La causa de la mayor parte de los astigmatismos reside en una alteración congénita (presente desde el nacimiento) de la curvatura corneal.
Los síntomas característicos de astigmatismo son:
Visión borrosa y distorsionada en sentido horizontal y vertical (como los espejos de feria, fabricados con fines de diversión)
Guiños de párpados
Astenopatía acomodativa: es decir, cansancio visual, que provoca dolor de cabeza frontal, escozor y enrojecimiento de los ojos tras esfuerzos continuados de acomodación), este último sobre todo en los astigmatismos asociados a hipermetropía.
El astigmatismo puede provocar, también, aunque raramente, diplopía monocular (visión doble con un solo ojo, mientras el otro ojo se mantiene tapado).
¿SABÍAS QUE…?
El colegio supone un lugar donde los defectos visuales se manifiestan de forma evidente, ocasionando un bajo rendimiento escolar.
Diagnóstico
El diagnóstico de los defectos de refracción deberá ser realizado por el oftalmólogo . Desde la consulta del pediatra debemos derivar al niño al especialista ante la sospecha de la existencia de alguno de estos defectos oculares.
Son pruebas o métodos subjetivos los llamados optotipo s (objetos/dibujos/letras) que deben situarse a cinco metros de distancia del niño a explorar y, a ser posible, en un ambiente con condiciones de buena iluminación y con el niño lo más tranquilo posible.
También se puede utilizar, a partir de los 4 años de edad, la clásica prueba de la “E de Snellen”: se presentadas diversas letras “E” en diferentes posiciones y s tamaños y el niño debe identificar su posición señalando con los dedos o colocando una “E” grande a su lado en la misma posición. Con esta exploración simple se pueden diagnosticar las hipermetropías, siendo obviamente necesaria la colaboración del niño.
Para la exploración concreta de las hipermetropías, posteriormente se valorará al niño colocando unas gafas con una corrección de +2 dioptrías en cada ojo, volviendo a explorar los optotipos. El niño hipermétrope continuará viendo los optotipos con la corrección de +2 dioptrías ya que habrá estado corregida parte de su hipermetropía. En cambio, el niño que no padezca hipermetropía verá borroso con esa corrección. En este caso, igualmente se procederá a explorar primero la visión de un solo ojo y posteriormente de ambos, haciendo que el niño mire las figuras primero de manera aislada y luego agrupadas con la finalidad de detectar ambliopías ligeras.
Además de todo lo especificado, el oftalmólogo, previa administración de colirios para provocar la parálisis medicamentosa del sistema de acomodación ocular, puede realizar pruebas como la llamada esquiascopía (prueba que mide la refracción de manera objetiva).
Tratamiento
La corrección óptica de las ametropías se realizará con lentes esféricas o cilíndricas , que pueden ser positivas (convexas) o negativas (cóncavas), dependiendo del defecto de refracción a tratar.
En el caso concreto del astigmatismo, el tratamiento se basa en la prescripción de cristales correctores cilíndricos.
Pronóstico
Respecto a la evolución de los defectos de refracción (ametropías) en general, aunque no siempre se cumple, se puede admitir que el ojo del niño es hipermétrope en el momento del nacimiento y tiende hacia la normalidad (la emetropía) durante la etapa del crecimiento y desarrollo, sin acabar de conseguirla con plenitud, ya que el patrón refractivo de la especie humana es ligeramente hipermétrope. Partiendo de este esquema evolutivo, las hipermetropías tienden a mejorar con el paso del tiempo, las miopías empeoran y los astigmatismos se mantienen relativamente estables.
Esquemáticamente se dice que la ambliopía es recuperable hasta los cinco años, difícilmente se recupera a partir de esta edad y es prácticamente irrecuperable a partir de los 9-11 años. Por esta razón, tiene tanta importancia llevar a cabo la detección y tratamiento precoz de las anomalías que pueden causar ambliopía (defectos de refracción, opacidades, estrabismos, etc.)

Artículo especializado
Motivos por los que Tenemos Gastritis
Muchas personas, ante cada comida, viven el momento con sufrimiento y pierdan las ganas de comer . Además, en muchos casos limitan mucho su alimentación y no siguen una dieta variada y equilibrada, con el riesgo que esto conlleva para la salud si se mantiene en el tiempo. Es el caso de quienes sufren gastritis, una inflamación de la mucosa gástrica , o capa que reviste por dentro el estómago, que lo protege de la acidez de los jugos gástricos y que cuando se inflama ocasiona molestias.
Qué sucede
Cuando esta inflamación aparece en un corto periodo de tiempo se denomina gastritis aguda . En estos casos suele aparecer de repente, suele durar pocos días y remite cuando desaparece el agente causante. Suele estar provocada por el consumo prolongado de algunos fármacos (ibuprofeno, acetilsalicílico o naproxeno), la ingesta excesiva de alcohol y también por estrés. Si esta inflamación se prolonga en el tiempo durando meses o años se denomina crónica. En estos casos la causa más habitual es debido a la infección bacteriana producida por la bacteria Helicobacter pylori.
Otra clasificación sería según la morfología o zona donde la lesión inflamatoria afecta a la mucosa digestiva . Se clasifica como gastritis fúndica (afecta a la zona fúndica o fondo del órgano), gastritis antral (afecta el antro o porción inferior del estómago), gastritis corporal media, pangastritis (afección total)
Por último, según la sintomatología que presenta , también se puede clasificar como gastritis erosiva o atrófica. Se define como erosiva, cuando se produce una ulceración en la mucosa del estómago, permitiendo el paso de los jugos digestivos (ácidos) y llegando a veces, a producir sangrado. Se suele relacionar con el abuso de tabaco y alcohol. En el caso de la gastritis atrófica, la capa protectora o tejido interno del estómago está alterado o afectado, provocando una mala absorción de nutrientes durante la digestión, déficit de algunas vitaminas y anemia. Esta afectación suele estar causada por la bacteria Helicobacter pylori y en ciertas ocasiones si no se trata puede derivar a cáncer de estómago.
¿Cuáles son los síntomas más habituales?
Los síntomas de la gastritis pueden ser muy variables ya que cada persona los puede experimentar de diferente forma . Aun así, cuando aparecen, los más frecuentes suelen ser náuseas, vómitos, dolor abdominal, acidez o ardor, aerofagia, eructos, inapetencia y en ocasiones presencia de sangre en vómito o heces.
¿Cómo realizar el diagnóstico?
Para confirmar el diagnóstico de gastritis puede que tu digestólogo además de basarse en los síntomas clínicos expresados solicite alguna prueba exploratoria más . Cuando hay sospecha de que la mucosa puede estar dañada o afectada es necesario realizar una gastroscopia con biopsia para obtener una muestra de tejido.
Cómo se trata
El tratamiento, por tanto, dependerá del agente que provoca la inflamación y, en la mayoría de los casos, se cura cuando desaparece el agente causante (alcohol, medicamentos antiinflamatorios…). En otras ocasiones es necesaria la toma de medicamentos que ayudan a disminuir la acidez en el estómago y antibióticos para eliminar la Helicobacter pylori .
Por último, se recomienda realizar cambios en la dieta , siempre según tolerancia individual, para intentar dentro de las restricciones, seguir una alimentación lo más variada posible y, cuando haya mejoría se debe ir introduciendo más alimentos de forma progresiva hasta lograr una alimentación equilibrada.
Recomendaciones dietéticas
A continuación, detallamos unos consejos y unas recomendaciones dietéticas a seguir cuando se tiene gastritis:
Hacer comidas frecuentes, pero de poco volumen, para evitar la excesiva distensión ya que aumenta la secreción ácida.
Evitar irritantes para la mucosa gástrica y que aumenten las secreciones ácidas gástricas como el café, condimentos fuertes (pimienta, chile, salsas para condimentar), alcohol, alimentos cítricos (jugo de naranja, limón, piña, fresas).
Sustituir el café, el descafeinado y el té (estimulan la secreción gástrica), por achicoria, malta o infusiones suaves (romero, salvia, manzanilla, etc.).
No ingerir comidas abundantes, pesadas o copiosas. Comer lentamente y masticar bien.
Evitar tomar alimentos grasos a la vez, procurando que no formen parte de la misma comida: huevo, quesos, frutos secos…
No comer alimentos sólidos o líquidos justo antes de ir a la cama, y dejar pasar al menos dos horas.
Tratar de no consumir alimentos muy grasos o técnicas culinarias como fritos, rebozados… pues retardan el proceso de vaciamiento gástrico y aumentan la secreción de ácido en el estómago, decántese por cocciones como cocido o hervido, vapor, escalfado, rehogado, plancha, horno, papillote…
En procesos agudos no incluir temporalmente alimentos ricos en fibra (verduras y legumbres cocinadas enteras, cereales integrales, frutos secos y frutas secas).
En procesos agudos suprimir los lácteos, ya que hay que recordar que el calcio y las proteínas lácteas estimulan la secreción de ácido.
Evitar alimentos muy salados o en escabeche por su acción irritativa al estomago.
No tomar bebidas con gas
No consumir cantidades excesivas de azúcar
Evitar los alimentos muy calientes o muy fríos ya que provocan irritación
En algunas personas que padecen acidez los derivados del tomate (salsas) y el zumo de cítricos pueden causarles molestias (comprobar tolerancia)
Sería aconsejable levantar la cabecera de la cama unos 15-20 cm, para permitir que la gravedad mantenga el contenido del estómago en su interior.
A continuación te mostramos una tabla con una serie de alimentos de mejor y peor tolerancia, a tener en cuenta en procesos agudos .
ALIMENTOS PERMITIDOS
ALIMENTOS PERMITIDOS
ALIMENTOS DESACONSEJADOS
CARNE, PESCADO, HUEVOS Y DERIVADOS
Se recomienda consumir la carne poco grasa
El pescado blanco (preferiblemente) y azul, cocinar con poca grasa.
El huevo se digiere mejor revuelto, en forma de tortilla, escalfados o pasados por agua.
Como fiambre se recomienda el de pollo o el de pavo, jamón cocido
Carnes grasas u embutidos grasos
Carnes fibrosas según tolerancia, como el conejo
Carnes muy condimentadas
Se recomienda no consumir huevo duro (según tolerancia)
Evitar los pescados en escabeche o en salazón
LECHE Y DERIVADOS
Preferible leche semidesnatada o desnatada, yogur natural, quesos poco fermentados; según tolerancia. Los lácteos sin lactosa se suelen digerir o tolerar mejor
Leche entera (puede tomarse según tolerancia), condensada, quesos fuertes y muy grasos, lácteos con nata (tipo yogurt griego) derivados lácteos (flanes, natillas…) y sobre todo los que lleven chocolate
En procesos agudos: Evitar los lácteos, ya que hay que recordar que el calcio y las proteínas lácteas estimulan la secreción de ácido.
CEREALES
Cereales de desayunos no integrales, azucarados o con miel según tolerancia individual. Arroces, pastas y patatas
Pan fresco recién horneado, cereales integrales tipo muesli, galletas rellenas y chocolate
LEGUMBRES
Cocidas enteras y con ingredientes grasos como tocino, chorizo, morcilla…según tolerancia individual
VERDURAS Y HORTALIZAS
Según tolerancia. En forma de purés mejora su digestibilidad
Evitar las verduras flatulentas (col, coliflor, repollo, coles de Bruselas, alcachofas, cebolla, pimiento crudo y pepino) pero según tolerancia individual
Tomate puede producir pirosis
FRUTAS
Se recomienda en compota, purés, asadas, batidas o si se consumen enteras mejor elegirlas muy maduras
Evitar la fruta muy verde, ácida, en almíbar, desecadas y confitadas
Zumo de naranja o de uva pueden producir pirosis
BEBIDAS
Agua, caldos o infusiones suaves, zumos (evitando los ácidos) y bebidas refrescantes no azucaradas
Bebidas que irritan la mucosa y aumentan la acidez: Café, descafeinado, té, bebidas excitantes (cola, guaraná,…), bebidas con gas, bebidas con chocolate y alcohólicas.
GRASAS
Aceite de oliva y semillas (girasol, maíz, soja,…). La grasa en crudo se tolera mejor
Cocciones que requieran poca grasa, como horno, vapor, hervidos, rehogados con poco aceite,…
Nata, manteca, tocino, sebo…
Evitar fritos, empanados, rebozados, y platos muy oleosos
OTROS PRODUCTOS
Extractos para sopas en cubitos, caldos concentrados, miel, fritos grasos, pastelería, repostería, chocolate, frutos secos, salsas picantes, helados y sorbetes. Los contrastes de temperatura irritan la mucosa digestiva

Artículo especializado
Tratamientos más Adecuados para la Gota
Puede que no sepamos exactamente qué es ni por qué se produce, pero seguro que te suena que se manifiesta con dolor e inflamación del primer dedo del pie. Pues bien, la gota es una enfermedad producida por el depósito de cristales de urato monosódico (comúnmente hablamos de ácido úrico) en las articulaciones, las zonas de su alrededor y el tejido subcutáneo. Se trata de un proceso crónico, a pesar de que las manifestaciones clínicas no siempre están presentes. Al principio de la enfermedad los síntomas se dan en forma de crisis de gota. Se producen diversos episodios de artritis (inflamación de la articulación), de duración variable, y entre los cuales existen periodos más o menos prolongados en los que no se presentan síntomas.
La hiperuricemia
El depósito de cristales de ácido úrico se debe a la existencia de una hiperuricemia prolongada , es decir, la existencia de unos niveles elevados de ácido úrico en la sangre. La hiperuricemia es, por lo tanto, una condición necesaria para que aparezca la gota, aunque no es la única. Puede existir una hiperuricemia asintomática, es decir, la presencia de concentraciones elevadas de ácido úrico en ausencia de manifestaciones clínicas de inflamación articular.
Hablamos de hiperuricemia cuando los niveles en sangre son superiores a 7 mg/dL.
La prevalencia de hiperuricemia se estima cercana al 10%. Aproximadamente un 10% de las personas con hiperuricemia acaban padeciendo gota. Por otro lado, de los pacientes que tienen gota, un 80%- 90% presentan niveles elevados de ácido úrico.
Tipos de gota
Desde un punto de vista del origen de la enfermedad, la gota puede ser primaria, sin que haya ningún factor externo que la cause, sino una alteración del metabolismo del ácido úrico que haga que el organismo lo produzca más o lo excrete menos, y secundaria, por factores externos, ya sean alimentarios o diversas enfermedades.
Algunas de las causas de la gota secundaria son:
Dieta rica en purinas.
Alcohol.
Actividad física intensa.
Psoriasis.
Enfermedad de Paget.
Enfermedades hematológicas y neoplásicas.
Quimioterapia citotóxica.
Enfermedad renal crónica.
Deshidratación.
Ciertos fármacos (tiacidas, diuréticos de asa, salicilatos, ciclosporina).
Intoxicación por plomo.
Enfermedades endocrinas (hiperparatiroidismo, hipotiroidismo).
Cómo se diagnostica
El diagnóstico de la gota suele ser clínico , con la presencia de la inflamación de la articulación, frecuente en el primer dedo del pie (crisis de podagra), que se aprecia tumefacto, rojo y muy doloroso al tacto. Se pueden realizar pruebas de imagen para valorar el nivel de afectación de la articulación si se dan episodios repetidos de artritis aguda. El diagnóstico de certeza nos lo daría la visualización de cristales de ácido úrico en el líquido sinovial, pero a la práctica esta prueba rara vez se realice, a menos que los síntomas no mejoren con el tratamiento y se sospeche la acumulación de otro tipo de cristales.
Los pacientes con gota de larga evolución pueden presentar acúmulos de cristales de ácido úrico en las zonas que rodean las articulaciones y el tejido subcutáneo. Son los llamados tofos y se localizan con frecuencia en el codo, la oreja o la zona del tendón de Aquiles.
El papel de la dieta
De cara al tratamiento de la gota y la hiperuricemia, la alimentación es esencial . Se habla mucho de alimentos que pueden agravar la gota, pero la realidad es que existe poca evidencia sobre este tema. De todos modos, lo que sí se sabe con certeza es:
Alimentos con un efecto nocivo :
Carne roja.
Marisco.
Pescado (más el azul que el blanco).
Alimentos con un elevado contenido de fructosa (salvo las cerezas).
Alimentos con efecto protector :
Lácteos.
Legumbres.
Frutos secos.
Café, incluido el descafeinado.
Otras medidas a tener en cuenta para reducir el riesgo de gota e hiperuricemia son:
Reducir el consumo de alcohol.
Combatir el sobrepeso y la obesidad.
realizar una actividad física moderada y adecuada a cada uno.
Cómo se trata
El objetivo del tratamiento farmacológico de la gota se focaliza en eliminar la inflamación mediante la disolución de los cristales de ácido úrico del líquido articular y los tejidos afectados , así como la prevención de las crisis de gota. Se logrará disolver estos cristales en la medida en que se reduzcan los niveles en sangre de ácido úrico.
La primera opción para corregir los niveles en sangre de ácido úrico son las medidas higienicodietéticas. Si después de unos tres a seis meses no se ha logrado descender los niveles de ácido úrico de manera significativa, deberá añadirse entonces el tratamiento farmacológico para reducir de la uricemia. Esto no implica que no se deba seguir manteniendo las medidas no farmacológicas indicadas previamente.
Los principales fármacos empleados para la reducción de los niveles en sangre de ácido úrico son:
Alopurinol.
Febuxostat.
Benzobromarona.
El tratamiento reductor del ácido úrico en sangre debe mantenerse a largo plazo para conseguir la completa disolución de los cristales y evitar la recurrencia de la hiperuricemia.
El tratamiento de las crisis agudas de gota se basará en el control del dolor. Los principales fármacos que se emplean para el control de estas crisis son:
AINE (antiinflamatorios no esteroides), como ibuprofeno, diclofenaco, dexketoprofeno.
Antiinflamatorios del grupo COXIB, como rofecoxib, lumiracoxib y etoricoxib.
Corticoides, ya sea vía oral o incluso intraarticulares.
Colchicina: es un fármaco muy empleado en el tratamiento de los ataques de gota a pesar de que la evidencia científica de que se dispone es escasa. Pese a que se ha demostrado su eficacia desde un punto de vista sintomático cuando se usa a dosis bajas, es frecuente que cause alteraciones digestivas, como náuseas, dolor abdominal y diarreas.
Asimismo, al iniciar un tratamiento reductor de la uricemia con frecuencia se pueden desencadenar crisis agudas de gota, por lo que es recomendable no comenzar el tratamiento durante un ataque agudo y, con frecuencia, se realiza un tratamiento preventivo de nuevas crisis agudas mediante el uso de colchicina.
Si sospechas que puedes tener gota, no te automediques . Consulta con tu médico y, si es posible, pide visita con un reumatólogo.

Artículo especializado
Prevención y Control de la Hipertensión Arterial
La hipertensión (HTA) no suele dar señales de alerta y, si no se detecta a tiempo, el corazón debe hacer un sobreesfuerzo, lo que genera problemas en el sistema cardiovascular y otros órganos como el cerebro y los riñones. Para evitar que la hipertensión dañe gravemente la salud se recomienda realizar controles y llevar un estilo de vida saludable .
¿Qué es la presión arterial?
La presión arterial es la fuerza que ejerce la sangre , expulsada por el corazón al circular por las arterias, para aportar el oxígeno y los nutrientes a los diferentes órganos del cuerpo. La presión más alta o máxima se obtiene cuando el corazón realiza una contracción y recibe el nombre de presión sistólica, por el contrario, la presión mínima o más baja se obtiene cuando el corazón se relaja o está en reposo, entre latidos, lo que se denomina presión diastólica.
¿TENSIÓN O PRESIÓN ARTERIAL?
Aunque a veces se utilice el término de tensión arterial como sinónimo de presión arterial, no describen lo mismo ya que la tensión arterial hace mención a la forma en que las arterias reaccionan a esta presión, lográndolo gracias a la elasticidad de sus paredes.
¿Cómo se mide?
La presión arterial se mide en unidades de presión (mm de Hg) y para su medición se utilizan unos aparatos llamados esfingomanómetros, popularmente conocidos como tensiómetros . En su lectura aparecen dos números que hacen referencia a la presión sistólica y la presión diastólica.
Los valores de referencia son:
120/80 o menos se considera presión arterial normal.
Entre 120-139/80-89 es prehipertensión. Estos valores indican que se puede desarrollar una tensión arterial alta si no se toman medidas.
140/90 o más se considera hipertensión arterial.
Tanto si se está en la fase de prehipertensión como en hipertensión se debe vigilar el tipo de alimentación y se recomienda estar en un peso saludable para evitar que los valores sigan aumentando o se mantengan en cifras altas, poniendo en riesgo la salud.
¿Qué causa la hipertensión?
La HTA en la mayoría de los casos es primaria o de causa desconocida y en una minoría de los casos es secundaria o debido a otra enfermedad (problemas cardiovasculares, renales o del sistema hormonal). Sin embargo, existen factores de riesgo que predisponen a su aparición .
Entre ellos:
Tener antecedentes familiares de hipertensión.
Padecer obesidad.
Estar sometido a un nivel elevado de estrés.
Fumar.
Abusar del consumo de sal. Seguir una alimentación rica en sodio y baja en potasio con un consumo pobre en vegetales, legumbres, cereales integrales y frutos secos.
No realizar actividad física.
Padecer diabetes o tener problemas de riñón o cardiovasculares.
Consumir alcohol.
¿Qué hacer?
Una presión arterial alta mantenida de forma prolongada incrementa el esfuerzo y afecta tanto al corazón como a las arterias . Si padeces hipertensión y no lo sabes, esta situación puede derivar en problemas cardiovasculares (anginas de pecho, arritmias, infarto de miocardio), cerebrales, renales y otras enfermedades. Por todo ello, es muy importante realizar controles de cara a una detección precoz. Una vez diagnosticada, debe tratarse modificando algunos hábitos y en algunos casos también es necesaria la prescripción de medicación.
Medidas dietéticas
En cuanto a la dieta, seguir una serie de recomendaciones ayuda a controlar la hipertensión arterial.
Entre las medidas recomendadas destaca :
Evitar la adición de sal común (normal, marina o yodada), tanto en la cocción como en salazones y otros alimentos que se procesen con salmuera.
Evitar los alimentos ricos en sodio o con sodio añadido (leer las etiquetas de los productos procesados):
Sal o cloruro sódico (ClNa).
Bicarbonato sódico o soda (helados, pasteles, productos horneados, galletas).
Carbonato sódico (mantequilla, cremas, helado de crema, flanes, encurtidos).
Glutamato monosódico (carnes, condimentos, encurtidos y sopas).
Evitar el consumo de cualquier tipo de bebida alcohólica lo máximo posible. La reducción o eliminación del consumo de alcohol disminuye la presión arterial en aquellos individuos que toman este tipo de bebidas con frecuencia.
Se puede tomar una cantidad moderada de café: los estudios disponibles hasta la actualidad no muestran suficiente rigor para establecer recomendaciones a favor o en contra del consumo de café para personas hipertensas.
Se recomienda la pérdida o estabilización de peso en pacientes con sobrepeso u obesidad ya que esta medida mejora los valores de tensión.
Es muy importante el consumo de verduras y frutas frescas por ser grandes fuentes de potasio, mineral que ayuda a controlar y prevenir la hipertensión
Tomar una cantidad adecuada de proteínas, especialmente de origen vegetal como las legumbres: soja, lentejas, garbanzos, alubias, etc.
Limitar las proteínas animales con elevado contenido en grasa: ternera, cerdo, embutidos, etc.
Tomar el arroz, pan o pasta en su forma integral.
Evitar el consumo de azúcar común y de productos con azúcar (bollería, galletas, etc.)
Aumentar el consumo de grasas saludables: aceite de oliva virgen extra, nueces (sin sal), aguacate.
Evitar el consumo de grasas saturadas presentes en productos procesados: dulces, bollería, galletas, pizzas, pan de molde, etc.
Coma a diario lácteos bajos en grasas (queso fresco, yogur natural) y evite los enteros (nata, queso graso, mantequilla, helado…). En los quesos, elija la opción baja en sodio.
Es aconsejable llevar a cabo una vida activa que incluya 180 minutos de actividad física aeróbica moderada-intensa por semana (caminar, correr, nadar, etc.), lo cual corresponde a 30 minutos de actividad física para la mayoría de los días de la semana ya que esta medida puede reducir la presión arterial de 4 a 9 mmHg.
TRUCOS PARA REDUCIR EL SODIO DE ALGUNOS ALIMENTOS AL COCINAR
Cocinar los alimentos hervidos, al vapor, a la plancha o al horno sin la adición de sal . Priorizar la cocción al vapor que el hervido, ya que así se conserva mejor el sabor natural de los alimentos sin necesidad de sazonar.
Evitar cocciones grasas como fritos, rebozados y empanados
Utilizar potenciadores de sabor naturales : vinagre, limón, ajo, cebolla, cebolletas, puerros, especias (pimienta, pimentón, azafrán, canela, mostaza sin sal, clavo, nuez moscada…) o hierbas aromáticas (orégano, albahaca, hinojo, comino, estragón, laurel, menta, perejil, romero, tomillo, salvia, eneldo…).
Se puede reducir el sodio de los alimentos si utilizamos técnicas de remojo prolongado (más de 10 horas) o doble cocción, cambiando el agua a mitad de la misma ya que el sodio se disuelve y queda en el agua. El empleo de esta técnica es útil en verduras, legumbres y pescados congelados y en conserva.
Si se come fuera de casa, es aconsejable elegir del menú ensaladas y aves o pescados a la parrilla en lugar de fritos o guisos y pedir que las salsas se sirvan a parte (aliñar con aceite de oliva).
LISTADO DE ALIMENTOS PARA CONTROLAR LA HIPERTENSIÓN
ALIMENTOS PERMITIDOS
Aves y carnes magras (pollo, pavo, lomo de cerdo, conejo)
Pescados frescos (blancos y azules)
Huevos
Leches, yogur, cuajada y requesón sin sal
Pan integral sin sal
Cereales integrales (sin azúcar)
Patatas cocidas o al horno (sin sal)
Legumbres cocidas sin sal
Verduras y hortalizas frescas (en forma de purés, al horno, ensaladas, etc.)
Frutas frescas y fruta seca sin sal ni azucares añadidos (dátiles, pasas, orejones, etc.)
Frutos secos (sin sal). nueces, avellanas, almendras
Condimentos: pimienta, pimentón, azafrán, canela, mostaza sin sal, hierbas aromáticas, curry, nuez moscada, cúrcuma, jengibre, etc.
Bebidas. agua de baja mineralización, caldos vegetales sin sal, infusiones
ALIMENTOS
A EVITAR
Quesos curados con sal
Legumbres en conserva (se pueden poner en remojo para eliminar la sal)
Patatas chips
Verduras y hortalizas en conserva (olivas, pepinillos y cebolletas encurtidas, etc.)
Salsas comerciales (tomate frito, kétchup, mayonesa, mostaza, salsa de soja, etc.)
Carnes en conserva, salazones o ahumados, extractos, precocinados (croquetas, salchichas, empanadillas…).
Fiambres con sal (jamón cocido, pavo, jamón curado, etc.)
Embutidos: charcutería tradicional, foie gras, patés y enlatados.
Pescados en conserva, salazones, ahumados, extractos, precocinados…
Crustáceos (gambas, langostinos…), moluscos, (caracolillos, almejas…), caviar
Frutos secos con sal
Mantequilla o margarina

Artículo especializado
Cómo Eliminar el Anisakis
Sin duda el pescado es un alimento muy interesante para el consumo humano, por su contenido nutricional. Sin embargo también puede ocasionar problemas de salud, por el riesgo asociado que conlleva la presencia de ciertos contaminantes. La infestación de parásitos como el anisakis es uno de ellos. Según los últimos datos, en España hasta un 36% del pescado tiene anisakis, especialmente el que viene del cantábrico (50%) y siendo más raro el del Mediterráneo (6%).
¿Qué es el anisakis?
El anisakis simplex, conocido comúnmente con el nombre de anisakis, es un parásito , en concreto, un gusano nematodo que mide hasta 3 cm de largo y un poco menos de 0,1 mm de diámetro, es blanquecino y casi transparente . En su etapa adulta habita en los mamíferos marinos (ballenas, delfines, focas…), reproduciéndose en su interior y liberando al mar sus huevos a través de las heces, lo que conlleva que llegue en a la cadena alimentaria de otros peces y, por tanto, al consumo humano.
En los humanos la parasitación se limita a la infección por la larva y no continua su desarrollo en el interior de nuestro organismo, ya que lo elimina tras sufrir las secuelas de la infección.
Cuando una persona se alimenta de un pescado contaminado con anisakis, se produce lo que médicamente se conoce con el nombre de anisakiasis , que es capaz de producir las siguientes reacciones:
Gastroenteritis: puede empezar hasta uno o dos días después de haber comido el pescado contaminado. Síntomas: dolor de estómago, vómitos, náuseas, diarrea, estreñimiento… y en casos graves obstrucción intestinal. No suele dar fiebre.
Alergia: empieza minutos o, como mucho, horas después de comer el pescado. Puede quedarse en una leve urticaria o complicarse, llegando a casos extremos con un shock anafiláctico.
También es posible una combinación de ambos cuadros : síntomas gástricos y después urticaria.
Medidas preventivas y dietéticas
La prevención es la principal medida dietética para hacer frente al parásito. No todo el pescado está igual de contaminado, sino que el parásito suele concentrarse en la ventresca y zona abdominal , mientras que escasea en la cola. También es importante conocer qué pescados presentan mayor riesgo:
Los pescados más comúnmente contaminados (de más de 65 cm) son: merluza, besugo, bacaladilla, pescadilla, gallineta, bacalao, jurel, abadejo…
Los que no requieren calor en su preparación y se consumen crudos, ahumados, marinados, en vinagre, en salazón como: boquerón, salmón, anchoa y sardina.
Los cefalópodos : pulpo, sepia y calamar.
Los crustáceos : langostinos, gambas, cangrejos y langostas.
El riesgo es mínimo con los bivalvos como: mejillones, almejas, ostras…
No tienen anisakis los peces de agua dulce como: truchas, percas, carpas…
El principal enemigo del anisakis es la temperatura. Por eso, se recomienda mantener el pescado en una congelación prolongada durante cinco días a -20˚C o bien someterlo a cocciones que superen los 60ºC para asegurar la muerte del parásito.
¿QUÉ PASA CUANDO COMPRAMOS PESCADO PREPARADO O COMEMOS FUERA?
La legislación europea y española obliga a que los productos de la pesca no se pongan a la venta con parásitos visibles. En España, en concreto, se exige a los establecimientos que sirven comida a los consumidores finales o a colectividades o que elaboran estos productos para su venta al consumidor final, garantizar que los productos de la pesca para consumir crudos o tras una preparación que sea insuficiente para destruir los parásitos, hayan sido previamente congelados en las condiciones mencionadas antes. Si no dispone de esta información, el consumidor siempre la puede solicitar.
El control de la temperatura siempre es más fácil en el caso de la congelación. En el caso de comprar pescado congelado, es mejor ultracongelado porque se eviscera en alta mar y la posibilidad de parasitación es menor. Para asumir una temperatura positiva es más difícil su control, sobre todo porque en muchas ocasiones no disponemos de un termómetro que nos informe sobre la temperatura. Por este motivo conviene tener en cuenta algunas recomendaciones fundamentales para cocinarlo de manera segura:
Pescado al horno. Si queremos asar una pieza entera, se debe cocinar a 200ºC durante 20 minutos por cada kilo de pescado. Para saber si está cocinado, se debe girar ligeramente la cabeza del pescado, y si ésta se desprende con facilidad de la espina central con la que se une al cuerpo, significa que el interior del ejemplar ha superado los 60ºC y ya está cocinado.
Pescado a la parrilla. Se debe abrir la pieza por la mitad, a una alta temperatura colocándolo sobre un foco directo de brasa. Se regula la distancia en función del tamaño del pescado: cuanto mayor sea el tamaño, alejarlo más de la fuente de calor. De esta manera se evita que se cocine en exceso el exterior y quede crudo el interior. El pescado está cocinado cuando la espina adquiere un color blanquecino y se separa con facilidad de su carne.
Pescado a la plancha. Mediante dicha técnica las porciones de pescado se incorporan directamente en la superficie lisa de la plancha con elevada temperatura, superior a 150°C. No es necesario incorporar mucha grasa, sino que un toque de aceite será suficiente para un cocinado rápido. Cuanto más gruesas sean las piezas, menos temperatura tendrá la plancha, así evitamos que se cocine demasiado por fuera dejando crudo el interior. La manera de comprobar si el pescado está cocinado y ha superado los 60ºC es presionarlo y observar si las láminas de las que se compone se separan con facilidad. Si es así, significa que ya está hecho.
Pescado empanado o rebozado y frito. De todas las técnicas culinarias, ésta es la que presenta más dificultades para saber si la carne está hecha dado el grosor del empanado o rebozado, ya que puede ocurrir que la superficie esté dorada y el interior quede crudo. La temperatura del aceite no debe estar demasiado alta. La mejor manera de asegurarse es dar a todas las tajadas el mismo tiempo de cocción: unos cinco minutos por cada lado, a una temperatura de 170ºC.
La práctica cada vez más extendida de destripar los pescados en alta mar y arrojar sus vísceras al agua, y la moda del consumo de pescado crudo o poco cocinado como en el sushi hacen que sea un tema actual en nuestra sociedad. Pero por ello no debe ser motivo de prescindir su consumo dado que el pescado ofrece un valor nutricional muy importante para la salud humana. Presenta un contenido nutricional muy completo siendo una fuente importante de ácidos grasos omega 3, indispensables para la prevención de enfermedades cardiovasculares y la respuesta inflamatoria. También aporta proteínas de alto valor biológico y un contenido significativo en minerales como: calcio, yodo y selenio . Deberíamos aportarlo al menos entre dos y tres veces por semana.

Artículo especializado
Correcto Uso de los Antibióticos
Este artículo se convertiría en un tratado si quisiéramos condensar toda la información relevante en cuanto a los antibióticos. Me gustaría que al finalizar esta lectura tuvieras conciencia del uso racional del antibiótico, de la importancia de seguir el tratamiento a pesar de que los síntomas mejoren y de los riesgos del abuso del mismo.
¿Sabías que España es uno de los países desarrollados con más consumo de antibióticos? Desgraciadamente, está directamente relacionado con mayores tasas de resistencias bacterianas. Del total de prescripciones realizadas, el 90% procede de los centros de atención primaria y de los servicios de urgencias. Y el otro 10%, ¿responde a la automedicación?
Existen dos grandes grupos de antibióticos según su mecanismo de acción:
Bactericidas: su acción es letal, llevando a la lisis bacteriana. Erradica el germen.
Bacteriostáticos: impiden el desarrollo y la multiplicación bacteriana, pero sin llegar a destruirla.
Cuando un médico extiende una receta de antibiótico debe pensar en cosas muy diferentes a la vez. Fundamentalmente, el foco infeccioso bacteriano a tratar (si se trata de una infección respiratoria, urinaria, cutánea…), la selección del grupo específico de antibióticos (¿el paciente tiene alguna alergia? ¿ha realizado otra pauta recientemente?), la posología a recomendar (según el foco puede variar la dosis de antibiótico a recomendar). Por ejemplo, no es igual la dosis de amoxicilina para una amigdalitis que para una neumonía, el cumplimiento del tratamiento y otra medicación que pueda tomar el paciente.
TRATAMIENTO EMPÍRICO
Normalmente indicamos un tratamiento que llamamos empírico, ¿que significa? Consiste en prescribir el antibiótico que más probablemente va a erradicar la infección del área a tratar, sin conocer con exactitud el germen causante de la infección. ¿Qué ocurre si ese antibiótico no consigue erradicar los síntomas? Si es una infección poco relevante podemos recetar otro antibiótico de una familia diferente. Sin embargo, cuando existe afectación del estado general y, en caso de que el primer antibiótico no sea eficaz, puede estar indicado solicitar un estudio microbiológico y un antibiograma . ¿En qué consisten? Con el estudio microbiológico aislamos con exactitud el germen que causa la infección. Con el antibiograma conocemos exactamente los antibióticos a utilizar frente al germen aislado.
¿Por qué insistimos tanto en la resistencia al antibiótico?
Justamente porque los principales motivos del fracaso terapéutico son la automedicación y el abuso (utilización inapropiada y excesiva), ambos evitables.
Una de las consecuencias inmediatas del abuso de antibiótico es la resistencia de los gérmenes a los antibióticos con un gran impacto clínico negativo y una repercusión económica muy importante. Cuando el antibiótico empleado en primera opción no consigue erradicar la infección debemos iniciar otro antibiótico de una familia diferente. Ello conlleva, no sólo a un doble gasto (con repercusión económica) sino también a un alargamiento en el proceso clínico (mayor tiempo de incapacidad para el paciente).
Por otro lado, la prescripción de un tratamiento antibiótico implica tener un amplio conocimiento de las reacciones adversas y de las interacciones farmacológicas para informar adecuadamente al paciente.
¿Qué nos pasa por la cabeza a la hora de la prescripción?
Una vez confirmado el foco del cuadro infeccioso (tras un interrogatorio y una exploración dirigidos) pensaremos en los posibles gérmenes causantes. En este punto debemos ser conocedores de qué gérmenes son los más habituales en cada uno de los posibles focos infecciosos y de las familias de antibióticos más recomendables para cada tipo de infección. Es decir, que la amoxicilina, por ejemplo, no es eficaz para todos los focos infecciosos.
Vamos a recordar los principales grupos de antibióticos:
Betalactámicos: Se pueden clasificar en cuatro grupos diferentes: penicilinas (amoxicilina, cloxacilina…), cefalosporinas (cefuroxima, cefazolina…), monobactámicos y carbapenemes. Constituyen la familia más numerosa de antimicrobianos y la más utilizada en la práctica clínica. ¡Ojo! A este grupo pertenecen los derivados de la penicilina que producen reacciones alérgicas en un 5 % de la población. Si eres alérgico no puedes tomarlos. Además, si eres alérgico a la penicilina también podrías serlo a las cefalosporinas por la llamada reacción cruzada. ¡Cuidado! El 10% de la población es alérgica a las penicilinas y cefalosporinas a la vez.
Aminoglucósidos: gentamicina, amikacina y estreptomicina. Cuidado pueden ocasionar Ototoxicidad y nefrotoxicidad.
Macrólidos: eritromicina, claritromicina, azitromicina (famoso antibiótico de los 3 días consecutivos a una sola dosis diaria), josamicina.
Quinolonas: ciprofloxacino; ofloxacino; levofloxacino; moxifloxacino; norfloxacino. Muy utilizadas en infecciones urinarias.
Sulfamidas: trimetoprima; cotrimoxazol.
Tetraciclinas: doxiciclina; minociclina; tetraciclina; oxitetraciclina; tigeciclina.
Otras familias serían: glicopéptidos como vancomicina; lincosamidas como la clindamicina; anfenicoles como el cloranfenicol.
En el momento de elegir el antibiótico de elección es cuando valoramos el perfil de nuestro paciente (alergia, edad, peso, función renal y hepática, embarazo, antecedentes y tratamiento crónico). Asimismo, pensamos en la vía de administración más adecuada (oral, tópica, endovenosa, intramuscular…).
En la visita de control valoraremos el correcto cumplimiento y la eficacia del tratamiento.
¿Y qué decir en cuanto al uso de antibiótico profiláctico o para prevenir una infección? Su uso debe acotarse sólo para aquellas situaciones clínicas que puedan desestabilizar a un paciente frágil o inmunodeprimido.
¿Qué tenemos que preguntar obligatoriamente al prescribir un antibiótico?
Exactamente lo que has pensado: ¿tiene alguna alergia? Aquí te quiero añadir que es importantísimo tener estudiada cualquier posible alergia detectada previamente, dado que al catalogar a un paciente como alérgico, cerramos la puerta de una determinada familia de antibióticos para toda la vida. Por ello, si alguna vez has tenido una reacción extraña al tomar un antibiótico no te quedes con la duda, hazte las pruebas específicas para confirmar o descartar tu alergia. Ese posible antibiótico puedes necesitarlo en un futuro y tenemos que saber si te lo podemos prescribir o no.
Artículo especializado
Métodos Anticonceptivos: Beneficios y Contraindicaciones de Cada Tipo
Hay una variedad limitada pero amplia de métodos de planificación familiar . Dentro de este abanico, se trata de encontrar el más idóneo para cada mujer en función de la edad, el número de hijos y el deseo genésico, los antecedentes personales y la frecuencia de relaciones sexuales. Existen básicamente cuatro tipos de métodos anticonceptivos: los de barrera, los hormonales, los dispositivos intrauterinos (DIUs) y los quirúrgicos o definitivos.
Métodos de barrera
En cuanto a los métodos de barrera, hay poca cosa que comentar, consisten en establecer una barrera entre el óvulo y los espermatozoides.
Preservativo masculino: es el más popular. Simplemente consiste en una funda de material elástico , látex o similar, que se coloca sobre el pene en erección, en el extremo del cual hay un pequeño depósito con la finalidad de permitir la acumulación del semen durante la eyaculación y se retira justo después para evitar fugas.
Preservativo femenino: es el mismo concepto, pero permite ser colocado en la vagina antes del coito. También está fabricado en un material plástico y lleva una pequeña anilla flexible en un extremo que se coloca en el fondo de la vagina y por el extremo exterior presenta otra anilla de mayor diámetro que cubre parte de la vulva. Tanto el preservativo masculino como femenino pueden usarse también en el coito anal y son los únicos métodos anticonceptivos eficaces para protegernos de las enfermedades de transmisión sexual. No tienen ningún efecto secundario, son altamente seguros y el único riesgo que presentan es el de romperse y alergia al material.
Diafragma: es una pequeña cúpula de material flexible que se coloca en el interior de la vagina previo al coito a modo de “paraguas” que impide el contacto de los espermatozoides con el cuello uterino. Requiere cierta destreza en la colocación y consejo médico para escoger modelo y medida y hay que usarlo junto a cremas espermicidas porque su efectividad es más baja que la de los preservativos y no se puede retirar hasta pasadas unas horas.
Métodos hormonales
Combinados: se trata de una medicación que combina una proporción de estrógenos y de progesterona y que habitualmente se administran de forma secuencial, es decir, se toman durante un periodo de tres semanas y la cuarta semana se descansa o se toma un placebo, de esta manera obtenemos una regla cada cuatro semanas imitando el ciclo normal de la mujer. ¿En qué se basa su efecto anticonceptivo? En condiciones normales una glándula central situada en la base del cerebro llamada hipófisis segrega unas hormonas que son las mensajeras que dan instrucciones al ovario para que haga su doble función: segregar hormonas (estrógenos y progesterona) y fabricar un óvulo. Al estar tomando esta combinación de estrógenos y progesterona la hipófisis interpreta que el ovario ya está haciendo su trabajo sin necesidad de instrucciones y deja de enviar las hormonas mensajeras, con lo que el ovario permanece en reposo y no fabrica ni hormonas ni óvulos. Los anticonceptivos hormonales combinados los podemos administrar por distintas vías: por vía oral en forma de píldora diaria, por vía vaginal mediante un anillo que se coloca en la vagina como un tampón y va segregando durante 21 días la combinación de hormonas o por vía transdérmica mediante unos parches que se adhieren a la piel y que hay que cambiar semanalmente también en ciclos de tres semanas.
¿Cuáles son mejores? Pues el tratamiento es similar y simplemente cambia la vía de administración y por ese motivo pueden adaptarse mejor unos u otros a cada paciente, pero son todos muy seguros y habitualmente no provocan efectos secundarios o muy leves, incluso disminuyen el riesgo de cáncer de ovario y no afectan para nada la fertilidad futura.
Continuos de progesterona: la llamada minipíldora es una píldora de sólo progesterona que se administra de forma continua. Es todavía más inocua que las píldoras combinadas, se puede dar durante la lactancia y en mujeres con contraindicaciones para los otros anticonceptivos hormonales, pero al no hacer pausas no conseguimos un ciclo regular de 28 días. El mismo efecto que consigue una pastilla diaria lo podemos obtener con inyecciones trimestrales o colocando un implante debajo de la piel que tiene tres años de duración o los DIUs hormonales, que comentaremos en el apartado siguiente. Son altamente efectivos, tienen pocos efectos secundarios y, aunque no sea ningún problema, no todas las mujeres se adaptan a no tener la regla regular.
Dispositivos intrauterinos
Son unos pequeños aparatos que se colocan en el interior del útero de forma ambulatoria en la consulta del ginecólogo. Tienen una duración variable de tres a cinco años, dependiendo del modelo. Los hay metálicos y hormonales.
DIUs metálicos: fundamentalmente de cobre, o cobre recubierto de plata u oro con escasas ventajas sobre el de cobre. Generalmente es un pequeño dispositivo de plástico en forma de “T” sobre el que hay envuelto un hilo de cobre en forma de espiral, cilindros o bolas. Los iones que libera el cobre alteran tanto el funcionamiento del espermatozoide, el ovulo y el propio endometrio evitando así los embarazos. Son bastante seguros, cómodos y no presentan efectos secundarios sistémicos más allá de que pueden aumentar el volumen de sangrado menstrual.
DIUs hormonales: llevan una carga de progesterona que se va liberando lentamente en un plazo de tres a cinco años dependiendo del modelo actuando igual que los anticonceptivos hormonales que hemos comentado anteriormente provocando un escaso o nulo crecimiento del endometrio con lo que la mujer tendrá reglas escasas o ausentes sin que ello implique menopausia pues los ovarios siguen segregando sus hormonas, aunque no haya sangrado menstrual. Muy seguros, y con efectos secundarios muy leves.
Quirúrgicos
Sería la sección o ligadura de las trompas de Falopio en la mujer, que requiere una laparoscopia y anestesia general. Hay que tener en cuenta que es definitivo. O la vasectomía, en el hombre, que consiste en la sección o ligadura de los conductos deferentes que comunican los testículos con la uretra. Es un método que puede llegar a ser reversible pero que hay que decidirse por él cuando pensamos que va a ser definitivo.
Con la ayuda de tu ginecólogo, dependiendo del perfil de cada mujer, seguro que encontrarás el método más adecuado.

Artículo especializado
Qué Son y Para Qué Sirven los Antihistamínicos
Pese a que los antihistamínicos son fármacos que se pueden adquirir en la farmacia sin receta , es recomendable no tomarlos si no están prescritos por un médico. En caso de sufrir alergias estacionales o alimentarias, no está de más tener antihistamínicos en el botiquín de casa y llevarlos encima. De todos modos, si se sufre alguna alergia severa, lo que se recomienda es llevar siempre consigo un bolígrafo de autoadministración de adrenalina, que en caso de una reacción alérgica grave es lo que nos puede salvar la vida.
¿Cómo funcionan?
Los antihistamínicos son medicamentos que se emplean para reducir o eliminar los síntomas de las reacciones alérgicas. Su mecanismo de acción se basa en el bloqueo de un receptor de una sustancia, la histamina , que se libera cuando se entra en contacto con un alérgeno, es decir, un agente externo al que la persona es susceptible y que al entrar en contacto con el mismo se desencadena una reacción alérgica.
Cuando se produce una reacción alérgica, el alérgeno interactúa con los receptores de anticuerpos de la superficie de unos glóbulos blancos específicos llamados mastocitos, aunque también con otro tipo de leucocitos llamados basófilos. Cuando se produce esta unión y se forma el llamado complejo antígeno-anticuerpo , estos glóbulos blancos liberan la histamina (junto con otros moduladores químicos) que se encuentra en su interior. Ya fuera de la célula, la histamina reacciona con tejidos cercanos. La unión de la histamina con los receptores H1 produce picor, una dilatación de los vasos (lo cual provoca el rubor facial), bajada de la tensión, dolor de cabeza, aumento de la frecuencia cardíaca, constricción de los bronquios, dolor, etcétera. Es decir, es esta unión de la histamina con sus receptores lo que provoca los síntomas de una reacción alérgica.
¿Son eficaces?
Los antihistamínicos H1 se encargan de bloquear la unión de la histamina con su receptor H1 y así se evita la aparición de los síntomas alérgicos. Los antihistamínicos H1 son útiles siempre y cuando la reacción sea leve y sobre todo si se toman de manera preventiva , es decir, antes de que el cuerpo entre en contacto con el alérgeno. En caso de reacciones alérgicas severas se deben tratar en urgencias con corticoides y especialmente con adrenalina si existe riesgo vital.
Los antihistamínicos H1 se utilizan para tratar diferentes reacciones alérgicas y sus síntomas, ya sean los alérgenos sustancias naturales del medio, como pólenes, ácaros, pelos de animales, metales o alimentos, o bien fármacos. En general, las reacciones alérgicas por alérgenos externos son más leves que las producidas por fármacos . Al ingerir el fármaco o ser administrado por otra vía, la cantidad de alérgeno que llega a las células es mayor, de manera que la magnitud de la reacción alérgica también es mayor y, por consiguiente, puede existir un riesgo para la vida de la persona que sufre la reacción.
PRINCIPALES MANIFESTACIONES DE UNA REACCIÓN ALÉRGICA
Rinitis (picor nasal, estornudo, moqueo).
Conjuntivitis (enrojecimiento ocular, picor, lagrimeo).
Urticaria (aparición de habones, picor, enrojecimiento cutáneo).
Dermatitis de contacto (enrojecimiento en la zona de contacto, picor).
Angioedema (rubor, edema de párpados o labios, molestia al tragar o al respirar).
Diarrea (abundante, líquida, sobre todo por alérgenos alimentarios).
Anafilaxia (reacción alérgica aguda y grave que afecta a todo el organismo).
Tipos de antihistamínicos
Existen diferentes tipos de antihistamínicos H1 (hay unos antihistamínicos H2, que se utilizan para el tratamiento de la úlcera gástrica al disminuir la secreción de ácido clorhídrico a nivel estomacal). Los principales antihistamínicos H1 son:
De primera generación:
Difenhidramina.
Carbinoxamina.
Doxilamina.
Dimenhidrinato.
Clorfeniramina.
Dexclorfeniramina.
Prometacina.
Ketotifeno.
De segunda y tercera generación:
Cetirizina.
Loratadina.
Mizolastina.
Terfenadina.
Levocetirzina.
Desloratadina.
Sobre los antihistamínicos de primera generación
Son los más antiguos y tiene la ventaja de que son más baratos . Alivian muy bien los síntomas de la alergia, pero no solamente actúan sobre los receptores H1 de la histamina, sino que también lo hacen sobre otros receptores, como el de la acetilcolina, la serotonina o la adrenalina. Al no ser fármacos que actúen de manera selectiva sobre los receptores H1 de la histamina los efectos secundarios que provocan hacen que muchas personas los toleren mal. Su efecto secundario más habitual es la somnolencia , con lo cual se debe extremar la precaución al tomar estos fármacos si se tiene que conducir y no se deben mezclar con otros depresores del sistema nervioso como el alcohol.
Sobre los antihistamínicos de segunda generación
Son medicamentos igualmente eficaces para el tratamiento de los síntomas de la alergia pero que además tienen la ventaja de ser selectivos , es decir, se unen solamente a los receptores H1 de la histamina que se encuentran fuera del sistema nervioso central, de manera que el efecto secundario de la somnolencia no existe con esta generación de antihistamínicos H1 más moderna. En los antihistamínicos H1 de tercera generación (levocetirzina y desloratadina) la selectividad por los receptores H1 es aún mayor que en los de segunda generación.
¿Tienen efectos secundarios?
Además de la somnolencia, los efectos secundarios más habituales de los antihistamínicos H1 (especialmente de los de primera generación) son:
Mareo.
Acúfenos o tinnitus (pitidos en los oídos).
Visión borrosa.
Euforia.
Descoordinación.
Ansiedad.
Insomnio.
Temblores.
Náuseas y vómitos.
Estreñimiento o diarrea.
Sequedad de boca.
Tos seca.
Los antihistamínicos H1 de segunda generación pueden producir también algunos de estos síntomas, pero con menor frecuencia y de manera leve. Otros efectos secundarios menos habituales son la posibilidad de una retención de orina, la presencia de palpitaciones, el descenso de la tensión arterial o un posible dolor de cabeza.

Artículo especializado
Vida Sana Contra la Angina de Pecho: Antes y Después
Cuando hablamos de patologías isquémicas nos referimos a la falta de oxígeno, y si lo asociamos a enfermedades cardíacas nos referimos a una falta de oxígeno en el tejido muscular del corazón (miocardio). Esta hipoxia o falta de oxígeno puede ser transitoria (angina de pecho) sin dejar daño permanente o puede producir la muerte o necrosis de las células del miocardio (infarto agudo de miocardio), que precisa de atención médica inmediata. En ambos casos existe una obstrucción en las arterias coronarias con una reducción del flujo sanguíneo, siendo una oclusión parcial en el caso de la angina y total en el infarto.
LA IMPORTANCIA DEL ESTILO DE VIDA
La cardiopatía isquémica es la principal causa de muerte en hombres y mujeres, y constituye s una urgencia médica de extrema gravedad. Contribuir a reducir el riesgo cardiovascular a través de hábitos saludables como la disminución del peso, control de la tensión arterial y mejora del perfil lipídico es de vital importancia.
¿Qué causa la angina de pecho?
La causa más común que produce esta obstrucción suele ser la aterosclerosis . Esta afectación ocurre cuando se acumulan depósitos de grasa (colesterol) formando placas de ateroma que se depositan en las paredes de las arterias y estrechan y obstruyen las arterias coronarias.
¿Qué factores de riesgo pueden influir su aparición?
Entre los factores de riesgo que predisponen a la angina de pecho destaca tener algún antecedente familiar de cardiopatía isquémica, así como fumar , tener hipertensión, hipercolesterolemia o colesterol alto , sufrir obesidad, presentar diabetes, el sedentarismo y tener una edad avanzada.
Por todo ello es importante actuar sobre los factores de riesgo que podemos modificar y llevar unos hábitos saludables que puedan influir en la prevención. Entre las medidas preventivas podemos destacar:
Dejar de fumar.
Llevar una alimentación equilibrada y saludable.
Realizar ejercicio. Las personas que hacen ejercicio aeróbico de forma regular tienen un menor riesgo de isquemia miocárdica. Además, también ayuda a controlar el peso y reduce la hipertensión arterial.
Evitar la obesidad y mantenerse en un peso saludable.
Realizar revisiones de la tensión arterial.
Vigilar que los índices de colesterol y glucosa sean los correctos.
Disminuir el estrés.
¿Qué síntomas suelen aparecer?
La angina de pecho suele aparece después de realizar un esfuerzo físico por aumentar la demanda de flujo sanguíneo (deporte, levantar pesos…) o sufrir estrés emocional . Se caracteriza por una sensación de opresión o dolor en el tórax debido a la isquemia o falta de oxígeno y puede extenderse al cuello, mandíbula, espalda y brazos. El dolor suele ser de intensidad moderada y duración limitada, mejorando con el reposo, y cede con la toma de fármacos vasodilatadores.
Si aparece alguno de estos síntomas debes acudir al hospital para que te realicen una exploración, diagnostiquen el tipo de angina de pecho e inicies a tiempo el tratamiento más adecuado. Tal y como recoge la Sociedad Española de Cardiología pueden ser de tres tipos:
Angina estable o angina de esfuerzo: es la más común y la que tiene mejor pronóstico. Ocurre cuando se realiza un esfuerzo que exige más demanda de oxígeno por parte de las fibras musculares cardíacas o miocardio. Se trata con reposo o vasodilatadores.
Angina inestable o angina en reposo: es la más peligrosa. Se produce de forma espontánea y puede ocurrir sin realizar ningún esfuerzo físico. Se debe a una obstrucción no total en una arteria coronaria, pero es de peor evolución que la anterior. No desaparece espontáneamente con el reposo y se debe tratar como una emergencia ya que se considera una señal de que existe un riesgo elevado de producirse un infarto, una arritmia grave o muerte súbita.
Angina variante, vasoespástica o de Prinzmetal: es una variedad de la angina inestable y ocurre frecuentemente durante el reposo nocturno. El mecanismo causante se debe a un espasmo o cierre espontáneo de un vaso coronario a diferencia de la oclusión de un vaso, como sucede en la inestable. El pronóstico de estos pacientes depende fundamentalmente del estado de sus vasos coronarios.
¿Qué dieta se debe seguir una vez se ha sufrido una angina de pecho?
Las recomendaciones dietéticas a seguir deben ir dirigidas a reducir el riesgo cardiovascular a través de diferentes mecanismos como la disminución del peso, control de la tensión arterial y mejora del perfil lipídico . La dieta debe ser:
Pobre en alimentos ricos en colesterol, grasas saturadas, grasas trans y grasas hidrogenadas tales como:
Quesos curados, postres lácteos (helado, natillas, flan, etc), margarina, mantequilla.
Carnes grasas: cordero, cerdo (excepto el lomo) cabrito, ternera, buey, pato, embutidos grasos (chorizo, salchichón, mortadela, sobrasada, etc.) y patés.
Otros productos de pastelería o repostería o ciertos alimentos ultraprocesados contienen grasas trans. Se pueden identificar en el etiquetado bajo el nombre de grasas hidrogenadas o parcialmente hidrogenadas. Son: margarinas, galletas, productos de bollería, palomitas de microondas, pastelería industrial, caramelos, snacks salados (patatas fritas, cortezas, etc.) y dulces, helados, salsas, empanadillas, pizzas, lasañas, pescado frito, etc…
Rica en ácidos grasos insaturados (mono y poliinsaturados): aceite de oliva, pescado azul y frutos secos.
Añade aguacate a las ensaladas (rico en grasas monoinsaturada).
Añade semillas de lino en purés, ensaladas o yogur (ricas en grasas poliinsaturadas tipo omega-3.
Utiliza tres o cuatro cucharadas diarias de aceite de oliva (preferiblemente virgen extra) entre las cocciones y su uso en crudo.
Consume de dos a cuatro raciones de frutos secos a la semana (no salados ni fritos): un puñado de nueces, avellanas o almendras.
Consume de dos a cuatro raciones de pescado azul a la semana ya que es un alimento rico en grasas poliinsaturadas tipo omega-3.
Rica en fibra y antioxidantes: frutas, verduras, cereales integrales y legumbres
Tomar tres raciones de fruta diarias y al menos una ración diaria de ensalada o verdura cruda (no cocida).
Consumir el pan y los cereales en sus variedades integrales.
Recomendaciones
Mantener unos buenos hábitos alimentarios para que en un futuro tu alimentación sea más correcta y equilibrada.
Tomar cinco raciones de fruta y verdura diarias :
Tres piezas de fruta fresca al día (una de ellas cítricas: kiwi, naranja, mandarina, pomelo).
Dos raciones de verdura al día (una de ellas en forma de ensalada)
Consumir tres raciones diarias de farináceos , preferiblemente integrales (pan, pasta, arroz, otros cereales), deben constituir la base de nuestra alimentación.
Consumir de dos a cuatro raciones semanales de legumbres (60-80 g/ración en crudo, 150-200 g cocidas). Recuerda cocinarlas con poca grasa (con verduras y carnes magras, y evitando chorizo, morcilla, etc.)
Tomar a diario de dos a cuatro raciones de lácteos (leche, yogur natural y quesos) en sus variedades desnatadas
Consumir tres o cuatro raciones (100-125 g/ración) a la semana de carnes magras (pollo y pavo sin piel, conejo, ternera magra, solomillo de buey, lomo de cerdo…)
Consumir un mínimo de cuatro raciones a la semana de pescado (dos de ellas de pescado azul).
Ejemplos de pescado blanco: lenguado, merluza, rodaballo, bacalao, congrio, dorada, gallo, lubina, pescadilla, mero, rape…
Ejemplos de pescado azul: aguja, angula, aún, bonito del norte, boquerón o anchoa, caballa o verdel, chicharro o jurel, melva, salmón, salmón ahumado y sardina…
Evitar los patés y embutidos grasos (chorizo, salchichón, mortadela, sobrasada, etc.). En contraposición, consumir con moderación los embutidos de menor contenido en grasa (jamón cocido o serrano sin la grasa visible, fiambre de pavo…).
El consumo de tres o cuatro huevos por semana es una buena alternativa a la carne y el pescado.
No abusar del azúcar.
Es muy conveniente beber abundante agua a lo largo del día.
Evitar las bebidas alcohólicas , aportan gran cantidad de calorías “vacías” (no aportan nutrientes)
Controlar la cantidad de aceite diaria (tres o cuatro cucharadas soperas). Para ello, preparar los platos de manera sencilla: asados, en su jugo, en microondas, en papillote, al vapor, hervidos o a la plancha. Evitar las frituras, rebozados, empanados y los guisos con salsas grasa.
Y, sumado a todo ello, se recomienda realizar actividad física diaria. El ejercicio físico practicado de forma regular y con intensidad moderada es cardiosaludable. Siga las indicaciones de su médico para no someterse a un sobreesfuerzo.
 Savia
Savia