Artículos Especializados

Artículo especializado
Tratamiento de una Contractura Muscular
Todos podemos diferenciar cuando tenemos un músculo contracturado al sentirlo duro y doloroso al tacto o a la presión . También es habitual notar cómo no podemos realizar movimientos habituales por falta de fuerza y dolor. Es en ese momento cuando podemos decir: “tengo una contractura”. Y no se asocia al ejercicio, sino más bien a lo contrario, pues el sedentarismo es una de las causas, así como posturas estáticas.
La RAE define contractura como contracción involuntaria, duradera o permanente, de uno o más grupos musculares. Puede aparecer al realizar un esfuerzo y entre los síntomas más frecuentes encontramos el abultamiento o inflamación de la zona, dolor y alteración del funcionamiento normal del músculo. S on episodios muy comunes, pero no graves.
Tono muscular
Para entender cómo se produce una contractura, explicaremos lo que es el tono muscular , también conocido como tensión muscular residual o tono. Es la contracción parcial, pasiva y continua de los músculos . Ayuda a mantener la postura y suele decrecer durante la fase REM del sueño . De aquí podemos deducir la importancia del sueño y descanso reparador para normalizar el tono muscular de todo nuestro cuerpo.
Incluso cuando están relajados los músculos presentan una ligera contracción que limita su elasticidad y ofrece cierta resistencia al movimiento pasivo. Cuando el tono está disminuido hablamos de hipotonía , la elasticidad de músculo es excesiva y su consistencia es blanda, las articulaciones no se encuentran bien fijadas, aún con el músculo contraído, por lo que al moverlas apreciamos flacidez y un movimiento muy amplio.
Por el contrario, la hipertonía es un exceso de tono muscular que produce articulaciones fijadas a menudo en posturas anómalas, al intentar moverlas notamos una resistencia.
Explicado ya este pequeño inciso, continuamos con el tema a tratar. La contractura muscular puede presentarse como causa o consecuencia de un dolor, se da cuando el músculo no puede realizar un esfuerzo correctamente, ya sea porque no esté preparado o porque este débil.
Cómo sé que tengo una contractura
Todos podemos diferenciar cuando tenemos un músculo contracturado al sentirlo duro y doloroso al tacto o a la presión . También se siente impotencia funcional, lo que se explica cómo intentar hacer una actividad física o movimiento y sentir que no se puede realizar normalmente por falta de fuerza y dolor.
El diagnóstico de las lesiones musculares se basa en la clínica, fundamentalmente en la sintomatología y especialmente en la anamnesis del mecanismo lesional, y en la exploración física . Los estudios de imagen mediante la ecografía musculoesquelética y la resonancia magnética (RM) son complementarios, a pesar de que cada vez pueden ser más útiles a la hora de confirmar un diagnóstico y sobre todo emitir un pronóstico para el resto de lesiones osteomusculares.
Causas comunes
Posturas estáticas : hacen que el músculo este en la misma posición por más tiempo del adecuado. Esto hace que el músculo se fatigue por soportar cargas inadecuadas.
Sedentarismo : que se traduce en falta de movimiento. Y a su vez, la falta de movimiento hace que no haya una correcta irrigación sanguínea. Los músculos no estarán en condiciones óptimas, por lo que las contracturas son más susceptibles de aparecer ante cualquier esfuerzo.
Estrés : por la liberación de elementos químicos que llevan a la contracción involuntaria y sostenida del músculo.
¿Y cómo se produce?
Una contractura se puede formar básicamente como consecuencia de dos procesos:
Cuando se le exige al músculo un trabajo superior al que está capacitado de realizar , ya sea puntual e intenso (como en el caso de las lesiones por esfuerzo repetitivo), o bien, por un esfuerzo mantenido, pero no tan fuerte, por ejemplo, al estar en una misma posición inadecuada por algún tiempo.
Cuando el músculo está débil y no tiene potencia suficiente para llevar a cabo trabajos que tiene que realizar. Este es el caso típico de las contracturas de los músculos paravertebrales de un lado específico de la espalda a causa de una escoliosis, ya que un lado de la musculatura se atrofia lo que lleva a la asimetría de cargas y pesos para el otro lado.
Tipos de contracturas
Básicamente existen dos tipos de contracturas:
Durante el esfuerzo : son contracturas que se producen por el acúmulo de desechos metabólicos dentro de la fibra muscular. Lo explicamos: cuando se efectúa un movimiento brusco, los vasos sanguíneos musculares no están preparados para trabajar tan rápido y cuando se liberan los elementos tóxicos provocan al mismo tiempo dolor y contracturas. Esta es una de las razones por las cuales el calentamiento previo al ejercicio es tan importante.
Después del esfuerzo: en este caso las contracturas ocurren por el estiramiento de la fibra y/o su trabajo excesivo que hizo en el esfuerzo, lo cual le produce lesiones y dolor.
Tratamiento y recomendaciones
La pauta de tratamiento de las lesiones musculares no sigue un modelo único , pero la aplicación de calor (compresas calientes, bolsas de agua, esterilla eléctrica), estiramientos, masaje en la zona afectada y punción seca son las técnicas más habituales para tratarlas.
Las contracturas, si bien son comunes, son fáciles de evitar. Para ello, sigue estos consejos :
Realiza siempre un calentamiento previo al ejercicio de unos 10 minutos. Y, si tienes un trabajo físico, mueve los músculos que utilizas normalmente antes de empezar tu jornada laboral.
Estira correctamente después del ejercicio. Si no sabes cómo hacerlo, pide a un fisioterapeuta o especialista en ejercicio físico que te guíe.
Recuerda hacer el ejercicio progresivamente, de menos a más intensidad.
Si entrenas con pesas, levanta el peso con el que puedas resistir y completar la serie.
No mantengas una misma posición por mucho tiempo. Si tu trabajo te exige estar sentado o de pie toda la jornada, tómate unos 5-10 minutos de cada hora para cambiar de posición y hacer estiramientos ligeros.
Un descanso nocturno de unas ocho horas y una alimentación equilibrada y rica en frutas y verduras son recomendables.
Cuando sufras una contractura, visita a un fisioterapeuta. El tratamiento tiene una duración de entre una y tres sesiones, dependiendo de la gravedad de la contractura.
Artículo especializado
Qué es la Laparoscopia
El término laparoscopia procede del griego “laparo”, que significa abdomen, y “skopein”, que significa examinar. Es decir, la laparoscopia consiste en un examen visual de la cavidad abdominal . Aunque inicialmente fue desarrollada por los ginecólogos con fines diagnósticos, han sido los cirujanos los que la han orientado más a realizar tratamientos sobre diversas enfermedades.
La técnica se basa en introducir aire dentro de la cavidad abdominal para crear un espacio en el que se pueda trabajar. Para ello se hace una pequeña incisión a nivel del ombligo , se introduce un elemento plástico como un tubito, llamado trocar, y a través de él aire que hace expandir la cavidad. A través de este trocar se introduce un sistema óptico de visualización , es una cámara o endoscopio, conectada a un sistema de televisión externa que nos permite ver en directo lo que ocurre en el interior del cuerpo. Se realizan también varias puertas de entrada de pequeño tamaño por donde introducir el instrumental. Todas estas técnicas forman parte del concepto denominado en la actualidad cirugía mínimamente invasiva que consiste en realizar operaciones mayores a través de pequeñas incisiones , con sistemas de alta tecnología, y reduciendo al mínimo el traumatismo propio de la intervención.
A parte de toda esta tecnología también son necesarios diferentes instrumentos de trabajo. Se utilizan diversas pinzas de agarre, para sostener tejidos, tijeras, disectores, portas y agujas para realizar suturas… Los mismos elementos que se emplean en una cirugía convencional, pero de menores dimensiones. ¿Por qué son más pequeñas?, porque tienen que poder entrar a través de los trocares (instrumentos en forma de lápiz para proporcionar puertos de acceso durante la cirugía) ya que estos tienen un diámetro de pequeña envergadura.
Ventajas
Hoy día es considerada técnica de elección en muchos procedimientos por sus ventajas frente a la cirugía convencional. Estas ventajas frente a la cirugía abierta son varias:
Existe menos traumatismo de la pared abdominal, se debilitan menos los músculos abdominales y por eso son menores las apariciones de hernias.
Hay una disminución importante del riesgo de desarrollar de infección a nivel de las heridas sobre todo porque son más pequeñas.
Menos dolor después de la cirugía.
Todo ello contribuye a que la paciente esté menos tiempo ingresada, además se moviliza antes que, con una cirugía abierta, en general la recuperación postoperatoria suele ser más rápida y fácil.
Otra ventaja importante es que, al ser una cirugía poco invasiva, los órganos cercanos se manipulan mucho menos que en las cirugías convencionales, esto hace que haya menos irritación e inflamación y se evitan con mayor facilidad las adherencias.
Hay una ventaja estética evidente al no existir las grandes cicatrices que acompañan a la cirugía convencional, quedando reducidas a heridas menores de un centímetro en la gran mayoría de los procesos.
¿Es difícil la cirugía laparoscópica?
Es cierto que se necesita un mayor entrenamiento y especialización porque puede resultar una técnica más compleja , pero hoy en día en casi todos los hospitales se enseñan y se entrenan para este tipo de intervenciones quirúrgicas.
La cirugía laparoscópica puede ser empleada por varias especialidades quirúrgicas en las técnicas que realizan habitualmente:
Cirugía General y del Aparato Digestivo: cirugía de la vesícula biliar, cirugía del reflujo, cirugía de la pared abdominal (hernias), cirugía del esófago y del estómago, lo que incluye la cirugía de la obesidad mórbida, cirugía del colon y del recto, cirugía del apéndice, y cirugía del hígado, del páncreas y del bazo.
Urología: cirugía del riñón, cirugía de la glándula suprarrenal, cirugía de la próstata, cirugía de la vejiga urinaria, etc.
Ginecología: cirugía del útero, cirugía del ovario, cirugía de esterilización, etc.
Cirugía torácica: cirugía del pulmón, cirugía de la pleura, etc.
La tendencia actual de la cirugía es evolucionar hacia técnicas todavía de menos invasión . Así pues, se empieza a utilizar la cirugía laparoscópica de puerto único, es decir, a través de la incisión del ombligo se introduce un tubo con varios accesos sin necesidad de hacer otras incisiones en la piel. Otro avance un tanto curioso para la mayoría es la cirugía a través de orificios naturales (NOTES), esto quiere decir que no se hacen nuevos accesos para operar, sino que se utilizan los que ya tiene el cuerpo, por ejemplo, operar a través de la vagina, del recto o del estómago.
En conclusión, la cirugía evoluciona cada día junto con las nuevas tecnologías, hacia técnicas de menos invasión. Se puede decir que actualmente están demostradas las ventajas de la cirugía laparoscópica frente a la cirugía convencional en muchas técnicas de diferentes especialidades, siendo preciso un entrenamiento específico para el éxito de los procedimientos, el cual está cada vez más desarrollado en los distintos servicios quirúrgicos hospitalarios.

Artículo especializado
Tratamientos Efectivos para la Cistitis
Se define cistitis como una infección del tracto urinario de vías bajas . Provoca dolor al orinar (disuria), sensación de ir al baño, pero luego hacer poquita cantidad, ir muchas veces a orinar, dolor al iniciar la micción o al finalizar, y sensación de no haber vaciado bien la vejiga. A veces, incluso, hay presencia de un poquito de sangre en la orina.
¿Cuándo se consideran recurrentes?
Las infecciones del tracto urinario recurrentes (ITUR) se consideran cuando hay tres o más episodios en un año o al menos dos en seis meses . Se sabe que un 5% de las mujeres tienen ITUR a lo largo de la vida, siendo más frecuente en las jóvenes sexualmente activas.
REINFECCIÓN O RECIDIVA
Hay que diferenciar entre reinfección y recidiva, aunque lo más frecuente son las reinfecciones . Estas suelen ocurrir pasadas dos semanas de la infección inicial, suelen ser por diferente germen, no está relacionada con alteraciones en el tracto urinario ni de riñón, es más frecuente en mujeres jóvenes sexualmente activas, en postmenopáusicas por el déficit estrogénico y en las que hay una patología de base como la incontinencia urinaria.
Las mujeres con problemas uroginecológicos que tiene posibilidad de ser corregidos mediante cirugía como la incontinencia o los prolapsos, suelen mejorar tras la cirugía. En cambio, en aquellas en las que la corrección quirúrgica no es viable se deberá plantear el tratamiento con profilaxis antibiótica para evitar nuevas recurrencias.
En caso de infección recurrente…
En las mujeres jóvenes en las que la reaparición de la infección suele estar más relacionada con las relaciones sexuales, en las menopaúsicas sin patología urológica de riesgo en las que las infecciones se relacionan con la falta de estrógenos en la región vaginal y en las que tienen una patología no subsidiaria de intervención quirúrgica les recomendaremos estas medidas para las infecciones recurrentes :
-Tratamiento preventivo con antibióticos tras la relación sexual . Se trata de tomar un antibiótico pautado después de las relaciones sexuales. Si la actividad sexual es intensa la pauta de antibiótico será de Fosfomicina 3 g cada siete a 10 días. Esta pauta se puede mantener entre seis y 12 meses además es cómoda y de fácil cumplimiento.
-Tratamiento antibiótico en pauta continúa . Porque disminuye las bacterias a nivel fecal, esteriliza la orina o inhibe la unión bacteriana a los tejidos. Se administra una dosis baja de antibiótico cada noche durante seis a 12 meses.
– Estrógenos tópicos . De primera elección cuando hay una importante atrofia vulvovaginal. Normalmente la pauta es de una aplicación diaria durante las dos o tres primeras semanas y luego dos aplicaciones por semana.
– Toma de extracto de arándanos . Los arándanos contienen proantocianidinas, que son unas sustancias que previenen la colonización por bacterias en la vejiga. Se pueden consumir en forma de extracto o bien en zumos. La cantidad diaria de proantocianidinas al día es de 36 mg.
– Toma de D-Manosa . Es una sustancia pura que el cuerpo no puede metabolizar, se pega a las paredes de la vejiga evitando la adhesión de las bacterias a la mucosa y por medio de la orina es arrastrada junto con las bacterias.
– Otras estrategias como Lactobacilos , que aplicados en vagina parecen tener un efecto preventivo transitorio, son otra posibilidad para evitar las reinfecciones.
De todas formas, no está claro que la combinación de varias estrategias tenga más eficacia que una sola. Por tanto, se pueden elegir según sea la más cómoda para la mujer o la que resulte más efectiva.

Artículo especializado
Consejos para Dormir
¿Es lo mismo insomnio que mala calidad de sueño? ¿Duermes mucho pero mal? ¿Duermes poco pero bien? En definitiva, ¿cómo duermes? A continuación, te daremos algunos consejos para poder relajarte y dormir mejor , pues muchas veces el motivo de nuestro insomnio está en el estrés.
El insomnio es una de las principales y más frecuentes quejas de malestar en nuestra consulta médica. En ocasiones es expresado como síntoma único y, en otras, asociado a otros síntomas como mal humor, cansancio extremo, tristeza, dolor generalizado y contracturas musculares. La duración normal del sueño varía según las personas y la edad, de manera que conforme avanza la edad, la necesidad de sueño disminuye. Así, un lactante tiene una necesidad de sueño de 16 horas al día mientras que un anciano suele tener suficiente con 5 o 6 horas al día.
¿NO TENEMOS QUE DORMIR OCHO HORAS AL DÍA?
El número de horas necesarias para el sueño está sometido a grandes variaciones individuales y circunstanciales (es decir, una misma persona puede necesitar más o menos horas de sueño según su momento personal o laboral). Por ello, si tú eres una persona que sólo necesitas dormir seis horas y te levantas estupendamente, no eres raro, tienes mucha suerte de poder disfrutar de un día más largo que el resto de la población.
¿A qué llamamos insomnio y a qué sueño reparador?
A la dificultad para conciliar o mantener el sueño y/o al despertar más temprano de lo esperable durante un periodo de tiempo mantenido. ¿En qué se traduce? En sensación de insatisfacción, contrariedad y rabia. Cuando una persona se despierta con la sensación de haber dormido mal o de forma insuficiente (sería un sueño no reparador) es posible que padezca sensación de fatiga e irritabilidad durante gran parte de ese día.
Decimos que un sueño es reparador cuando, en cambio, nos despertamos con sensación de bienestar, es decir, descansados y con satisfacción personal. Concretando, para hablar de insomnio debemos tener un sueño de mala calidad y/o cantidad y que se prolongue durante al menos tres meses (con un mínimo de tres días a la semana durante esos meses).
Diagnóstico
A pesar de que nos basamos en la información aportada (damos mucha importancia a la información procedente del paciente y a la del acompañante), debemos dedicar un tiempo a la valoración general y a observar la actitud del paciente (nerviosismo, impaciencia, coherencia, gesticulación, etc). Por otro lado, debemos indagar sobre su situación personal y laboral, cambios recientes, hábitos dietéticos, actividad deportiva y consumo de sustancias tóxicas y alcohol.
No siempre encontramos una causa clara de insomnio pero en la mayoría de casos encontramos una causa desencadenante en cuyo caso debemos tratarla para solucionar el insomnio.
Insomnio primario y secundario
Insomnio secundario es el explicado por alguna causa. Sólo en los casos en los que descartamos una causa subyacente tratable hablamos de insomnio primario o sin causa aparente.
No suele ser necesaria ninguna prueba complementaria para llegar al diagnóstico de insomnio, pero si sospechamos una causa, sí debemos estudiarla o tratarla . Aquí te quiero mencionar el insomnio debido al síndrome de Sleep apnea. Conozco muchos casos de pacientes que solicitan una pastilla para dormir y acaban con un aparato llamado CPAP para mejorar su calidad de sueño. Si es tu caso seguro que me entiendes perfectamente. Si roncas y haces pausas respiratorias durante el sueño consulta con tu médico.
¿Qué puedo aconsejarte para que duermas mejor?
Es evidente que, según la causa de tu insomnio, nuestro papel o tratamiento puede cambiar. Si tienes insomnio por una ruptura sentimental reciente abordaremos la esfera psíquica hasta que te recuperes. Si tienes insomnio porque tomas demasiados cafés o comes mal te enviaré a la nutricionista. Sin embargo, si la causa es el estrés ¿qué hacemos?
En general, lo que quiero es mejorar tu calidad de vida . Inicialmente recomendamos medidas no farmacológicas en casos de insomnio leve. ¿A qué me refiero? Al abordaje no farmacológico en el que facilitamos unas pautas dirigidas a reducir o evitar conductas que dificultan el sueño.
Algunas instrucciones podrían ser:
Disciplina en el sueño: intentar acostarse y levantarse todos los días a la misma hora.
No cenar copiosamente ni realizar actividad física intensa al final de la tarde.
Realizar una rutina antes de acostarnos como puede ser tomar algo caliente, poner música relajante o leer un rato.
Si es posible evitar la siesta durante el día y tomar estimulantes como café, té y tabaco.
Crear un ambiente favorable (sin ruido y con poca luz) y potenciar estrategias de relajación. Pretendemos la relajación muscular y el control de la respiración. Se trata de preparar el cuerpo para entrar en la fase de descanso.
Si no conseguimos dormir en un tiempo prudencial (30-45 minutos), es preferible salir de la cama que continuar en ella dando vueltas y poniéndonos nerviosos. Se recomienda no volver a la cama hasta sentir sueño de nuevo.
Si las medidas no farmacológicas no resultan efectivas debe considerarse la prescripción de medicación. Entonces valoraremos si te cuesta conciliar el sueño o lo que te ocurre es que te despiertas a media noche y no te puedes volver a dormir. Aquí tengo que decirte que es importante revisar la medicación que tomas pues alguna de ellas podría ser la causa de tu insomnio.
La medicación ansiolítica e hipnótica debe recomendarse el mínimo tiempo necesario y retirarse progresivamente. No olvidemos que uno de los efectos secundarios más temidos es la somnolencia diurna. Así mismo, es fácil habituarse a estos medicamentos siendo difícil su retirada (por ello suelen suspenderse de forma gradual disminuyendo su dosis hasta suspenderlo definitivamente). Otra opción es tomarlos sólo a demanda, y no diariamente.
¿Con qué me quedo? Si duermes mal o tu sueño no es reparador consulta con tu médico y trata de poner en práctica los consejos no farmacológicos. En caso de precisar medicación, resérvala sólo para aquellos días en que te resulta totalmente imposible conciliar el sueño.

Artículo especializado
Descubre las Causas del Cáncer de Piel
Como cualquier órgano del cuerpo, la piel puede desarrollar tumores malignos o cánceres. Al estar en contacto con el exterior, y muy especialmente con la luz solar, que puede provocar alteraciones en las células, los cánceres de piel son muy frecuentes . Por fortuna, al ser visibles a simple vista, pueden curarse con un diagnóstico precoz y una actuación terapéutica correcta.
¿Qué tipos de cáncer de piel hay?
Existen centenares de tipos de cánceres de la piel, pero los más frecuentes son tres: el carcinoma basocelular, el carcinoma escamoso (también llamados “cáncer de piel no melanoma”) y el melanoma. De ellos, el más grave puede ser el melanoma , por su capacidad de extenderse e invadir otros órganos y provocar la muerte.
¿Cómo se produce el cáncer de piel?
En cualquiera de los tres tipos de cáncer mencionados, la luz solar parece ser el factor más claramente implicado , especialmente el haber padecido muchas quemaduras solares en la infancia o el permanecer muchas horas al sol sin protección adecuada. No es el único factor, ya que vemos melanomas y carcinomas en zonas donde no toca el sol, como las axilas o las plantas de los pies. El tabaco, otras radiaciones o factores genéticos parecen jugar un papel, aunque menos importante que el sol.
Síntomas del cáncer de piel
El carcinoma basocelular suele manifestarse como un granito brillante de crecimiento muy lento o una herida que no cura y crece.
El carcinoma escamoso puede tener un aspecto algo similar, aunque forma más costra, y el crecimiento es más rápido.
El melanoma es muy diferente, ya que se manifiesta como una peca especialmente irregular, asimétrica o de diferentes colores (sobre todo si hay un color muy negro), que puede aparecer sobre una peca presente anteriormente y que ha cambiado, o sobre cualquier otra zona de la piel sin pecas.
Diagnóstico del cáncer de piel
Es importantísimo acudir al dermatólogo a revisarse periódicamente la piel, especialmente si se han padecido muchas quemaduras solares, si hay historia de cáncer de piel en la familia, y si se es una persona de piel y ojos claros.
Los dermatólogos estamos muy bien entrenados para reconocer posibles cánceres de piel, y utilizamos unos dispositivos para la exploración llamados dermatoscopios , que son como pequeños microscopios portátiles que permiten ver el interior de la piel. En caso de necesitar extirpar alguna lesión por sospechosa de cáncer debe hacerse con biopsia para saber el tipo del tumor y para asegurar que está completamente extirpado.
Tratamiento del cáncer de piel
El tratamiento pasa por extirpar el tumor con unos márgenes suficientes para asegurar que no volverá a crecer, e intentando obtener unos resultados estéticos aceptables, ya que una gran mayoría de los cánceres “no melanoma” aparecen en la cara.
En casos de carcinomas basocelulares de tipo infiltrante, existe una técnica denominada cirugía micrográfica de Mohs que asegura la curación en prácticamente el 100 % de los casos. En casos no operables es posible utilizar radioterapia. También existe una quimioterapia llamada vismodegib para los carcinomas basocelulares múltiples, gigantes o no operables.
En el caso del melanoma , los márgenes de extirpación dependerán del grosor del tumor en el momento de extirparlo. Además, en función de la fase de crecimiento en que se encuentra, puede ser necesario buscar afectación de los ganglios (ganglio “centinela”). Asimismo, el dermatólogo u oncólogo buscará extensión de la enfermedad por otros órganos del cuerpo mediante radiografías, TACs, o PETs (diferentes pruebas radiológicas). Para el melanoma con metástasis el pronóstico es malo. Existen diferentes tipos de quimioterapia aprobados.
Medidas preventivas del cáncer de piel
Las medidas preventivas del cáncer de piel se basan en una correcta protección solar y en la detección precoz mediante autoexploración o visita al dermatólogo . En personas con elevado riesgo de melanoma por una historia familiar, por haber padecido muchas quemaduras solares o presentar muchas pecas, se realiza un mapeado de todo el cuerpo con una técnica de microscopía de epiluminiscencia, con el fin de detectar cambios en las pecas o pecas nuevas que pueden ser melanomas incipientes. Un melanoma detectado y extirpado a tiempo puede estar completamente curado.
Artículo especializado
Es Hereditario el Cáncer de Pulmón
Hay datos para la esperanza respecto al cáncer de pulmón, y es que, aunque en la actualidad es el tumor con mayor mortalidad de nuestro país , en aquellos casos en los que se detecta de forma precoz, la supervivencia puede llegar al 70%. El tabaco es el principal causante de este tipo de cáncer.
¿Qué es?
El cáncer de pulmón se produce cuando algunas células pulmonares sufren una mutación que provoca que se multipliquen sin control. Esto genera una masa de células que va creciendo continuamente, de forma desestructurada. Este crecimiento puede ir afectando a las estructuras cercanas, pero también puede producirse el hecho de que alguna de las células tumorales penetre en algún vaso sanguíneo y se traslade a otro órgano del cuerpo originando una metástasis.
¿Cuánto nos afecta?
El cáncer de pulmón, a nivel global, es el tercer cáncer con más frecuencia en nuestro país , por detrás del cáncer de próstata o de colon. Cada año se detectan aproximadamente unos 60 nuevos casos de cáncer de pulmón por cada 100.000 habitantes. Sin embargo, si diferenciamos entre su prevalencia por sexos, vemos que ésta es muy superior en hombres, entre los que se detectan unos 22.500 casos anuales, comparado con los 5.900 casos detectados en mujeres. Esta diferencia por sexos se aprecia también en la evolución de la incidencia en los últimos años, ya que en los hombres la incidencia ha disminuido más de un 8% en la última década comparado con el aumento de incidencia del 93% en mujeres.
Pese a ser el tercer cáncer más frecuente en nuestro país, el cáncer de pulmón es el que más muertes provoca , con algo más de 21.000 fallecimientos anuales. Así pues, tan solo algo más del 10% de pacientes diagnosticados de cáncer de pulmón sobrevivirá más allá de 5 años. Sin embargo, esta cifra dependerá en gran medida del tipo de cáncer de pulmón y de su extensión en el momento del diagnóstico, llegando a supervivencias superiores al 70% cuando el diagnóstico es precoz.
¿Podemos evitarlo?
La única forma efectiva de disminuir el riesgo de cáncer de pulmón es evitando los factores de riesgo que favorecen su aparición. Y entre ellos hay uno que destaca por encima de todos. El tabaco.
Bien es cierto que existen casos de cáncer de pulmón en personas no fumadoras, pero alrededor del 90% de los casos se presenta entre los fumadores . Y si tenemos en cuenta que, según los últimos datos, alrededor de un 30% de la población es fumadora habitual, podemos concluir que el consumo habitual de tabaco aumenta en un 2.000% el riesgo de padecer cáncer de pulmón (21 veces más riesgo).
La exposición pasiva al tabaco (el fumador pasivo) tiene un riesgo aumentado también de desarrollar cáncer de pulmón, estimándose dicho riesgo en torno a un 20% superior al de una persona no expuesta al humo del tabaco.
Existen otros factores de riesgo para el desarrollo del cáncer de pulmón, como la contaminación del aire, la exposición al radón, asbesto, arsénico, etc., pero son de menor relevancia comparado con el riesgo que ocasiona el tabaquismo.
¿Cómo se manifiesta?
Uno de los principales problemas del cáncer de pulmón es que los síntomas que provoca son poco específicos y muchas veces se presentan de forma tardía , provocando que el diagnóstico se efectúe cuando el tumor ya está extendido:
La tos: es el síntoma más común del cáncer de pulmón, muchas veces acompañada de expectoración. El principal problema es que la tos es uno de los síntomas más frecuentes en una consulta de salud. La principal causa de tos son los cuadros catarrales o infecciones respiratorias.
La expectoración con sangre : llamada hemoptisis. Es un síntoma más específico y que nos llevará a iniciar un estudio radiológico, aunque la principal causa de hemoptisis sigue siendo las sobreinfecciones pulmonares.
La falta de aire: llamada disnea. Es un síntoma poco específico y puede estar causado tanto por infecciones pulmonares como por problemas cardíacos, entre otros.
El dolor torácico : en el caso de tumores que afectan a la pared torácica o la pleura (membrana que recubre los pulmones). Puede ser uno de los síntomas iniciales de este tipo de tumores.
Existen otro tipo de síntomas menos frecuentes como pueden ser la disfonía (cambios de voz), la disfagia (dificultad para deglutir) o síntomas inespecíficos y comunes a cualquier tipo de cáncer como son la pérdida de peso, debilidad, cansancio, etc.
QUE NO TE ASUSTE LA TOS
En multitud de ocasiones nos encontramos con pacientes que presentan una tos de varios días de evolución tras un proceso catarral y que están asustados por si pudiera estar provocada por algún tipo de cáncer de pulmón. Tras un cuadro catarral, la tos puede prolongarse durante varias semanas, y hasta pasadas las ocho semanas consecutivas de tos, no podemos hablar de una tos crónica que nos llevaría a iniciar un estudio en profundidad.
¿Cómo se diagnostica?
Las principales pruebas que se suelen solicitar para diagnosticar un cáncer de pulmón son:
La radiografía de tórax. Es una prueba sencilla y con poca irradiación, pero los tumores de pequeño tamaño son difíciles de visualizar mediante esta técnica.
El TAC de tórax : es una muestra mucho más sensible para aquellos tumores de pequeño tamaño, pero también supone un aumento en la radiación sobre el paciente, por lo que su realización debe estar justificada en una duda diagnóstica.
La citología de esputo : consiste en el estudio microscópico del esputo del paciente para descubrir la presencia de células tumorales. Da un diagnóstico definitivo, pero es poco sensible.
La broncoscopia : consiste en la inspección visual del árbol bronquial a través de unas cámaras que se introducen en la vía respiratoria.
Otras pruebas diagnósticas útiles en ocasiones podrían ser el PET/TC o la RMN.
¿Cómo se trata?
En general el tratamiento se basará en cirugía, quimioterapia o radioterapia , y variará en función del tipo de célula que ocasiona el cáncer y de su extensión. Como norma general:
Por tipo celular : el cáncer de pulmón tipo “Célula pequeña” suele tener una buena respuesta a la quimioterapia por lo que, en general, no se trata con cirugía. Por el contrario, el cáncer de pulmón tipo “No célula pequeña” tiene una respuesta inferior a la quimioterapia, por lo que en muchos casos se valorará la posibilidad de realizar cirugía.
Por extensión : alrededor de uno de cada tres pacientes diagnosticados de cáncer de pulmón lo presentan de forma localizada, cosa que permite realizar una resección quirúrgica (extirpación). Sin embargo, otro tercio presentará diseminación tumoral a nivel ganglionar, por lo que, en general, se les recomendará quimioterapia y/o radioterapia. El tercio restante de pacientes tendrá metástasis al diagnóstico, por lo que el tratamiento se basará en quimioterapia.

Artículo especializado
Qué Debes Saber sobre el Desprendimiento de Retina
Disponer de la mayor cantidad de información posible acerca del desprendimiento de retina puede ayudar a minimizar sus consecuencias. ¡Atención a sus síntomas!
El desprendimiento de retina es una enfermedad ocular grave que se produce cuando la retina se separa de la pared interna posterior del ojo, dejando la zona de retina afectada sin riego sanguíneo y produciendo una pérdida indolora y progresiva de la visión. Inicialmente el desprendimiento puede ser localizado, pero sin tratamiento tiende a extenderse, afectando finalmente a toda la retina y, por tanto, acabando en ceguera completa de ese ojo.
¿Hay varios tipos?
Existen diversos tipos de desprendimiento de retina : regmatógeno, traccional, exudativo, mixto…
El primero es el más frecuente y se produce cuando la retina neurosensorial se separa del epitelio pigmentario al que en condiciones normales está adherida, acumulándose líquido en el espacio que queda entre ambas. Ocurre asociado a una rotura en la retina, habitualmente debilitada en la parte más periférica o con degeneración predisponente (60% de los casos), lo que permite que el vítreo licuado (degenerado) pase al espacio subretiniano.
Las roturas retinianas incluyen los desgarros y los agujeros; los primeros se desarrollan por tracción del vítreo sobre la retina y los segundos suelen tener un origen atrófico (desgaste).
SOBRE LA RETINA…
La retina es la porción más interna de la pared del ojo. Se sitúa en la parte posterior del globo ocular, tapizando su interior y es la responsable de la captación del estímulo luminoso. La componen varias capas, que, de una forma simplificada, se incluyen en dos subgrupos: la retina neurosensorial (más interna), en la que se encuentran las células sensibles a la luz y, por otro lado, el epitelio pigmentario (más externa).
El vítreo es una sustancia gelatinosa y transparente que ocupa 2/3 del volumen total del ojo (formando la cavidad vítrea). Está formado en el 99% de su composición por agua y limita en su parte anterior con el cristalino y en la posterior con la retina.
Frecuencia
La incidencia de esta enfermedad se estima en 1 caso de cada 10.000 habitantes por año. El desprendimiento de retina regmatógeno es el más frecuente y aparece sobre todo de forma bilateral (ambos ojos) y es más frecuente entre los 40-70 años de edad, con pico máximo en la quinta década de la vida. Puede aparecer por igual en hombres y en mujeres.
Factores de riesgo
Miopía: más del 40%de los desprendimientos de retina ocurren en ojos miopes, siendo mayor el riesgo cuanto mayor es la miopía (más dioptrías). Esto ocurre porque el desprendimiento posterior del vítreo y las degeneraciones en la retina más periférica son más frecuentes en miopes.
Cirugía previa de catarata complicada.
Existencia de tumores o inflamaciones intraoculares.
Si existe desprendimiento de retina en el ojo contralateral.
Si existe historia familiar (de primer grado) con desprendimiento de retina.
Los traumatismos oculares abiertos o cerrados pueden acompañarse de roturas en la retina, hemorragia vítrea y desprendimiento de retina (suponen el 10-12% de los casos de desprendimiento).
Algunas enfermedades generales (retinopatía diabética; Síndrome de Marfan; Síndrome de Ehlers-Danlos, etc).
Signos y síntomas
Hay dos síntomas que son apreciados en el 60% de los casos:
Síntomas premonitorios en forma de destellos luminosos (fotopsias): es el síntoma más importante, que refleja la existencia de tracciones sobre la retina. Suele aparecer cuando ya se ha producido la rotura retiniana.
Visualización de “moscas volantes ” (miodesopsias), que son puntos negros que se mueven al mover el ojo. Son causadas por las modificaciones del vítreo.
Otros síntomas son:
Defectos en el campo visual: tras un periodo de tiempo el paciente describe que aprecia como un “telón o cortina negra” en su campo visual. Se manifiesta pérdida de visión central cuando se ve afectada la mácula (territorio central de la retina con máxima capacidad visual). Se aprecia cuando ya se ha producido el desprendimiento de retina.
Distorsión de las imágenes y posterior disminución importante de la agudeza visual. Este síntoma aparece si se daña la zona central de la retina (mácula).
ATENCIÓN
Al ser una patología que no causa dolor, se pueden malinterpretar los síntomas como aparentemente inofensivos y retardar la consulta al oftalmólogo.
¿Cómo se diagnostica?
La aparición de los síntomas anteriormente mencionados debe ser motivo de consulta urgente con un oftalmólogo. Es muy importante hacer un diagnóstico lo más rápidamente posible.
El desprendimiento de retina se diagnostica revisando el fondo de ojo después de haber procedido a la dilatación de la pupila mediante fármacos específicos (para poder examinar la mayor superficie posible del interior del ojo).
¿Tiene tratamiento?
La cirugía debe ser lo más precoz posible para mejorar la tasa de éxito y el resultado visual final . Antes de proceder a la intervención, al paciente se le recomendará reposo adoptando medidas posturales específicas a fin de evitar o minimizar la progresión del desprendimiento, facilitando con ello el acto quirúrgico.
El objetivo principal será “cerrar” las roturas retinianas y devolver la retina a su posición natural . Para ello podemos recurrir a diferentes técnicas, algunas de las cuales resumimos a continuación:
Retinopexia neumática: se basa en el empleo de una burbuja intravítrea de gas expansible para adherir la retina y cerrar la rotura retiniana después. La técnica es ambulatoria en consulta o en quirófano, bajo anestesia tópica local y en condiciones de asepsia (desinfección). Posteriormente, se indicará un tratamiento postural de la cabeza de forma que la rotura esté en la posición más alta posible durante una semana, aproximadamente. Se cerrará la rotura a las 24 horas con láser.
Crioterapia: mediante una criosonda se congela el tejido situado alrededor de la zona desgarrada, tras lo cual se produce una cicatrización que actúa de forma protectora.
Anillo escleral: se realizará colocando una banda de silicona sólida alrededor de la capa más externa de la pared del ojo (la esclera) para mantener una presión externa sobre el globo ocular que facilite el cierre de la rotura.
Vitrectomía: en este caso, mediante un abordaje intraocular, eliminaremos la tracción del vítreo extrayendo el mismo del interior del ojo. A continuación, se realizará la retinopexia (sujeción, recolocación) con endoláser. Se realiza en quirófano, bajo anestesia local y con un instrumental muy sofisticado.
¿Se puede prevenir?
Las alteraciones preexistentes en la retina periférica (desgarros retinianos, agujeros atróficos, etc.) deben ser tratadas cuanto antes para evitar que ocasionen problemas más graves, principalmente mediante técnicas de fotocoagulación con láser o crioterapia.
En los pacientes con desprendimiento de retina en un ojo debe explorarse siempre el ojo contralateral sano con el fin de buscar y tratar de forma preventiva las degeneraciones existentes.
¿Qué pronóstico tiene?
El pronóstico visual depende de si existe o no desprendimiento de la mácula. Si la mácula no se ve afectada probablemente se mantendrá la agudeza visual preoperatoria o tan sólo ligeramente disminuida. Después de la cirugía, la visión suele ir mejorando de forma gradual durante un periodo de días o semanas. Si, por el contrario, la mácula está afectada, el resultado dependerá del tiempo de evolución.
Se consigue la solución del problema en el 95% de los casos con un diagnóstico precoz y una buena cirugía. Si la cirugía tarda más de una semana en realizarse, la posibilidad de recuperar la visión es mucho menor. En este sentido, es especialmente importante recordar que la población en riesgo se someta a revisiones oculares periódicas, como mínimo una vez al año.

Artículo especializado
Para Qué Sirve la Cámara Hiperbárica
¿Sabías que al administrar oxígeno puro en cámara hiperbárica, la sangre transporta unas 22 veces más oxígeno que en condiciones normales ? Además, en lugar de ser transportado por los glóbulos rojos (hematíes), el oxígeno circula de forma libre por la sangre y llega a lugares donde no llegan los hematíes cuando se respira oxígeno a presión atmosférica.
El tratamiento con oxigenoterapia en cámara hiperbárica se basa en el aumento de la presión parcial de oxígeno en los tejidos, facilitando la difusión de éste. El aire que se respira habitualmente tiene un 21% de oxígeno en su composición (a nivel del mar y con una presión atmosférica estándar). El oxígeno se transporta en sangre mediante dos mecanismos: a través de la unión a la hemoglobina (que se encuentra en los glóbulos rojos) y directamente disuelto en el plasma.
Si se aumenta la presión atmosférica se puede ampliar muchísimo la cantidad de oxígeno disuelto en plasma. Al aplicarse a una presión superior, el oxígeno se disuelve y se transporta más fácilmente en sangre, consiguiéndose una hiperoxigenación de todas las células del cuerpo . Esto efecto se traduce en los tejidos en un aumento de la regeneración celular, de la acción bactericida y de un aumento de la vascularización.
Tipos de cámaras hiperbáricas
La terapia con oxígeno a presión superior a la atmosférica se administra en las llamadas cámaras hiperbáricas.
Cámaras multiplazas , con dos o más compartimentos tanto para el paciente como para el equipo médico.
Se presurizan con aire comprimido, permiten que varios enfermos, al mismo tiempo, respiren oxígeno puro con una mascarilla.
Cámaras monoplaza , diseñada para un único paciente.
Se presurizan hasta alcanzar la presión establecida por el especialista en medicina hiperbárica y respirando oxígeno puro en un tiempo de exposición de alrededor de 60 minutos como promedio.
Consejos prácticos
Se puede experimentar un poco de calor en el cuerpo a medida que se presuriza la cámara, seguido de una sensación en los oídos similar a las que se siente en los vuelos en avión. Estas molestias se pueden solucionar deglutiendo repetidas veces, chupando algún caramelo, masticando chicles, bostezando o por medio de la maniobra de Valsalva.
El paciente debe entrar a la cámara hiperbárica con ropa 100% de algodón, sin accesorios ni objetos metálicos, sin aceites, cremas ni maquillaje de ningún tipo en el cuerpo.
¿Cuándo está indicada?
La oxigenoterapia hiperbárica se ha mostrado eficaz en aquellas situaciones en las que se requiere un mayor aporte de oxígeno que no llega a través de los hematíes cuando se respira oxígeno a presión atmosférica.
Actualmente, según la Sociedad Española de Medicina Hiperbárica, las principales enfermedades en las que está indicada por haberse demostrado su eficacia clínica son:
Embolismo gaseoso (burbujas de gas en la sangre) típico en los accidentes de buceo.
Envenenamiento por monóxido de carbono que es el que se produce en los incendios, con las cocinas o estufas en mal estado.
Problemas vasculares y úlceras cutáneas. Situaciones en las que hay destrucción de tejido y mala cicatrización.
Esto ocurre en diferentes enfermedades como la gangrena gaseosa, insuficiencia/isquemia arterial, osteomielitis, lesiones de tejidos por radioterapia, lesiones por aplastamiento, isquemias traumáticas agudas, anemias muy severas, abcesos intracraneales, infecciones de tejidos blandos, injertos y colgajos cutáneos con mala evolución, retrasos en la cicatrización (pacientes diabéticos), cegueras y sorderas súbitas por embolia o trombosis, riesgo de infección en fracturas abiertas.
En oncología, la principal indicación es en las complicaciones postradioterapia . Los tejidos que rodean a las zonas tumores irradiadas pueden verse afectadas, quedando desvitalizadas -como consecuencia de la pérdida de vasos sanguíneos- y que se dañan con facilidad: por ejemplo, la cistitis rádica (tras tumores de vejiga), proctitis rádica (tras tumores del recto) y osteoradionecrosis de mandíbula.
¿Cuáles son los posibles riesgos y complicaciones?
Se considera un tratamiento seguro , pero debe administrarse según el protocolo establecido por las sociedades médicas . Generalmente, se recomiendan pautas de tratamiento con duración inferior a tres horas y con una presión máxima de 3 ATA.
La oxigenoterapia puede dar las siguientes complicaciones :
Lesiones pulmonares debido a barotrauma que son aquellas provocadas por aumento de la presión del aire: neumotórax (entrada de aire entre las dos hojas de la pleura), embolismo.
Dolor en los senos frontales.
Lesiones de oído medio, también por el mecanismo de barotrauma.
Lesiones oculares: favorece el empeoramiento de cataratas ya existentes y aumento transitorio de la miopía (se corrige espontáneamente al finalizar el tratamiento).
Síntomas neurológicos (crisis epilépticas), son reversibles tras retirada la de la mascarilla.
¿Cuándo no debe administrarse?
No existe ninguna contraindicación absoluta para el uso de la oxigenoterapia, y hay que valorar en cada caso el beneficio-riesgo del paciente y estar atento para cualquier complicación potencial en cualquier paciente.
¡NO ES ANTIENVEJECIMIENTO!
En personas sanas no hay ninguna evidencia científica sobre su efecto en el envejecimiento . Los expertos alertan contra la utilización por personal no médico de cámaras hiperbáricas no homologadas. Los bares y los refrescos de oxígeno que se han postulado como tratamientos rejuvenecedores son simplemente un reclamo al consumidor sin ninguna evidencia científica.
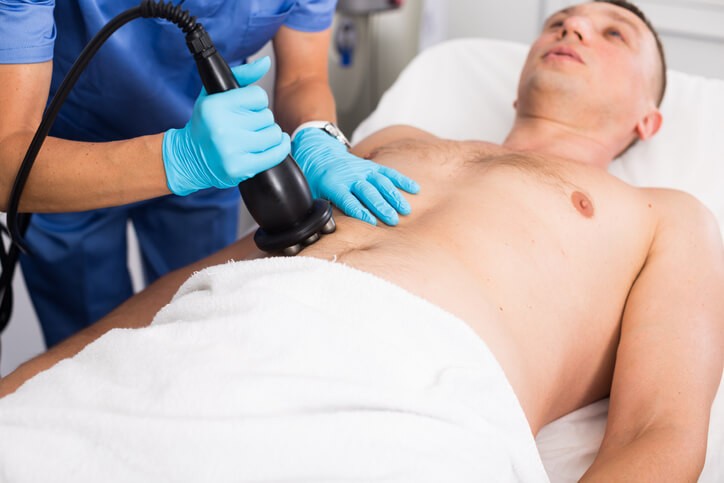
Artículo especializado
Tratamiento, Beneficios y Contraindicaciones de la Cavitación Médica
La cavitación es una de las mejores técnicas para eliminar la celulitis y mejorar la piel de naranja que no logra resultados sólo con el ejercicio físico. Este procedimiento acaba con la grasa localizada, difícil de eliminar, propia de la zona de muslos, abdomen y flancos. Es un procedimiento que debe realizarse por un profesional en el centro correspondiente.
¿Cómo funciona?
La cavitación médica es un procedimiento nuevo, desarrollado para reducir las áreas grasas del cuerpo de forma no invasiva . Se lleva a cabo aplicando ultrasonidos de baja frecuencia que permiten reducir la grasa localizada mediante la formación de burbujas, y darle mayor definición del contorno al cuerpo, sin necesidad de pasar por el quirófano. Funciona mediante ondas de ultrasonidos localizados , que concentran energía en un determinado tejido corporal, rompiendo las células grasas, sin dañar las estructuras adyacentes. La grasa se transforma en líquido, que se elimina naturalmente del organismo. Los efectos son bien tolerados, y se mantienen a largo plazo, dando tonicidad a las zonas que carecían de ella.
¿Qué máquinas se utilizan?
Al ser un procedimiento no quirúrgico, utiliza máquinas de ultrasonidos que emiten pulsos localizados hacia los tejidos , pasando una sola vez por cada punto. Según la cantidad de grasa corporal presente en cada área marcada a tratar, se emitirá un tipo de onda sonora especifico, lo cual varia de paciente a paciente, ya que es un tratamiento que debe individualizarse. Se deben realizar mínimo 8 a 12 sesiones, espaciadas un mínimo de cuatro días y un máximo de un mes. Es importante que la persona esté bien hidratada antes de realizar la sesión, y también que realice masajes de drenaje linfático posteriores para potenciar el efecto de la misma. Se aconseja que, durante todo el tratamiento, se continúe con un estilo de vida saludable, donde no haya grandes cambios en el peso corporal.
Es un tratamiento sencillo e indoloro , y que permite obtener una reducción de 2 a 3 cm cada tres sesiones. Se considera un tratamiento confortable, ya que las sondas están diseñadas para no recalentarse y generar aumento de temperatura en las zonas tratadas.
Efectos, riesgos y contraindicaciones
El proceso se produce por cuatro tipos de efectos .
En primer lugar, se producen efectos micro-mecánicos, a nivel de las macropartículas de grasa, en las que se genera una destrucción.
En segundo lugar, se generan efectos térmicos, aumentando parcialmente la temperatura de la zona a tratar por el paso de los rayos de ultrasonido.
En tercer lugar, se produce un efecto químico, que estimula la aceleración de la modificación química de los tejidos.
Finalmente, un efecto de cavitación, donde las microburbujas que produce, al entrar en contacto con las ondas sonoras, estimulan la muerte celular de las células grasas.
Aunque no es un procedimiento invasivo, pueden aparecer complicaciones a nivel de la piel, como quemaduras y ampollas, o pequeñas acumulaciones liquidas como los seromas. Debe realizarse en pacientes sanos. Antes, se debe hacer una historia exhaustiva del paciente, descartando embarazos, enfermedades cardiacas, vértigo o alteraciones auditivas, así como también epilepsia, esquizofrenia o fobias.
Cavitación facial / radiofrecuencia
La cavitación facial permite obtener una mejoría de la piel , otorgando mayor firmeza y tensión a nivel de la dermis, y consiguiendo que las fibras de colágeno se acorten y tensen la piel, y se atenúe la flacidez. Actúa en las arrugas locales, tanto en rostro, como en párpados y zona la “papada” y, al ser un método no invasivo, la recuperación es rápida y sólo se deberá proteger de los rayos solares, con cremas de alta protección.
Las pacientes en las que se ven los mejores resultados es en las que tienen de 35 a 65 años. Asimismo, se debe evitar realizar estos procedimientos en personas que hayan sufrido recientemente parálisis faciales, peeling químico, implantes dentales, hilos de oro o tatuajes.

Artículo especializado
Cenas Saludables en Familia
Compromisos, reuniones, la escuela, el gimnasio… todos los miembros de la familia tenemos mil gestiones durante el día y, cuando llega la hora de cenar la pereza suele apoderarse de nosotros propiciando cenas rápidas a base de pan con embutido y productos procesados que tenemos en nevera o congelador. ¿No os suena? Aprovechar la última comida del día para conectar con la familia y hacer una cena saludable, libre de distracciones, es fundamental para nuestra salud tanto física como emocional ya que ayuda a prevenir el sobrepeso y otros trastornos de la conducta alimentaria, sobre todo en adolescentes.
Por eso, es muy importante recuperar y transmitir a los hijos la importancia de una cena saludable, sin presión y sin agobios, haciéndoles partícipes del proceso de elaboración de los platos (batir huevos, hacer una vinagreta para la ensalada, etc.) para que aprecien mejor el resultado final y disfruten de una comida saludable y real, lejos de pizzas, frankfurts y hamburguesas.
¿Qué alimentos debe contener una cena saludable?
Según la guía que representa el “plato de Harvard”, creado por expertos en nutrición de la escuela de salud pública de Harvard, una comida saludable debe contener los siguientes alimentos, ya sea combinados en un mismo plato o en 2 platos (primer plato + segundo plato)
Vegetales : ensaladas, verduras al horno, cocidas, purés de verduras, conservas de verduras… deben representar casi el 50 % de nuestra cena ya que son una gran fuente de minerales y vitaminas antioxidantes y fibra que resultan indispensables para el buen funcionamiento de nuestra microbiota intestinal. Además, podemos complementar estas verduras con tubérculos (patatas, chirivía o boniato) ya sea añadidos al puré, asados al horno o hervidos.
Proteínas saludables : representando el 25% de nuestro plato, entre las proteínas más saludables encontramos las legumbres (¡sí! se pueden comer en la cena sin problemas), carne magra de aves (pollo, pavo), pescados blancos (merluza, bacalao, rape…), pescados azules (salmón, atún, caballa… incluso en conserva y en aceite de oliva) y huevos (en forma de tortilla o huevo duro). Las carnes rojas se deberían consumir en menor frecuencia (1 vez a la semana) y, por último, se recomienda evitar al máximo el consumo de carnes procesadas (salchichón, chorizo, mortadela, Frankfurt, fiambres, bacon, etc.)
Cereales integrales: arroz, quinoa, trigo sarraceno, pan, pasta… son cereales que deberíamos consumir en su forma integral ya que nos aportarán un plus de fibra que puede ayudar a mejorar nuestro tránsito intestinal. Además, al ser alimentos ricos en hidratos de carbono, nos pueden ayudar a complementar las necesidades energéticas de nuestro día a día, sobre todo si realizamos actividad física. La cantidad de cereales representada en la cena dependerá mucho de nuestra edad, peso, y nivel de actividad física, aunque se recomienda, en líneas generales, que este grupo de alimentos ocupe ¼ de nuestro plato ya sea como acompañamiento de carnes, pescado, huevos, legumbres o mezclándolos con vegetales (por ejemplo, una ensalada de arroz con pollo).
Grasas saludables: al cocinar o aliñar nuestros platos, es importante utilizar aceite de oliva y evitar las grasas saturadas presentes en pizzas, panecillos de hamburguesa u otros platos precocinados. Además, una buena forma de incluir grasas saludables a nuestra cena es añadiendo frutos secos, semillas o incluso aguacate en las ensaladas.
Frutas o lácteos: estos alimentos son de libre elección en el postre ya que dependerá de cuántas raciones de frutas o lácteos hayamos consumido a lo largo del día. Por lo general se recomienda un consumo de unas tres raciones de fruta diarias y no hay un consenso sobre el consumo ideal de lácteos, aunque puede variar entre unas dos a cuatro raciones de lácteos (yogur, leche o queso). En definitiva, el postre de la cena puede ser el “comodín” que te permita llegar a estas ingestas recomendadas
¿Cómo organizar cenas saludables en familia?
El principal problema que nos encontramos a la hora de realizar una cena familiar equilibrada es la falta de planificación. Sin ella, el tiempo juega en nuestra contra y será más probable recurrir a la opción fácil que no siempre es la opción más sana. Por ello, mis dos recomendaciones principales son:
Hacer un plan semanal de cenas para poder mantener una alimentación equilibrada
Teniendo en cuenta que ya hemos mencionado qué grupos de alimentos deben formar parte de un plato saludable, el siguiente paso es planificar las cenas en base a lo que hayamos comido ese día, ya que se recomienda variar la alimentación e intentar no repetir el mismo grupo de alimentos que hemos tomado al mediodía. Por ejemplo, si hemos comido paella con pescado y ensalada, sería interesante no repetir paella y decantarnos por algún plato que contenga huevo o pescado o carne y un acompañamiento de vegetales a los que podemos añadir patata.
A grandes rasgos, un ejemplo de esquema semanal de cenas podría ser el siguiente:
LUNES
MARTES
MIÉRCOLES
JUEVES
VIERNES
SÁBADO
DOMINGO
Ensalada de tomate
Tortilla de patatas
Crema de calabacín, patata y puerros
Filetes de merluza al horno
Caldo de verduras con pasta
Pollo a la plancha con ensalada
Salteado de verduras con arroz integral
Salmón al horno
Ensalada verde con huevo duro
Pizza casera con tomate y mozarela
Ensalada con pollo, picatostes de pan y pasas
Humus de garbanzos con palitos de zanahoria
Wok de verduras variadas (pimiento, calabacín, cebolla, etc.) con gambas y fideos de arroz
Disponer de alimentos básicos que nos permitirán ahorrar tiempo y energía a la hora de elaborar nuestras cenas semanales. Hay ciertos alimentos que deberíamos tener siempre presentes en la nevera o en nuestra despensa que nos pueden facilitar la tarea de “ponerse a cocinar” cuando llegamos cansados a casa:
Bolsas de ensalada preparadas y tomates cherry : imprescindibles en todas las comidas ya que además de aportar vitaminas minerales y fibra, son un recurso muy fácil para acompañar carnes o pescados. Además, añadiéndole huevo duro o una lata de atún tendremos un plato único completo.
Verduras en conserva, congeladas o preparadas para microondas: ideales para complementar la ensalada.
Verduras y hortalizas frescas : se pueden tener preparadas en forma de pisto (calabacín, cebolla, zanahorias, berenjenas), hervidas (menestra) o al horno el día anterior. En todo caso también podemos optar por consumir verduras en forma de purés que podemos congelar en raciones individuales.
Legumbres cocidas o tofu : se pueden añadir a la ensalada o hacer cremas tipo humus para acompañar verduras, obteniendo así un plato completo. Estas opciones son ideales si hay algún miembro de la familia que sea vegetariano
Arroz, quinoa o pasta integrales : se pueden comprar en raciones individuales y preparadas para cocer al microondas o se pueden cocer el día anterior y guardarlas en la nevera
Conservas de pescados en aceite de oliva : el atún, la ventresca o las sardinas son una fuente de proteínas y ácidos grasos omega 3 y un recurso muy fácil para completar una ensalada. No obstante, el atún en lata puede contener pequeñas cantidades de mercurio así que se recomienda no superar un consumo de 10 latas pequeñas (52 gramos) semanales
Huevos cocidos : son un comodín ideal para potenciar la proteína en las ensaladas. Para optimizar el tiempo, se pueden cocer varios huevos a la vez, marcar la cáscara con un rotulador para identificar que están cocidos y guardarlos en la nevera. Hay que tener en cuenta que deben ser refrigerados no más tarde de dos horas después de su cocción y que los podemos conservar en la nevera una semana como máximo.
Pescado y marisco : lo ideal es tener este grupo de alimentos congelados y descongelarlos en la nevera de un día para otro. Además, en los supermercados podemos encontrar mariscos precocidos como gambas que se pueden descongelar al momento o añadir directamente a la sartén para mezclar con verduras o añadir a las ensaladas.
Carnes : el pollo y el pavo a la pancha se pueden incluir en las ensaladas o cocinarlos al horno con verduras obteniendo así un plato completo
Fruta y yogures : además de utilizarlos como postre, se pueden incluir en ensaladas. Si no sabes qué tomar de postre, recuerda que hay que consumir al menos tres piezas de fruta al día, así que, partiendo de esta recomendación, haz un repaso mental y si te falta añadir una ración de fruta ¡lo puedes hacer en el momento de la cena sin problemas!

Artículo especializado
La Dentición de tu Bebé
Llamamos dentición al proceso de salida de los dientes de leche en el bebé . Es un gran momento, tanto para los niños, ya que pueden empezar a masticar, como para los padres, que viven con ilusión otro hito en el crecimiento de su hijo.
El proceso de dentición
Su inicio en muy variable. La salida de los dientes puede empezar entre los tres y los 12 meses de vida, aunque lo más habitual es que se inicie alrededor de los seis meses .
Los primeros dientes que aparecen son los incisivos inferiores (dientes localizados en la parte central e inferior de la encía). En uno o dos meses más, erupcionan los incisivos superiores y les siguen los cuatro incisivos laterales, dos superiores y dos inferiores.
A partir del año salen los molares de leche, imprescindibles para triturar los alimentos. Los últimos dientes en salir son los colmillos o caninos y los segundos molares , a partir del año y medio y dos años.
El total de dientes de leche que han de salir son 20 y la mayoría de los niños los tienen todos al cumplir los tres años . Son dientes que acabarán cayendo durante la infancia y serán reemplazados por los dientes definitivos.
Tabla de dentición bebé: cuándo salen y cuándo se caen los dientes
Estos datos son sólo una media de edad. Hay bebés que empiezan el proceso antes.
Dientes superiores
PIEZAS
SALEN
CAEN
Incisivo central
8-12 meses
6-7 años
Incisivo lateral
9-13 meses
7-8 años
Canino o colmillo
16-22 meses
10-12 años
Primer molar
13-19 meses
9-11 años
Segundo molar
25-33 meses
10-12 años
Dientes inferiores
PIEZAS
SALEN
CAEN
Incisivo central
6-10 meses
6-7años
Incisivo lateral
10-16 meses
7-8 años
Canino o colmillo
17-23 meses
9-12 años
Primer molar
14-18 meses
9-11 años
Segundo molar
23-31 meses
10-12 años
¿Un bebé puede nacer con dientes?
Algunos bebés, en muy pocas ocasiones, pueden nacer con alguna pieza dental o les puede salir en las primeras semanas de vida.
La mayoría de veces no se hace nada y sólo se extraen si interfieren con la alimentación o están muy sueltos y pueden suponer un riesgo de asfixia para el bebé.
¿Existen las molestias de dentición?
Este tema preocupa mucho a los padres, ya que muchos observan que el bebé suele babear más o tiende a morder objetos. La máxima preocupación es si la salida de los dientes causa dolor. Pero, en general, la erupción dental no debe causar demasiadas molestias al bebé .
Quizás, la sensación extraña que puede acompañar a dicho proceso puede ocasionar un ligero malestar o irritabilidad en los niños. Debido a esto, pueden verse afectados los patrones de sueño.
Evidentemente, si el bebé muestra s ignos de dolor importantes, se debe acudir al pediatra para valorar qué es lo que está provocando este malestar tan intenso.
Otro de los mitos es que la dentición ocasiona fiebre y diarrea. Esto no es del todo cierto. Las encías, durante la salida de los dientes, están más sensibles y ligeramente hinchadas y esto, por sí solo, no puede justificar la presencia de febrícula (temperatura menor de 37,9ºC). Si observas que, durante la erupción dental, el bebé presenta fiebre de más de 38ºC, conviene que acudas al pediatra porque se debe diagnosticar el foco infeccioso. Lo más lógico es que tengamos, al mismo tiempo, una infección y la erupción dental.
¿Qué podemos hacer durante la salida de los dientes?
El tiempo lo cura todo y la salida de los dientes acabará en un momento u otro, pero podemos ayudar al bebé de las siguientes maneras:
Si el bebé presenta mucho babeo : limpiar y mantener seca la cara y el cuello para evitar irritaciones. Si ya se han producido, aplicar una crema adecuada para tratarlas. Tu pediatra puede aconsejarle.
Si las encías se ven muy enrojecidas e inflamadas : podemos frotarlas con el dedo limpio, aplicando un suave masaje u ofrecer un objeto para morder (mordedor de silicona). Lo podemos tener en la nevera, ya que el frío ayudará a calmar las molestias. Debe ser lo suficientemente grande para que el bebé no se lo pueda tragar ni asfixiarse. Hay que lavarlo con agua y jabón después de cada uso. Se pueden comprar aros de dentición específicamente diseñados para este fin, pero se desaconseja que estén rellenos de líquido. Este tipo de aros se enfrían siempre en la nevera, nunca en el congelador. Tampoco se deben hervir ni esterilizar, ya que los cambios extremos de temperatura podrían dañar el plástico y provocar pérdidas de sustancias químicas perjudiciales para el bebé. Lavarlos con agua y jabón es más que suficiente.
Si el bebé está irritable : consulta con tu pediatra si puedes ofrecer algún analgésico para aliviar las molestias si éstas son excesivas y se ha descartado otra causa de las mismas. No se aconseja aplicar fármacos sobre las encías, ni cremas anestésicas, ni geles de dentición, así como tampoco frotarlas con alcohol.

Artículo especializado
Cómo detectar y tratar la bulimia
Podemos afirmar que el acto nutricional no es sólo una experiencia de gratificación fisiológica , sino que también es, en su origen, una experiencia emocional de sosiego y conexión con el otro. Ser nutrido es ser cuidado y, en última instancia, querido.
A medida que vamos creciendo aprendemos a establecer una relación autónoma con la alimentación y pasamos a ser nosotros quienes nos auto-nutrimos, comprando, preparando e ingiriendo la comida que consideramos apropiada. El acto de nutrirse tiene una función relacional, hetero y auto reguladora de las emociones , por lo tanto, es susceptible de verse alterado y desorganizado cuando aparecen conflictos emocionales y psicológicos. Vamos a hablar a continuación de uno de los trastornos de la alimentación más conocido, la bulimia nerviosa.
¿Qué es la bulimia?
El síndrome bulímico es un trastorno que se caracteriza por un modelo de alimentación anormal , con episodios de ingesta voraz seguidos de la puesta en marcha de maniobras que buscan eliminar las calorías ingeridas, acto seguido la persona que padece dicho síndrome se siente malhumorada, triste y eventualmente con sentimientos de autocompasión . El trastorno presenta su máxima incidencia entre mujeres de 19 a 25 años.
Podemos diferenciar dos tipos de bulimia:
El purgativo : la persona se provoca regularmente el vómito o usa laxantes, diuréticos o enemas en exceso.
El tipo no purgativo: se utilizan otras conductas compensatorias inadecuadas, como el ayuno o el ejercicio intenso.
¿Cómo lo detectamos?
Hay una serie de rasgos característicos de este síndrome que pueden ayudarnos mucho si sospechamos que algún familiar o amigo puede padecerlo. Nos centraremos en tres grandes criterios:
Preocupación continua por la comida acompañada de un deseo irrefrenable por comer, finalmente, la persona acaba por sucumbir a este deseo presentando periodos de gran ingesta en poco tiempo.
Intentos por contrarrestar el aumento de peso mediante métodos purgativos y no purgativos tal y como hemos explicado anteriormente.
La persona que padece el trastorno se fija como objetivo el alcanzar un peso por debajo del adecuado para su masa corporal y/o del que tenía antes de padecer el síndrome, por la misma naturaleza de la patología, dicho objetivo no se consigue mientras dure la misma.
A diferencia de la anorexia nerviosa, la persona que padece bulimia presenta una conducta desordenada en relación a la alimentación, más adelante también en otros aspectos de la vida. La frecuencia y duración de los atracones varían en función del estado de ánimo.
Tratamiento
Dimensión física : lo que buscamos con el tratamiento es mejorar el estado físico del paciente, lo que incluye la estabilización del peso, rehidratación y normalización electrolítica, corrección de anomalías físicas (erosión de la mucosa digestiva, dilatación gástrica, etc.).
Dimensión psicológica : tratar eventuales trastornos de la personalidad concomitantes, evitar abusos de sustancias y/o conductas auto-líticas, así como la facilitación de la toma de conciencia y resolución de los conflictos emocionales que causan la inestabilidad del estado de ánimo.
¿Qué podemos hacer para ayudar a la persona que lo padece?
Comprensión, compasión, vinculación, escucha, apoyo… son algunas de las actitudes que debemos tener hacía la persona que padece dicho trastorno. Si verdaderamente queremos ayudarle, es importante que nos sienta capaces de recoger y contener su angustia sin juicio . Hemos de tener en cuenta que, aunque las causas que producen el trastorno son variadas, éste no es más que una disfuncional manera de lidiar con algún tipo de sufrimiento mental y emocional. Por ello, hemos ser capaces de apoyar a la persona e insistir en la importancia de la búsqueda de ayuda externa para que se lleve a cabo un adecuado tratamiento.
Consideraciones
Es muy importante tener en cuenta que la persona que sufre dicho trastorno necesita una ayuda que aborde su forma de vivir, de sentir, de relacionarse y que incida en cambiar los aspectos de la vida y de su mundo interno que se le hacen más dolorosos e inaceptables. Por ello, si tenemos un caso cercano debemos asegurarnos de que el profesional que lo abordará está capacitado para tratar dicho trastorno.

Artículo especializado
Hábitos Saludables para Combatir la Cefalea
La cefalea (dolor de cabeza) es una de las dolencias más frecuentes en la sociedad . ¿Quién no ha sufrido alguna vez un dolor de cabeza? Pero no por ello hay que dejar que nos atormente. Existen recomendaciones que te ayudarán a mitigarla.
En efecto, entre el 85 y 90% de la población ha vivido un episodio de cefalea en el último año, según estima la Sociedad Española de Neurología (SEN). Además, es el principal motivo de consulta en esta especialidad y afecta en mayor medida a las mujeres (en concreto, al 92% de la población femenina frente al 73% de la masculina). Además, padecen migraña o jaqueca, sobre todo, personas de entre 20 y 30 años, en plena edad laboral. Y si la padecen aproximadamente 3’5 millones de españoles, de éstos, más de 1 millón la sufren de forma crónica, es decir, tienen dolor de cabeza durante más de 15 días al mes.
¿Cuántos dolores de cabeza hay?
Existen numerosos tipos distintos de cefalea que conviene diferenciar. Las más destacables son:
Migraña. Es una enfermedad crónica de causa no claramente conocida, atribuida clásicamente a procesos de alteración de los vasos sanguíneos cerebrales, que se manifiesta por crisis o ataques repetitivos de cefalea, que suelen tener unas ciertas características en cuanto a su duración (entre 4 y 72 horas), tipo de dolor (pulsátil o “palpitante”) o existencia de molestias con la luz (fotofobia) o el ruido (sonofobia), entre otros aspectos. Suele tener una localización frontal o temporal (a ambos costados del cráneo), o retro-ocular (detrás de los ojos) y puede acompañarse de náuseas, vómitos, mareos de tipo vertiginoso… Las migrañas a su vez se subdividen en:
Migraña sin aura (80% de los casos).
Migraña con aura : el aura es un “aviso” que puede ocurrir desde varias horas a dos días antes del inicio del dolor de cabeza y dura menos de 60 minutos, dejando paso a la aparición del propio dolor de cabeza. Un ejemplo de “aura” sería la visión de una luz en forma de zig-zag que se va abriendo a medida que migra del centro del campo visual a la periferia del mismo para, finalmente, desaparecer. Destacar que el aura puede ser muy escandalosa, pero en la gran mayoría de las veces se trata de procesos de disfunción neural y vascular benignos.
Cefalea tensional. Este tipo de dolor de cabeza es causado por tensión muscular en los hombros, el cuello, el cuero cabelludo y la mandíbula. Puede estar relacionado con el estrés, la depresión, la ansiedad, un traumatismo craneal o por tener la cabeza y el cuello en una posición mantenida y poco adecuada. Tiende a darse en ambos lados de la cabeza, pero a menudo comienza en la parte posterior y se propaga hacia adelante, hacia la zona frontal. El dolor puede ser sordo u opresivo, como una banda apretada y es posible que vaya acompañado de dolor y rigidez en los hombros, cuello y/o mandíbula, con hipersensibilidad a la palpación en la exploración física.
Cefalea en racimos. Se caracteriza por dolores muy severos estrictamente unilaterales (sólo un costado facial) en región frontal y alrededor del ojo, con una duración de 15 minutos a tres horas, asociados a enrojecimiento ocular o cutáneo-facial, lagrimeo, congestión nasal, sensación de taponamiento de oídos, sudoración frontal o facial, inquietud o agitación…
Cefalea numular . Es un dolor continuo de leve a moderada intensidad, presente en una zona bien delimitada, de pequeño tamaño y forma circular o elíptica de la cabeza. El patrón temporal es variable, y se han descrito remisiones espontáneas y exacerbaciones dolorosas.
Otros. Puede ser una cefalea atribuida a traumatismos cráneoencefálicos, a trastornos intracraneales vasculares y no vasculares, cefaleas atribuidas a infección sinusal, a administración/supresión de una sustancia, cefalea secundaria a trastorno psiquiátrico… entre otros múltiples ejemplos.
¿Cuál es su causa?
No por su elevada frecuencia de aparición está más clara su causa. En la actualidad, el d iagnóstico correcto y el adecuado tratamiento es uno de los desafíos más severos a los que se enfrenta la medicina.
En muchas ocasiones, el dolor de cabeza tiene una causa bastante simple , como por ejemplo el hecho de haber trasnochado demasiado, haber ingerido más cantidad de alcohol de la deseable, haber pasado excesivo tiempo expuesto al sol o el estrés ante un examen importante, pero en otras ocasiones es un problema más complejo. Conocer los factores que se considera que predisponen a sufrir una cefalea puede ayudar a evitarla:
Genética : muchas personas que sufren migraña cuentan con antecedentes familiares que también la padecen. Los niños también la pueden sufrir.
Cambios hormonales : esto explica que, en determinadas etapas de la vida, la migraña sea más común, como es el caso de la etapa de pubertad-adolescencia o durante el periodo menstrual. También puede estar influenciado por la toma de medicación anticonceptiva.
Determinados alimentos : alimentos excitantes como el chocolate; alimentos con tiramina como el vino tinto, quesos curados, pescados ahumados o ciertas legumbres; carnes con nitratos o lácteos son algunos ejemplos.
Cambios en el ciclo del sueño .
Estrés : se pueden producir dolores de cabeza durante la crisis de estrés o, incluso, cuando éste ya ha pasado, apareciendo dolores de cabeza post-estrés.
Otros factores: cambios de altitud, de clima, oscilaciones bruscas de temperatura, exposición a luces u olores intensos, deshidratación corporal…
Decálogo de estrategias de vida saludable para combatir la cefalea
Óptimo descanso . las cefaleas pueden ser la consecuencia de un trastorno del sueño, que puede tratarse. Se trata de dormir las horas suficientes durante la noche (si es posible, ocho horas al día), pero también de garantizar que ese tiempo se invierta en un sueño de calidad. Descansa en una habitación tranquila y oscura y adopta hábitos para descansar bien.
Alimentación saludable.
Suficiente hidratación corporal , lo que implica beber agua frecuentemente a lo largo del día.
Practicar ejercicio físico regularmente . Es el mejor remedio contra el dolor. No sólo atenúa el estrés, sino que rebaja tensiones posturales y mejora la circulación. Además, las endorfinas que se liberan durante el ejercicio físico actúan como una anestesia natural, con un efecto similar al de la morfina.
Evadirse . Uno de los objetivos principales para dar carpetazo a la jaqueca es reducir el estrés, aunque sean 10 minutos tan sólo al día. Es posible buscar un momento para ti, meditar o realizar alguna actividad que te guste. Aprender a gestionar el tiempo te ayudará a elevar tu nivel de satisfacción personal.
Masajes y aceites esenciales . En las cefaleas provocadas por tensiones musculares o vasculares, los masajes pueden ser útiles para aliviar tensiones en una zona concreta. Los aceites esenciales de menta, albahaca o romero también ayudan a combatir el dolor, y esta propiedad los convierte en un complemento ideal tanto para un masaje como para una actividad de relajación.
Práctica de yoga. Algunas posturas de esta modalidad han sido descritas como beneficiosas para el tratamiento del dolor de cabeza. Cabe destacar también el taichí o el mindfulness.
Acupuntura e hipnosis. De entre las terapias alternativas, estas dos son las más utilizadas para combatir las cefaleas. No obstante, la SEN advierte de la dificultad para determinar la efectividad real de estas técnicas.
Uso del jenjibre . Este producto, al cual se le atribuyen propiedades antiinflamatorias, puede ser útil en el tratamiento de las cefaleas causadas por el estrés. Se puede tomar en forma de infusión, a la que puedes añadirle miel y/o limón.
Fármacos. Analgésicos como el paracetamol, el ibuprofeno o el metamizol se usan de forma recurrente para calmar el dolor de cabeza. No obstante, se aconseja que se consulte al médico para que indique la opción más adecuada en cada caso, pues la automedicación puede comportar problemas sobreañadidos. Existen otros grupos específicos de medicamentos para el tratamiento de la migraña (siempre bajo supervisión médica) como son los “triptantes”, los antidepresivos, los anticonvulsivos o los antihipertensivos, entre otros. Una medida no farmacológica que puede ayudarte, puede ser, por ejemplo, la aplicación de paños fríos sobre la cabeza durante las crisis.

Artículo especializado
Qué es la Celulitis y Cómo Eliminarla
Ni siquiera las delgadas se libran, y es que l a celulitis afecta al 85% de las mujeres , sobre todo a partir de los 30 años, aunque puede aparecer desde la pubertad. La llamada “piel de naranja” trae de cabeza a muchas féminas, que sólo esperan dar con la solución que la elimine para siempre. Pero, ¿es posible?
¿SABÍAS QUE…?
Este artículo trata sobre la celulitis estética que tanto nos preocupa a las mujeres, pero también existe el concepto de celulitis en el entorno de las enfermedades infecciosas (en este caso hace referencia a un proceso inflamatorio agudo de origen infeccioso que suele manifestarse con signos inflamatorios externos: eritema, inflamación y calor local). La celulitis “estética”, en términos médicos, recibe el nombre de lipodistrofia ginecoide, lipoesclerosis nodular o paniculopatía edematofibroesclerótica.
¿Dónde se localiza?
Es un trastorno local del tejido subcutáneo (por depósitos circunscritos de grasa) predominantemente en caderas, glúteos, muslos y abdomen. Se caracteriza por un aspecto típico de la piel que llamamos “piel de naranja”.
Puede afectar tanto a mujeres delgadas como con sobrepeso , y aparecer desde la pubertad, pero es mucho más frecuente a partir de los 30 años. Se debe a un crecimiento de las células grasas por un incremento en los depósitos de lípidos (en forma de nódulos adiposos) entre el tejido conjuntivo. La aparición en el hombre es escasa: sólo alcanza el 5%.
¿Cuál es la principal causa de la celulitis?
La celulitis se considera un trastorno multifactorial , en el que están implicados, por tanto, varios factores. Sin duda, la dieta hipercalórica favorece la síntesis y el almacenamiento de grasas en el tejido adiposo, pero habría otros factores implicados:
La vida sedentaria (la falta de ejercicio físico ocasiona una disminución de la masa muscular por lo que se hace más evidente la masa grasa).
Posiciones mantenidas: las posiciones mantenidas en sedestación (sentados) dificultan el retorno venoso y facilitan el depósito graso. Empeora si, además, cruzamos las piernas.
Hábito tabáquico produce alteraciones de la microcirculación.
Abuso de alcohol: favorece la lipogénesis.
Estrés y ansiedad: conllevan a un incremento de las catecolaminas (adrenalina y noradrenalina) que favorecen la formación de grasa.
L os estrógenos femeninos : incrementan la actividad de los adipocitos, que favorece la formación de nódulos celulíticos. Así, existe un empeoramiento de la celulitis en el embarazo, la menopausia y en los tratamientos con estrógenos.
¿Cuántos tipos de celulitis hay?
Existen tres formas clínicas diferentes: limitada, difusa y edematosa.
Lipodistrofia dura o limitada : de márgenes bien delimitados con la piel engrosada y compacta. Frecuente en mujeres jóvenes que practican ejercicio físico regularmente. No cambia con las modificaciones posturales (estar de pie o sentada). Se localiza generalmente en rodillas y muslos.
Lipodistrofia blanda o difusa : es la forma más frecuente. Suele presentarse a partir de los 40 años y es típica de mujeres sedentarias y en aquellas que han perdido mucho peso de forma brusca (tras cirugía bariátrica o régimen muy restrictivo). Encontramos una piel gruesa (espesor 5-8 cm), flácida, móvil con poca masa muscular. Muy frecuente en caderas. A la palpación se notan pequeños nódulos duros. Cambia de forma al modificar la postura o al presionar con los dedos. Puede ocasionar alteración de la esfera social y psicoafectiva y disminución de la autoestima.
Lipodistrofia edematosa : es la forma más grave, pero la menos frecuente. Se asocia a obesidad y linfedema (excesiva retención de líquidos). Afecta a extremidades inferiores con un incremento del volumen total. A la exploración observaremos un signo de Godet positivo (depresión de la piel al presionar con el dedo que se mantiene cuando se retira). Se asocia a otros síntomas como pesadez de piernas, edema, varices y calambres.
Recordemos que la misma persona puede presentar diferentes tipos de celulitis en diferentes áreas anatómicas.
¿Cómo se confirma el diagnóstico?
El diagnóstico es clínico y basado en la inspección de la piel y en la palpación . Encontraremos una piel con superficie irregular, con aspecto reticulado (típico aspecto de piel de cáscara de naranja). Pueden aparecer otros signos como: estrías (por ruptura de fibras elásticas de la dermis), equimosis (por fragilidad capilar) y varículas.
Al palpar apreciamos una piel con aumento de grosor y consistencia. Al pellizcar evidenciaremos el aspecto de piel de naranja.
Se puede recurrir a exploraciones complementarias no utilizadas de forma rutinaria. Entre ellas destacan la ecografía, la termografía, la xerorradiografía y la impedanciometría bioeléctrica.
¿Existe un tratamiento eficaz contra la celulitis?
Existen múltiples terapias para el tratamiento de la celulitis con el fin de reducir las células grasas, mejorar la microcirculación y reducir el edema. Mencionaremos las diferentes alternativas terapéuticas: físicas o mecánicas, quirúrgicas y dermocosméticas.
Tratamientos físicos y mecánicos :
Iontoforesis: uso de corriente galvánica de alta frecuencia para que el fármaco tópico penetre mejor en la dermis, catabolice los lípidos y aumente la eliminación del líquido retenido.
Ultrasonidos: ondas de alta frecuencia que tienen efecto vasodilatador y mejoran la penetración de los preparados tópicos en la dermis .
Electrolipoforesis: agujas conectadas a un generador de baja frecuencia. Se crea un campo electromagnético que favorece el drenaje linfático y la lipólisis.
Termoterapia: utiliza calor y frío para obtener vasodilatación y facilitar la penetración de los productos.
Presoterapia y drenaje linfático: favorecen el retorno venoso, activan la microcirculación y reducen el edema.
Endermología o lipomasaje: masaje con dos rodillos que mejora la apariencia de la pie l actuando a nivel del sistema linfático y circulatorio.
Tratamientos quirúrgicos :
Cirugía estética: por ejemplo, la abdominoplastia, para eliminar el exceso de piel y grasa abdominal.
Liposucción: mediante la destrucción de los acúmulos de grasa localizados. Se introduce una cánula en la hipodermis y se desestructura y aspira el material graso.
Liposhifting: técnica que moviliza el tejido graso y remodela las irregularidades de la piel. Se utiliza con mucha frecuencia para corregir irregularidades secundarias tras una liposucción.
Tratamiento dermocosmético:
Mediante preparados tópicos (de aplicación local). Son más eficaces en las primeras fases de la enfermedad. De uso diario. Existen varios preparados tópicos:
Mucopolisacáridos (ejemplo la mucopolisacaridasa): Actúan al inicio del proceso y permiten recuperar la permeabilidad y fluidez del tejido conjuntivo.
Fibrinolíticos: evitan la desestructuración de las fibras de colágeno, elastina y fibrina por acúmulo de los nódulos celulíticos. Destacan las colagenasas, elastasas, hidrolasas, oligoelementos (manganeso, cinc, cobalto) y derivados del yodo.
Vitaminas: E, A. B y C con propiedades anticelulíticas.
Lipolíticos: efecto destructor sobre el tejido graso. Se emplean en mesoterapia administrados de forma intradérmica o subcutánea con agujas de pequeño calibre. Se utiliza, sobre todo: pentoxifilina, hialuronidasa, l-carnitina, aminofilina y cafeína. Muc has cremas anticelulíticas contienen cafeína en un porcentaje nada despreciable, ya que activa las enzimas que rompen las moléculas de grasa.
Rubefacientes: activan la circulación periférica. Producen aumento de temperatura en la zona tratada. Por ejemplo, el nicotinato de metilo, el mentol, el alcanfor y aceites esenciales.
Plantas de efecto venotónico (centella asiática, Ginkgo biloba, castaño de Indias, rusco, ciprés y naranja amarga) y antiedematoso (centella asiática, hiedra, pilosella o algas marinas como Fucus vesiculosus o Palmaria palmata ). Persiguen activar la circulación sanguínea y mejorar la retención de líquidos.
¿Se puede prevenir la aparición de la celulitis?
Justamente el mejor tratamiento contra la celulitis es su prevención . Como medidas generales se recomienda la realización de ejercicio físico regular, el seguimiento de una dieta equilibrada y el control de la ansiedad y el estrés. Debemos promover una forma de vida sana, potenciando las normas higiénico-dietéticas que todos conocemos:
Evitar el sedentarismo (realizando ejercicio físico con frecuencia regular).
Evitar el tabaquismo y el exceso de alcohol.
Uso de prendas y calzado cómodos (no excesivamente ajustados).
Gestionar el estrés.
Mantener el peso ideal.
Ingesta abundante de agua.
Realizarse algún masaje venoso y drenaje linfático de vez en cuando para activar la microcirculación.
Con todas estas medidas conseguiremos retrasar la aparición de la celulitis o mejorar el resultado de los tratamientos cuando ya está instaurada.
Artículo especializado
Conoce Todos los Tipos de Leucemia
¿Qué sucedería si existe una reproducción sin control de las células encargadas de producir los leucocitos?. La respuesta: pues que se originaría una leucemia. Y lo que sucedería no es otra cosa que una gran cantidad de glóbulos blancos, en diferentes grados de maduración, accedería a la sangre. Te explicamos qué es una leucemia y los diferentes tipos que existen .
¿Qué son los leucocitos?
Los leucocitos son las células comúnmente llamadas “glóbulos blancos” y forman parte fundamental de las defensas del organismo frente a infecciones externas. Los leucocitos se originan en la médula ósea, que es un tejido esponjoso que se encuentra en el interior de la mayoría de los huesos. En esa zona se originan unas células inmaduras llamadas blastos . Estos blastos sufren un proceso de maduración mediante el cual se acaban transformando en un tipo concreto de leucocitos, como son por ejemplo los linfocitos, o los neutrófilos o los monocitos. Cada uno de ellos tendrá una función particular dentro de la defensa del organismo frente a infecciones.
Tipos de leucemia
Como ya hemos comentado, dentro de los glóbulos blancos o leucocitos, podemos diferenciar varios tipos. Si la proliferación de células afecta a las células que producirán los linfocitos, hablamos de una leucemia linfática y, por el contrario, si afecta a las células que madurarán a otros tipos de glóbulos blancos (neutrófilos, basófilos, etc.) hablamos de leucemia mieloide.
Por otro lado, es muy importante conocer el grado de madurez que tienen las células mutadas que se reproducen sin control. Debemos saber que las células inmaduras (blastos) no tienen poder efectivo frente a las infecciones. En un individuo sano, la gran mayoría de células que circulan por su torrente sanguíneo son células maduras, que están listas para luchar contra las infecciones. En el caso de un individuo con una leucemia, las células que se reproducen sin control van sustituyendo paulatinamente a las células normales que circulan por la sangre. Así pues, si la leucemia va sustituyendo células normales por células inmaduras, el individuo no tendrá capacidad de luchar contra las infecciones y aparecerá una leucemia aguda. Si, por el contrario, la leucemia va originando células maduras, se tratará de una leucemia crónica, en la que el individuo no será tan frágil frente a las infecciones.
Así pues, en función del tipo de células que está proliferando y de su grado de madurez, podremos diferenciar 4 tipos de leucemias
Leucemia mieloide crónica
Qué es
Este tipo de leucemia se presenta en personas de mediana edad (habitualmente entre 30-70 años) y está relacionada en el 95% de las ocasiones con una mutación en un cromosoma llamado Cromosoma Philadelphia.
Diagnóstico
En la mayoría de ocasiones, solemos detectar la existencia de este tipo de leucemia de forma accidental en una analítica de control, puesto que suele ser asintomática hasta que ya se encuentra muy evolucionada. Lo que observamos en la analítica es una elevación muy acusada del número de leucocitos (si un individuo normal no suele tener más de 11.000 leucocitos, un paciente con leucemia frecuentemente sobrepasará los 20.000).
Síntomas
Cuando la leucemia produce sintomatología, ésta suele ser muy inespecífica, como cansancio, debilidad, pérdida de peso, falta de apetito o sudoración profusa. En algunas ocasiones también se puede detectar una esplenomegalia (aumento del tamaño del bazo). Si no se realiza el diagnóstico en esta fase, en algunas ocasiones la leucemia crónica puede ir progresando hasta desarrollar una leucemia aguda. Esta evolución de la enfermedad no se produce en todos los pacientes y, en caso de producirse, lo hace en un tiempo muy variable, en algunas ocasiones incluso al cabo de varios años tras iniciarse la enfermedad.
Una vez existe sospecha de una posible leucemia, se realizan una serie de pruebas que confirmarán el diagnóstico:
Hemograma y frotis de sangre periférica: en el que se aprecia un aumento de los glóbulos blancos, con presencia de células inmaduras que no suelen aparecer en individuos sanos, y con disminución de glóbulos rojos.
Biopsia de médula ósea: nos dará el diagnóstico definitivo. Se detectará una médula ósea hipercelular, con un incremento de células mieloides muy superior al número de células eritroides (precursores de los glóbulos rojos, que también se producen en la médula ósea).
Tratamiento
El tratamiento de estos pacientes ha evolucionado mucho en los últimos años. En la actualidad, el primer tratamiento que se ofrece a los pacientes con leucemia mieloide crónica es mediante el uso de fármacos. En gran parte de los casos, estos fármacos consiguen controlar la enfermedad, si bien no consiguen erradicarla por completo y considerar al paciente completamente curado. El único tratamiento curativo es el trasplante de médula ósea, pero dado que se trata de un procedimiento no exento de riesgos, suele considerarse como tratamiento de segunda elección y utilizarse sólo en aquellos casos que no respondan al tratamiento farmacológico.
Leucemia mieloide aguda
Qué es
Es uno de los tipos de leucemia más frecuente, afectando principalmente a personas entre 60-75 años. Se detectan entre 1.000-1.500 nuevos casos en España anualmente.
En este caso suele provocar una clínica similar al de la leucemia mieloide crónica, pero dada su rápida evolución, en poco tiempo comienza a presentar síntomas como dolores óseos, hemorragias o problemas de coagulación, esplenomegalia, o aparición de adenopatías, entre otros.
Diagnóstico, tratamiento y pronóstico
El diagnóstico es similar al de la leucemia mieloide crónica y su tratamiento puede ir desde el uso de quimioterapia a la necesidad de un trasplante medular. El pronóstico es muy variable en función del subtipo de células que estén involucradas.
Leucemia linfática crónica
Qué es
Se produce en personas de edad avanzada, siendo la media de edad en el momento del diagnóstico de 60-70 años. Afecta a alrededor de 1.400 nuevas personas cada año en España.
Síntomas
En gran parte de los pacientes (75%) no suele producir sintomatología y únicamente provoca un aumento de la susceptibilidad a padecer infecciones.
Diagnóstico, tratamiento y pronóstico
El diagnóstico es similar al del resto de leucemias y su pronóstico muy variable según el caso, yendo desde casos indolentes que no necesitan ni siquiera tratamiento y que no afectan a la esperanza de vida del paciente, hasta casos agresivos que precisan de tratamiento médico, quimioterapia o incluso trasplante de médula ósea.
Leucemia linfática aguda
Qué es
La leucemia linfática aguda es una enfermedad que suele afectar a los niños, siendo el tipo de cáncer más común entre las personas menores de 20 años.
Síntomas
La sintomatología es común al resto de leucemias, igual que su diagnóstico.
Tratamiento
El tratamiento se basa en el uso de quimioterapia y en algunos casos puede precisar de la realización de un trasplante de médula ósea.
Pronóstico
El pronóstico es muy variable en función del subtipo de leucemia linfática, pero en líneas generales, la supervivencia en niños se sitúa en torno a un 70% comparado con una supervivencia del 30-40% en los adultos.

Artículo especializado
Bruxismo y su Relación con el Estrés
Todos apretamos alguna vez los dientes o hacemos movimientos con ellos como forma de dar salida alguna tensión interna, sin embargo, solo podemos hablar de bruxismo cuando esto ocurre de manera regular e inconsciente o semi-inconscientemente, con riesgo de producir eventual daño a nuestra salud dental .
Muchas causas
El bruxismo es un frotamiento o tensión excesiva de los dientes sin ninguna función aparente, a diferencia de, por ejemplo, la masticación o los movimientos articulares que se producen para emitir sonidos y/o palabras. Las causas del bruxismo no están claras, pues hay estudios que lo relacionan con trastornos de la ansiedad y que achacan su aparición a episodios depresivos continuados o a la exposición continuada a situaciones de estrés. Sin embargo, también son numerosos los estudios que demuestran que puede haber una predominancia de factores fisiológicos tales como una mala masticación o un trastorno del sueño. Es por ello que se considera que tiene múltiples causas .
Tipos de bruxismo
Existen básicamente dos modalidades de bruxismo: el diurno y el nocturno.
El bruxismo diurno (BD) es una actividad normalmente semi-voluntaria que la literatura científica asocia al estrés vital que puede ser producido por causas de responsabilidad familiar o de trabajo, es decir, por causas psicosociales. El bruxismo diurno lo padece un 20% por ciento de la población adulta.
El bruxismo nocturno (BN), sin embargo, es un comportamiento mandibular definido como estereotipado y repetitivo caracterizado por, como decíamos al principio, tensión y frotamiento dental cuya causa más común es la de un trastorno del sueño, relacionado o no con causas psicosociales. Este tipo de bruxismo lo sufre entre el 8 y el 16%.
¿Cómo prevenirlo?
En primer lugar, es importante que hagamos un chequeo de nuestras vidas : ¿tiene mi forma de vivir algo que ver con esto? ¿Hay algo que pueda hacer para vivir con menos estrés u hostilidad? Si la respuesta a estas preguntas es afirmativa cabe hacer balance y preguntarse ¿el qué? No es una cuestión menor, pues en el momento en que la aparición de un síntoma irrumpe en nuestra vida las alarmas saltan y esto nos pone en la tesitura de tener que buscar respuestas a medida, no hay fórmulas estándar y cuanto más conscientes seamos de nuestra manera de funcionar y de relacionarnos con nosotros mismos y con el mundo, más capacidad desarrollaremos para la armonía y el orden interno. Y esto no es tarea fácil. Dicho esto, vamos a introducir unos elementos prácticos que esperamos sean de utilidad. Por supuesto, es conveniente también acudir a un especialista en salud buco-dental y/o a uno en trastornos del sueño para confirmar o descartar causa orgánica . El primero puede prescribirnos la utilización de una férula de descarga, en el caso de que se trate de bruxismo nocturno.
Revisemos nuestro hábito de sueño
Vamos a intentar proveeros de algunos e lementos que te sirvan para iniciar este autochequeo . Dado que el bruxismo se relaciona en parte con posibles trastornos del sueño revisemos pues nuestros propios hábitos. A continuación, enumeramos algunos elementos para sanear nuestra forma de relacionarnos con el dormir :
Acostarse a la misma hora cada día.
Hacer la misma rutina antes de ponerse en la cama y apagar la luz.
Haber hecho la digestión antes de acostarse, pudiendo así irse a la cama con las necesidades fisiológicas de evacuación realizadas.
No haber tomado estimulantes (café, tabaco o alcohol) en las horas previas al momento de acostarse.
Haber realizado una actividad sosegada antes de acostarse (lectura, escuchar música relajada, una conversación amable, etc. es conveniente evitar las pantallas (móvil, televisión) por la noche ya que la excesiva exposición nocturna a elementos audiovisuales ha demostrado ser un factor que dificulta el descanso y facilita la aparición de trastornos del sueño.
Convendría irse a dormir siempre con la cama hecha y las sabanas limpias, asimismo, es importante utilizar la cama para el descanso o los momentos de intimidad con la pareja, pero conviene abstenerse de otras actividades como pueden ser trabajar, comer, etc.
Estas pautas básicas de higiene del sueño deberían ayudarnos autorregular mejor el descanso . Como todos sabemos, hay veces en la vida en la que menos es más y este principio aplica para el acto del buen descansar.
En este párrafo final queremos reiterar la multi-factorialidad causante del bruxismo y la importancia de acudir tanto a especialistas dentales como a especialistas en sueño . En caso de identificar causas psicológicas como la aparición constante de emociones desbordantes o de pensamientos aflictivos es recomendable acudir a un psicoterapeuta para una evaluación y posible tratamiento psicoterapéutico para combinarlo, si es necesario, con los tratamientos médicos.

Artículo especializado
Tratamiento, Beneficios y Contraindicaciones de la Carboxiterapia
¿Qué problema estético es uno de los que más preocupan a las mujeres? Sin duda, muchas contestarían que la celulitis . Pues bien, para obtener buenos resultados en este “dolor de cabeza” de tantas mujeres, la carboxiterapia ha demostrado su eficacia. Y la celulitis no es la única aplicación que tiene esta técnica.
En qué consiste
Se trata de un procedimiento cosmético no quirúrgico , que consiste en la inyección a nivel subcutáneo e intradérmico de dióxido de carbono de uso medicinal. Este procedimiento ha demostrado resultados estéticos favorables en el tratamiento de estrías, reducción de celulitis y mejora de cicatrices hipertróficas y de coloración de ojeras, así como de la flaccidez corporal y facial, rejuvenecimiento de piel de manos y tratamiento de psoriasis. Los pocos efectos adversos, contrastados con los buenos resultados del procedimiento, otorgan un gran grado de satisfacción en los pacientes.
Puede aplicarse en tratamientos conjuntos con uso de botox, mesoterapia, tratamientos láser o radiofrecuencia; o para mejora posterior del aspecto corporal luego de una liposucción. Debe aplicarse en pacientes con buena salud, y está contraindicado, a nivel general, realizarse en pacientes con fobia a las agujas, apnea del sueño, enfermedades del tejido conectivo, insuficiencia hepática, respiratoria, renal y cardíaca, diabetes, cáncer, infecciones de la piel, trastornos de circulación, epilepsia, asma activa, estados gripales con fiebre y tos, así como embarazo, o mujeres estando en ciclo menstrual.
¿Cómo funciona?
Al inyectarse el dióxido de carbono en forma intradérmica con agujas, se produce una vasodilatación importante e incremento del flujo sanguíneo en la zona de la aplicación, lo cual incrementa localmente la presión de oxígeno. Esta actividad, sumada al descenso del pH del tejido, genera una mayor liberación de hemoglobina. En consecuencia, se eliminan los radicales libres tóxicos que favorecen el envejecimiento del tejido. Todo ello permite obtener tejidos más firmes y sanos, eliminándose células grasas y produciéndose un mayor efecto lipolítico (movilización de grasas).
¿Cuándo dura?
La duración del tratamiento se adecúa al morfotipo corporal de cada paciente . Las sesiones se pueden realizar una por día, o por semana, con una duración de dos a 15 minutos, según las zonas a tratar. Se requieren de 10 a 20 sesiones. Aunque no son necesarios ningún tipo de cuidados después, es importante que el paciente se comprometa a llevar una vida sana, acompañada de dieta y ejercicio, para lograr un resultado óptimo.
¿Qué pasa después?
Los efectos secundarios que pueden aparecer en la zona, como hinchazón, pesadez, calor o dolor pueden mejorar tras un masaje local , posterior a la aplicación del tratamiento. Durante las primeras sesiones, el dolor puede ser más intenso, e irá disminuyendo con el paso del tiempo. Si éste continua, deben espaciarse las sesiones de aplicación, así como si aparecen infecciones locales o hematomas.
El tratamiento permite obtener efectos de forma inmediata , aunque puede apreciarse un estancamiento del mismo tras la segunda sesión. No hay que preocuparse por este detalle, ya que el mayor efecto se apreciará a partir de la mitad del tratamiento, culminándose en la última. Tras un año de haber finalizado el tratamiento se podrán realizar retoques si fuera necesario.
Carboxiterapia y estrías
La carboxiterapia tiene mayor efecto durante la primera fase de la producción de estrias (las llamadas estrías violetas), aunque también mejora el aspecto de las estrías viejas (estrías blancas). Produce un aumento de la neovascularización a nivel de las mismas, y estimula una mayor concentración de melanocitos, los cuales repigmentan la estría, y le otorgan un color más rosáceo natural. Asimismo, estimula la producción de colágeno , que mejora el aspecto de las marcas. No obstante, se debe recordar que cada tratamiento depende del estado de la piel individual de cada paciente. Puede utilizarse en cualquier lugar donde exista una aparición de estrías: pecho, caderas, nalgas, brazos, piernas y muslos. Aunque no requiere cuidados posteriores, puede generarse dolor local, que cede tras la aplicación de masajes.
Carboxiterapia facial
La carboxiterapia se convierte en un tratamiento efectivo para las pieles envejecidas por el paso de los años y la continua exposición solar . Los efectos que produce son:
Estimula la producción de nuevo colágeno, mejorando la elasticidad de la piel.
Aumenta de la oxigenación del tejido y el intercambio de gases, junto con la neovascularizacion de los tejidos, y la eliminación de radicales libres tóxicos que potencian el envejecimiento.
Reduce el nivel de células grasas, gracias a su efecto lipolítico.
Este conjunto de acciones otorga más luminosidad natural a la piel, y pueden realizarse sesiones cada semana, de 10- 15 minutos cada una.
El aumento de la vascularización de la piel, a nivel de la decoloración que presentan las ojeras azules, mejora visiblemente la piel de las mismas, desplazando la sangre saturada de toxinas. Debe realizarse una sesión por mes, y las inyecciones deben aplicarse tanto en el plano subcutáneo como intradérmico.
Carboxiterapia y celulitis
La celulitis consiste en la aparición de pequeños hoyuelos en la piel ocasionados por los depósitos de grasa que existen debajo de ella. Se clasifica en tres grados, donde el tercero implica la aparición de la piel de naranja.
El tratamiento con carboxiterapia estimula los receptores asociados a la lipólisis corporal, mejorando la elasticidad y el estado de la piel de naranja característica. Debe realizarse una sesión por día, o por semana, hasta completar las 20 sesiones.
Debe advertirse a la paciente de que no tome baños prolongados durante las primeras 24 horas posteriores, que evite las actividades deportivas y los golpes en la piel. Puede realizarse un retoque al año, y puede combinarse con otros tratamientos, como la mesoterapia.

Artículo especializado
Qué Debes Saber sobre la Miopía
A medida que has cumplido años, has ido sumando dioptrías, ¿por qué? Eres miope y quieres saber si tus hijos también pueden serlo… Son preguntas habituales que intentaremos resolver en este artículo y que interesarán a muchos, pues la prevalencia de miopía en la población es de hasta el 25%.
Las ametropías
El desarrollo de la visión se produce de forma progresiva desde el nacimiento hasta alcanzar los 8-9 años de edad y, durante este periodo de “plasticidad”, la función visual se caracteriza por ser reversible, es decir, puede volver atrás o regresar. Por esta razón, cualquier anomalía ocular que en el periodo inicial de la vida dificulte el estímulo visual de la retina provocará una detención del desarrollo visual, e, incluso, una regresión de la función existente en el momento de la aparición de la misma. A este proceso de paro o recesión de la función visual, se le conoce como ambliopía .
En el ojo normal, también llamado emétrope, el foco de la imagen se forma en un punto que coincide exactamente sobre la retina, produciéndose una imagen nítida sin necesidad de usar mecanismos de acomodación ocular. En el ojo con defecto de refracción (ojo amétrope) el foco de la imagen de un objeto del exterior no coincide con la retina, dando lugar a una imagen poco nítida y hace necesaria la aparición de fenómenos de acomodación ocular para conseguir que esa imagen se vuelva nítida. Las ametropías pueden ser la hipermetropía, la miopía o el astigmatismo.
¿Qué pasa en el ojo miope?
Por el mayor tamaño del globo ocular del que sería deseable, los rayos luminosos que inciden en el ojo miope, procedentes de un objeto situado en el infinito, se enfocan por delante de la retina y, por tanto, formando una imagen borrosa . Contrariamente a lo que ocurre en el ojo hipermétrope, en el miope el mecanismo de acomodación no compensa el defecto de visión y, al no disponer de ningún otro mecanismo compensatorio que contrarreste el defecto de refracción, la agudeza visual del ojo disminuye claramente en la visión de lejos. El niño ve mal aunque los defectos sean leves (-0,5 a 1 dioptría).
Tipos de miopía
Existen distintos tipos diferenciados de miopía:
La miopía benigna o simple : afecta al 10% de la población y suele aparecer en edad escolar. Va aumentando gradualmente para detenerse al terminar la etapa de crecimiento. Su evolución es benigna y no suele superar las 5-6 dioptrías.
La miopía maligna o degenerativa : representa entre un 1% y un 4% de los miopes. Suele iniciarse muy precozmente y aumentar a lo largo de toda la vida. Generalmente es superior a 6 dioptrías. Se trata de una enfermedad degenerativa de la retina.
La miopía transitoria del lactante : es poco frecuente y se debe a una excesiva curvatura natural, propia de los primeros años de vida, en la córnea y el cristalino, que se va aplanado de forma espontánea a medida que uno crece. Con ello, se consigue que el defecto llegue a corregirse parcial o completamente.
La miopía secundaria : se produce como consecuencia de otra enfermedad (un glaucoma congénito, por ejemplo).
Causas
En general, las ametropías tienen un origen hereditario multifactorial , aunque se expresa de forma muy diferente en cada persona. Por lo tanto, debe descartarse, siempre, que existan antecedentes familiares de este tipo de patologías.
La causa más frecuente de miopía es la debida a una longitud axial del globo ocular (una longitud antero-posterior del ojo) más grande de lo normal. Con menos frecuencia, se produce por la existencia de mayores curvaturas de las que serían deseables en la córnea o el cristalino, entre otros motivos.
Síntomas
Se produce una disminución de la agudeza visual lejana (“de lejos”), con buena visión próxima (“de cerca”). Los miopes suelen hacer guiños de párpados para mejorar la agudeza visual, lo cual puede ocasionar dolores de cabeza. También es muy frecuente el enrojecimiento ocular y la blefaritis crónica (inflamación de los párpados). En la miopía maligna se pueden hallar alteraciones en la prueba del fondo de ojo, como lesiones degenerativas en la retina más periférica predisponentes al desprendimiento de retina, o bien hemorragias.
La escuela es donde los defectos visuales se manifiestan de forma evidente, ocasionando un bajo rendimiento escolar.
Cómo se diagnostica
El diagnóstico de los defectos de refracción deberá ser realizado por el oftalmólogo . Desde la consulta del pediatra se deberá derivar al niño al especialista ante la sospecha de la existencia de alguno de estos defectos oculares.
La determinación de la agudeza visual mediante métodos subjetivos es posible a partir de los tres años de edad. Son pruebas o métodos subjetivos , los llamados “ optotipos ” (objetos/dibujos/letras) que deben situarse a cinco metros de distancia del niño y, a ser posible, en un ambiente con condiciones de buena iluminación y con el niño lo más tranquilo posible. Algunos de ellos son los “optotipos de Allen” o los “optotipos de Pigassou”, que se explorarán primero haciendo que el niño mire con ambos ojos y posteriormente con cada ojo por separado. También puede ser utilizada a partir de los cuatro años de edad la clásica prueba de la “E de Snellen”: se presentan diversas letras “E” en diferentes posiciones y de distintos tamaños y el niño debe identificar su posición señalando con los dedos o colocando una “E” grande a su lado en la misma posición. Con esta exploración simple se pueden diagnosticar fácilmente todas las miopías , ya que éstas cursan con una clara disminución de la agudeza visual, siendo claramente necesaria la colaboración del paciente.
Además de todo lo especificado, el oftalmólogo, previa administración de colirios que tienen la finalidad de provocar la parálisis medicamentosa del sistema de acomodación ocular, puede realizar pruebas como la llamada “esquiascopía”, sin precisar respuestas del paciente a pruebas subjetivas.
Es muy importante tener presente que la agudeza visual del niño pequeño no está completamente desarrollada y que los resultados, por tanto, podrán variar con el paso del tiempo .
Tratamiento
La corrección óptica de las ametropías se realizará con lentes esféricas o cilíndricas , que pueden ser positivas (convexas) o negativas (cóncavas), dependiendo del defecto de refracción a tratar.
En el caso concreto de la miopía, el tratamiento se basa en la aplicación de cristales correctores negativos (divergentes, cóncavos). En los niños más pequeños y en defectos importantes se recomienda el uso de las gafas todo el día para asegurar el buen desarrollo visual. Los niños más mayores y con miopías leves pueden utilizar las gafas solamente para la visión lejana. En la miopía maligna deben realizarse controles periódicos de fondo de ojo.
Qué pronóstico tiene
Respecto a la evolución de los defectos de refracción (ametropías) en general, aunque no siempre se cumple, se puede admitir que el ojo del niño es hipermétrope en el momento del nacimiento y tiende hacia la normalidad (la emetropía) durante la etapa del crecimiento y desarrollo , sin acabar de conseguirla con plenitud, ya que el patrón refractivo del ser humano es ligeramente hipermétrope. Partiendo de este esquema evolutivo, las hipermetropías tienden a mejorar con el paso del tiempo, las miopías empeoran y los astigmatismos se mantienen relativamente estables.
Conforme el niño crece, la miopía tiene a crecer por el aumento de tamaño del globo ocular, generalmente hasta pasados los 20 años. En la miopía maligna, puede ir aumentando durante toda la vida. En general, se dice que la ambliopía es recuperable hasta los cinco años, difícilmente se recupera a partir de esta edad y es prácticamente irrecuperable a partir de los 9-11 años. Por esta razón tiene tanta importancia llevar a cabo la detección y tratamiento precoz de las anomalías que pueden causar ambliopía (defectos de refracción, opacidades, estrabismos, etc.).
En la época de aprendizaje escolar, si mejora el rendimiento visual, paralelamente mejora el rendimiento escolar . El porcentaje de defectos de refracción que se detectan entre los niños más avanzados y los más atrasados en la adquisición de contenidos dentro de una misma aula, evidencian que entre los que presentan más dificultades hay un tanto por ciento más elevado de defectos de refracción que en el grupo de los más avanzados.
 Savia
Savia