Artículos Especializados

Artículo especializado
Ejercicios de Rehabilitación de una Fractura de Cadera
Pensar sólo en los ancianos como grupo susceptible de sufrir una fractura de cadera es un error. Es cierto que es frecuentísima en la población senil pero también se da en jóvenes tras sufrir traumatismos de alta potencia, en deportistas por fracturas de estrés o en niños por displasias de cadera. Veremos cómo se produce y qué papel juegan los ejercicios de rehabilitación en su tratamiento.
La mayoría de fracturas de cadera son tratadas quirúrgicamente. Normalmente suele ser necesario el empleo de material de osteosíntesis (placas y tornillos) para su reparación, aunque, en ocasiones, se opta por reemplazar toda la articulación de la cadera por una prótesis completa o artroplastia. No sería el caso de la fractura de las ramas pélvicas, la cual suele requerir tan sólo reposo domiciliario.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Qué hacer tras la intervención
Una vez el paciente ha sido intervenido de su fractura se recomienda movilización precoz . Si la evolución es favorable, se aconseja la sedestación (posición sentada) a las 24 horas. A las 48 horas se recomienda la bipedestación (ponerse de pie) con ayuda, normalmente, de un caminador. Cuando aún se está ingresado es el momento de adiestrarlo para agilizar su rehabilitación domiciliaria . Evidentemente, ello va a depender de la edad del paciente, de sus comorbilidades y de la cirugía a la que ha sido sometido (no es lo mismo recuperarse tras una osteosíntesis mediante la colocación de un tornillo que la recuperación tras un recambio completo de la cadera).
Sobre la rehabilitación
¿Cuánto tiempo de rehabilitación voy a precisar? En general, a los tres meses podrás reiniciar tu actividad, aunque con restricciones. A los seis meses estarás prácticamente restablecido para realizar la actividad que tenías antes de la fractura.
¿Qué pretendemos con el inicio de la rehabilitación de forma precoz? Queremos potenciar el tono muscular de la extremidad operada para evitar la temida atrofia muscular. Una rigidez articular podría ocasionarte posturas viciosas que afectarían a la marcha y estabilidad definitivas.
Ejercicios
En general, los ejercicios a realizar serán de intensidad progresiva durante todo el proceso de la rehabilitación. A continuación, te detallo las diferentes etapas:
Durante las dos primeras semanas perseguimos el mantenimiento de un buen tono muscular. Somos conscientes de que la fractura ha supuesto una interrupción absoluta de tu actividad física. Te recomendaremos los siguientes ejercicios (todos ellos debes realizarlos en la cama, en posición boca arriba y con las piernas estiradas. Aún es pronto para flexionar la rodilla y la cadera):
Contracciones del cuádriceps : colocar una pequeña almohada bajo las rodillas y presionar hacia abajo contrayendo el cuádriceps durante cuatro segundos y luego relajar. Hacer tres series de 10 repeticiones con ambas extremidades y de forma alterna.
Potenciación de la musculatura glútea : Aquí pretendemos que despegues tu pelvis del colchón durante tres segundos. Elevar discretamente la pelvis y contraer los glúteos durante tres segundos y luego bajar lentamente. Se recomiendan cuatro series de 10 repeticiones.
Trabajo de adductores de la cadera : es muy fácil. Apretar las rodillas durante 3 segundos. Puedes interponer una pelota de goma semielástica, si te resulta más cómodo. Hacer cuatro series de 10 repeticiones.
Fortalecimiento de los músculos posteriores de la extremidad: sujetar una banda elástica con la punta del pie y coger las puntas con las manos. Aguantar la pierna elevada y recta durante 10 segundos. Cuatro series de 10.
Si has logrado realizar estos ejercicios es el momento de parar y aplicarte frío local durante diez minutos. Sobre todo, recuerda que al levantarte por cualquier motivo debes ayudarte de un bastón o muleta y sostenerla siempre en el lado opuesto al de la pierna lesionada (es decir debe llevarse en el lado sano).
A partir de la tercera semana post-quirúrgica podemos incorporar ejercicios que impliquen cierta flexión de rodilla y, durante la quinta semana, es el momento de iniciar la deambulación sin ayuda. Puede ser en las barras del centro rehabilitador o en el pasillo de tu casa.
Recuerda que debes continuar con el resto de ejercicios. Prueba a hacer los ejercicios dentro del agua (te resultará mucho más fácil). Ir a la piscina será una opción muy acertada.
Si no quieres desplazarte, otro recurso sería la bicicleta estática, pero recuerda poner una intensidad baja al inicio.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Consejos preventivos
Tan sólo me queda aportarte algunos pequeños consejos a tener en cuenta de cara a la prevención de futuras caídas:
Evita cruzar las piernas al sentarte y acostarte. Te puede desestabilizar.
Utiliza un asiento elevado para el inodoro. Te permitirá acceder con menos esfuerzo.
Utiliza zapatillas cerradas por detrás. Las abiertas pueden hacerte resbalar.
Pon material antideslizant e en el suelo de la ducha y barras de soporte. No pongas escalón para acceder a la ducha. Si te resulta más cómodo dúchate sentado.
Retira las alfombras de tu vivienda.
Ten siempre una linterna y un teléfono en la mesita de noche.
Y, sobre todo, ten paciencia y sé constante. Eres la persona más interesada en recuperarte. Tu esfuerzo se verá compensado.
Artículo especializado
Hiperplasia Benigna: Diagnóstico
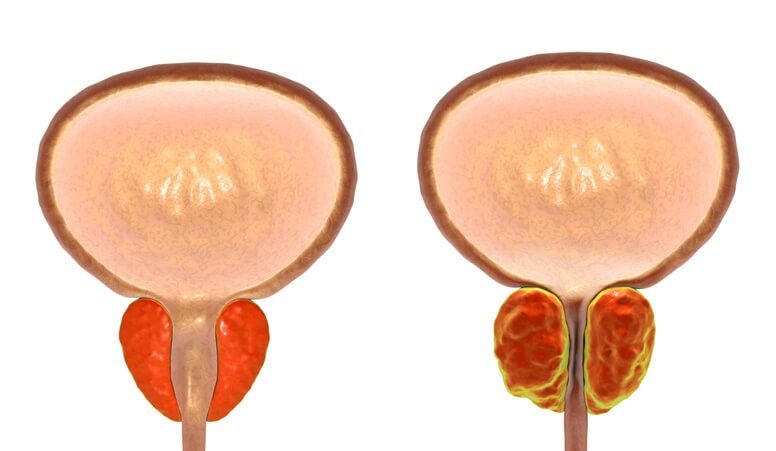
Ningún hombre escaparemos a medida que envejecemos del crecimiento de la glándula prostática, pero no todos estos aumentos conllevarán síntomas que requieran tratamiento. La hiperplasia benigna de próstata (HBP) afecta en mayor o menor grado al 80-90% de los hombres de más de 80 años.
¿En qué consiste?
La hiperplasia benigna de próstata (HBP), también llamada adenoma prostático , consiste en el crecimiento benigno (a diferencia de una neoplasia o cáncer) del tejido prostático. La próstata va aumentando de tamaño a medida que nos hacemos mayores. Cuando crece lo hace a expensas de su parte central, que es donde se ubican las glándulas prostáticas, que son las encargadas de producir la secreción prostática. Esta secreción forma parte del líquido seminal y aporta nutrientes a los espermatozoides.
Síntomas
Inicialmente el crecimiento de la próstata no conlleva ningún tipo de síntomas, Sin embargo, a medida que el tejido va creciendo la próstata comprime la uretra, que pasa a través de la parte central de la próstata. Esta compresión de la uretra puede dificultar la expulsión de la orina , lo cual es el principal problema de la HBP y lo que condiciona la aparición de los síntomas. Como la salida de la orina está dificultada, el músculo detrusor, que es el que se encarga de presionar la vejiga para que la orina salga, tiene que hacer más fuerza para vencer la presión a la que se ve sometida la uretra a su paso por una próstata aumentada de tamaño. Al fin y al cabo, todo es una cuestión de física: si se tiene que hacer más presión para que la orina salga, a la larga las fibras del músculo pierden su capacidad de contracción por exceso de uso y la salida de la orina se ve dificultada.
Los pacientes que acuden a la consulta por problemas relacionados con la HBP explican una serie de síntomas muy característicos:
Dificultad para orinar (disuria)
Urgencia para orinar
Aumento de la frecuencia al orinar
Poca cantidad de orina en cada micción (polaquiuria)
Disminución de la potencia del chorro de la orina
Goteo tras acabar la micción
Sensación de no haber vaciado del todo
Predominio de ganas de orinar por la noche (nicturia)
Todos estos síntomas se van agravando a medida que va aumentando el tamaño prostático. Si no se hace nada para evitarlo, la próstata seguirá creciendo y cada vez costará más que se vacíe la orina. Si llega un momento en que la fuerza para vaciar la vejiga es menor que la presión que tiene que vencer la orina no saldrá, con lo cual se producirá lo que se llama una retención aguda de orina (RAO) . Si la RAO no se resuelve, la orina comenzar a fluir en sentido contrario, hacia los riñones, lo cual puede afectar a su funcionamiento y llegar a causar una infección renal de origen obstructivo.
Diagnóstico
Primero, síntomas: el diagnóstico de la de la HBP se basará inicialmente en los síntomas por los que acuda el paciente a la consulta, que serán los anteriormente descritos: retraso en el inicio de la micción, disminución del calibre y la fuerza del chorro de la orina, sensación de vaciado incompleto, goteo tras la micción, polaquiuria (aumento del número de micciones) y nicturia (expulsión involuntaria de orina durante la noche).
El siguiente paso para el diagnóstico será la exploración. Mediante el tacto rectal, introduciendo el dedo por el ano, se puede palpar la próstata. En los pacientes con HBP vemos que esta se palpa aumentada de tamaño de manera homogénea, no es dolorosa, la consistencia es gomosa y no se parecían zonas induradas. Es esencial no el tacto rectal para poder descartar con esta sencilla maniobra la posible presencia de una prostatitis o de un cáncer de próstata, dado que ambas entidades pueden dar síntomas similares a los causados por la HBP.
Analítica de sangre: ante la sospecha de una HBP es importante realizar una analítica de sangre para valorar los niveles del antígeno prostático específico o PSA. En condiciones normales los niveles de PSA en sangre no suelen estar por encimas de los 4 ng/litro. Si se detectan valores superiores pero estos no alcanzan los 10 ng/litro se pueden realizar pruebas complementarias para asegurar el diagnóstico de la HBP y, sobre todo, para descartar el cáncer de próstata.
Ecografía prostática: es la principal prueba complementaria, que nos permite visualizar la estructura de la próstata, medir su tamaño y asegurarnos que no haya zonas sospechosas de un cáncer de próstata. En caso de dudas y en pacientes con valores por encima de 10 ng/litro se puede realizar una biopsia prostática, que permitirá tomar muestras del tejido y asegurar el diagnóstico.
Urodinamia: es otra prueba complementaria esencial y permite hacer un estudio de la micción. Dicha prueba consiste en valorar, mediante unos sensores especiales, la capacidad de vaciado de la vejiga y las presiones que se producen en la misma y las que tiene que vencer a su paso por la próstata. Esto permite valorar objetivamente el grado de obstrucción y tomar la mejor opción terapéutica.
¿Cómo se trata?
El tratamiento de la HBP dependerá de la gravedad de los síntomas. Las diferentes opciones terapéuticas son:
Fitoterapia , fármacos con extractos de plantas
Alfabloqueantes , que disminuyen las resistencia a la salida de la orina.
Hormonoterapia, reduciendo la producción de testosterona, que es la hormona que permite el crecimiento del tejido prostático.
Cirugía , con diversas aproximaciones, bien a través de la uretra o mediante cirugía abierta.
Resección mediante láser KTP o láser verde , o bien radiofrecuencia, con una mejor recuperación tras la intervención.
A pesar de que la próstata va a crecer de todos modos, existen algunas medidas que pueden retrasar la aparición de estos síntomas, como son mantener buenos hábitos de micción , es decir, tener una ingesta adecuada de agua, orinar con frecuencia y no retener la orina durante mucho tiempo.
En caso de presentar síntomas que puedan sugerir una HBP es necesario que ponerse en contacto cuanto antes con un urólogo para que lo valore y lo trate.
Artículo especializado
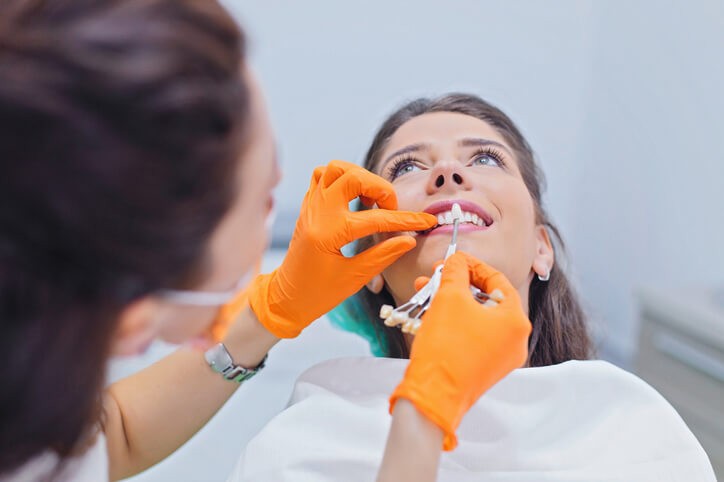
Implante Dental de Titanio, lo Mejor para Ti
¿Cuándo vas a decidirte a ir al odontólogo para solucionar ese problema estético que te dejó la extracción y que te impide sonreír abiertamente? No nos engañemos, no es sólo un problema estético, sino también funcional. Si pierdes un diente sucede que el que está en la otra arcada y se articulaba con él deja de ser funcional al poder colaborar en el trabajo masticatorio. Además, con el tiempo sobresaldrá y creará interferencias en la oclusión del resto de piezas de ese lado. Déjame que te aporte una pincelada sobre los implantes y el resto de alternativas terapéuticas para que puedas decidirte.
¿De qué están hechos los implantes?
Ante todo, vamos a definir el implante como un material protésico que tiene la finalidad de sustituir un diente extraído. Por ello, morfológicamente intenta semejarse a un diente real con una parte integrada en el hueso a modo de raíz y una parte expuesta en boca que alberga la prótesis a modo de corona. Se vería, pues, como un diente natural.
El implante debe estar fabricado con materiales biocompatibles de mínimo poder alergénico para minimizar la posibilidad de rechazo. Actualmente la mayoría de implantes colocados en boca son de titanio, excepto que exista una contraindicación específica. Otro tipo de implantes serían los de material cerámico .
La colocación
Una vez colocado el implante en boca, la parte que penetra en el interior del hueso (a modo de raíz) se une al mismo mediante puentes químicos que le confieren estabilidad. La superficie del implante que se inserta en el hueso presenta diferentes grabados y recubrimientos que tienen la finalidad de aumentar la superficie de contacto con el hueso y por tanto su adhesión. Cuando el implante está absolutamente adherido al hueso hablamos de osteointegración y, en ese momento, ese implante es ya capaz de soportar la carga del diente e iniciar su función.
Desde el momento en que se coloca el implante en la boca (en el acto quirúrgico) hasta que se carga (colocación de la corona protésica o prótesis fija o restauración) pueden pasar alrededor de tres meses. Antes de colocar la corona protésica sobre el implante realizamos una radiografía para asegurarnos de que el implante esté correctamente osteointegrado en el hueso siendo capaz de soportar la carga. Tenemos que decir que existen implantes de carga inmediata cuya corona se coloca directamente sobre el implante en el acto quirúrgico inicial.
¿Cuál es la indicación principal de un implante en la actualidad?
La indicación estrella del implante es la reposición de un diente extraído. Sin embargo, actualmente la mayoría de prótesis completas son colocadas sobre un soporte de implantes de forma de se mantienen fijas en boca (están en desuso las dentaduras de “quita y pon”).
¿Qué otras indicaciones terapéuticas tienen los implantes?
Asimismo, el uso de implantes ha ocasionado una disminución notoria en la colocación de los llamados “Puentes” o prótesis parciales fijas. Hasta finales del siglo XX la colocación de un puente en consulta era una práctica habitual del odontólogo. Pero no olvidemos que esta opción supone reponer la pérdida de una pieza dental mediante el sacrificio de los dientes contiguos (anterior y posterior) que eran endodonciados (con el nervio desvitalizado) y tallados para soportar el puente de tres piezas siendo la del medio una pieza falsa que sustituía al diente que faltaba mientras que los pilares del puente se enclavan en el diente anterior y posterior.
¿Todo el mundo es candidato al implante?
No olvidemos que la colocación de un implante supone un acto quirúrgico no exento de posibles complicaciones. Antes de su colocación se realiza un estudio pormenorizado del paciente para asegurarnos el éxito de la cirugía. En el estudio preoperatorio se realiza una ortopantomografía (para evidenciar si hay suficiente hueso y de calidad óptima para soportar la colocación del implante) y un TAC (mandibular o maxilar) así como un estudio del estado médico del paciente. Pueden existir situaciones médicas que contraindiquen la colocación de un implante como, por ejemplo, una enfermedad ósea severa (osteoporosis u osteomalacia), un trastorno de la coagulación, un trastorno de la inmunidad, una enfermedad metabólica mal controlada, etcétera. Por otro lado, la presencia de enfermedad concomitante en boca ya sea de encías, de hueso o maloclusión, así como malos hábitos de higiene, tabaquismo, alcohol y determinados fármacos de uso crónico (por ejemplo, los bifosfonatos usados en el tratamiento de la osteoporosis) pueden comprometer la osteointegración del implante por lo que podrían considerarse contraindicaciones relativas. Así mismo, antes de la cirugía deben tratarse posibles focos infecciosos en la boca como pueden ser caries y acúmulo de sarro.
¿Duele?
Durante la cirugía, para colocar el implante en el interior del hueso es preciso un abordaje mediante una incisión en la encía y la tunelización del hueso mediante fresas para crear un canal óseo donde irá alojado el implante. Una vez colocado el implante se cierra la encía mediante la colocación de puntos de sutura que deben ser retirados una semana después.
Tras la manipulación quirúrgica y al cesar el efecto de la anestesia es posible que el dolor aumente levemente siendo de intensidad tolerable. Podemos encontrarnos, así mismo, con una infamación del lado afecto que debemos contrarrestar con la aplicación de frío local. El paciente realizará un tratamiento antibiótico y antiinflamatorio durante unos días y será controlado en consulta posteriormente.
¿Con qué nos quedamos después de haber leído el texto?
Actualmente los implantes dentales son el tratamiento de elección para rehabilitar espacios sin dientes. La colocación de un implante implica la recuperación funcional de la boca y aporta al paciente una recompensa estética y psicológica de valor incalculable.

Artículo especializado
Cuáles son los Factores de Crecimiento
¿Has oído hablar de los factores crecimiento ? ¿Sabes qué son? Se trata de un conjunto de proteínas presentes en el plasma y en las plaquetas de la sangre, que tienen una función protagonista en los procesos de reparación y regeneración de los tejidos de nuestro cuerpo. Tienen un papel importante dentro de la medicina regenerativa, sobre todo en las especialidades de dermatología, reumatología y traumatología para la cura de lesiones en la piel, músculo esqueléticas o inflamatorias articulares.
Esto es debido a que son capaces de desencadenar en las células procesos biológicos como la proliferación y la diferenciación celular, la generación de vasos sanguíneos (angiogénesis) y la migración o desplazamiento de células a lugares donde son necesarias (quimiotaxis). En otras palabras, los factores de crecimiento son mensajes que utiliza nuestro organismo para informar a las células cuándo crecer, cómo diferenciarse o a dónde moverse para reparar un tejido dañado. Además, ayudan a que el lugar dónde se repara la lesión esté protegido de infecciones y disminuya el dolor y la inflamación.
Un poco de historia
Rita Levi-Montalchi, una científica italiana especialista en neurología, fue la descubridora del primer factor de crecimiento conocido, el NGF (factor de crecimiento neuronal ), por lo que fue laureada con el Premio Nobel de Medicina en 1986. Este trabajo realizado en la Universidad Washington, en San Luis, fue imprescindible para descubrir que las células sólo comienzan a reproducirse cuando reciben la orden de hacerlo, orden que transmiten unas proteínas llamadas factores de crecimiento.
Tipos de factores de crecimiento
Hay una gran cantidad de factores de crecimiento en nuestro organismo, y aquí te vamos a explicar los más importantes:
Hormona del crecimiento (HC): es una hormona fabricada por la glándula hipófisis, que se sitúa en el cerebro. Tiene un efecto global en nuestro organismo. Es producida durante toda la vida, pero en la infancia es sumamente importante para que el niño crezca adecuadamente y alcance su talla normal de acuerdo a su genética. En el ser humano tiene dos funciones importantes: estimula el crecimiento de los tejidos (promueve la mitosis o división de las células) y tiene un papel básico en el metabolismo de los carbohidratos, lípidos y proteínas.
Factor de crecimiento derivado de las plaquetas (FCDP): es una proteína sintetizada y liberada por las plaquetas que estimula la multiplicación celular 10 minutos tras coagular una herida y ayuda a la reparación del tejido lesionado.
Factor de crecimiento vascular endotelial (FCVE): es una sustancia importantísima en el crecimiento de los vasos sanguíneos durante el periodo embrionario y en la formación de nuevos vasos capilares en el ser humano adulto.
Factor transformador del crecimiento-beta (FTC-beta): ayuda a la síntesis de colágeno y a la reparación del tejido conectivo.
Factor fibroblástico ácido y básico (FCFa y FCFb): ayuda en la reparación de los tejidos lesionados mediante la formación de colágeno.
¿Sabes que los factores de crecimiento pueden ser tu medicina?
Los factores de crecimiento se usan como tratamiento de muchas enfermedades desde hace un par de décadas. Por ejemplo, son ampliamente utilizados en enfermedades hematológicas (de la sangre) tales como las granulocitopenias, los síndromes mielodisplásicos, las leucemias, las anemias aplásicas y los trasplantes de médula ósea. Por ejemplo, la eritropoyetina (EPO) se utiliza en pacientes con anemia e insuficiencia renal.
Otro de sus usos es dentro de la medicina regenerativa, sobre todo en las especialidades de dermatología, reumatología y traumatología para la cura de lesiones en la piel, músculo esqueléticas o inflamatorias articulares.
¿Qué es la medicina regenerativa?
La medicina regenerativa es una parte de la medicina relativamente moderna. Tal y como su nombre indica, su objetivo es regenerar tejidos dañados por la vejez o por un traumatismo. Este tipo de medicina se vincula a diferentes áreas científicas como la terapia celular avanzada, la ingeniería genética o la de tejidos. El uso de células madre, hematopoyéticas (las células de la sangre que proceden de la médula), la terapia génica (consiste en insertar un gen en una célula para sustituirlo o bloquear su función), la ingeniería de tejidos (desarrollo de órganos bioartificiales cultivados en el laboratorio) o el uso de sustancias como los factores de crecimiento.
Usos de los factores de crecimiento y medicina regenerativa
Hace unos años sería imposible pensar que podemos mejorar una lesión o frenar la progresión de una artrosis utilizando sustancias que fabrica nuestro propio cuerpo. Este planteamiento tiene ciertas ventajas ya que no presenta efectos secundarios, intolerancia o rechazo porque no estamos introduciendo ninguna sustancia extraña en nuestro organismo.
En el tratamiento de las tendinitis o las artrosi s (sobre todo de grandes articulaciones como la cadera o la rodilla) los factores de crecimiento promueven la regeneración del cartílago y reducen la inflamación, la deformidad y el dolor, mejorando el movimiento de la articulación y el bienestar del paciente.
En lesiones músculo esqueléticas, producidas, por ejemplo, tras un accidente o las que puede padecer un deportista, la aplicación de factores de crecimiento reduce el tiempo de recuperación y acelera la curación y cicatrización del tendón, músculo o hueso dañado.
En el pie diabético y otras úlceras crónicas por presión de la piel (heridas crónicas en la piel que no cicatrizan), los factores de crecimiento pueden favorecer su curación.
Parece ser que también han hecho su incursión en la medicina estética, ya que regulan la remodelación y reparación de la piel envejecida si se aplican de forma subcutánea.
Este tratamiento solo está contraindicado en caso de i nfección en la zona a tratar, procesos neoplásicos y ciertas enfermedades de la sangre.
¿Cómo se aplica?
El tratamiento se realiza bajo prescripción médica , en un ambiente estéril y sin anestesia. Para poder obtener los factores de crecimiento del paciente hemos de realizar una extracción sanguínea . Es el mismo proceso que una analítica. Esta sangre se procesa y se separa el plasma que es rico en factores de crecimiento. Tras obtener el concentrado se infiltra en la zona a tratar.
El proceso, que puede durar entre 25 y 40 minutos, se realiza en un ambiente estéril y sin anestesia en la mayoría de los casos. Puede usarse en una articulación o durante una intervención quirúrgica. El número de infiltraciones, en patología articular, que es la más frecuente, suelen ser tres sesiones durante tres semanas consecutivas, con una sesión de recuerdo a los seis meses o un año si la evolución es favorable.

Artículo especializado
Descubre los Hidratos de Carbono de Calidad
Si te decimos “hidratos de carbono ” seguramente podrás relacionarlos con pasta, pan… sabrás que son una parte importante de la dieta… pero quizás poco más. En este artículo te explicaremos todo sobre ellos: qué son, dónde se encuentran, por qué es importante su consumo, y cuáles son los hidratos de carbono de calidad y por qué conviene consumirlos en detrimento de los que no lo son… En fin, que al escuchar o leer el concepto “hidratos de carbono” de nuevo, seguro que sabrás decir muchas más cosas.
Indispensable en una dieta equilibrada
Hablamos de una dieta equilibrada cuando contiene la energía y los nutrientes en cantidad y calidad suficientes para conservar la salud. Uno de estos nutrientes son los hidratos de carbono, que constituyen la principal fuente energética inmediata del organismo y pueden almacenarse como sustancias de reserva. Para asegurarnos una alimentación equilibrada, rica en hidratos de carbono de buena calidad, la dieta debería estar compuesta mayoritariamente por legumbres, cereales integrales, frutas y verduras , disminuyendo e incluso eliminando de la alimentación los cereales refinados (carecen de las partes realmente nutritivas y de la fibra dietética) y los dulces (azúcares simples). Conozcamos más sobre los hidratos de carbono y dónde se encuentran los que nos convienen más.
Nutriente orgánico
Un nutriente es una sustancia química necesaria para que las células de un organismo produzcan la energía empleada en las funciones de crecimiento, reparación y reproducción, metabolismo, entre otras. Estos nutrientes se encuentran en los alimentos y son necesarios para cumplir las funciones vitales. Los nutrientes pueden ser orgánicos e inorgánicos:
Entre los inorgánicos tenemos el agua, que constituye más del 60% de nuestro cuerpo, y es utilizada como medio para la descomposición de alimentos.
Entre los nutrientes orgánicos se encuentran los hidratos de carbono, que constituyen la principal fuente energética inmediata del organismo y pueden almacenarse como sustancias de reserva. Además de las grasas y las proteínas.
Tipos de hidratos de carbono
También llamados glúcidos o carbohidratos, debido a su composición: carbono, hidrógeno y oxígeno, los hidratos de carbono se dividen en glucémicos (los cuales se digieren en el sistema digestivo dando lugar a la glucosa que se absorbe en el intestino delgado, como puede ser el almidón) y no glucémicos (los cuales no son digeridos y pasan directamente al intestino grueso donde son fermentados por la flora intestinal, un claro ejemplo es la fibra dietética).
Los HC glucémicos se dividen en:
Simples (azúcares)
Son los monosacáridos y los disacáridos de sabor dulce y de rápida absorción intestinal y se dividen en:
Monosacáridos: los más conocidos son la glucosa (constituyente fundamental en todos los HC, se almacena en el hígado y en el músculo en forma de glucógeno), la fructosa (se encuentra en la fruta y en la miel, se absorbe en el intestino, pasa al hígado donde se metaboliza rápidamente a glucosa) y la galactosa (forma parte del disacárido de la lactosa).
Disacáridos: los más conocidos son la lactosa (es el azúcar de la leche), maltosa (azúcar de malta, localizado en el grano de la cebada) y sacarosa (es el azúcar común obtenido de la remolacha o caña de azúcar).
Complejos
También llamados polisacáridos. De sabor escasamente dulce y de absorción intestinal lenta . Los más conocidos son el almidón o fécula (reserva energética de los vegetales, se encuentra en cereales, tubérculos y legumbres), y el glucógeno (principal reserva de energía del organismo que se almacena en el hígado y en el músculo).
En los HC no glucémicos encontramos la fibra dietética, que incluye los componentes más importantes como la celulosa, hemicelulosa, pectina, agar, gomas, mucilagos, etc. Recordemos que éstos no pueden ser degradados por enzimas digestivas y pasan directamente al intestino grueso, donde serán fermentados por la flora intestinal.
¿Qué funciones tienen los hidratos de carbono?
Su principal función es la energética (cada gramo aporta 4 kcal), a través de la utilización de la glucosa. Ésta es la única fuente de energía para el cerebro, que en circunstancias normales consume alrededor de 100 gramos al día para satisfacer sus demandas energéticas.
Reserva de energía : los hidratos de carbono son almacén y reserva de energía en forma de glucógeno que se moviliza rápidamente para generar glucosa cuando es necesario.
Ahorran proteínas : al usarse los hidratos de carbono como gasolina, se deja a un lado el uso de las proteínas con este fin, ya que éstas pueden ser utilizadas para muchas otras funciones.
Forman parte de tejidos importantes: los hidratos de carbono son partes imprescindibles en tejidos conectivos y nerviosos. Además, también se encuentran en las moléculas del ADN y trifosfato de adenosina (ATP), una molécula necesaria para obtener energía.
Evitan la formación de los cuerpos cetónicos : cuando el cuerpo no tiene suficientes carbohidratos para obtener energía, utiliza la grasa en su lugar, que produce unos desechos que son conocidos como cuerpos cetónicos.
Reguladora: la celulosa (fibra dietética) se encarga de regular el tránsito intestinal, teniendo además de éste otros efectos beneficiosos para la salud como: disminuir el estreñimiento ablandando las heces y aumentando su volumen, aumentar la sensación de saciedad, enlentecer el vaciado de estómago, disminuir la absorción del colesterol, disminuir la subida de azúcar en sangre, proteger contra el cáncer de colon y enfermedades cardiovasculares.
Alimentos ricos en hidratos de carbono
Podemos encontrar hidratos de carbono en diversos alimentos, y en una dieta equilibrada el consumo de hidratos de carbono complejo debe suponer la mitad de las calorías totales diarias. Se pueden obtener de las siguientes fuentes de alimentos:
Cereales: en el arroz, el trigo, el maíz, la avena, el mijo, la quinoa y el trigo sarraceno (estos dos últimos son pseudocereales), entre otros, se encuentra un gran potencial de hidratos de carbono de absorción lenta. Se recomienda su consumo en grano completo para preservar todos los nutrientes y la fibra dietética; tanto de los cereales como sus derivados (pan, pastas, cereales de desayuno).
Pan de grano completo: además de hidratos, nos aporta gran cantidad de proteínas de origen vegetal y poca grasa. Este alimento es uno de los primeros que suelen suprimirse en las dietas para perder peso, sin embargo, la Organización Mundial de la Salud (OMS) recomienda su consumo.
Pastas integrales : macarrones, espaguetis, tallarines… Deben acompañarse con vegetales y proteínas magras, y pertenecen al grupo de hidratos de carbono de absorción lenta.
Legumbres: como las judías, lentejas o los garbanzos. Son una gran fuente de energía, pues tienen un alto contenido de hidratos de carbono complejos, más de la mitad de su composición.
Tubérculos y raíces : la más consumida de este grupo es la patata, ya que el 75% de su composición es almidón, un carbohidrato de absorción lenta. También son buenas opciones la batata o boniato, la yuca, etc.
Frutas y verduras : la fruta es el carbohidrato más dulce, pues nos aporta fructosa, pero el que menos cantidad de hidratos de carbono posee. Sin embargo, junto a las verduras, ricas en almidón, aportan una gran cantidad de minerales y vitaminas indispensables para el organismo.
Azúcar simple: como el de caña, remolacha, miel o melaza. Aporta una gran cantidad de energía debido a su rápida absorción. Tanto para los adultos como para los niños, el consumo de azúcares simples se debería reducir, según la OMS, a menos del 10% de la ingesta calórica total. Y una reducción por debajo del 5% de la ingesta calórica total produciría beneficios adicionales para la salud .
Por lo tanto, para llevar una alimentación equilibrada, rica en hidratos de carbono de buena calidad, la dieta debería estar compuesta mayoritariamente por legumbres, cereales integrales (de grano completo), frutas y verduras, disminuyendo e incluso eliminando de la alimentación los cereales refinados (carecen de las partes realmente nutritivas y de la fibra dietética) y los dulces (azúcares simples).

Artículo especializado
Hipermetropia: Síntomas y Tratamiento
Si acaban de diagnosticarle hipermetropía a tu hijo y quieres saber más sobre el tema, este artículo te interesa.
¿Qué es?
La hipermetropía es un defecto de refracción frecuente en los niños . En el ojo hipermétrope, debido al menor tamaño del ojo del que sería deseable, la imagen de los objetos lejanos no se forma sobre la retina, sino detrás de ella. Esto hace que la visión sea borrosa a cualquier distancia de posición del objeto.
En el ojo hipermétrope el defecto de visión puede ser compensado por el mecanismo de acomodación (capacidad de modificación del tamaño del cristalino para enfocar los objetos), que es muy activo en la etapa infantil y va disminuyendo su capacidad con el paso de los años.
Debido a e este gran poder del mecanismo de acomodación en la infancia, exámenes convencionales de la agudeza visual pueden no detectar la existencia de hipermetropías ligeras o medianas, ya que el niño hipermétrope puede ver normalmente.
Cuando el defecto de refracción en ambos ojos es diferente hablamos de anisometropía , una afección que da lugar a una ambliopía (un “ojo vago”) en el ojo con más defecto de refracción y que es más frecuente y más grave cuanto más pequeño sea el niño. La anisometropía hipermétrope origina ambliopía más fácilmente que la miope.
¿Por qué se produce?
En general, las ametropías tienen un origen hereditario multifactorial, aunque se expresa de forma muy diferente en cada persona. Por lo tanto, debe descartarse siempre que existan antecedentes familiares de este tipo de patologías.
La causa más frecuente de hipermetropía es la debida a una longitud axial del globo ocular (una longitud antero-posterior del ojo) más pequeña de lo normal. Con menos frecuencia, su causa hay que buscarla en la existencia de menores curvaturas de las que serían deseables en la córnea o el cristalino. Asimismo, existen causas de hipermetropía extrema que serían el microoftalmos (ojo en general más pequeño de lo normal) y la afaquia o ausencia de cristalino (generalmente quirúrgica).
Síntomas
Los signos evidentes y síntomas pueden variar considerablemente en función del grado de hipermetropía y de la capacidad de acomodación del niño. Las hipermetropías moderadas pueden cursar con una agudeza visual incluso normal, mientras que las más importantes cursan con visión borrosa , especialmente en la visión próxima (“de cerca”) con “astenopatía acomodativa” (dolor de cabeza frontal, escozor y enrojecimiento de los ojos tras esfuerzos continuados de acomodación). Un signo frecuente de aparición es la blefaritis crónica (la inflamación de los párpados), secundaria a la contracción crónica que realizan los párpados con la finalidad de enfocar la visión. La hipermetropía puede provocar un estrabismo , denominado convergente acomodativo (endotropía acomodativa), que se corrige con el uso de gafas correctoras.
El colegio supone un lugar donde los defectos visuales se manifiestan de forma evidente, ocasionando un bajo rendimiento escolar.
Diagnóstico
El diagnóstico de los defectos de refracción deberá ser realizado por el oftalmólogo. Desde la consulta del pediatra debemos derivar al niño al especialista ante la sospecha de la existencia de alguno de estos defectos oculares.
Son pruebas o métodos subjetivos los llamados optotipos (objetos/dibujos/letras) que deben situarse a cinco metros de distancia del niño a explorar y, a ser posible, en un ambiente con condiciones de buena iluminación y con el niño lo más tranquilo posible.
También se puede utilizar, a partir de los 4 años de edad, la clásica prueba de la “E de Snellen”: se presentadas diversas letras “E” en diferentes posiciones y s tamaños y el niño debe identificar su posición señalando con los dedos o colocando una “E” grande a su lado en la misma posición. Con esta exploración simple se pueden diagnosticar las hipermetropías, siendo obviamente necesaria la colaboración del niño.
Para la exploración concreta de las hipermetropías, posteriormente se valorará al niño colocando unas gafas con una corrección de +2 dioptrías en cada ojo, volviendo a explorar los optotipos. El niño hipermétrope continuará viendo los optotipos con la corrección de +2 dioptrías ya que habrá estado corregida parte de su hipermetropía. En cambio, el niño que no padezca hipermetropía verá borroso con esa corrección. En este caso, igualmente se procederá a explorar primero la visión de un solo ojo y posteriormente de ambos, haciendo que el niño mire las figuras primero de manera aislada y luego agrupadas con la finalidad de detectar ambliopías ligeras.
Además de todo lo especificado, el oftalmólogo, previa administración de colirios para provocar la parálisis medicamentosa del sistema de acomodación ocular, puede realizar pruebas como la llamada esquiascopía (prueba que mide la refracción de manera objetiva).
Es muy importante tener presente que la agudeza visual del niño pequeño no está completamente desarrollada y que los resultados, por tanto, podrán variar con el paso del tiempo.
¿Cómo se trata?
El uso de la corrección debe ser permanente en niños pequeños y en defectos importantes, aunque en niños más mayores con defectos leves sólo será necesario aplicar los cristales correctores en algunas situaciones (para ver concretamente de lejos o concretamente de cerca). La corrección óptica de las ametropías se realizará con lentes esféricas o cilíndricas , que pueden ser positivas (convexas) o negativas (cóncavas), dependiendo del defecto de refracción a tratar.
En el caso concreto de la hipermetropía, el tratamiento se basa en la aplicación de cristales correctores positivos (esféricos, convexos).
Pronóstico
Respecto a la evolución de los defectos de refracción (ametropías) en general, aunque no siempre se cumple, se puede admitir que el ojo del niño es hipermétrope en el momento del nacimiento y tiende hacia la normalidad (la emetropía) durante la etapa del crecimiento y desarrollo, sin acabar de conseguirla con plenitud, ya que el patrón refractivo de la especie humana es ligeramente hipermétrope. Partiendo de este esquema evolutivo, las hipermetropías tienden a mejorar con el paso del tiempo, las miopías empeoran y los astigmatismos se mantienen relativamente estables.
Esquemáticamente se dice que la ambliopía es recuperable hasta los cinco años, difícilmente se recupera a partir de esta edad y es prácticamente irrecuperable a partir de los 9-11 años. Por esta razón, tiene tanta importancia llevar a cabo la detección y tratamiento precoz de las anomalías que pueden causar ambliopía (defectos de refracción, opacidades, estrabismos, etc.)
MEJOR RENDIMIENTO VISUAL, MEJOR RENDIMIENTO ESCOLAR
En la época de aprendizaje escolar, si mejora el rendimiento visual, paralelamente mejora el rendimiento escolar. El porcentaje de defectos de refracción que se detectan entre los niños más avanzados y los más atrasados en la adquisición de contenidos dentro de una misma clase evidencian que entre los que presentan más dificultades hay un tanto por ciento más elevado de defectos de refracción que en el grupo de los más avanzados.

Artículo especializado
Ejercicios para Combatir la Incontinencia Urinaria
La incontinencia urinaria es la salida involuntaria de la orina , sin que se puedan controlar los deseos de orinar. En España hay aproximadamente unos 150.000 hombres que la padecen por diferentes motivos. Esta incontinencia la presentan una quinta parte de las personas mayores de 65 años.
La incontinencia urinaria puede ser de diferentes tipos:
Incontinencia de esfuerzo : por un menor tono muscular del cuello de la vejiga.
Incontinencia de urgencia: el músculo encargado de contraerse para vaciar la vejiga lo hace de manera súbita, incluso con pequeñas cantidades de orina en la vejiga.
Incontinencia mixta: con alteraciones de los dos tipos anteriores
Incontinencia por rebosamiento : por una obstrucción de la salida de la orina en la que esta acaba saliendo por rebosamiento.
Incontinencia funcional : por demencia o alteraciones neurológicas o psiquiátricas.
Algunos de estos tipos de incontinencia tienen difícil solución, pero son varias las cosas que podemos hacer (más allá de los posibles tratamientos farmacológicos) para poder sobrellevarla mejor e intentar paliarla:
Perder peso si es preciso.
Mantener una ingesta hídrica correcta sin que sea excesiva.
Evitar la cafeína y las bebidas gaseosas.
Ir con frecuencia al baño (cada hora) para vaciar la vejiga y prevenir las pérdidas.
Reforzar el suelo pélvico mediante ejercicios físicos.
Ejercicios de Kegel
Los ejercicios más habituales para reforzar el suelo pélvico son los ejercicios de Kegel Con estos ejercicios se pretende fortalecer la musculatura del suelo pélvico, es decir, el conjunto de músculos que sustentan la vejiga, la próstata y la uretra, para así tener un mejor control de la vejiga y del flujo de la orina.
El primer paso para fortalecer estos músculos es localizarlos. Para eso se puede intentar detener el flujo de la orina cuando se está orinando. Los músculos que se contraen son los del suelo pélvico. Pruebe a hacerlo un par de veces cada vez que vaya a orinar para ir localizándolos y poder realizar los ejercicios independientemente de la micción. Una vez localizados se debe intentar contraer estos músculos de la siguiente manera (lo mejor es hacer estos ejercicios estirados bocarriba, por lo menos inicialmente):
Contraerlos durante cinco segundos y luego relajar los músculos.
Realice la contracción muscular hacia adentro y hacia arriba.
Repetir esta contracción 10-20 veces a intervalos de 10 segundos.
Realizar esta actividad unas tres veces al día.
Realizar el ejercicio en espiración , es decir, expulsando el aire de los pulmones; no contenga la respiración al hacerlo.
A tener en cuenta…
Al principio es probable que al intentarlo se contraiga también la pared abdominal, los glúteos y los muslos. Es normal. A medida que se van realizando los ejercicios se va logrando contraer solamente los músculos del suelo pélvico.
Asimismo, son unos ejercicios que cansan, sobre todo porque es una musculatura que no ejercitamos voluntariamente en nuestro día a día. Lo mejor es comenzar con un objetivo de 10 contracciones en cada tanda de ejercicios, hacerlas tres veces al día y cada semana ir aumentando dos repeticiones más hasta llegar a un objetivo de 20 repeticiones en cada tanda de ejercicios. De esta manera progresiva es probable que se vean resultados al cabo de 6 semanas de comenzar los entrenamientos.
Una vez se domina un poco la contracción de la musculatura del suelo pélvico estando tumbado se puede comenzar a practicarlos estando sentado. Esto permitirá que se puedan realizar estos ejercicios en cualquier sitio: en el trabajo, en el transporte público, en el coche… Puede costar un poco más al principio dado que se debe actuar contra la gravedad, pero si se realizan las secuencias adecuadas se fortalecerá el suelo pélvico adecuadamente.
Resultados
Gracias a los ejercicios Kegel muchos hombres con incontinencia urinaria secundaria a una extirpación de la próstata por un cáncer prostático ven cómo mejora su calidad de vida. La mayoría de los hombres logran controlar el goteo de la orina de nueve a doce meses tras la intervención quirúrgica, aunque el tiempo de recuperación de cada paciente es diferente.
No te desanimes si tienes goteo de orina. Si realizas los ejercicios Kegel todos los días y persevera, verás resultados en unas semanas. Pese a que la clínica mejora sería conveniente seguir realizando los ejercicios Kegel una vez se haya instaurado la rutina de llevarlos a cabo para que así los músculos del suelo pélvico se mantengan fuertes. Son músculos como los de los brazos y las piernas, que conviene ejercitarlos para mantenerlos en forma.
Otras actividades físicas
Además de estos ejercicios específicos para fortalecer el suelo pélvico, existen una serie de actividades físicas que no perjudican ni sobrecargan el suelo pélvico y que, por lo tanto, se pueden realizar en caso de sospecha de incontinencia urinaria:
Andar a paso moderado
Marcha nórdica
Senderismo
Natación
Cinta elíptica
Cinta de andar (no correr)
Otras medidas
Además de estos ejercicios, existen otras medidas para fortalecer el suelo pélvico, como son la electroestimulación o el biofeedback . En otros casos de incontinencia urinaria también se pueden utilizar ciertos fármacos o incluso tratamientos quirúrgicos más o menos invasivos.
Ante una incontinencia urinaria es preciso que se ponga en manos de un urólogo para llegar a un diagnóstico y comenzar cuanto antes tratar el problema. Independientemente de que exista o no incontinencia urinaria, es una buena idea que todos ejercitemos la musculatura de nuestro suelo pélvico para prevenir las pérdidas de orina.
Artículo especializado
Inmunoterapia Contra el Cáncer
¿Existe luz al final del túnel? La inmunoterapia puede ser la clave que nos ayude a ganar definitivamente la batalla en la lucha contra el cáncer.
La inmunoterapia es un tratamiento que ha aparecido en los últimos años como herramienta fundamental en el tratamiento de determinados tipos de cáncer . En pocos años, este tipo de tratamiento ha pasado a ser uno de los avances más importantes en la lucha contra el cáncer. Prueba de ello es que en el año 2013, la prestigiosa revisa Science designó a la inmunoterapia contra el cáncer “Revelación del año”.
¿Qué papel tiene el sistema inmune en el cáncer?
El tratamiento con inmunoterapia contra el cáncer se basa en la estimulación del sistema inmune para frenar o erradicar las células tumorales . Antes de proseguir, es muy importante conocer el papel que desempeña el sistema inmune frente al cáncer.
El sistema inmune (las defensas) es un sistema que tiene nuestro organismo para identificar y eliminar células que nuestro cuerpo identifica como extrañas (ajenas). Así pues, cuando sufre una infección por un virus o una bacteria, por ejemplo, el sistema inmunitario es capaz de identificar que esas células no son células propias y actúa contra ellas, destruyéndolas. Esta identificación la realiza mediante la identificación de las proteínas que presentan las células en sus membranas (sus paredes).
Como hemos comentado, las células tumorales son células de nuestro organismo que sufren una mutación que provoca que crezcan sin control. En muchas ocasiones, esa mutación provoca que aparezcan nuevas proteínas en la superficie celular y gracias a ello, el sistema inmune puede actuar contra ellas y eliminar el tumor o frenar su crecimiento. De hecho, el sistema inmune elimina muchas células que sufren mutaciones incluso antes de que lleguen a provocar tumores.
Gran parte de los cánceres están provocados por defectos en el sistema inmune , que deja de identificar a las células tumorales como células ajenas y deja de actuar sobre ellas.
¿Y cómo actúa la inmunoterapia?
La inmunoterapia es un tipo de tratamiento que intenta estimular al sistema inmune del organismo para que éste sea el encargado de luchar contra las enfermedades.
Tipos de inmunoterapia
Anticuerpos monoclonales : los anticuerpos son proteínas que produce el organismo para identificar y eliminar células nocivas (generalmente infecciones). Hoy en día, los avances científicos nos han permitido crear anticuerpos en un laboratorio. Esos anticuerpos pueden tener principalmente dos objetivos: unirse a las células tumorales como agentes extraños y facilitar que el sistema inmune del paciente identifique más fácilmente esas células o, por el contrario, unirse a las células tumorales bloqueando su funcionamiento y frenando de esa manera su reproducción y crecimiento.
Inmunoterapias no específicas (citoquinas): son tratamientos que mejoran el funcionamiento del sistema inmune del paciente. Ejemplos de ellos son las interleuquinas, que aumentan el crecimiento y la actividad de las células inmunitarias, o los interferones, que mejoran la respuesta inmunitaria contra el cáncer.
Vacunas: las vacunas clásicas ya eran un tipo de inmunoterapia. Cuando nos vacunamos frente a una infección, no estamos haciendo otra cosa que estimular al sistema inmune para que detecte y actúe rápidamente en caso de que se identifique un determinado virus o bacteria. Este tipo de estimulación también se puede utilizar en el tratamiento contra el cáncer. El objetivo de las vacunas contra el cáncer es que el organismo reconozca las células tumorales y las destruya antes de que estas lleguen a provocar una enfermedad.
Transferencia celular adoptiva: es un tipo de terapia en la que se extraen células del sistema inmune del paciente (glóbulos blancos -células T) que se modifican en un laboratorio para hacer que sean más efectivas en la detección y eliminación de un tipo de células cancerosas. Esas células se cultivan y multiplican en el laboratorio y se vuelven a introducir en el paciente de forma que puedan actuar contra su cáncer.
¿Cuándo se utiliza?
El tratamiento con inmunoterapia ha evolucionado mucho en los últimos años. Cada vez son más los estudios que buscan demostrar su eficacia para nuevos tipos de tumores. Aunque su uso no es tan extendido como el de las quimioterapias tradicionales, cada vez son más los tipos de tumores que pueden tratarse ya con este tipo de fármacos. Cánceres como el de pulmón, el melanoma, el cáncer de vejiga o el cáncer de cérvix son ejemplos en los que la eficacia de la inmunoterapia ya está totalmente comprobada.
¿Qué efectos secundarios puede presentar?
Tal y como el resto de tratamientos contra el cáncer, la inmunoterapia también puede ocasionar efectos secundarios no deseados. Estos efectos dependerán del tipo específico de inmunoterapia, pero los más frecuentes son síntomas similares a los de una gripe, debilidad, mareos, fatiga o problemas digestivos. Algunos tipos de inmunoterapias pueden favorecer la aparición de infecciones e incluso de otros tumores. En ocasiones, pueden producirse reacciones alérgicas al tratamiento (como a cualquier otro tratamiento), que pueden ser incluso graves.
Aunque pueda parecer que existen muchos efectos adversos, es importante valorarlos con su médico especialista, puesto que en general, el beneficio potencial de utilizar este tipo de fármacos es infinitamente superior.

Artículo especializado
Qué Ocurre Cuando el Himen se Rompe
El himen se define como una membrana que se encuentra en los genitales externos femeninos . Es una membrana horadada fina que recubre la vagina y que deja salir hacia afuera las secreciones del aparato genital interno, como la menstruación. Está relacionada con las siguientes estructuras anatómicas:
La cara inferior o externa es convexa y se corresponde con los labios menores
Su cara superior o interna mira hacia la cavidad vaginal.
El borde que circunscribe el orificio himeneal es libre y delgado y más o menos festoneado o dentellado.
En la mujer adulta la morfología externa puede variar, lo habitual es que tenga una forma anular con un orificio más o menos redondeado en su centro.
La perforación normal en la mujer adulta es aproximadamente de 1 cm. El tamaño del orificio himeneal es variable y cambia con la edad, la condición física, el uso de tampones, las relaciones sexuales, la práctica de determinados deportes…
El exceso de rigidez puede ocasionar sangrados en las primeras relaciones y en casos de coitos imposibles, en estas situaciones puede ser necesaria una pequeña intervención quirúrgica.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Qué anomalías pueden afectarle
Las anomalías en el himen se producen por un defecto en la canalización de la porción distal de la vagina en el desarrollo embriológico. Estas anomalías son frecuentes porque el himen es la estructura más variable de los genitales.
Himen imperforado. La falta de comunicación entre vagina y vulva puede pasar desapercibida. Al aparecer las primeras secreciones, éstas se depositan en la vagina provocando inicialmente un acúmulo de secreciones que van desde las que tienen aspecto transparente o gelatinoso, tipo moco, a las que tienen contenido de sangre. La forma en la que este trastorno se hace visible es como una membrana delgada, brillante, que asoma por los genitales externos. Si las secreciones son muy abundantes la membrana estará abombada y se verá de color azulado. Esta alteración se diagnostica en la infancia o en el momento de la pubertad, una vez que se ha iniciado la menarquia (primera regla). La clínica más frecuente es dolor en la parte baja de la tripa, como de ovarios, este dolor suele puntual en algún momento del mes. Si no se produce la salida de estas secreciones el dolor se puede llegar a convertir en un dolor crónico pélvico, de creciente intensidad. El diagnóstico es sencillo, es suficiente con mirarle los genitales externos a la mujer. Hay que diferenciarla de otra patología que es la sinequia de la vagina . Sinequia no es otra cosa que fusión, y es que en esta dolencia las paredes vaginales están pegadas en la porción más inferior, la más externa, y también hay que diferenciarla de otra alteración que es la atresia vaginal (no presencia de vagina).
Apertura himeneal incompleta (himen microperforado, septado y cribiforme). Generalmente es asintomático y empieza con dificultad para la inserción de tampones higiénicos o para mantener relaciones sexuales. Por la retención de secreciones puede producir manchado y un aumento de flujo maloliente.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
¿En qué consiste la cirugía?
Tanto en el himen imperforado como en la apertura himeneal incompleta el tratamiento es quirúrgico. La himenectomía es un procedimiento quirúrgico sencillo de fácil recuperación. Por lo general, con una intervención es suficiente ya que el epitelio del himen es difícil que se reepitelice, y no suele ser necesario intervenir de nuevo porque el himen se haya vuelto a cerrar. Se suele realizar de forma ambulatoria , es decir, sin necesidad de ingreso hospitalario y bajo anestesia general. La técnica consiste en realizar una incisión en forma de cruz desde las 10 a las 4 y desde las 2 a las 8 horas del cuadrante del reloj sobre la membrana himeneal. Luego se recortan los colgajos del anillo himeneal y se suturan los bordes. Los cuidados posteriores consisten en realizar lavados de asiento dos veces al día y revisión en consulta en el plazo de 15 días.
Himen artificial
El himen artificial es una especie de prótesis de plástic o o albúmina de 5 x 7 cm con una tinta roja a los lados que durante el coito deja escurrir unas gotitas de “sangre”. Permite simular un himen intacto y se utiliza en algunas culturas como preservación de la honra de la mujer y de su familia.
Cirugía de reconstrucción
Existe también la cirugía de la reconstrucción del himen o himenoplastia , muy solicitada por mujeres en cuya cultura se le da mucha importancia al hecho de la virginidad. La técnica más frecuente es aquella en la que simplemente se unen los restos de himen que puedan quedar aplicando anestesia local. En esta técnica las relaciones sexuales deben mantenerse en los primeros días ya que la técnica es poco duradera. No como en la cirugía vaginal plástica, en la que se hace una incisión a ambos lados de las paredes vaginales y se unen entre sí. En este caso las relaciones se deben posponer unos días para que se cicatricen bien los tejidos.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Artículo especializado
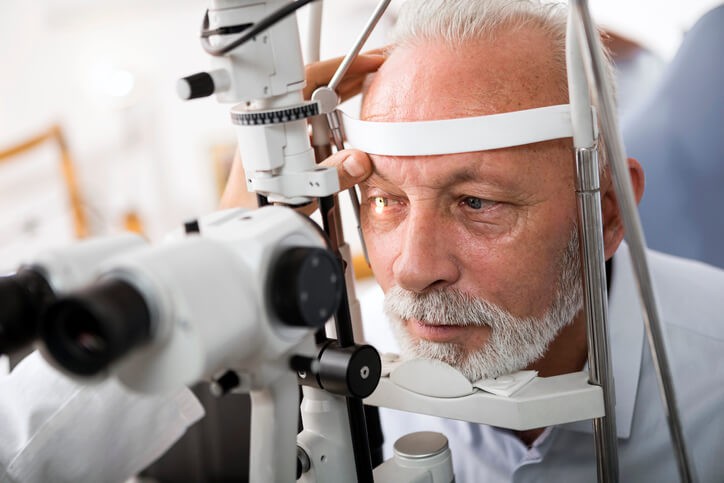
Síntomas, Tratamiento y Prevención del Glaucoma
¿Has oído hablar alguna vez de la “ceguera silenciosa ”? ¿Sabes lo qué es? Se le llama coloquialmente así a la enfermedad del glaucoma y la importancia de conocer su existencia radica en que es básica la prevención de cara a su aparición. ¡Vigila y revisa periódicamente tu presión intraocular!
Qué es
El glaucoma es una enfermedad óptica grave caracterizada por una afectación del nervio óptico y defectos en el campo visual, generalmente progresiva. Se presenta de diferentes formas:
Glaucoma de ángulo cerrado : se produce una elevación brusca de la presión intraocular. La sintomatología se caracterizará por la aparición de un dolor ocular intenso (en clavo), ojo rojo, dilatación pupilar fija (midriasis), córnea opacificada y síntomas vegetativos (náuseas y vómitos) con dolores de cabeza. Se trata de una urgencia médica, y es una patología rara.
Glaucoma crónico simple o de ángulo abierto : es el más frecuente y una de las primeras causas de ceguera en el mundo desarrollado. Su prevalencia suele estimarse entre el 1%-1’5%. Es asintomático y produce una pérdida de campo visual periférico que el paciente no percibe. sólo en estadios avanzados hay afectación de la visión central en la retina y por tanto déficit de agudeza visual.
Glaucoma congénito primario de ángulo abierto : está presente al nacimiento en el 25% de los casos, en el 80% antes del año de edad. Dos de cada tres de los niños afectados son varones. Se trata de una patología ocular rara en la edad pediátrica pero que puede ser extremadamente grave. Supone el 5-18% de las cegueras infantiles.
En los niños, un aumento del tamaño del globo ocular (buftalmos) y una córnea aumentada de tamaño (megalocórnea) pueden ser signos de existencia de glaucoma. En este caso, esta córnea además presentará un aspecto turbio, existirá lagrimeo y el niño presentará fotofobia (molestias al mirar directamente a la luz).
Causas
Demográficas: aumenta con la edad (a partir de los 60 años de edad, se presenta siete veces más), en la raza negra y el sexo masculino.
Genéticos: herencia multifactorial, aumenta el riesgo entre familiares de primer grado.
Enfermedades sistémicas : mayor prevalencia en enfermos diabéticos.
Oculares: el aumento de la presión intraocular es factor de riesgo para la aparición de daño glaucomatoso, aunque el efecto de ésta en la generación de la lesión del nervio óptico en la actualidad todavía no es del todo bien conocido. Este es el único factor de riesgo sobre el que podemos implementar actividades preventivas.
Diagnóstico
Se necesitan instrumentos ópticos especiales para el examen del ojo. No obstante, pese a que un enfermo determinado pueda precisar una atención ocular especializada, la evaluación inicial de los síntomas oculares está al alcance de todos los médicos y la valoración de la agudeza visual, pupilas, movimientos oculares, campos visuales y fondo de ojo forma parte de toda exploración física completa.
Tonometría: mide la tensión ocular. No existe una cifra exacta de PIO que separe a los individuos afectos de glaucoma de los sanos. El valor medio se sitúa en los 15.5 mmHg; se considera normal hasta 20 mmHg, sospechoso de glaucoma entre 20-24h mmHg y patológico igual o superior a 25 mmHg. Asimetrías en el valor de la PIO entre ambos ojos mayores a 5 mmHg también deben ser sospechosas de glaucoma.
Oftalmoscopia: se conoce como “fondo de ojo” al área interna del ojo que se puede observar por medio de la oftalmoscopia, incluyendo la retina, sus vasos sanguíneos y el nervio óptico. El examen de fondo de ojo puede realizarse sin dilatación para una primera observación de las estructuras del polo posterior del ojo (papila y mácula) pero requiere de una dilatación de la pupila para poder explorar con comodidad toda la extensión de la retina. Al dirigir una luz a través de la pupila, y traspasar ésta todos los medios transparentes anteriores del ojo, se observa un reflejo rojizo que normalmente la llena de manera casi uniforme. La presencia de un reflejo rojo normal indica que no existen opacidades en el camino de la luz, y que la retina, al menos en su porción posterior, no está desprendida.
Campo visual (campimetría): explora la sensibilidad retiniana en cada punto del campo visual. Es necesario realizarlo para el diagnóstico e imprescindible en el seguimiento evolutivo de la enfermedad. Los hallazgos campimétricos que se presentan en el glaucoma son: estrechamiento del campo visual periférico (“visión de túnel”), agrandamiento de la mancha ciega y áreas arqueadas de déficit de visión alrededor de la mancha ciega (escotomas arqueados). Podemos afirmar que la enfermedad está bien tratada cuando no hay progresión del defecto campimétrico.
Tratamiento y pronóstico
El glaucoma no tiene un tratamiento curativo definitivo. Se puede evitar la evolución natural a la ceguera manteniendo una presión intraocular lo suficientemente baja (en general, por debajo de 20mmHg) para que no progrese la lesión del nervio óptico. El tratamiento debe mantenerse a lo largo de los años.
El tratamiento quirúrgico puede consistir en la denominada trabeculoplastia, en la que se realizan impactos con láser de argón en el trabeculum (estructura por donde drena el humor acuoso) y es prácticamente inocua, o en la denominada trabeculotomía, en la que se crea una nueva vía de salida artificial del humor acuoso a través del trabeculum. Con los años puede volver a cerrarse, lo que supondrá tener que recurrir nuevamente a la instauración de tratamiento médico o nuevamente quirúrgico.
En el caso del glaucoma de ángulo cerrado, las medidas terapéuticas irán encaminadas a intentar reducir farmacológicamente la presión intraocular, a intentar reducir el volumen intraocular de humor acuoso y, finalmente, a revertir la dilatación pupilar. Se deberá dirigir al paciente al especialista en oftalmología para el tratamiento definitivo, que consiste en la práctica de una intervención quirúrgica llamada iridotomía, mediante láser, si la inflamación ocular lo permite. De lo contrario, sería la técnica convencional quirúrgica urgente (se practica una ventana en el iris que permite el paso del humor acuoso acumulado a su través). Se deberá practicar una iridotomía preventiva (profiláctica) en el otro ojo.
Si el diagnóstico y tratamiento precoces son importantes en todas las formas de glaucoma, en el caso del niño son fundamentales para evitar secuelas irreversibles.

Artículo especializado
Cómo Prevenir el Ictus
En la sociedad occidental actual, en la que los estilos de vida (alimentación, nivel de estrés, sedentarismo…) han cambiado notablemente, el ictus es una de las patologías que más problemas de salud y mortalidad causa . De hecho, es la primera causa de muerte en las mujeres y la primera causa de discapacidad en nuestro país. Pero… ¡no todo son malas noticias! Se puede actuar eficazmente a muchos niveles para disminuir su impacto. Si no, atento a estos datos:
Cuantos más factores de riesgo presente una persona, mayor será el riesgo de que lo sufra. Simplemente adoptando una serie de consejos sencillos que vamos a exponer a continuación, entre el 60 y el 80% de los ictus se pueden prevenir.
Una vez padecido, la identificación inmediata de sus síntomas será crucial en la evolución del enfermo. Te explicamos cuáles son esos síntomas para que puedas reconocerlos con agilidad. ¡Puedes salvar una vida!
La precocidad en el acceso al tratamiento aumenta la probabilidad de recuperación casi total o con muy pocas secuelas del enfermo. ¡Avisa con celeridad a los servicios médicos de emergencia!
¿Qué es un ictus?
El “ictus”, “ataque cerebral” o “accidente vascular cerebral (AVC)” es una enfermedad cerebrovascular que se produce por la disminución u obstrucción del flujo sanguíneo que llega al cerebro y, por tanto, éste no recibe la cantidad necesaria de oxígeno, lo que provoca que las células nerviosas dejen de funcionar o, incluso, mueran.
Hasta 1 de cada 6 personas en el mundo padecerá un ictus en algún momento de su vida. Aunque los accidentes cerebrovasculares suelen afectar en mayor medida a los mayores de 65 años, en los últimos años la incidencia en menores de 64 años creció de forma significativa.
Existen dos grandes categorías de ataque cerebral: aquellos llamados “isquémicos” y causados por un bloqueo del flujo sanguíneo (por la generación de una trombosis, una embolia vascular o por una estenosis) y aquellos llamados “ hemorrágicos ”, causados por una hemorragia, coloquialmente denominada derrame cerebral.
La formación de un coágulo dentro del vaso sanguíneo en el cerebro o en el cuello se denomina “trombosis”.
El movimiento del coágulo por el torrente sanguíneo desde otra parte del cuerpo, como p.ej. desde el corazón al cerebro, se denomina “embolia”.
El estrechamiento grave de una arteria dentro del cerebro o que va hacia él se denomina “ estenosis ”.
Los trastornos cardíacos comunes como la enfermedad coronaria, las valvulopatías, el latido cardíaco irregular (fibrilación auricular) o el aumento de tamaño de una de las 4 cámaras cardiacas, pueden dar lugar, como resultado, a la formación de coágulos que pueden bloquear vasos sanguíneos dentro del cerebro o que van hacia él y también que éstos se desprendan y viajen a otros puntos del organismo. Su médico tratará su enfermedad cardíaca y también podría recetar medicamentos, como la aspirina, para ayudar a prevenir la formación de coágulos. Incluso podría recomendarle la cirugía para limpiar una arteria del cuello tapada si usted presenta un perfil de riesgo particular.
Signos y síntomas
Algunas de las señales de alarma son las siguientes:
El entumecimiento, la pérdida de fuerza o de la sensibilidad en la mitad del cuerpo (a nivel del brazo o la pierna). A nivel facial, la asimetría entre ambos lados de la cara (la desviación de la comisura labial).
La visión se vuelve borrosa o incluso se pierde repentinamente, de uno o los dos ojos.
Confusión súbita, dificultad para hablar o no se entiende lo que el enfermo dice cuando habla (Disartria).
Dolor de cabeza intenso y repentino asociado o no a la presencia de vómitos.
Cuando se presenten estos síntomas no debemos caer en los errores siguientes:
Decir “¡ya se me pasará!”, retrasando la llegada a un hospital.
Automedicarse , sin haber consultado antes el consejo específico de un médico.
Conducir el coche personalmente para acudir al centro médico.
Ante la más mínima sospecha de estar padeciendo un ictus, lo más seguro y acertado siempre será avisar a los servicios médicos de emergencia y simplemente decir “¡creo que me está dando un ictus!”.
A veces los signos de advertencia pueden durar solamente unos pocos segundos o minutos y luego desaparecen. Estos episodios conocidos como “ataques isquémicos transitorios (AIT)”, aunque son breves, identifican una afección seria subyacente que no desaparece sin atención médica. Desgraciadamente, cuando se disipan, muchas personas los ignoran. ¡No lo hagas y préstales atención: pueden salvarte la vida!
Factores de riesgo
Cabe destacar que tener un factor de riesgo no implica que forzosamente se vaya a padecer un ictus, sólo indica un aumento de probabilidad de padecerlo.
Algunos de los factores de riesgo asociados al ictus no pueden controlarse, como es el caso de la edad, o la herencia genética, pero otros muchos sí pueden ser controlados (como p.ej. el tratamiento de la enfermedad cardiaca) y algunos de ellos incluso con gran éxito.
Decálogo de consejos para reducir el riesgo de padecer un accidente cerebrovascular
Controla la hipertensión arterial: es el principal factor predisponente a padecer ictus. Conviene intentar mantener sus niveles en valores óptimos.
Deja de fumar: si necesitas ayuda, consulte con los especialistas.
Reduce el consumo de alcohol : porque un buen número de ictus están provocados por un consumo abusivo de alcohol.
¡ Adelgaza! La obesidad suele llevar asociada problemas de hipercolesterolemia, diabetes o el sedentarismo, así como enfermedad cardiovascular.
Dieta sana y equilibrada : aprovecha nuestra dieta mediterránea y aumenta el consumo de verduras, frutas y hortalizas.
Controla la diabetes.
Controla el colesterol elevado : junto con el tabaco es el principal causante de la creación de la placa arteriosclerótica que obstruye o tapona las arterias.
Muévete más: la práctica de ejercicio físico con regularidad es el mejor aliado en la prevención del ictus debido a que mantiene un corazón fuerte y unas arterias limpias. ¡Sólo con caminar una hora a diario ya es suficiente!
Mantente sereno y positivo : el estrés crónico y/o el carácter “temperamental” aumenta el riesgo de ictus.
Aumenta la reserva cognitiva : leer, aprender un idioma, hacer tareas bimanuales, o escribir un diario son experiencias que hacen a nuestro cerebro más resistente frente a posibles secuelas de ictus y hacer que la recuperación sea significativamente mejor.
Tratamiento
El ACV es una emergencia neurológica que requiere un tratamiento inmediato. Los estudios científicos han situado el denominado “tratamiento trombolítico” como la primera elección terapéutica durante las primeras tres horas de iniciado el evento isquémico, cuando los cambios cerebrales todavía no se han evidenciado en las imágenes del TC (o TAC) cerebral.

Artículo especializado
Las Infecciones Vaginales más Comunes
Aproximadamente un 75% de las mujeres experimentan un episodio de infección vaginal a lo largo de su vida y, casi un 50%, un segundo. Puede afectar a mujeres de todas las edades, independientemente de su actividad sexual y son uno de los motivos más frecuentes de consulta, tanto en atención primaria como en la consulta del ginecólogo.
¿Qué es la vulvovaginitis?
Las infecciones vaginales reciben el nombre de vulvovaginitis que no es otra cosa que la inflamación de la mucosa vaginal y de la piel vulvar , pero no siempre se afectan ambas áreas anatómicas de forma simultánea. Generalmente, la causa es infecciosa (micosis, vaginosis y trichomoniasis) pero puede ser de origen no infeccioso.
La vaginitis está causada por un cambio en el equilibrio normal de las bacterias vaginales, una infección o una reducción en los niveles de estrógenos después de la menopausia. Las afectadas suelen notar picor e irritación de la zona genital acompañada de un aumento de secreción vaginal, en ocasiones, maloliente.
¿Cómo son las secreciones normales?
Las secreciones vaginales son normales y son un mecanismo de defensa de la mucosa genital que ayuda a limpiar y mantener húmeda la vagina. Dependiendo del momento del ciclo, pueden ser más o menos abundantes. Son normales cuando cumplen estas características:
Son blancas, ligeramente amarillentas y turbias
No presentan olor desagradable.
Su olor normal es ligeramente salado
A mitad del ciclo menstrual, durante la ovulación, son más espesas o “fibrosas ” (como la clara de un huevo)
La flora o microbiota vaginal
Es el conjunto de microorganismos que habitan en condiciones normales en la vagina. Es un ecosistema complejo y cambiante, que depende de los cambios hormonales y la edad. Cuando está en equilibrio, forma una excelente defensa de la zona genital contra los agresores externos.
Los lactobacilos son los protagonistas del mantenimiento del ecosistema vaginal. Sus funcionen consisten en competir con los hongos , es decir, se alimentan de las mismas sustancias, manteniendo a raya el crecimiento anormal de los hongos para que no causen enfermedad. También producen sustancias que son capaces de metabolizar la glucosa a ácido láctico . Este ácido es el responsable de mantener el pH vaginal ligeramente ácido (entre 3,5 – 4,5), representando el principal mecanismo de defensa frente a la colonización por patógenos.
No es de extrañar, sabiendo todo esto que se hayan desarrollado jabones de higiene íntima específicos que mantienen el pH de la zona genital en este rango, así como el uso de probióticos, de administración vaginal y oral, como preventivos en mujeres con vulvovaginitis de repetición.
Causas más frecuentes de vaginitis o vulvovaginitis
Infecciones por hongos (candidiasis)
La vaginosis bacteriana
La trichomoniasis
Enfermedades de transmisión sexual como la gonorrea o la Chlamydia (estas últimas son menos comunes, pero pueden producir secreciones vaginales que nos alerten de que algo no va bien).
¿Cómo sé si tengo una vulvovaginitis?
Los síntomas pueden ser más o menos intensos. Los más frecuentes son: secreciones vaginales anormales y malolientes, picazón o irritación, micción dolorosa y dolo r o irritación durante las relaciones sexuales. Sin embargo, algunas mujeres pueden no tener síntomas y no darse cuenta de ellos si no son muy intensos. Se debe acudir siempre al centro de salud o al ginecólogo para que realizar un buen diagnóstico y un correcto tratamiento.
Vulvovaginitis candidiásica
La vulvovaginitis candidiásica es una enfermedad inflamatoria de la vagina y vulva , producida por hongos, fundamentalmente Candida spp . Un desencadenante muy frecuente es la aparición de este tipo de infección tras la toma de antibióticos , ya que estos alteran y eliminan las bacterias de la flora normal. Es importante recordar que la Candida puede formar parte de la flora normal femenina y es sólo cuando crece de forma descontrolada produce patología o molestias. Esta infección representa el 25% de los casos de vulvovaginitis.
Las mujeres inmunodeprimidas o con una diabetes no controlada, suelen tener mayor predisposición a padecer candidiasis recurrentes o de difícil control. La mayoría, sin embargo, son vulvovaginitis que se tratan y se curan sin problemas. Las infecciones por hongos tienen mas probabilidades de aparecer justo antes o después del período menstrual.
Los síntomas que da son:
Aumento de la secreción vaginal: más blanquecina y grumosa (aspecto de yogur)
Picor
Molestias al orinar
Sensación de ardor o escozor en genitales externos
Dolor o escozor durante las relaciones sexuales
Lesiones en la piel de la vulva y el periné
El diagnóstico no debe basarse exclusivamente en los síntomas y debe realizarse una exploración y pruebas complementarias , como un frotis con tinción (para ver los hongos) y cultivo de las secreciones para saber el tipo de hongo que causa el problema.
En las candidiasis no complicadas sólo es necesario aplicar una crema o unos óvulos en el área vaginal. En casos complicados o resistentes, puede ser necesario la toma de una antifúngico (medicamento contra los hongos) por vía oral.
Vaginosis bacteriana
Es una entidad muy frecuente que se caracteriza, sobre todo, por un i ncremento en la secreción vaginal que se hace más acuosa y maloliente. El flujo es espumoso y tiene olor a pescado. Afecta aproximadamente al 8-30% de las mujeres sexualmente activas.
Hace unos años se creía que la vaginosis era causada, exclusivamente, por una bacteria llamada Gardnerella vaginalis . Hoy se sabe que su causa el polibacteriana (la causan diferentes bacterias) y sin componente inflamatorio. La Gardnerella se identifica en el 10% de mujeres sin esta patología.
La vaginosis se entiende, actualmente, como una variante de la microbiota vaginal dónde aparece una flora superpoblada de bacterias en la zona genital. El mal olor estaría justificado por este aumento de bacterias así como de su actividad enzimática, que, a su vez, aumentaría el volumen de desechos.
No se sabe con exactitud qué lleva a desarrollar este desequilibrio normal de la microbiota. Una hipótesis reciente la considera una forma natural de respuesta a la actividad sexual.
Vulvovaginitis por Trichomona
La Trichomona vaginalis es un protozoo o parásito que puede infectar la vagina y que no forma parte de la flora normal. Es catalogada como una enfermedad de transmisión sexual .
Se caracteriza por el mal olor y aumento de las secreciones vaginales. Estas son de un color amarillo-verdoso. El picor y la irritación de la zona genital es muy intenso. Hay mujeres, por eso, que no tienen a penas síntomas. Es importante descartar esta infección en embarazadas, ya que su presencia se ha relacionado con rotura prematura de membranas, parto pretérmino, o bajo peso al nacer.
Para el diagnóstico se realiza un frotis de las secreciones y se observa al microscopio para observar la presencia del protozoo. Se debe dar un medicamento específico para eliminar el parásito. En este caso, debe ser tratada la mujer y su pareja.
MEDIDAS PREVENTIVAS: CÓMO PUEDO CUIDAR MI ZONA ÍNTIMA
La mejor manera de evitar problemas en la zona genital es mantener una correcta higiene. Las medidas que detallamos a continuación son importantes tenerlas en cuenta:
Mantener el área genital limpia y seca.
No es conveniente realizar duchas vaginales, ya que pueden causar infecciones al alterar el equilibrio de la flora.
El uso de productos de higiene femenina (incluso el papel higiénico perfumado) con perfumes pueden alterar la flora.
Evitar el uso de polvos de talco.
No utilizar desodorantes en la zona genital o jabones no específicos.
El uso de ropa apretada y sintética puede atrapar la humedad y ser muy irritante.
El uso de ropa interior de algodón absorbe la humedad y mantiene el área genital mejor ventilada.
Hay que tener en cuenta que sustancias como espermicidas, detergentes o suavizantes de la ropa pueden causar irritaciones.
Cambia los tampones y las toallas sanitarias cada 4 a 8 horas. Lavar la copa menstrual de forma cuidadosa según las instrucciones.
Tener una higiene diaria con jabones adecuados para la zona íntima, con un pH que no desequilibre la flora genital.
Mantener la zona genital seca, por ejemplo, tras ir a la playa o la piscina no quedarse con el bañador húmedo.

Artículo especializado
¿Por qué se produce intolerancia a la lactosa?
¿Sabías que la cantidad de lactosa tolerada por cada persona es variable y que, por tanto, las recomendaciones dietéticas deben ajustarse a las necesidades y tolerancia de cada cual? Alrededor del 20% de la población española sufre intolerancia a la lactosa (IL), si bien no se encuentran cifras oficiales ya que existen muchos casos de intolerancia a la lactosa de distinta intensidad sin diagnosticar al no considerarse una patología.
Alergia e intolerancia alimentaria: diferencias
Aún hoy es muy común confundir la alergia alimentaria y la intolerancia alimentaria, de manera que es habitual utilizar ambos términos como sinónimos, cuando en realidad son muy diferentes.
Se considera que existe alergia alimentaria siempre que aparece una reacción inmunológica , sea ésta mediada o no por anticuerpos, como respuesta a la ingesta de un alimento o aditivo. La manifestación clínica cursa con:
Problemas para respirar, opresión en la garganta, ronquera, tos
Dolor de estómago, vómitos.
Urticaria, inflamación.
Disminución de la tensión arterial, anafilaxia.
En muchas ocasiones, la reacción alérgica aparece aun cuando la persona haya ingerido sólo una pequeñísima cantidad del alimento, o a veces incluso con solo tocarlo o inhalarlo.
La intolerancia alimentaria es una reacción adversa en la que no se puede demostrar ninguna reacción de hipersensibilidad del sistema inmunológico. Esta intolerancia se debe a la acción de alimentos o aditivos que contienen determinadas sustancias que causarán una alteración de la mucosa digestiva, o bien síntomas por su consumo excesivo. Estos síntomas son:
Náuseas y gases.
Retortijones abdominales.
Diarrea.
Dolor de cabeza.
Sensación de nerviosismo e irritabilidad.
¿Qué es la lactosa?
La lactosa es un azúcar presente en todas las leches de los mamíferos : vaca, cabra, oveja y en la humana; y también puede encontrarse en muchos alimentos preparados (natas, cremas, postres, helados…) y en ciertos medicamentos. Se le llama azúcar de la leche, un disacárido natural compuesto de glucosa y galactosa.
¿Qué es la lactasa?
La lactasa es una enzima producida por el intestino delgado que desdobla la lactosa en sus dos componentes básicos (glucosa y galactosa) para que éstos puedan ser absorbidos por nuestro organismo. Ésta es la última enzima en aparecer y madurar en el bebé que está a punto de nacer. Muestra su máxima actividad en el momento de nacer y durante el periodo de lactancia, y empieza a descender su actividad tras el destete.
Cuando la persona tiene un déficit de esta enzima, la lactosa de la dieta no puede ser digerida de manera correcta en el intestino delgado, por lo que pasa directamente al intestino grueso, donde es fermentada por la flora bacteriana, provocando náuseas, diarrea , calambres, gases e hinchazón del vientre . Esta situación se conoce como intolerancia a la lactosa.
¿Qué síntomas presenta la intolerancia a la lactosa?
Para identificarla, se debe tener en cuenta que en la mayoría de las ocasiones suelen aparecer uno o varios de los siguientes síntomas de manera simultánea tras la ingesta de productos que contengan lactosa; pueden presentarse entre 30 minutos y 2 horas después :
Náuseas
Hinchazón abdominal
Dolor abdominal
Distensión abdominal
Ruidos abdominales
Gases (como hidrógeno, dióxido de carbono y metano)
Diarrea
Heces con olor fétido
Pérdida de peso
En algunos casos también puede aparecer estreñimiento , esto es debido a una disminución de la motilidad del intestino como consecuencia de las bacterias productoras de metano.
La intensidad de los síntomas no solo va a depender del umbral de cada persona, sino también de la cantidad de lactosa ingerida, el tipo de lácteo que se haya tomado, la motilidad intestinal, de la actividad de la lactasa, la capacidad que tenga el colon de absorber el agua, el consumo junto con otros alimentos y de la actividad de la flora intestinal.
Diagnóstico de la intolerancia a la lactosa
El diagnóstico debe ser médico. El digestólogo cuenta con una serie de pruebas que le permiten valorar la LNP (deficiencia primaria de lactasa) mediante test genético o biopsia intestinal ; y la mala digestión (incapacidad de digerir la lactosa) mediante test de hidrógeno, test de tolerancia a la glucosa y test de gaxilosa . Pero el diagnostico final de IL es difícil porque no todas las personas con LNP+mala digestión sufren IL (es decir, no padecen síntomas). Por lo tanto, el medico especialista debe tener en cuenta los síntomas “subjetivos” detectados por el paciente como diarrea, hinchazón, gases , etc.
Como ya hemos dicho anteriormente hay varios factores (algunos relacionados con el consumo de alimentos y otros con la propia fisiología de cada persona) que influyen en la aparición o no de los síntomas y su intensidad.
¿Qué tratamiento dietético seguir si se padece intolerancia a la lactosa?
El único tratamiento para la IL es la reducción o eliminación de la lactosa , adaptada al nivel de tolerancia de cada persona.
Tal y como he comentado, la lactosa es un azúcar presente en todas las leches de los mamíferos, y, por tanto, también en todos los derivados lácteos y productos que contengan leche.
La cantidad de lactosa presente en los alimentos lácteos es variable, por ejemplo, mientras que la leche presenta un contenido mayor, los yogures y quesos son tolerados por personas con intolerancia parcial a la lactosa. Se deben excluir de la dieta la leche y los todos los derivados lácteos , además de aquellos productos que en su composición contienen leche o algún derivado lácteo. En su lugar, se puede optar por lácteos exentos de lactosa (leche, yogur y queso) o por bebidas o postres vegetales (avena, soja, kamut, espelta, almendra, arroz) siempre enriquecidos en calcio y vitamina D.
Debido a que se limita el consumo de estos productos, se pueden experimentar carencias nutricionales (calcio y vitamina D). Por ello debemos aumentar el consumo de otros alimentos ricos en estos micronutrientes.
Alimentos ricos en calcio (excluyendo los lácteos)
Frutos secos y semillas : sésamo y tahini (pasta de sésamo), nueces, semillas de girasol y de calabaza, avellanas, almendras, pistachos, castañas.
Frutas secas : higos secos, dátiles, uvas pasas.
Verduras frescas: de hoja verde como el brécol, repollo, grelos, nabizas, apio, espinacas, perejil, puerro, col rizada, etc.
Algas marinas: hiziki, arame, wakame, kombu y agar-agar.
Cereales integrales : avena, arroz, cebada, trigo.
Legumbres : garbanzos, guisantes, judías blancas y pintas, habas, soja, lentejas.
Brote de alfalfa y germinados de cebada o trigo.
Bebidas vegetales : arroz, soja, avena, almendras, avellanas, sésamo, chufas.
Pescados azules : bacalao, caballa, salmón, sardinas, angulas, langostinos y arenques frescos.
Alimentos ricos en vitamina D
Pescados azules : bonito, arenques, salmón, anchoas, sardinas, trucha, caballa, atún.
Huevos
Productos enriquecidos en esta vitamina .
Además, es aconsejable una exposición controlada a los rayos de sol , ya que así contribuiremos a la síntesis de vitamina D en la piel. También es recomendable practicar de forma regular ejercicio físico (adaptado a las características de cada persona) para favorecer el mantenimiento de la densidad ósea.
¿SON NECESARIOS LOS SUPLEMENTOS DE LACTASA?
En la farmacia se pueden encontrar suplementos de lactasa en forma de pastilla o cápsula que permiten consumir productos lácteos. Se recomiendan para un uso esporádico, cuando se come fuera de casa y no se puede controlar la preparación de las comidas. Estos suplementos aportan la lactasa que se necesita para digerir la lactosa de una comida en concreto, por lo tanto se debe tomar cada vez que se haga una comida, ya que el efecto es momentáneo.
El problema está en encontrar la dosis adecuada, que como ya he mencionado antes, dependerá de varios factores, pero especialmente de la relación entre el nivel de enzima lactasa y la cantidad de lactosa ingerida.
¿SABÍAS QUE…?
La lactosa se tolera mejor si se ingiere con otros alimentos que si se toma de forma aislada.
La lactosa se tolera mejor si se distribuye su ingesta a lo largo de todo el día (con otros alimentos) que si se ingiere en una única toma.
Algunos medicamentos pueden contener lactosa. Consúltelo con su médico.
Puede haber alimentos que habitualmente no contienen lácteos, pero se les ha agregado lactosa en alguna etapa de su preparación. Por ello es aconsejable leer atentamente las etiquetas de los productos y preguntar en restaurantes, y así evitarlos.

Artículo especializado
Linfoma no Hodking en Adultos
El linfoma no Hodgkin es el tumor de las paradojas: el tumor que no es un tumor sino muchos y que en ocasiones es mejor cuando es peor (la probabilidad de curación aumenta cuando el tumor es más agresivo).
¿Qué es?
Un linfoma es un tipo de tumor maligno originado en el tejido linfoide . Se inicia cuando una de las células del tejido linfoide sufre una mutación genética que provoca que se multiplique sin control, creando un tumor que va creciendo y frecuentemente afectando a tejidos de su alrededor. El tejido linfático está distribuido por todo nuestro organismo en forma de vasos linfáticos (un sistema similar al sistema venoso) y de ganglios linfáticos , aunque también pertenecen al tejido linfático órganos como el bazo, las amígdalas o el timo (un pequeño órgano situado en la parte superior del tórax, por detrás del esternón). Gran parte de este tejido está directamente relacionado con el sistema inmune (las defensas) del organismo, por lo que este tipo de tumores pertenecen a los llamados tumores hematológicos, como las leucemias.
¿Dónde se produce?
Dado que el tejido linfático está distribuido por todo nuestro cuerpo, el tumor puede originarse en cualquier localización, aunque es más frecuente que se origine en el cuello, en el tórax o en el abdomen . En raras ocasiones, estos tumores pueden originarse en otras localizaciones como en la piel, el cerebro, el corazón, etc.
El linfoma no Hodgkin no se trata en realidad de un tipo concreto de cáncer, sino que bajo este nombre se engloban más de 20 tipos distintos , cada uno con unas particularidades que lo diferencian del resto. El nombre de Linfoma no Hodgkin se utiliza para diferenciarlo del Linfoma de Hodgkin, un tipo concreto de linfoma con unas características y un pronóstico muy diferente al resto de linfomas.
¿A cuánta gente afecta?
Se estima que en 2017 se han diagnosticado aproximadamente unos 6.429 nuevos casos de Linfoma no Hodgkin, siendo el noveno tipo de cáncer más frecuente de nuestro país. Es alrededor de un 30% más frecuente en hombres que en mujeres.
¿SABÍAS QUE…
La mortalidad del Linfoma no Hodgkin ha ido disminuyendo progresivamente en los últimos años gracias a los avances en los tratamientos que se utilizan, llegando en la actualidad a una tasa de supervivencia media a los cinco años superior al 70%, aunque para los tipos de más bajo riesgo la tasa de supervivencias a los cinco años es superior al 91%.
¿Por qué se produce?
El motivo de la aparición de un Linfoma no Hodgkin, como ya hemos dicho, es una mutación en una de las células del tejido linfático. La causa de estas mutaciones es desconocida, pero lo que sí que se conocen son factores que pueden favorecer su aparición:
La edad: es el principal factor de riesgo conocido. La mayoría de pacientes que presentan un Linfoma no Hodgkin se encuentran por encima de los 60 años. Existen casos también de Linfomas no Hodgkin diagnosticados en niños, pero mucho menos frecuentemente de lo que se diagnostican en adultos.
Exposición a productos químicos : algunos estudios demuestran mayor incidencia en la aparición de linfoma en pacientes expuestos a herbicidas o insecticidas. Como ya hemos comentado, algunos tratamientos inmunosupresores como la quimioterapia utilizada para tratar otro tipo de cánceres, pueden aumentar también el riesgo de desarrollar un Linfoma no Hodgkin.
Exposición a radiaciones : la exposición incontrolada a radiación puede aumentar el riesgo de presentar tumores hematológicos, como leucemias o linfomas. Sin embargo, cabe destacar que la radiación recibida al realizar estudios radiológicos como radiografías o TACs (escáneres) es muy limitada y no supone un riesgo para desarrollar este tipo de enfermedades.
Enfermedades que afecten al sistema inmune : las personas con algunos tipos de infecciones (VIH, virus de Epstein-Barr o el virus herpes humano tipo 8, entre otras), enfermedades autoinmunes, algunos síndromes genéticos, y las personas que han precisado un trasplante de órganos, tienen un riesgo algo superior al del resto de la población para desarrollar esta enfermedad.
¿Cómo se presenta?
Los síntomas que puede provocar un linfoma no Hodgkin son muy inespecíficos, ya que dependen en gran parte de la localización en la que aparezca el tumor y del tipo de tumor en concreto que se trate.
Más del 60% de los casos se detectarán por la palpación de un bulto en alguna localización (en muchas ocasiones un ganglio aumentado de tamaño).
En alrededor de un 40% de los casos se presenta un síndrome con síntomas generales como fiebre, pérdida de peso, episodios de sudoración profusa sin motivo aparente, etc. Más rara es la presentación del linfoma en forma de cansancio, falta de apetito, malestar general, dolores óseos, etc.
¿Cómo se diagnostica?
Dependerá en gran medida de la localización del tumor. Se suelen usar técnicas de imagen como la ecografía (en tumores más superficiales) o el TAC (en tumores más profundos como en tórax o abdomen) para identificar la localización y el número de lesiones (en muchos casos pueden haber varios ganglios afectados).
Es preciso realizar un estudio del tejido mediante una biopsia (en la mayoría de casos obtenida mediante cirugía), aunque en algún caso se puede realizar un diagnóstico con una punción del tumor o incluso con una biopsia de médula ósea (alrededor de un 40% de casos afectan también a la médula ósea).
¿Cómo se trata?
En el caso del Linfoma no Hodgkin es muy importante destacar que hay tipos agresivos y tipos indolentes, por lo que el tratamiento y el pronóstico se basarán en gran medida en el tipo concreto de tumor del que se trate. El tratamiento también dependerá de la edad del paciente, de la extensión y de la localización de la enfermedad. En general, el tratamiento se basará en el uso de quimioterapia y en aquellos casos de tumores más localizados, de radioterapia.
En este tipo de cáncer, se produce la paradoja de que los tumores más indolentes (menos malignos), pese a que tienen buena respuesta al tratamiento, en escasas ocasiones se consigue su curación completa, y en muchas ocasiones se reproducen al cabo de los años. Sin embargo, los tumores más agresivos responden incluso mejor al tratamiento de quimioterapia que los tumores más indolentes, y en muchas ocasiones se consigue la curación completa de la enfermedad.

Artículo especializado
Qué Hacer ante una Luxación
¿Es una luxación? ¿Se acompaña de fractura? ¿Es el primer episodio o es recidivante? Si me encuentro en una situación así, ¿cómo puedo ayudar?
Para que exista una luxación debe darse una pérdida del contacto de las superficies articulares que conforman una articulación. Normalmente, va asociada a una lesión cápsulo-ligamentosa debido al traumatismo que ha ocasionado la luxación. ¿Qué quiere decir que es recidivante? Pues que esa articulación se ha luxado en varias ocasiones.
Ante todo, debemos identificar cuál es la articulación que está presuntamente luxada. El afectado se quejará de un dolor importante y presentará una impotencia funcional absoluta (no podrá moverla) pues de los dos huesos que forman la articulación uno de ellos está desplazado y no permite el recorrido normal de la articulación. Nos encontraremos una deformidad externa muy llamativa (con una gran asimetría respecto al otro lado).
Posibles causas
El mecanismo desencadenante es muy probable que haya sido un golpe seco en la zona.
Una luxación de hombro (técnicamente luxación glenohumeral). Es muy frecuente tras sufrir un accidente de moto en el que la persona se cae de lado al suelo o en el caso de un portero de fútbol que se cae al lateralizarse para coger la pelota.
En caso de luxación de tobillo (luxación tibio-peroneo-astragalina) la persona tendrá deformidad con el pie girado e impotencia funcional. Es muy frecuente en accidentes de coche de alta potencia o caídas desde elevada altura.
La luxación de los dedos de las manos (luxación interfalángica o metacarpofalángica) es frecuentísima en lesiones deportivas, sobre todo en baloncesto.
También mencionaremos la luxación de la articulación temporo-mandibular . Es la luxación de la mandíbula. Se trata de una luxación infrecuente que suele desencadenarse en personas que sufren de alguna patología previa en esta articulación y que, con un simple bostezo, se quedan con la boca abierta sin poderla cerrar. Es una situación muy embarazosa para el paciente y para las personas de su alrededor. ¿Te has encontrado con algún caso en alguna ocasión? ¿Sabías que esa articulación tiene meniscos al igual que la rodilla? Te puedo decir que en urgencias nos encontramos con algunos casos y que su reducción es muy gratificante tanto para el médico como para el paciente.
¿Cómo debo actuar si presencio una luxación?
Llegado este punto quizás debería decirte lo que no debes hacer: bajo ningún concepto te dispongas a reducir una luxación sin saber la lesión a la que nos enfrentamos. ¿No te sorprende que al llegar al hospital el médico solicite una radiografía antes de proceder a la reducción? No es que el médico dude de cómo reducir la articulación, sino que debe descartarse una fractura asociada y observar el tipo de luxación (anterior, posterior o lateral) antes de su manipulación.
Por tanto, ¿cómo ayudo si me encuentro un caso?
En primer lugar, intenta inmovilizar la zona sin forzar el movimiento (si es una extremidad superior basta con un cabestrillo, y si es una extremidad inferior traslado en bloque sin doblar la pierna).
Posteriormente aplica hielo local sobre la zona afecta y con intención antiinflamatoria local.
Y por último gestiona el traslado de la persona a urgencias (en vehículo o ambulancia, según precise) y, sobre todo, no le des nada de beber ni de comer.
¿Y si me pide agua? ¿Por qué no puede ingerir nada?
En primer lugar, es muy importante que tengas claro por qué no puede beber ni comer. La respuesta es comprensible. Puede ocurrir que la recolocación ortopédica o convencional en urgencias no sea posible y el paciente tenga que ir al quirófano para ser reducido bajo sedación o anestesia general. En este caso es imprescindible que no tenga ningún tipo de contenido gástrico. Si precisa ir a quirófano y ha bebido o comido nos encontramos con un problema para anestesiarlo. ¿Qué hacemos si, por el dolor, tiene la boca seca y nos pide agua? Cogeremos unas gasas o pañuelo empapado en agua y le mojaremos los labios para aliviar su sequedad de boca.
¿Qué hacemos los médicos en el box de urgencias ante una presunta luxación?
Ante todo, lo primero es priorizar esa visita . La pasamos, pues, inmediatamente al box y tras la exploración solicitamos una radiografía y le administramos medicación analgésica intramuscular (recuerda que no puede beber ni comer).
Una vez estudiada la radiografía procedemos a la recolocación tras la cual exploramos la movilidad y sensibilidad nuevamente y procedemos a la colocación de un vendaje inmovilizador. En ese momento realizamos otra radiografía para comprobar que el hueso ha vuelto a su lugar. Siempre inmovilizamos la articulación tras una luxación y recomendamos un tratamiento analgésico para el domicilio. Posteriormente seguirá control evolutivo.
Si no resulta posible la recolocación manual en urgencias es cuando solicitamos la intervención del anestesista para hacerlo en quirófano.
Artículo especializado
Qué Sabes del Dexketoprofeno
Para familiarizarnos con el tema, vamos a posicionarnos en la familia a la que pertenece este fármaco, el dexketoprofeno. Seguro que has oído hablar de los antiinflamatorios (conocidos como AINE o antiinflamatorios no esteroideos). ¿Y sabías que los AINE son el grupo de fármacos más prescrito a nivel mundial?
Sobre los AINE
Dentro del grupo heterogéneo de los AINE tenemos infinidad de fármacos entre los que podríamos citar los conocidísimos principios activos : ibuprofeno, diclofenaco, naproxeno, aceclofenaco, meloxicam, AAS… Todos ellos tienen características en común, aunque dentro del grupo presentan una variabilidad en cuanto a perfil farmacológico y forma de comercialización (diferentes presentaciones comerciales y posologías, aunque equivalentes en cuanto a efecto).
Destaca su función analgésica/antiinflamatoria y de antiagregación plaquetaria y, además, están implicados en la prevención del cáncer de colon. Existen diversos estudios que confirman que la aspirina reduce el riesgo de cáncer colon en un 40%-50% y la aparición de adenoma de colon en un 30%-50%. Sin embargo, debido a los posibles efectos secundarios gastrointestinales y cardiovasculares, en la actualidad no se recomienda el uso para la prevención de cáncer colon.
Tienen un alto poder analgésico por lo que se emplean para el tratamiento del dolor de cualquier causa como puede ser en enfermedades reumáticas , traumatológicas, degenerativas… Así mismo, se emplean en el control de otros tipos de dolor como migraña, cefalea, odontalgia, dolor oncológico, dolor menstrual…
También se les atribuye una función antitérmica .
Cómo actúan
Los AINE actúan inhibiendo unas sustancias llamadas prostaglandinas (que son mediadoras de la inflamación) y de la protección gástrica). Los AINE no selectivos inhiben el proceso inflamatorio y el proceso de protección gástrica, por tanto controlan el dolor pero producen pirosis o molestias gástricas. Profundizando un poco más te diré que algunos AINE son selectivos, es decir capaces de inhibir sólo la inflamación, pero no la protección gástrica por lo que son mejor tolerados (son los llamados AINE selectivos o inhibidores de la COX-2 como celecoxib, etoricoxib y lumiracoxib).
¿Entiendes ahora por qué algunas personas tienen síntomas gástricos al tomar determinados AINE? Ello también explica que hayan salido al mercado algunos AINE combinados con protección gástrica en la misma pastilla, de forma que el paciente no tiene que tomar una pastilla de protección gástrica adicional.
Dentro de los AINE estableceremos una subclasificación, en función de su vida media y de su composición, que nos será útil a la hora de realizar un cambio de tratamiento, en el que nos cuidaremos de cambiar de grupo, si lo precisamos.
El dexketoprofeno
En este artículo nos hemos comprometido a hablar del dexketoprofeno (uno de los nombres comerciales que seguro te suena más es Enantyum®), así que vamos a centrarnos en este AINE de forma específica. Ahora que ya conocemos la familia a la que pertenece te diré que se trata de un AINE no selectivo . Seguro que te ha venido a la cabeza que si existe un dexketoprofeno es porque existe un ketoprofeno y, efectivamente, así es.
Hace años se comercializó el Ketoprofeno, con una potente acción analgésica, antipirética y antiinflamatoria. Posteriormente salió al mercado su isómero (dex ketoprofeno ) de propiedades prácticamente equivalentes con leves cambios en su molécula que persiguen la minimización de los efectos adversos .
El dexketoprofeno está comercializado por diferentes laboratorios y con presentación vía oral (cápsula, sobre granulado o solución oral bebible), tópica (gel) y parenteral (intramuscular o endovenosa). Como el resto de AINE posee una acción analgésica, antipirética y antiinflamatoria potente. Se indica en el tratamiento del dolor de intensidad leve o moderada de cualquier origen (musculoesquelético, odontológico, oncológico, menstrual, cólico nefrítico, post-quirúrgico…).
¿Cuál es la posología recomendada?
La presentación vía oral puede encontrarse en dos dosis: 12’5 mg y 25. Emplearemos la dosis eficaz más baja durante el menor tiempo posible para el control del dolor . Normalmente se recomienda su administración con alimentos para minimizar los efectos gastrointestinales . Sin embargo, los alimentos retrasan su absorción, por lo que, en caso de dolor agudo intenso es preferible tomarlo en ayunas (como mínimo 15 minutos antes de las comidas).
Las ampollas de administración parenteral (intramuscular o endovenosa) contienen una dosis más alta.
¿Tiene contraindicaciones?
Debemos tener presente si el paciente tiene alergia al ácido acetil salicílico (AAS) en cuyo caso también podría reaccionar ante los AINE (sobre todo en caso de asma o broncoespasmo).
Otras causan que contraindican su uso serían: úlcera gastroduodenal, enfermedad inflamatoria intestinal en fase activa, insuficiencia cardíaca, renal o hepática y alteraciones de la coagulación.
No debe emplearse en niños ni adolescentes , según la ficha técnica.
¿Interacciona con otros fármacos?
No se recomienda el uso de dexketoprofeno de forma concomitante con otros fármacos de tipo: corticoides, anticoagulantes, litio, heparina u otro AINE. Antes de iniciar un tratamiento con este fármaco debe valorarse el tratamiento previo que realiza el paciente.
¿Qué ocurre en el embarazo y durante la lactancia?
Durante el tercer trimestre de embarazo los AINE pueden provocar en el feto un problema cardiopulmonar y/o una disfunción renal por lo que no se recomienda su uso. Su uso durante el primer y segundo trimestre del embarazo debería estar médicamente muy justificado y siempre bajo supervisión médica .
Dado que se desconoce si el dexketoprofeno se excreta en la leche materna, estaría contraindicado su uso durante la lactancia, según la ficha técnica.
¿Tiene efectos adversos?
Los más frecuentes serían los efectos gastrointestinales (náuseas y/o vómitos, dolor abdominal, diarrea, dispepsia). Otros posibles efectos, aunque menos frecuentes serían: rash cutáneo, vértigo, insomnio, cefalea, palpitaciones, hipertensión, etc.
LA PREGUNTA DEL MILLÓN
¿Qué AINE me tomo la próxima vez que lo necesite? Te respondería que su perfil de acción es muy similar. Se postula que el dexketoprofeno hace efecto más rápidamente , pero todos ellos poseen parecida acción farmacológica, eficacia clínica y perfil de efectos adversos. No obstante, te recuerdo que el fármaco de elección inicial para el control del dolor es el paracetamol. No te preocupes. También te lo explicaremos con detalle en otro artículo.

Artículo especializado
Afrontar Correctamente la Diabetes Infantil
En España se calcula que hay cerca de unos 30.000 niños menores de 15 años con diabetes (95% de los casos de tipo diabetes tipo 1). Te explicamos más acerca de esta enfermedad y cómo afrontarla en los más pequeños.
Qué es
La diabetes mellitus (DM) comprende un grupo de enfermedades metabólicas caracterizadas por unos niveles de azúcar (glucosa) en sangre elevados. El nivel de glucosa en sangre se denomina glucemia o glicemia.
La hormona humana encargada de la regulación de la glucemia es la denominada insulina, sintetizada en el páncreas. Esta hormona actúa como “una llave” que permite abrir “las puertas” de la membrana o pared celular, para que la glucosa entre en los diferentes tipos de células y, así, puedan satisfacer sus necesidades de energía para poder realizar sus funciones.
¿Es muy frecuente?
La DM es una enfermedad frecuente. Puede ser considerada uno de los principales problemas de salud pública en el mundo occidental . La Organización Mundial de la Salud (OMS) considera que hasta el 50% de las personas que padecen diabetes están sin diagnosticar.
Causas
Cuando una persona sana come, el páncreas inmediatamente libera la insulina y ésta aumenta rápidamente en sangre para hacerse cargo de gestionar todo el azúcar que está entrando y acumulándose en el torrente sanguíneo.
Cuando se produce un defecto de producción de insulina, o se produce un fallo en la acción de la misma (es decir, casos en los que se encuentra en concentraciones normales, pero no es efectiva) o bien, ambas cosas a la vez, se generará un aumento de los niveles de glucemia, dando lugar a la hiperglicemia o hiperglucemia. De no controlarse adecuadamente esta situación, la presencia permanente de hiperglicemia puede provocar lesiones en la función de diversos órganos corporales, especialmente los ojos, los riñones, los nervios, el corazón y los vasos sanguíneos.
Tipos de diabetes
La diabetes tipo I es característica de personas jóvenes . Tiene una base autoinmune en unos casos y desconocida, en otros. En España se calcula que hay cerca de unos 30.000 niños menores de 15 años con DM (95% de los casos de tipo DM 1). Se calcula que cada año aparecen unos 1100 casos nuevos.
Cómo se produce
Aunque el origen es esencialmente desconocido, se acepta que la historia natural de la DM es la siguiente: en una persona genéticamente predispuesta (componente hereditario), actúa un factor desencadenante desconocido que motiva una respuesta autoinmune (defensas que atacan al propio cuerpo,) destruyéndose con ello, de forma progresiva y selectivamente, las células Beta del páncreas (encargadas de la producción de insulina).
La forma más frecuente de DM es la de tipo II (85-90% de los casos totales de DM), principalmente observada en adultos. Se debe a una resistencia de los tejidos a la acción de la insulina junto a un déficit secretor relativo de la misma.
Signos y síntomas
El cuadro clásico de la DM tipo I comprende los siguientes:
Poliuria o exceso de orina . Al estar la glucosa muy alta en sangre, ésta se filtra por el riñón y aparece en la orina, arrastrando con ella una gran cantidad de agua. Es por esta razón que el diabético orina muchas veces.
Polidipsia o exceso de ingesta de líquido . Para compensar la pérdida de agua por la orina, se tiene mucha sed, levantándose incluso por la noche varias veces por necesidad de beber.
Polifagia o ingesta abundante de alimentos . Al no poder utilizar la glucosa presente en cantidades elevadas en sangre, las células siguen reclamando su fuente de energía y el cerebro trata de compensarlo aumentando la ingesta de alimentos.
Pérdida de peso . Aunque se coma más, las células no llegan a recibir la glucosa que necesitan y el paciente, paradójicamente, pierde peso.
Otros síntomas como, por ejemplo, fatiga, dolor abdominal, irritabilidad, disminución del rendimiento escolar, visión borrosa, etc.
Diagnóstico
El diagnóstico de DM p uede realizarse de forma inmediata en Atención Primaria si el paciente presenta la clínica cardinal de hiperglicemia antes mencionada (poliuria, polidipsia…) y se demuestra una glicemia mayor de 200mg/dL mediante un control de glucemia capilar (en cualquier momento, sin necesidad de estar en ayunas).
En el niño que no padece estos síntomas de forma tan evidente, el diagnóstico es analítico y debe establecerse en condiciones basales (ayunas, sin estar cursando ninguna enfermedad y ni recibiendo ningún tratamiento que puede alterar la glucemia).
Es importante realizar un diagnóstico lo más precoz posible , para evitar que se desencadene un estado denominado de cetoacidosis diabética, que es un cuadro clínico grave de descompensación metabólica.
Tratamiento
El objetivo del tratamiento es conseguir un adecuado control metabólico con glucemias próximas a la normalidad y éste debe implantarse desde el inicio de la enfermedad. Se basa en lo siguiente: educación diabetológica – dieta – autocontrol insulina – ejercicio.
Hoy se propugna un tratamiento intensivo consistente en la administración de múltiples dosis de insulina o en el sistema de infusión continua (buena alternativa terapéutica en la edad pediátrica), realización de múltiples controles de glicemia capilar, automonitorización y autocontrol, basado todo esto en una educación diabetológica continuada .
Los pacientes con DM tipo I no producen suficiente cantidad de insulina para mantener la normalidad metabólica. Por ello, para su manejo debemos administrarla farmacológicamente, tanto para cubrir las necesidades basales como las de la ingesta.
El control de la ingesta es parte integral del tratamiento. La dieta o forma de alimentación debe ser semejante a la del niño sano, pero adaptada a la insulinoterapia y al ejercicio . Las tomas deben ser regulares y equilibradas en los distintos nutrientes esenciales.
El ejercicio físico (incluyendo tanto actividades y deportes recreativos como competitivos), realizado en condiciones óptimas, puede ayudar a un mejor control de la enfermedad. Se recomiendan los ejercicios aeróbicos. Además de las ventajas que aporta el deporte a corto plazo (descenso de glucemia, disminución de las necesidades de insulina por aumento de la sensibilidad a ésta…), es beneficioso también a largo plazo sobre el perfil lipídico (nivel de grasas sanguíneas), la tensión arterial y la actividad cardiaca.
Para conseguir los objetivos, el personal sanitario debe realizar una educación y motivación continuada, entrenar a los pacientes en el autocontrol e individualizar los objetivos.
Las nuevas posibilidades terapéuticas que se desarrollan o perfeccionan en los últimos años incluyen el trasplante de páncreas , la inyección de células madre pluripotenciales o la prevención de la enfermedad mediante la administración de ‘vacunas’ contra la diabetes mellitus, entre otros ejemplos.
Recuerda que…
El tratamiento intensivo de la diabetes retrasa la aparición de las complicaciones crónicas de la enfermedad (la neuropatía, la micro y macroangiopatía…) que comprometen, de forma grave, la calidad y la expectativa de vida de los pacientes.

Artículo especializado
Prevención y mejora de la diabetes tipo 2
Hay 415 millones de personas con diabetes en todo el mundo y la Federación Internacional de Diabetes alerta de que, en el año 2040, uno de cada diez adultos padecerán la enfermedad, lo que supondrá 642 millones de personas. En España, la mayoría de los pacientes padece la diabetes tipo 2, que suele aparecer a partir de los 30-35 años, y el 70% podría prevenirse con una alimentación equilibrada, ejercicio físico y una vida saludable sin tabaco ni alcohol.
¿Qué es la diabetes?
La diabetes mellitus es una enfermedad metabólica en la que los niveles de azúcar (o glucosa) en la sangre están aumentados. A la glucosa que circula por la sangre se le llama glucemia.
El aumento de glucemia es el resultado de defectos en la secreción de insulina, en su acción o en ambas. La insulina es una hormona fabricada en el páncreas y que permite que las células utilicen la glucosa de la sangre como fuente de energía.
Un fallo de la producción de insulina, de la acción de la misma, o de ambas cosas, genera un aumento de los niveles de glucosa en la sangre (hiperglucemia). De no controlarse adecuadamente, a largo plazo, la presencia continua de glucosa alta en la sangre puede provocar alteraciones en la función de diversos órganos, especialmente los ojos, los riñones, los nervios, el corazón y los vasos sanguíneos.
Tipos de diabetes
La OMS (Organización mundial de la salud) reconoce tres formas de diabetes mellitus: tipo 1, tipo 2 y diabetes gestacional.
Características de la Diabetes tipo 1
Suele aparecer en gente joven, normalmente por debajo de los 35 años
Enfermedad autoinmune, provoca un déficit absoluto de insulina
Presentación brusca con sintomatología variada: intensa sensación de sed, aumento del volumen de orina, cansancio, aumento del apetito, pérdida de peso…
No existe relación con el estilo de vida: sedentarismo, sobrepeso u obesidad, tabaco, mala alimentación…
Tratamiento obligatorio con insulina
No se puede prevenir
Características de la Diabetes tipo 2
Es la forma más común de diabetes
Se presenta en personas de edad adulta , aunque cada vez hay más jóvenes, a partir de los 30-35 años.
De origen no inmunológico , se caracteriza por una resistencia a la acción de la insulina asociada a un fallo progresivo en la secreción pancreática de insulina.
Los síntomas son menos evidentes que la de tipo I y no suelen producir ninguna molestia, salvo cuando se producen complicaciones.
Los factores de riesgo que la favorecen son la obesidad, el sedentarismo, la mala alimentación y la falta de ejercicio físico.
Puede haber un factor genético o hereditario
El tratamiento inicial es mejorar el estilo de vida con una correcta alimentación e instaurando una rutina de ejercicio físico. Si aun así no se llega a controlar la glucemia, será necesario el tratamiento farmacológico oral, insulínico o ambos.
¿Cómo se diagnostica la diabetes?
El diagnóstico se basa en uno o más de los siguientes datos :
La presencia de síntomas típicos de la diabetes acompañados de unos niveles de glucosa en sangre en cualquier momento del día igual o mayor a 200 mg/dl.
Niveles de glucosa en sangre en ayunas iguales o superiores a 126 mg/dl confirmados en dos o más ocasiones.
Alteraciones en el resultado de una prueba especial que se llama Sobrecarga oral de glucosa (SOG). Esta prueba consiste en dar de beber 75 g de glucosa disueltos en agua y después determinar el nivel de azúcar en sangre a las dos horas. Valores por encima de 200 mg/dl son diagnósticos de diabetes. Cuando los valores se sitúan entre 140 y 199 mg/dl, hablamos de intolerancia a la glucosa, que se considera un paso previo a la diabetes. Esta prueba sólo se realiza cuando los apartados anteriores no han sido suficientes para establecer el diagnóstico.
Complicaciones por un mal control de la enfermedad, ¿cómo prevenirlas?
La diabetes puede provocar lesiones en los órganos como consecuencia del exceso continuado de glucosa (azúcar) en la sangre. La complicación más importante son las enfermedades cardiovasculares, que constituyen la principal causa de mortalidad prematura entre los diabéticos, pero no son las únicas:
Microangiopatía diabética.
Nefropatía, insuficiencia renal.
Neuropatía diabética.
Complicaciones del pie.
Retinopatía diabética .
Para prevenir estas complicaciones se debe:
Controlar los niveles de glucosa en sangre.
Medir los niveles de glucosa capilar en los dedos.
Medir la hemoglobina glicosilada en un análisis.
Cumplir correctamente con el tratamiento.
Evaluar las posibles complicaciones durante las visitas médicas:
Examen del fondo del ojo.
Examen diario de los pies.
Control de la tensión arterial.
Detección de proteínas en la orina.
Prevenir las complicaciones cardiacas : abandonar el tabaco, controlar la hipertensión, controlar la glucosa en sangre, etc.
¿Cómo mejorar la glicemia del diabético tipo 2?
La convivencia con la diabetes se asienta sobre tres pilares básicos : la alimentación, el ejercicio físico y el tratamiento farmacológico.
Los pacientes diabéticos (y no diabéticos) deben llevar una dieta sana, variada y equilibrada.
Los horarios de comidas deben ser regulares y sin saltarse ninguna ingesta para evitar posibles hipoglucemias o bajadas de azúcar . Por este motivo, es fundamental realizar una merienda y un tentempié a media mañana.
En caso de hipoglucemias, conviene tener a mano siempre azúcar (un sobre), una bebida azucarada o una fruta con tal de facilitar la recuperación del nivel de glucosa en sangre lo antes posible.
Se recomienda una alimentación rica en fibra . Retrasa el vaciamiento gástrico y disminuye la absorción de los hidratos de carbono y los lípidos, reduciendo las glucemias de después de una comida. Se aconseja el consumo de alimentos ricos en fibra: verduras, fruta entera (no en forma de zumo), legumbres, cereales integrales (opciones integrales de: cereales sencillos de desayuno como los copos de avena, pan, pasta o arroz integral).
Se debe controlar la cantidad y el tipo de grasa en la dieta . Se sustituirán los alimentos ricos en grasas saturadas y colesterol por otros con grasas mono y poliinsaturadas. Las grasas saturadas son las presentes en alimentos como los lácteos enteros, carnes grasas, charcutería, vísceras, carnes grasas. Se aconsejará el consumo de aceite de oliva, pescado blanco y azul, aves de corral, frutos secos, aguacate, semillas y derivados lácteos semidesnatados.
Se debe seguir una dieta libre de alimentos ricos en azúcares o hidratos de carbono simples (azúcar, miel, mermelada, zumo de fruta, bebidas azucaradas, refrescos, golosinas, bollería, chocolate y derivados) y controlada en alimentos ricos en azúcares complejos o absorción lenta (cereales, patata, legumbres).
La práctica de ejercicio físico regular (al menos 150 minutos por semana) ha demostrado mejorar el control de la glucemia, los factores de riesgo cardiovascular y el perfil lipídico, así como facilitar la pérdida de peso y aumentar el grado de bienestar.
También es altamente recomendable dejar de fumar , ya que el tabaquismo actúa como factor de riesgo cardiovascular.
La medicación es un complemento para aumentar el efecto de la alimentación y del ejercicio, constituyendo los distintos fármacos orales y/o insulina la base farmacológica en la diabetes tipo 2. El autocontrol en el hogar mediante análisis regulares y el seguimiento médico son fundamentales para prevenir y retrasar la progresión de complicaciones serias relacionadas con la enfermedad y reducir la mortalidad.
¿Se puede prevenir la diabetes tipo 2?
Como ya se ha comentado anteriormente, los factores de riesgo que favorecen la diabetes tipo 2 son la obesidad, el sedentarismo, la mala alimentación y la falta de ejercicio físico. Estos son factores modificables y dependen de uno mismo , por lo tanto, sí podemos prevenirla (siempre y cuando no haya un factor hereditario, ya que en ese caso sería un factor no modificable).
 Savia
Savia