Artículos Especializados
Artículo especializado
Preguntas y Respuestas antes de una Operación
De acuerdo con la Organización Mundial de la Salud (OMS), una cirugía mayor es todo procedimiento realizado en el quirófano, que comporte la incisión, la manipulación y/o la sutura de un tejido humano que generalmente requiere de anestesia para el control del dolor .
Tipos de cirugía
Los procedimientos quirúrgicos se clasifican generalmente por la urgencia con la que deben ser practicadas, el tipo de procedimiento, o la zona del cuerpo implicada, entre otros ejemplos. Así :
Basado en el tiempo : las alternativas incluirían la cirugía electiva, que se realiza para corregir una condición que no es mortal y se lleva a cabo en base a la aceptación del paciente y la disponibilidad del cirujano, así como de la instalación quirúrgica. La cirugía de emergencia, en cambio, es aquella que debe realizarse con prontitud para salvar incluso la vida del paciente.
Basado en el pronóstico : la cirugía exploratoria se realiza para ayudar o confirmar el diagnóstico. La cirugía terapéutica trata una condición previamente diagnosticada. La cirugía estética se hace para mejorar subjetivamente la apariencia de una estructura normal.
Basado en la zona del cuerpo implicada .
Basado en el grado de invasividad : la cirugía mínimamente invasiva implica una incisión externa más pequeña para insertar instrumentos miniaturizados dentro de una cavidad o estructura corporal. Por el contrario, la cirugía abierta (como p.ej. la laparotomía) requiere una incisión grande para acceder al área de interés.
Basado en los equipos utilizados o en las técnicas quirúrgicas : la cirugía con láser implica el uso del mismo en lugar del bisturí para cortar un tejido. La microcirugía implica el uso de un microscopio de operación para que el cirujano pueda ver pequeñas estructuras. La cirugía robótica utiliza un robot para controlar la instrumentación bajo la dirección del cirujano.
Basado en el tipo de procedimiento : existe la amputación, la resección, la reimplantación, el trasplante…
LOS TÉRMINOS DE UNA OPERACIÓN
Los nombres de la cirugía de la escisión a menudo empiezan con el nombre del órgano que se va a extirpar y terminan con el sufijo – ectomía (hepatectomía).
Los nombres de los procedimientos que implican cortar en un órgano o en un extremo del tejido terminan en -otomía (tenotomía, corte de tendones).
Los nombres de los procedimientos para la formación de una abertura permanente o semipermanente, llamada estoma, en el extremo del cuerpo terminan con -ostomía (colostomía).
El término que denomina la reconstrucción, la cirugía plástica o cosmética de una parte del cuerpo comienza con el nombre de ésta y termina en -plastia . (rinoplastia).
La reparación de la estructura anormal dañada o congénita termina con el sufijo -rrafia ( herniorrafia, reparación de una hernia).
El preoperatorio
Previo a la intervención quirúrgica, en la consulta del cirujano, recibirás las instrucciones para el día de la cirugía y podrás recibir respuesta a cualquier pregunta que se te pueda plantear.
Cualquier prueba pre-operatoria será solicitada por tu anestesista, con el que también se mantiene una entrevista, previa a la intervención. Idealmente, todo hospital o clínica debe contar con un servicio de anestesia, con especialistas que realicen la historia clínica anestesiológica al paciente, para recabar la información clínica pertinente, asegurarse de que se haga la valoración individual de cada caso y de que se soliciten las pruebas preoperatorias. Generalmente se solicitan, de forma rutinaria:
Una analítica sanguínea (que incluya, principalmente, un hemograma y las pruebas de coagulación).
Una Rx de tórax .
Un electrocardiograma (ECG).
El médico o la enfermera te informará de la preparación y de las restricciones de alimentación previas a la cirugía. Es muy importante que sigas las instrucciones o, de lo contrario, tu operación se podría retrasar o incluso cancelar por ello.
El día de la cirugía (decálogo de consejos)
Toma una ducha la mañana de la cirugía, sin usar después lociones, cremas o talcos sobre la piel.
Es importante la llegada al centro médico con puntualidad, en la hora que te fue informada.
Intenta no fumar el día del procedimiento. Fumar puede interferir con la anestesia, provocando náuseas, sobre todo en el periodo de recuperación.
Debes llevar contigo tus documentos identificativos y las tarjetas del seguro médico/Seguridad Social, así como todos aquellos medicamentos que habitualmente tomas y que es posible que puedas necesitar durante tu estancia en el hospital (inhaladores, insulina…) Cuando llegues al centro médico, serás registrado por el personal hospitalario.
Es mejor que dejes tus joyas y objetos personales de valor en el domicilio, evitando así acontecimientos inesperados y desagradables. No obstante, destacar que tus pertenencias serán almacenadas con seguridad hasta que estés listo/a para volver a casa.
Evita ese día el uso de esmaltes de uñas y maquillajes y si eres usuario/a de lentes de contacto, es mejor que ese día acudas con gafas.
Lleva ropa cómoda y que se pueda quitar fácilmente.
Es una buena idea acudir acompañado, por si se precisa algún tipo de ayuda (traslado en coche al hospital…).
Si el intervenido va a ser un niño, llevar consigo el peluche o similar que le haga sentirse más cómodo y tranquilo.
El personal hospitalario intentarán mitigar la ansiedad normal de familiares y amigos mientras dure o después del procedimiento. Y harán todo lo posible por manteneros informados.
Postoperatorio
En esta etapa, es importante controlar y supervisar al paciente que ha sido operado. Esto se lleva a cabo durante algunas horas, en una sala con monitorización que se conoce como Área de Recuperación. Algunos enfermos necesitan ser vigilados intensivamente en el postoperatorio inmediato y son trasladados a salas especializadas en cuidados intensivos, de las cuales son responsables los médicos anestesistas (suelen llamarse coloquialmente REAs o Áreas de reanimación.
La convalecencia
La cantidad de tiempo que cada uno empleará en su recuperación varía de paciente a paciente . Te enviarán a casa tan pronto como el equipo médico que te supervisa sienta que es seguro darte el alta del centro médico.
Si en la fase de rehabilitación sientes mucho dolor, o se manifiestan signos de alarma (fiebres, supuración por herida quirúrgica…) debes ponerte en contacto con tu médico o, en su defecto, llamar al 112 o acudir a un servicio de urgencias.
Para que las cicatrices cutáneas de la intervención quirúrgica queden lo más discretas posible, se debe realizar una adecuada atención de las heridas hasta su completa cicatrización, manteniendo la limpieza y asepsia de las mismas de una forma rigurosa.

Artículo especializado
Dolor de Corazón
El dolor de pecho o dolor torácico es una de las consultas más habituales, tanto en las consultas de atención primaria como en las urgencias de los hospitales. No obstante, tan sólo en una pequeña proporción de los casos, este dolor suele revestir una situación de gravedad para los pacientes.
¿Cómo es este dolor?
El dolor torácico agudo podría definirse como toda sensación álgica (de dolor) por debajo de las clavículas y por encima del diafragma. El objetivo principal sobre este síntoma consiste en diferenciar las causas que potencialmente pueden tener gravedad y las causas que no.
Para los profesionales médicos, este motivo de consulta representa un gran desafío diagnóstico debido a las múltiples causas por las que se puede desencadenar dolor en esta localización. Por tanto, resultará imprescindible una correcta interpretación de las causas y del significado de los síntomas del paciente.
Qué tener en cuenta ante un dolor torácico
Además de las características del dolor y del resto de síntomas acompañantes, son importantes otras consideraciones como:
La edad y sexo del paciente.
Los antecedentes personales y familiares.
El sobrepeso y la obesidad.
El consumo de tabaco y alcohol.
El consumo de otras sustancias tóxicas.
La presencia de otras enfermedades que tenga el paciente, principalmente:
La hipertensión arterial.
La diabetes mellitus.
La hipercolesterolemia (aumento de colesterol en sangre).
Algunas causas
Existen una infinidad de causas de dolor torácico agudo que, debido a su gran variabilidad, solemos agrupar en función del órgano o aparato del cuerpo humano al que afectan. Cada causa tiene su tratamiento específico. Entre las de mayor frecuencia y a destacar, unas más graves y otras más banales, encontramos:
Cardiovasculares
Isquémicas: disminución o incluso detención de la circulación sanguínea a través de las arterias, lo cual conlleva a un estado de sufrimiento y muerte celular por falta de oxígeno. En este tipo, potencialmente graves, destacan:
Cardiopatía isquémica : infarto agudo de miocardio y angina de pecho.
Valvulopatías: problemas en el cierre y apertura de las válvulas que regulan la entrada y salida de sangre en las cámaras del corazón.
Policitemias o anemias severas: aumento o disminución significativo de las células sanguíneas encargadas del transporte de oxígeno, es decir, los glóbulos rojos.
No isquémicas : no se produce destrucción celular por falta de aporte de oxígeno, pero pueden ser potencialmente graves igualmente. A destacar:
Pericarditis: inflamación del pericardio, que es una doble membrana fibrosa que recubre el corazón.
Angiopatías de la aorta : problemas relacionados con la principal arteria que distribuye la sangre por todo el organismo, la aorta.
Valvulopatías.
Pulmonares
Infecciones de vías respiratorias bajas: bronquitis agudas y neumonías principalmente.
Neumotórax: presencia de aire entre ambas pleuras pulmonares, que puede ser generado por múltiples causas.
Tromboembolismo pulmonar: obstrucción de una de las arterias pulmonares por un coágulo de sangre procedente del sistema venoso.
Osteomusculares
Traumatismo torácico.
Costocondritis : inflamación de los cartílagos costales.
Hernia discal cervical o torácica.
Trastornos articulares : artrosis (desgaste crónico) o artritis (inflamación aguda) a nivel cervical e intercostal.
Contracturas y espasmos musculares .
Digestivas
Trastornos relacionados con el esófago (conducto del aparato digestivo que comunica la cavidad oral con el estómago y que atraviesa el tórax medialmente): espasmos, reflujo, hernia de hiato, esofagitis…)
Úlceras gástricas y duodenales .
Perforación de víscera hueca (esófago, estómago o intestino).
Trastornos relacionados con el hígado, la vesícula biliar o el páncreas .
Psicógenas y por consumo de tóxicos
Estados de ansiedad o depresión , acompañado normalmente de aumento de la frecuencia respiratoria.
Consumo de cocaína y anfetaminas , entre otras drogas.
Muchos casos de diagnóstico incierto
Debido a la gran variedad de causas mencionadas, hasta en más de la mitad de los casos, y a pesar de un estudio exhaustivo, no se logra establecer un diagnóstico de certeza ni en las consultas de atención primaria ni en las urgencias hospitalarias. Esto nos lleva a pensar que, cuando la causa de un dolor torácico es verdaderamente una emergencia (causas cardiovasculares y pulmonares principalmente), sí que existe una mayor facilidad para establecer un diagnóstico con las pruebas complementarias de las que se disponen habitualmente en los centros hospitalarios .
Entre las causas que con más frecuencia contribuyen a este alto porcentaje de casos con diagnóstico inicial incierto están:
Origen psicógeno , debido mayoritariamente a la sintomatología ansiosa y/o depresiva.
Origen respiratorio , causado principalmente por infecciones de vías respiratorias bajas con un posible componente de irritación pleural o, simplemente, por el esfuerzo continuado de toser.
Origen osteomuscular de causa no traumática , principalmente debido a alguna alteración en los cartílagos intercostales o en las inserciones musculares desencadenadas por malos gestos, sobresfuerzo físico, tos…
Qué nos alerta de que es grave
Por último, los signos y síntomas clínicos que pueden revestir gravedad en un dolor torácico de aparición reciente (en los últimos minutos u horas) y, por tanto, se deben valorar inmediatamente en un centro de urgencias hospitalarias serían:
Dolor de características opresivas , es decir, como una presión en el pecho.
Sensación de mareo o inestabilidad , acompañado o no de sudoración y/o náuseas.
Pulso arrítmico o sensación de palpitaciones .
Dificultad para respirar y aumento en la frecuencia respiratoria , o sea, respiraciones rápidas y poco profundas.
Cambios en la presión arterial , ya sea por debajo de 100/60mmHg o por encima de 140/90mmHg.
Empeoramiento del estado general repentino o del nivel de concienci a.
Como inicialmente se ha comentado, estos últimos signos y síntomas clínicos mencionados representan una baja proporción de los casos que se nos presentan con dolor torácico en la práctica habitual. No obstante, todo paciente debe conocerlos y tener en cuenta que, ante la aparición de alguno de ellos, se debe solicitar ayuda inmediatamente o acudir a unas urgencias hospitalarias.

Artículo especializado
Prednisona, Indicaciones y Precauciones
Antes de profundizar en el tema vamos a aclarar algunos conceptos muy divulgados , y poner en contexto a la prednisona/prednisolona (a continuación, veremos la diferencia), que pertenecen al grupo de corticoides de acción intermedia.
En primer lugar, abordaremos el tándem prednisona-prednisolona . ¿Es lo mismo o no? Siendo puristas deberíamos decir que la prednisolona es el metabolito activo de la prednisona. La prednisona que tomamos vía oral sería el profármaco o precursor que, en el hígado, se transforma en prednisolona que sería el fármaco activo. Si contemplamos otras vías de administración diferentes a la oral, como la oftálmica, nasal, tópica, intramuscular o endovenosa emplearemos la prednisolona, directamente por ser activa de forma inmediata.
En segundo lugar, vamos a aclarar el concepto corticoide/corticoesteroide , ambos términos equivalentes se refieren a un tipo de hormona sintetizada en las glándulas suprarrenales (situadas sobre los riñones) a partir del colesterol. Estas sustancias pueden sintetizarse artificialmente y tienen innumerables aplicaciones terapéuticas. Los corticoides, en general, de clasifican en tres grupos según su vida media en sangre:
Corticoides de acción corta como la cortisona (su efecto dura entre ocho y 12 horas)
Corticoides de acción intermedia como la prednisona, la prednisolona y la metilprednisolona (su efecto dura entre 18 y 36 horas).
Corticoides de acción prolongada, como la dexametasona (su efecto dura entre 36 y 54 horas).
Se indican en infinidad de enfermedades siendo sus principales funciones la antiinflamatoria, la inmunosupresora (por ejemplo, en enfermedades autoinmunes o para evitar el rechazo en trasplantes de órganos) y la antineoplásica coadyuvante (se administran junto a fármacos antineoplásicos para minimizar sus efectos). Tienen un papel estrella en el tratamiento urgente de una anafilaxia o reacción alérgica grave y en un episodio de asma agudizado, por ejemplo.
Centrándonos en la prednisona…
La definiríamos como un glucocorticoide de acción intermedia que al ser ingerido vía oral se transforma en el hígado en prednisolona (o forma activa).
La posología de la prednisona se calcula en función del peso del individuo y según la patología a tratar. Para procesos graves calcularemos dosis elevadas al inicio, mientras que al mejorar o en procesos leves emplearemos dosis bajas. En caso de tratamientos crónicos o prolongados la dosis inicial debe ser supervisada y reducida en cuanto los síntomas mejoran hasta conseguir la dosis mínima eficaz de mantenimiento .
Cuándo se utiliza
En el momento actual, la prednisona es uno de los fármacos de elección para procesos inflamatorios y cuando está previsto un tratamiento de larga duración. Está comercializada en comprimidos de diferentes posologías (5, 10 y 30 mg) según la dosis que precisemos prescribir.
Se emplea para múltiples enfermedades entre las más relevantes:
Enfermedades reumáticas : polimialgia reumática, lupus eritematoso sistémico, artritis…
Enfermedades pulmonares : asma persistente grave, agudizaciones de enfermedades crónicas respiratorias…
Enfermedades hematológicas : anemia hemolítica autoinmune, púrpura, leucemia linfoblástica, linfomas, mieloma múltiple…
Enfermedades digestivas : colitis ulcerosa, enfermedad de Crohn, hepatitis.
Enfermedades renales y dermatológicas .
Enfermedades oculares : conjuntivitis alérgica, queratitis, iritis…
Tratamiento inmunosupresor en trasplantes : cuando una persona es trasplantada se instaura un tratamiento con corticoides para que el cuerpo no genere rechazo al nuevo órgano.
Coadyuvante en el tratamiento con quimioterapia o radioterapia (para minimizar efectos adversos).
Como curiosidad, ¿sabías que en situaciones de extraordinario estrés físico, por ejemplo, en enfermedades febriles, accidentes o intervenciones quirúrgicas, puede ser preciso aumentar temporalmente la dosis diaria de corticoides para conseguir el mismo efecto ?
En general, en los tratamientos con corticoides nos guiamos por los siguientes principios:
Mínima dosis necesaria.
Menor tiempo posible.
Máximo intervalo entre dosis.
Reducción de dosis ante el control de síntoma s (en cuanto la enfermedad mejora reducimos la dosis de forma paulatina hasta llegar a la dosis de mantenimiento necesaria o hasta finalizar el tratamiento).
¡Y ojo!, en caso de que el paciente sea deportista debemos advertirle de que la prednisona contiene un componente que puede dar positivo en un resultado analítico de control de dopaje.
¿Tiene contraindicaciones?
Como el resto de fármacos, el tratamiento con prednisona tiene unas contraindicaciones absolutas, sobre todo en tratamientos prolongados. No deben emplearse en caso de Infecciones víricas agudas (como varicela o herpes zoster) o cuando el paciente precise una vacunación profiláctica . Así mismo, por los efectos adversos que puedan aparecer se recomienda cautela en los pacientes diabéticos, osteoporóticos, hipertensos, con glaucoma o ulcus péptico.
¿Y reacciones adversas?
En tratamientos de corta duración con prednisona la incidencia de aparición de reacciones adversas es baja. En tratamientos prolongados las reacciones adversas más frecuentes asociadas a la prednisona serían: típica cara de luna llena, hiperglucemia, aumento de peso, aumento de colesterol, aumento de triglicéridos, retención de líquidos, hipertensión, disminución de potasio, mala cicatrización de las heridas, estrías, acné, hiperpigmentación, aumento del riesgo de trombosis, osteoporosis y aumento del riesgo de fracturas, malestar abdominal (en casos graves úlcera gastroduodenal y pancreatitis), insomnio, euforia, cambios de personalidad, depresión, trastornos de las hormonas sexuales (alteraciones menstruales, aumento de vello), impotencia…
¿Has oído hablar alguna vez del síndrome de la retirada?
Los tratamientos prolongados con corticoides hacen que no se secreten los endógenos. Por ello su retirada brusca puede ocasionar una deprivación de los niveles que puede causar síntomas como: dolor abdominal, náuseas, cefalea, fiebre, dolor articular o muscular, malestar general e hipotensión . Para evitarlo, en caso de tratamientos de más de tres semanas de duración, deben suspenderse gradualmente.
¿Los corticoides interaccionan con otros fármacos?
Debemos tener precaución respecto al resto de tratamientos que realice el paciente como anticoagulantes, antidiabéticos (la prednisona reduce los efectos de los antidiabéticos y puede ocasionar hiperglucemia), antiinflamatorios (aumenta el riesgo de úlcera gastroduodenal), relajantes musculares, diuréticos, etc.
El tratamiento con prednisona durante el embarazo o la lactancia
Como puedes imaginar durante el embarazo el tratamiento debe limitarse a los casos absolutamente necesarios . El uso de corticoides sólo se acepta cuando no existe otra alternativa terapéutica más segura.
Durante la lactancia sería una medicación compatible si está médicamente justificada. Cuando la madre precisa una dosis alta de tratamiento puede ser interesante minimizar el paso a leche al bebé esperando tres o cuatro horas para amamantar tras la toma de la dosis . La Academia Americana de Pediatría la contempla como medicación compatible con la lactancia, pero siempre supervisada médicamente.
Estoy segura de que todos nosotros tendremos contacto con algún corticoide en algún momento de nuestra vida ya sea por un episodio alérgico, por una crisis asmática, por una infiltración de una articulación dolorosa o por un proceso inflamatorio rebelde. Existe un amplio repertorio y constituye un grupo terapéutico muy socorrido en nuestra práctica médica diaria .

Artículo especializado
Ejercicios para Perder Peso
Perder peso es uno de los buenos propósitos del inicio de año, de la vuelta de vacaciones… Es un reto universal que se marcan cada día miles de personas, cada una con sus razones para ello. Y es que cada uno sabe los motivos por lo que quiere perder peso, pero si hay uno que cada vez adquiere mayor relevancia es el factor salud . Cada vez somos más conscientes del papel preventivo que tiene la práctica de ejercicio para muchas dolencias, y el sobrepeso es un factor de riesgo que conviene esquivar.
Son muchas las personas que dedican parte de su día a día a acudir al gimnasio, a calzarse unas zapatillas o ponerse un bañador para ejercitarse y conseguir perder esos kilos que le sobran. Establecer rutinas que se conviertan en hábitos debe ser uno de los primeros objetivos ya de inicio. Al hacer ejercicio resulta hasta cierto punto fácil perder peso pero es básico sortear la dificultad que para muchos supone la regularidad y llegar la cifra deseada sin “tirar la toalla” a medio camino .
La clave está en saber elegir
Una de las premisas para evitar el fracaso es escoger actividades que resulten divertidas y atractivas para quien se va a pasar horas ejercitándose. No tiene ningún sentido forzarse a un tipo de ejercicio que no resulta atractivo habiendo un amplio abanico de posibilidades . Todas ellas, evidentemente, habrá que valorarlas previa consulta médica si es que existe alguna patología o lesión que puede contraindicar su práctica. Hacer ejercicio debe estar relacionado con la obtención de beneficios, por lo que si existe alguna contraindicación médica es importante realizar una consulta previa y evitar así posibles efectos negativos a corto, medio o largo plazo.
Más que perder peso
Para perder peso hay que activarse, eso es evidente. Se necesita que el organismo aumente su metabolismo para aumentar el consumo calórico y de ese modo favorecer la pérdida de peso . Pero con la actividad física no sólo perdemos peso, sino que se altera la composición corporal, se disminuye la masa grasa y la masa magra se mantiene o aumenta, dicho de manera genérica, lo cual resulta positivo para el organismo y las posibles patologías derivadas de la debilidad muscular o del exceso de masa grasa.
PARTIR DE MÍNIMOS
Es indispensable antes de pensar en perder peso ser conscientes de que como mínimo se siguen las recomendaciones que hace la Organización Mundial de la Salud (OMS): realizar un mínimo de 150 minutos semanales de práctica de actividad física aeróbica, de intensidad moderada, o bien 75 minutos de actividad física aeróbica vigorosa cada semana, o bien una combinación equivalente de actividades moderadas y vigorosas.
Qué actividades realizar
Actividades cardiovasculares
A partir de estas premisas será necesario añadir otras acciones que impliquen mayor exigencia física . Las actividades cardiovasculares son las que se suelen recomendar desde un inicio y caminar sería la más básica. Son varios los estudios que se han publicado comparando la actividad de caminar con otras para perder peso. Uno de ellos lo publicó el Laboratorio Nacional Lawrence Berkeley de California, en el que se constata que se puede perder peso de igual manera corriendo que andando, si bien hace falta dedicarle el doble de tiempo para conseguir el mismo resultado. Una de las ventajas que tiene caminar sobre actividades de impacto, como correr, es que para aquellas personas con sobrepeso importante caminar no castiga tanto a las articulaciones y, por tanto, se minimiza el riesgo de lesión y complicaciones.
Otras actividades de tipo cardiovascular son todas aquellas que se realizan en gimnasios de tipo coreografiadas. Estas permiten aumentar la frecuencia cardíaca y, además, suelen utilizar materiales adicionales de forma que también se trabaja la fuerza, esencial para mantener una musculatura tonificada. En los mismos centros deportivos se pueden usar máquinas tipo cinta, bicicleta o elíptica para activarse y aumentar el metabolismo. La mayoría de equipamiento tiene incorporado unos programas que ya van encaminados a la pérdida de peso. Se suelen combinar momentos de mayor intensidad con otros menos exigentes .
Entrenamiento interválico
Este tipo de combinaciones también ocurre en el entrenamiento conocido como interválico, que tiene como uno de sus ejemplos más conocidos el método tábata. No se recomienda de manera genérica ya que es de elevada exigencia y por eso es mejor tener cierto fondo. Se trata de hacer ocho series de ejercicios determinados durante 20 segundo, seguidos de 10 segundos de recuperación. Estos ejercicios son sentadillas, sprints o flexiones .
Incorporar estos momentos de elevada intensidad aumenta aún más el metabolismo y según indican los expertos puede mantenerse elevado unas horas tras haber acabado el ejercicio en cuestión. Ello ocurre porque este tipo de ejercicios aumenta el consumo de oxígeno, dos horas tras haber finalizado la actividad . Parece que este consumo puede ser entre 6-15% mayor en estos casos .
Ejercicios de fuerza
Los ejercicios de fuerza poco a poco se han ido incorporando a las rutinas para perder peso. Mantener unos músculos tonificados es esencial para aquellas personas que pierden peso porque es evidente que al reducir la masa grasa se reduce el volumen. Pero no sólo por esta razón se han ampliado los ejercicios aconsejados, sino porque este tipo de entrenamiento puede mejorar la sensibilidad a la insulina, el perfil lipídico, el índice de masa corporal, la masa libre de grasa y disminuir el colesterol LDL (“malo”), y el perímetro abdominal. Las personas que tiene sobrepeso suelen sufrir alteraciones en parámetros de la analítica que, haciendo otro tipo de actividades, podría mejorar.
UTILIZA TU CUERPO COMO PESO
Una rutina de fuerza no significa tener que levantar kilos y kilos de peso sino que se trata de manera progresiva de añadir al programa cardiovascular otro tipo de actividades. Se puede empezar con el propio peso del cuerpo haciendo sentadillas, abdominales, flexiones… e ir añadiendo pequeños pesos hasta conseguir llegar al peso con el que se puede trabajar sin lesionarse.
Además de estas posibilidades, existen multitud de máquinas en las que se pueden trabajar los grupos musculares, sea de manera específica o por grandes grupos musculares. No hay que tener miedo a que la fuerza forme parte de un programa de entrenamiento , pero sí que conviene conocer cuáles son los ejercicios más indicados y adaptarlos a las condiciones individuales.

Artículo especializado
Hernia Inguinal
Una hernia inguinal se produce cuando un asa del intestino delgado sobresale a través de un punto débil de la musculatura abdominal, que es la que ejerce el papel de pared y contención de los órganos de la cavidad abdominal. Cuando se da esta situación se puede apreciar en la ingle un bulto de consistencia blanda, que en general se puede reducir apretando, es decir, se pueden volver a introducir las asas a través del orificio de salida. Este bulto suele aumentar con las maniobras que aumentan la presión en la cavidad abdominal, como al toser, al inclinarse o al cargar un peso.
Cuando la hernia se puede reducir, es decir, puede volver a sitio, no es problemática, pero en ocasiones no se puede reducir, con lo cual el bulto es doloroso y se compromete el riego sanguíneo en esta zona del intestino, con lo cual se puede producir una isquemia intestinal, que debe ser intervenida de urgencias. Es por eso por lo que, si se tiene una hernia inguinal que da molestia, es preferible operarla de manera programada y en condiciones de seguridad y no como una urgencia, lo cual implica un mayor riesgo para el paciente.
El tratamiento de la hernia inguinal es quirúrgico y su abordaje puede ser mediante cirugía abierta o a través de laparoscopia.
Tratamiento por cirugía abierta
La cirugía abierta de la hernia se realiza bien bajo anestesia local, bien mediante sedación o anestesia general. El cirujano practica una incisión en la zona de la hernia, separa los tejidos, reintroduce las asas de intestinos que han salido en la cavidad abdominal tras comprobar su correcto estado y procede a cerrar el defecto de la pared abdominal. En este sentido se pueden realizar dos técnicas:
Herniorrafía , que consiste en utilizar los mismos tejidos del cuerpo, los músculos y los tejidos serosos que los recubren para cerrar el orificio por el cual se habían deslizado las asas intestinales.
Hernioplastia , que consiste en colocar una malla de tela sobre la zona debilitada que se sutura al tejido muscular y que actúa como una faja para hacer contención de la zona debilitada.
Tratamiento por laparoscopia
El abordaje por laparoscopia consiste en un procedimiento mínimamente invasivo que se realiza bajo anestesia general. Se realizan unas pequeñas incisiones en el abdomen, se aprovecha el ombligo para el abordaje, se insufla aire en la cavidad abdominal para poder maniobrar mejor dentro de la misma y se introduce una cámara que permite ver los tejidos. El cirujano manipula la zona de la hernia mediante un aparataje minúsculo y se coloca una malla también para fijar la zona debilitada de la pared abdominal.
Ventajas de cada una
Las ventajas de la hernioplastia mediante laparoscopia es que el posoperatorio es más rápido y menos doloroso habitualmente, con heridas muy pequeñas que requieren solamente un par de grapas para cerrarlas. Asimismo, la laparoscopia es una buena opción para una hernia operada previamente mediante cirugía general, dado que el cirujano puede evitar el tejido cicatricial, así como una cirugía menos agresiva si se tiene una hernia inguinal bilateral, dado que se pueden solventar ambas en un mismo acto quirúrgico. Sin embargo, ciertos estudios indican que el riesgo de recurrencia, es decir, de que la hernia se reproduzca pese a la malla colocada, es mayor con esta técnica cuando se compara con las tasas de recurrencia de la cirugía abierta tradicional.
Otra opción quirúrgica más reciente
Se trata de la intervención mínimamente invasiva asistida mediante robot Da Vinci ® . Con esta técnica el cirujano manipula unos brazos robóticos desde una consola con una mayor precisión y libertad de movimientos y con una visión tridimensional más definida. Proporciona una mayor seguridad y control quirúrgico, reduce el temblor fisiológico de las manos del cirujano, permite una mayor precisión en la fase reconstructiva de la intervención (el cierre de la pared abdominal) y un posoperatorio sencillo y más rápido, pudiendo retomar más pronto las actividades habituales. Sin embargo, esta técnica tan novedosa es muy costosa y son muy pocos los centros, públicos y privados, que cuentan con ella.
Ante la sospecha de una hernia inguinal es importante que ponerse en contacto con un cirujano general y del aparato digestivo para que valore la mejor opción terapéutica para cada caso.
Artículo especializado
Operaciones de Miopía con Láser, ¿Cuál es la Mejor?
¿Estás considerando operarte la vista para quitarte esas molestas gafas? Infórmate de las técnicas que existen en el mercado.
El defecto refractivo (ametropía) aparece cuando los rayos de luz paralelos que entran en el ojo no quedan enfocados sobre la retina y el resultado visual es una imagen borrosa . Sería el caso de la miopía, la hipermetropía o el astigmatismo.
La cirugía refractiva se refiere a los distintos procedimientos quirúrgicos encaminados a corregir estas afecciones oftalmológicas.
El objetivo de la intervención es dejar el ojo en las máximas condiciones de normalidad refractiva, esto es, alcanzar la máxima agudeza visual posible sin corrección óptica, de manera que no sea necesario el uso de gafas o lentes de contacto.
¿SABÍAS QUE…?
el Dr. José Ignacio Barraquer es considerado el padre de la cirugía refractiva y ya en 1949 publicó su primer libro escrito acerca de la posibilidad de la corrección de la miopía mediante la modificación de la curvatura de la córnea?
Técnicas para tratar la miopía
Existen diversas técnicas quirúrgicas oftalmológicas para tratar las ametropías:
Técnica LASIK (Queratomileusis in situ asistida con láser Excimer): en estos momentos es la técnica más utilizada y fue descrita en 1988. Consiste en tallar una lamela corneal mediante un aparato denominado microqueratomo, aplicando el láser Excimer sobre el tejido corneal. Posteriormente, se recoloca la lamela sobre la zona tratada, conservando de esta manera la zona superficial de la córnea.
Otras técnicas: como el láser de femtosegundo (con resultados también muy positivos), la queratectomía fotorefractiva (PRK) con láser Excimer, la colocación de implantes intracorneales, la queratotomía radiada …
¿Cuándo se indica el LASIK?
Pacientes mayores de 21 años.
Error de refracción estable (dentro de +/- 0’5 dioptrías en los 12 meses anteriores).
Miopías o hipermetropías con o sin astigmatismo y astigmatismo mixto.
Ventajas del LASIK
Esta técnica ofrece ventajas frente a las demás opciones:
Es útil para la corrección de la miopía, permite mejorar la agudeza visual espontánea y disminuir la corrección óptica.
Se logra mayor exactitud en la corrección del defecto ocular.
Es una técnica segura.
No provoca dolor.
La recuperación postoperatoria es rápida.
Se consigue una disminución notable del riesgo de aparición de complicaciones postquirúrgicas.
Se realiza de forma ambulatoria (sin necesidad de ingreso hospitalario).
Se utiliza una cantidad mínima de anestésico tópico (aplicado directamente en el ojo).
Se pueden tratar ambos ojos en una misma sesión.
Existe la posibilidad de volver a realizar la técnica en un futuro.
Efectos adversos del LASIK
Como toda técnica médica, el LASIK también tiene riesgos, efectos adversos o desventajas. No es una técnica perfecta ni inocua. Algunos ejemplos serían:
Ojo seco: es el efecto adverso más frecuente asociado con el LASIK, con más de 95% de pacientes que experimentan estos síntomas en el primer mes después de la cirugía. Suele mejorar en los siguientes 6-12 meses posteriores a la intervención, de tal manera que tan sólo un pequeño porcentaje de pacientes desarrollarán un ojo seco severo resistente a tratamiento.
No puede tratar la presbicia (o vista cansada), que sería debida a una pérdida de capacidad de enfoque del cristalino del ojo, como resultado de la progresión natural de la edad.
Puede ser necesario el uso de gafas o lentes para la lectura o la conducción nocturna, una vez realizada la intervención con láser.
Alto coste económico en la compra y mantenimiento de los equipos necesarios para la realización de esta cirugía, que hacen su uso limitado en un gran número de países.
Está contraindicada en los algunos casos. Algunos ejemplos serían:
Mujeres embarazadas o en lactancia.
Enfermedades del colágeno (síndrome de Sjögren, lupus, artritis reumatoide, etc.), autoinmunes o inmunodeficiencia.
En casos de alergia ocular no controlada, glaucoma no controlado o cualquier grado de catarata.
Historia de queratitis por herpes zóster.
La diabetes mellitus no controlada.
En conclusión
Se debe realizar una cuidadosa selección de los pacientes candidatos, basándose en una exhaustiva evaluación “caso por caso”.

Artículo especializado
Reducción de Pecho: Cirugía, Recuperación y Resultados
La reducción de pecho, o mamoplastia , es el procedimiento quirúrgico mediante el cual se extrae tejido graso, tejido mamario y piel en el mismo acto quirúrgico, para disminuir el tamaño de las mamas en mujeres con mamas prominentes. Su objetivo es, por tanto, lograr unas mamas más pequeñas, ligeras y firmes.
¿Quiénes suelen someterse a una reducción de pecho?
Se realiza en todas aquellas mujeres que presenten problemas físicos, como dolores de espalda y cuello. Lo ideal es realizarla en pacientes a partir de los 18 años, aunque pueden evaluarse casos individuales que requieran intervención antes de esa edad. No se recomienda su realización en mujeres que pretendan amamantar.
Visita prequirúrgica
En la visita prequirúrgica se deben disipar todas las dudas. Es aquí cuando el cirujano realiza una evaluación del volumen de la mama, aspecto y firmeza de la piel. La evaluación de cada caso es particular, y las técnicas a utilizarse, también. En este momento, las dudas que pueda tener la paciente han de quedar resueltas, y limitar expectativas a un plano real de cómo quedarían las mamas. Es ideal que la mujer no fume, no esté programando embarazos próximos, ni beba demasiado alcohol.
El procedimiento
El procedimiento implica ingreso hospitalario de al menos 24 a 48 horas.
La anestesia que se utiliza es anestesia general. El procedimiento suele durar entre dos y cuatro horas. Las cicatrices resultan de la extracción de grasa, piel y tejido mamario, y suelen ser peri-areolares (circundando la areola), seguidas de una cicatriz en forma de T inferior (una cicatriz vertical y una cicatriz horizontal desde la areola, resultando una T invertida, en forma de ancla).
La areola puede o bien recolocarse, conservando su inervación y sensibilidad, o bien reinsertarse, generalmente en procedimientos de reducción mamaria de tamaño gigante. Existen diferentes técnicas, pero ésta es una de las más utilizadas.
Ésta siempre debe realizarse en un ambiente estéri l, quirúrgico adecuado, por un cirujano plástico cualificado.
La recuperación
Se dejarán dos drenajes , uno en cada mama, hasta que el débito por los mismos sea de 50 cc o menor. Entonces, se retirarán, y se colocará un vendaje para el postoperatorio inmediato, el cual se retirará el primer día y se colocará el sujetador ortopédico . Es ideal que la primera visita al cirujano sea dentro de los dos a cuatro días posteriores a la cirugía.
En los controles posteriores en consulta, se controlará la evolución de las cicatrices , y su mejoría, lo cual depende en gran medida de los cuidados extremos que lleve la paciente.
Las cicatrices son visibles, pero fácilmente ocultables. Pueden darse problemas de cicatrización en fumadoras , por lo cual se desaconseja que se fume al menos durante los 30-60 días previos a la intervención.
Posterior a la cirugía, la paciente no debe realizar esfuerzos durante los primeros 30 días, ni tampoco actividad física , ya que deberá cuidar mucho la cicatrización.
Deberá utilizar día y noche un sujetador anatómico especial , indicado por el cirujano. Esto evitará deformaciones e inflamaciones en el postoperatorio.
La recuperación total se produce al cabo de un año de la cirugía y es entonces cuando las mamas adquieren volumen y aspecto definitivo, algo que puede verse alterado por los cambios de peso o embarazo durante este periodo, por lo que no se aconsejan.
Si las expectativas fueron realistas, la paciente quedará totalmente satisfecha. Pueden utilizarse simuladores previos, en 3D, para dar a la paciente una dimensión del aspecto final que tendrá.
Siempre deberá evaluarse cada caso en particular, alergias, medicación ingerida, intervenciones previas, y hábitos para descartar la presencia de complicaciones durante y posteriores a la cirugía, que resulten de una ineficiente anamnesis en la visita pre-quirúrgica.

Artículo especializado
Consigue una Sonrisa Estética
Muchas son las características atribuibles a la sonrisa: belleza, salud, frescura, bienestar, atractivo e incluso éxito . Se trata de un atributo social y de un gesto mágico que puede cambiar la actitud de tu interlocutor de forma inmediata. Podríamos añadir muchas cualidades aportadas instintivamente por la sonrisa: aumento de la autoestima, seguridad, firmeza, convicción…
Son muchas más las cualidades que analizamos en la boca de nuestro interlocutor: dientes (tamaño, color, alineación, ausencias, rotaciones…), encías (color, tamaño, forma), labios (color, forma, grosor…), tipo de sonrisa… Es evidente que todas estas características las analizamos en segundos, pero tanto nosotros como el interlocutor apreciamos ese chequeo al instante. Es en ese momento cuando la persona conocedora de algunos de sus “defectos” baja la mirada automáticamente (reconociendo su propia inaceptación) o se lleva la mano a la boca o la cierra automáticamente. Es una conducta reiterada en nuestra sociedad, seguro que te has percatado.
La sonrisa forma parte de nuestra gesticulación y personalidad , en definitiva, de nuestra forma de expresarnos. No deberíamos ni reprimirla ni contenerla, ya que supondría una represión de las emociones y los sentimientos y un estado de alerta constante que nos mantendría en tensión y estrés.
Elementos de nuestra sonrisa
Vamos a analizar más detalladamente la sonrisa. ¿Qué información podemos obtener de nuestro interlocutor cuando sonríe?
Como es evidente, la primera apreciación es la arcada dental. Recordemos que al sonreír se expone más la dentadura superior mientras que al hablar se expone la inferior. Partiendo de la información obtenida ante una persona que sonríe, ¿qué podemos apreciar en tan sólo segundos?
Dientes : podremos apreciar el color, si presenta pigmentaciones, si los dientes están alineados, si están rotados, si son asimétricos, si tiene ausencias, si están limpios…
Encías : color, hipertrofia, reborde.
Labios : grosor, color, simetría.
¿Con qué herramientas contamos los odontólogos para mejorar la sonrisa?
Ante todo, tenemos que analizar en qué componente de la sonrisa radica el problema de nuestro paciente. Tras descartar una causa de otra competencia como pueden ser la cirugía plástica o la maxilofacial nos centramos en el componente dental. Respecto a la cirugía plástica quiero remarcar su gran aportación en la mejoría de la sonrisa en lo que se refiere a infiltraciones de los llamados materiales de relleno (sobre todo de ácido hialurónico) que corrigen la pérdida de elasticidad fisiológica de la piel y, por tanto, las arrugas y los surcos pronunciados peribucales que delatan tan sinceramente nuestra edad.
Para abordar el problema dental detectado disponemos de estos recursos terapéuticos:
Ortodoncia: para solventar los problemas de maloclusión o malposición. Disponemos de una amplia batería de tratamientos siendo el tratamiento clásico el realizado con brackets metálicos. En la actualidad también existe una tendencia clara, sobre todo en adultos, al uso de la llamada ortodoncia invisible.
Dentro del concepto de ortodoncia invisible podríamos citar la ortodoncia lingual y la técnica Invisalign®. La primera emplea brackets colocados en la cara interna de los dientes, no visibles por la cara expuesta del diente. La segunda emplea una férula de material acrílico transparente que recubre la totalidad de las arcadas.
Implantes dentales : sirven para subsanar las ausencias del frente anterior dental, muy visibles durante la sonrisa. Sobre cada implante se ancla una corona que, a su vez, puede estar elaborada en diferentes materiales, siendo la más estética la que está realizada en porcelana o circonio sin metal en su interior.
Actualmente es el tratamiento prínceps para sufragar los defectos de ausencia dental. La opción de las prótesis parciales fijas (llamados comúnmente puentes fijos) ha quedado relegada a un segundo lugar, normalmente cuando la colocación de implantes está contraindicada por algún motivo médico.
Blanqueamiento , carillas dentales y restauraciones con composite: para subsanar defectos de color, forma o cariogénicos.
El blanqueamiento químico es un tratamiento con finalidad estética que consiste en reducir el tono del diente, haciéndolo más blanco. Precisa de unos requisitos para ser realizado (sobre todo que los dientes anteriores no hayan sido tratados con materiales odontológicos ya que pueden teñirse con un tono diferente al de los dientes). La tonalidad obtenida tiene una duración determinada.
Las carillas consisten en la cobertura de todo el frente anterior del diente (el concepto es equivalente al de una uña postiza que se coloca sobre nuestra uña). Pueden elaborarse en cerámica en el laboratorio o en la consulta con composite. Se colocan en todos los dientes que se exponen en la sonrisa y, normalmente en la arcada superior. Permiten corregir el color, anomalías del esmalte, el tamaño y la forma del diente, incluso los espacios entre ellos.
Las restauraciones de composite permiten corregir defectos de esmalte y sanear las caries empleando un material de tonalidad prácticamente idéntica a nuestro esmalte. Existe una batería de tonos muy amplia de este material.
Periodoncia : para subsanar los problemas detectados en la encía. Los más frecuentes son la periodontitis y la gingivitis que cursan con encías engrosadas, sangrantes y pálidas.
Después de este breve repaso vas a fijarte mucho más en la sonrisa de tus próximos interlocutores. No dudes en solicitar consejo si tienes alguna inquietud estética.
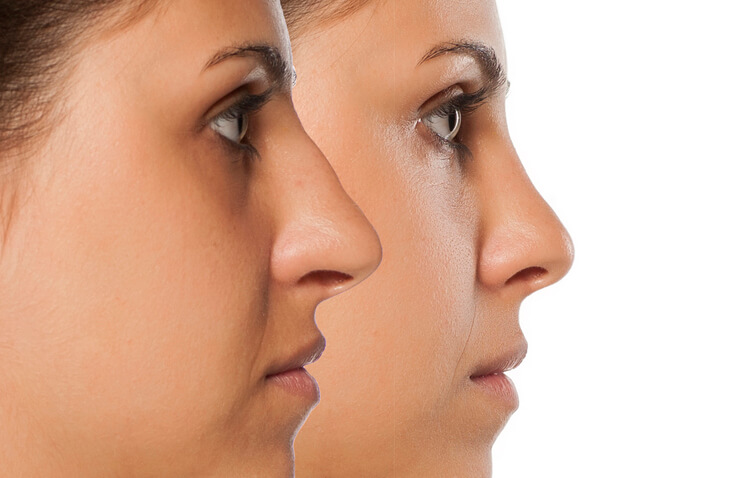
Artículo especializado
Rinoplastia con Ácido Hialurónico: A veces No es Necesario pasar por Quirófano
Se considera la rinoplastia con ácido hialurónico una alternativa a la realización del procedimiento quirúrgico de modificación del aspecto de la nariz. Consigue una mejoría en su aspecto, de una forma más simple.
En qué consiste
Generalmente, se realiza para tratar desniveles o pequeñas imperfecciones , resultado de un procedimiento quirúrgico incompleto. No requiere de ausencias laborales ni de grandes reposos. Es un procedimiento ambulatorio, que otorga equilibrio a los rasgos faciales de forma inmediata.
Puede realizarse en consulta, en menos de una hora; siempre que sea un medio adecuado y estéril para llevarlo a cabo, y por un profesional idóneo. Se comentarán previamente con el paciente las áreas a modificar, y previo a su inyección, se colocará un anestésico tópico (en algunos casos, hielo) y se procederá a aplicar cantidades mínimas en las zonas a modificar .
A pesar de que los efectos son inmediatos, pueden verse refinamientos hacia las dos semanas. Pueden existir morados mínimos, pero ello no implica complicaciones a largo plazo. Siempre se debe hacer una correcta anamnesis del paciente, descartando alergias, e ingesta de medicamentos anticoagulantes , para evitar morados en exceso. Los pacientes que utilicen gafas, deben evitarlas al menos dos semanas, para que el relleno no sufra modificaciones.
Los resultados suelen durar de seis meses a un año, permitiendo modificaciones con el paso de los meses .
Tipos de rellenos
Existen cuatro tipos de rellenos utilizados para las modificaciones nasales:
JUVEDERM: compuesto a base de ácido hialurónico. Es el más utilizado.
SCULPTRA AESTHETIC : compuesto de ácido poliláctico, a base de colágeno.
Hidroxiapatita cálcica : fomenta la producción de colágeno una vez puesta en contacto con tejidos dérmicos.
Radiesse : compuesto por material orgánico a base de agua.
Qué se consigue
Hay que tener claro que este tratamiento no modifica el tamaño nasal ni los problemas funcionales , sino que permite realizar pequeños refinamientos, que otorgan mejor aspecto a la pirámide nasal.
Se utilizan para modificaciones del puente nasal, relleno de depresiones, remodelar una punta torcida , ocultar defectos de lesiones; y reparar resultados insatisfactorios de una cirugía previa. No es una modificación permanente, sino temporal, para completar un procedimiento ya realizado.
Dentro de los beneficios obtenidos, se encuentra la mejoría del aspecto, con un mínimo dolor. Los resultados se obtienen en poco tiempo, por lo cual los pacientes pueden apreciarlos rápidamente, sin necesidad de atravesar un postoperatorio doloroso. Se utiliza como alternativa al envejecimiento de la piel de la nariz. Las zonas de mayor modificación son el perfil nasal, la punta y la base de la nariz, y sólo se trabaja adhiriendo volumen.
Las ventajas que presenta son la duración limitada ; lo cual permite que, si el paciente queda satisfecho con los resultados, al no ser permanente, se pueda detener el tratamiento y no volver a realizarse. Los resultados suelen ser excelentes, y rápidos, y en 48 horas máximo, la nariz adquiere su nuevo aspecto.
Siempre se debe tener en cuenta que los resultados pueden ir modificándose a lo largo de los tratamientos ; desde el primero al último puede haber pequeñas diferencias.
Después…
Durante las primeras 48 horas posteriores la nariz puede presentarse enrojecida, y no debe tocarse. En la semana siguiente al tratamiento no deben realizarse otros tratamientos faciales, ni deportes extremos, ni concurrir a sauna. Este tratamiento está autorizado para pacientes mayores de 18 años, con narices de tamaño medio.
No es recomendable que el paciente consuma tabaco ni alcohol en grandes proporciones, ni presente alteraciones del sistema inmunológico. Siempre se deben resolver todas estas dudas antes de realizar el procedimiento, y el cirujano será quien decida qué es lo mejor para el paciente en cada caso en particular. El precio medio oscila los 300 euros, y las sesiones pueden oscilar entre una y seis.
Artículo especializado
Rotura de Menisco: Alternativas Terapéuticas en la Actualidad
En la rodilla disponemos de dos meniscos: el interno y el externo y se encuentran alojados en el espacio interarticular entre el fémur y la tibia. Su función es la de amortiguar la fuerza y la carga que recaen sobre la superficie articular durante el movimiento favoreciendo la congruencia articular.
MENISCOS
Los meniscos son estructuras fibrocartilaginosas en forma de media luna situadas en las articulaciones, concretamente entre las superficies articulares de los dos huesos que la conforman. A pesar de que los meniscos de las rodillas son los protagonistas, existen muchas otras articulaciones con menisco en el cuerpo humano como son la clavícula, las costillas, la muñeca y la mandíbula.
El menisco interno tiene forma de semiluna mientras que el externo es casi circular. Curiosamente son más frecuentes las lesiones del menisco interno. Cada menisco posee un cuerpo y unos extremos llamados cuernos .
Por ser de consistencia cartilaginosa no es posible visualizarlos en una radiografía convencional por lo que cuando la exploración nos sugiere una posible lesión meniscal precisamos hacer un estudio mediante una resonancia magnética nuclear para confirmarla. Asimismo, y en función del tipo de lesión, existe una batería de tratamientos a considerar en función, sobre todo, de la edad del paciente, hábito deportivo, actividad laboral y entorno médico.
De entre las lesiones meniscales más frecuentes podríamos citar el quiste meniscal, el bloqueo meniscal, la meniscitis y la rotura meniscal.
¿Cuál es el mecanismo lesional más frecuente del menisco?
En general, podríamos citar la entorsis de rodilla o giro brusco como principal causa de lesiones meniscales. Supone un cizallamiento de su superficie pudiendo ocasionar una simple inflamación (meniscitis) o una solución de continuidad (rotura meniscal). En pacientes jóvenes estos giros bruscos de la rodilla aparecen normalmente durante la práctica de actividad deportiva (futbol, skate, artes marciales…). Sin embargo, en edad adulta es mucho más frecuente la lesión meniscal por causa artrósico-degenerativa o traumática.
¿Cómo se actúa ante una lesión?
Ante una lesión meniscal de rodilla podemos encontrarnos un dolor en fase aguda a nivel de la cara interna o externa coincidiendo con la línea interarticular donde se alberga el menisco lesionado. Puede o no aparecer derrame articular e incluso un bloqueo articular que impediría al paciente extender totalmente su rodilla. Dicho sea de paso, en caso de bloqueo meniscal es necesario acudir a urgencias para recolocar el menisco en su espacio articular. A pesar de que en el servicio de urgencias no se realiza la resonancia magnética nuclear es importante la visita ya que la exploración será muy evidente y específica. Existen múltiples maniobras meniscales para la exploración de los meniscos de las rodillas. Asimismo, nos pueden solicitar una radiografía que puede mostrar lesiones asociadas al menisco y el estado óseo de la articulación.
En fase aguda iniciaremos un tratamiento sintomático, generalmente con analgésicos y/o antiinflamatorios. Aplicaremos frío local (crioterapia) sobre la zona afecta, pero siempre interponiendo un paño entre la piel y el hielo para evitar quemaduras cutáneas y con una frecuencia alta y duración aproximada de 15-20 minutos en cada ocasión. Además, realizaremos un reposo relativo, no hace falta que estemos en reposo absoluto en cama, pero podemos estar sentados en el sofá con la pierna en alto y aplicándonos la crioterapia. En algunas ocasiones será necesaria la colocación de un vendaje con finalidad antiinflamatoria.
Si la lesión es leve…
En este caso el tratamiento es resolutivo, aunque puede ser necesaria la realización de un tratamiento rehabilitador para erradicar absolutamente los síntomas. Ahora bien, si no conseguimos controlar los síntomas debemos acudir nuevamente a visita médica pues puede ser el momento de solicitar la resonancia para ver el estado del menisco dañado.
La resonancia magnética nuclear es la prueba prínceps para valorar tanto las lesiones meniscales como las ligamentosas y cartilaginosas. Una vez confirmada la lesión meniscal podemos encontrarnos diferentes alternativas terapéuticas. Normalmente se opta por el tratamiento conservador en primer lugar, haciendo hincapié en el tratamiento rehabilitador. Ocasionalmente, pueden administrarse infiltraciones con corticoides o terapias biológicas . Por supuesto, recomendaremos reposo deportivo.
En caso de que el tratamiento conservador no consiga erradicar los síntomas o la lesión meniscal sea severa debemos optar por la opción quirúrgica donde, de nuevo, encontraremos diferentes opciones terapéuticas, siendo las más frecuentemente empleadas:
Meniscectomía parcial: es una cirugía conservadora en la que se realiza la resección del fragmento meniscal lesionado manteniendo el resto de menisco sano en su localización habitual.
Sutura meniscal : técnica de más reciente incorporación que opta por suturar el fragmento roto del menisco sin necesidad de resecarlo. Precisa un cirujano experimentado. Persigue la conservación de la integridad articular evitando procesos artrósicos secundarios.
Ambos procedimientos se realizan mediante la técnica artroscópica sin necesidad de incisión cutánea y cuya recuperación es de corta duración, aunque suele precisarse un tratamiento rehabilitador coadyuvante.

Artículo especializado
Tipos de Inseminación Artificial
Actualizado el 17/09/2021
La inseminación artificial es la técnica de reproducción asistida más sencilla y que ofrece una probabilidad de embarazo cercana al 15%. Para su utilización es necesario que la mujer conserve la capacidad de ovular.
¿Qué es la inseminación artificial?
La inseminación artificial es una de las técnicas de reproducción asistida más utilizadas, junto a la fertilización in vitro. Consiste en la introducción de una muestra de semen en el interior del útero en el momento en el que la mujer está ovulando y dejar que el proceso de fertilización del óvulo se produzca de forma natural. Previamente, la muestra de semen habrá sido tratada en el laboratorio y los ovarios habrán sido estimulados para promover la maduración de los óvulos.
¿Cuándo está indicada la inseminación artificial?
La inseminación artificial es útil en varios casos. En primer lugar, cuando el motivo de esterilidad es una alteración leve de la calidad del semen, ya que este se puede mejorar en el laboratorio.
También está indicada cuando en la mujer concurren defectos en la calidad del moco del cérvix uterino, que podrían dificultar el ascenso de los espermatozoides hacia el útero y las trompas.
Otras situaciones de la mujer en las que la inseminación artificial puede mejorar la probabilidad de conseguir la gestación incluyen endometriosis no severas, alteraciones de las trompas de Falopio que no supongan su obstrucción completa y trastornos de la ovulación, entre otras.
Por otro lado, la inseminación artificial con semen de donante está indicada en casos de azoospermia (ausencia de espermatozoides en el eyaculado), causas masculinas severas que impidan la producción de espermatozoides viables y trastornos genéticos masculinos transmisibles a la descendencia.
Finalmente, la inseminación artificial está indicada cuando no existe pareja masculina. En este caso también será necesario recurrir a una muestra de semen de donante.
Procedimiento
El tratamiento de inseminación artificial se suele comenzar con el inicio del ciclo menstrual. A partir de una ecografía vaginal se comprueba que el ovario está preparado para comenzar con la estimulación. A continuación, se procede a suministrar la medicación y se sucederán los controles necesarios para valorar la respuesta de la paciente. En los días siguientes tendrá lugar la inseminación, para lo que se debe disponer de una muestra seminal procesada en el laboratorio, con el fin de seleccionar los espermatozoides más útiles.
La inseminación se realiza de modo ambulatorio, ya que se trata de un procedimiento breve y completamente indoloro.
La disposición de la paciente es similar a cuando se somete a una citología . El ginecólogo introducirá hasta el útero un tubo de plástico blando o cánula para depositar los espermatozoides seleccionados.
Tras la inseminación se puede establecer un tratamiento con progesterona para preparar el útero para el inicio de la gestación.
La existencia de la gestación se comprobará mediante una prueba de orina o sangre, y se podrá confirmar semanas más tarde por medio de una ecografía.
Preparación de la muestra de semen
Para realizar la inseminación artificial se toma la muestra de semen y se purifica en el laboratorio seleccionando los espermatozoides móviles y funcionales y eliminando los de peor calidad. Se puede llegar a desestimar el 90% de líquido seminal cuya única finalidad es transportar a los espermatozoides hasta el interior del útero, ya que la muestra será depositada en su lugar de destino.
Pruebas previas a la inseminación
Con anterioridad a la inseminación se llevará a cabo una analítica de sangre en la mujer para comprobar que no hay ningún problema de cara a la gestación. Se puede incluir una valoración de la función tiroidea y una determinación de hepatitis B y C, VIH y sífilis, así como la prueba de inmunidad frente al toxoplasma y la rubeola.
También está indicada la realización de una histerosalpingografía , prueba encaminada a valorar la permeabilidad de las trompas de Falopio.
Finalmente, si la inseminación se lleva a cabo con el semen conyugal, se realizará previamente un seminograma con recuento de espermatozoides móviles.
Tipos de inseminación artificial
En función del origen del semen para realizar la inseminación artificial se distinguen la inseminación con semen conyugal y con semen de donante.
Inseminación artificial conyugal
Es la que se produce cuando hay un miembro masculino en la pareja y su semen es normal o solo existen alteraciones leves en el semiograma. También cuando la esterilidad es de causa desconocida y en casos de alteraciones del cuello del útero que dificulten el ascenso de los espermatozoides.
Inseminación artificial con semen de donante
Será necesaria una muestra de semen de donante en casos de pareja estéril en el que el seminograma muestre ausencia total de espermatozoides, o alteraciones muy severas del porcentaje de formas móviles que no sean significativamente mejorables en el laboratorio. También cuando el miembro masculino de la pareja sea portador de alguna alteración genética que haga desaconsejable el embarazo. Finalmente, la inseminación artificial con semen de donante está indicada cuando no hay pareja masculina o una mujer quiere quedarse embarazada por su cuenta.
Resultados y tasa de éxito
La inseminación artificial con semen de donante suele tener buenos resultados cuando se recurre a la técnica de reproducción por no tener pareja masculina, ya que las muestras de banco de semen son evaluadas para que sean de óptima calidad. Por su parte, la inseminación artificial con semen conyugal presenta resultados más variables, según sea cada caso. En términos generales, la probabilidad media de obtener gestación por cada ciclo realizado es de un 10-15%. En cualquier caso, se trata de una técnica bastante inocua que no suele requerir tratamientos médicos agresivos.
Preguntas frecuentes
¿Es lo mismo inseminación artificial y fecundación in vitro?
No. La inseminación artificial consiste en depositar los espermatozoides en el aparato genital de la mujer, por medio del instrumental adecuado. Por el contrario, la fertilización in vitro es un procedimiento más complejo consistente en obtener un óvulo para que sea fertilizado en el laboratorio y transferir el embrión obtenido al interior del útero en el momento adecuado para que se pueda implantar.
¿La inseminación artificial es un tratamiento doloroso?
La inseminación artificial es una técnica muy sencilla e indolora y su realización es comparable a la de una citología. Después de su realización no es necesario guardar reposo y se puede continuar con la rutina habitual.
¿Cuántas veces se puede someter una mujer a inseminación artificial?
No existe un número máximo que suponga un riesgo para la salud. Determinados estudios recomiendan realizar hasta un máximo de 4 inseminaciones con semen conyugal y 6 con semen de donante. Sin embargo, el ginecólogo debe valorar cada caso para aplicar el tratamiento en función de las características y necesidades de cada pareja.
Riesgos de la inseminación artificial
Al igual que sucede en otras técnicas de reproducción asistida, existe un mínimo riesgo de hiperestimulación ovárica, si bien gracias a los controles analíticos y ecográficos es poco habitual.
Otros riesgos son los propios del embarazo, como la gestación gemelar (poco probable si solo hay 1 o 2 folículos), gestación ectópica , aborto, etc.
¿Cuántos tratamientos de inseminación artificial se producen en España?
En el año 2018 se llevaron a cabo en España 34.100 tratamientos de inseminación artificial y 149.337 tratamientos de fecundación in vitro. Como consecuencia, 37.094 bebés nacieron gracias a los tratamientos de reproducción asistida realizados, lo que supone más de un 9% del total de nacimientos.
Bibliografía
Sociedad Española de Fertilidad. Saber más sobre fertilidad y reproducción asistida. 2011. Consultado: 14/06/2021 .
Sociedad Española de Ginecología y Obstetricia. Inseminación Artificial. Consultado: 14/09/2021 .
Ministerio de Sanidad. Notas de prensa. Los tratamientos de reproducción asistida en España aumentan un 28% en los últimos 5 años. 01/10/2020. Consultado: 14/09/2021 .
Merviel P et al. Une étape nécessaire dans la prise en charge du couple infertile: Inséminations intra-utérines [Intrauterine insemination]. Rev Prat 2014; 64(1): 87-91. PMID: 24649556 .

Artículo especializado
Tipos de Injertos Capilares, ¿Qué Resultados Debo Esperar?
El injerto capilar es una técnica que consiste en añadir, mediante procedimiento quirúrgico , cabellos en zonas de alopecia o calvicie, aumentando la calidad y densidad del pelo. Se puede realizar tanto en hombres como en mujeres, en un intento de mejorar la calidad de vida del paciente.
El procedimiento debe llevarse a cabo por un profesional idóneo en una clínica habilitada, en un ambiente estéril. El cirujano valorará en la visita prequirúrgica los motivos para su realización y los resultados esperables según el procedimiento, ofreciendo una solución permanente a la caída de cabello.
Para su realización, se deben tener en cuenta el tamaño de las placas de alopecia y las zonas a injertar, así como el diagnóstico de causa de caída de cabello. En las visitas prequirúrgicas también deben establecerse las expectativas del paciente, siendo el cirujano lo más realista posible acerca de lo que es posible obtener.
¿Cómo se llevan a cabo?
El injerto capilar es un procedimiento ambulatorio , que dura unas horas y que no implica un gran descanso postoperatorio. Se puede realizar un primer trasplante capilar de mucha cantidad de folículos en una sesión, y luego realizar una segunda sesión de apoyo. Se recomienda injertar de 250 a 2.500 cabellos en un día.
Existen varias técnicas para realizar injertos capilares:
Técnica FUE : el paciente es su propio donante de cabello. Se extraen los folículos individualmente, de la zona occipital de la cabeza. Se obtienen folículos pilosos completos, que se microinjertan, sin cortes ni suturas. Durante los primeros días el paciente no debe lavarse el cabello ni realizar esfuerzos físicos. Es una técnica recomendada para zonas pequeñas. El precio total ronda los 8.000 euros en esas zonas.
Técnica FUSS: recomendada para cualquier tipo de calvicie. Se basa en extraer tiras de pelos de 15-20 cm de longitud, por 1 cm de ancho de la region occipital de la cabeza.
No sólo se extrae el folículo piloso, sino todos los componentes que permiten el mantenimiento y crecimiento del pelo. Permite realizar grandes trasplantes capilares, y un crecimiento más rápido del cabello en bloque. Como desventaja está la presencia de cicatriz, y suturas, por lo cual el paciente debe cuidarse mucho en el postoperatorio. El precio también oscila en torno a los 5.000 euros.
Técnica BHT: se extraen pelos de otra zona del cuerpo diferente a la cabeza (torso, piernas, brazos, abdomen). El objetivo fundamental de esta técnica es dar volumen y espesor al cabello. Es un complemento para las otras dos técnicas. Deben tenerse en cuenta la densidad del cabello, la similitud con el pelo del cuero cabelludo, la extensión y longitud; y el número de folículos a insertar. Se debe recurrir a ella como último recurso, ya que actualmente se encuentra en estudio.
En Savia te ofrecemos el injerto capilar de mano de los mejores profesionales al mejor precio.
Diferencias entre FUE y FUSS
La diferencia entre las técnicas FUE Y FUSS es que la técnica FUSS es un 50% más barata , y permite hacer trasplantes de hasta 10.000 cabellos diarios. La tasa de supervivencia del cabello es mayor, ya que se extrae más tejido en el procedimiento; y permite una mayor densidad del cabello en la zona receptora, aunque es necesario un mes de reposo y requiere el cuidado de la cicatriz.
En cuanto a la técnica FUE, la extracción individual de los folículos pilosos de a uno permite que no exista periodo de reposo obligado. El postoperatorio es mucho más suave , y hay una exactitud en la cantidad de injertos realizados. Se pueden realizar múltiples injertos en pocos días.
Como desventaja, se tarda más tiempo en su realización, es más caro y es difícil la repoblación total, teniendo el pelo, una tasa de sobrevida menor. Para su realización es necesario raparse la cabeza.
La elección de la mejor técnica para cada paciente debe ser evaluada por cirujano y paciente, dependiendo de los resultados que se persigan, de forma individualizada, y teniendo en cuenta los pro y contras de cada procedimiento. Se recomienda siempre consultar a un especialista idóneo y formado en el ámbito.

Artículo especializado
Logopedia en Niños, ¿Qué Opción es Mejor para Tus Hijos?
¿Conoces el inestimable trabajo que realizan los logopedas de nuestro país? En los primeros años de vida de un niño, los dos hitos más importantes que se adquirirán son el aprendizaje de la lengua materna y el rápido desarrollo psicomotor . A partir de ellos son posibles las posteriores interacciones con el medio y el establecimiento de bases sólidas que permiten nuevos y más complejos aprendizajes.
El desarrollo del lenguaje
A lo largo de la historia, han existido numerosas teorías que intentan explicar y comprender el desarrollo del lenguaje infantil y, desde el punto de vista más integrador de todas ellas, el lenguaje se desarrollaría a través de una serie de etapas sucesivas cronológicamente, constituyendo un complejo proceso de adquisición, que evoluciona paralelamente al desarrollo físico y mental del niño/a, gracias, entre otros factores, a la maduración del Sistema Nervioso Centra l y la estimulación proveniente del medio ambiente que rodea al individuo.
Pero las adquisiciones no se producen de forma lineal y uniforme, sino que pueden aparecer múltiples variables que dificulten dichos procesos y, en consecuencia, perjudiquen el desarrollo global de las capacidades del sujeto.
Será posible llevar a cabo una intervención temprana para corregir o tratar el déficit en el rango de edad entre los 0 y los 6 años.
¿Qué es?
La logopedia es la disciplina profesional que se ocupa de la prevención, la evaluación y la intervención de los trastornos de la comunicación humana , manifestados a través de alteraciones de la voz, el habla, el lenguaje escrito y gestual, la audición, etc. y atiende tanto a la población infantil como adulta. Su campo de aplicación es amplísimo.
Área de la Voz:
Disfonías /afonías.
Educación vocal/Entrenamiento vocal.
En los adultos: optimización de la voz en uso profesional, pacientes laringuectomizados (extirpación de la laringe), etc.
Área de lenguaje infantil:
Trastornos específicos del lenguaje: retraso simple en la adquisición del lenguaje, disfasias (falta de coordinación en las palabras).
Trastornos asociados al lenguaje: trastornos generalizados del desarrollo, TDAH – trastorno por déficit de atención e hiperactividad -, etc.).
Área de la lecto-escritura:
Dislexia.
Disgrafía (trastorno de la capacidad de escribir).
Discalculia (dificultad para aprender los principios del cálculo).
Comprensión lectora, etc.
Área del habla y deglución:
Dislalias (dificultad de articular palabras por uso incorrecto de los órganos articulatorios del habla).
Alteración en la fluidez del habla (disfemia o popularmente denominada “tartamudez” ).
Disfagia (dificultad para tragar).
Degluciones atípicas.
Respiración bucal.
Área de audiología:
Prevención, detección, localización y medición de la lesión auditiva.
Equipamiento protésico en la disminución de la audición.
En adultos: Medición de ruido laboral y sus repercusiones.
¿Cuándo sería necesario consultar a un logopeda?
Si aprecias en tu hijo alguna de las siguientes situaciones:
Dificultades en la audición , o si, aun oyendo bien, encuentra dificultades para discriminar algún sonido.
Si no habla o habla escasamente.
Si padece afonía con frecuencia.
Si respira con la boca abierta.
Si tiene dificultades para pronunciar algún sonido.
Si es difícil comprenderle cuando habla.
Si se salta la pronunciación de algún sonido o agrega otros que no corresponden.
Si presenta dificultades a la hora de leer o escribir correctamente.
Si presenta afecciones como parálisis cerebral o espina bífida.
Si padece algún tipo de retraso del desarrollo, autismo u otros síndromes.
Si se despista/desconcentra con facilidad ante cualquier situación de la vida diaria.
CONSEJOS DE ACTUACIÓN EN LOS PADRES
El cumplimiento de unas sencillas normas de conducta lingüística por parte de los padres reportará evidentes beneficios en el desarrollo del lenguaje infantil. Se resumen en:
Atender tempranamente el desarrollo de la capacidad de la comunicación oral, mediante la implicación de la familia en la estimulación del desarrollo del lenguaje.
Hablar clara y de forma correcta a los niños (adecuados modelos verbales).
Evitar el uso del lenguaje infantilizado.
Convertir en juego la imitación de sonidos y palabras.

Artículo especializado
Brackets o Aparatología Removible
La elección del tipo de ortodoncia estará condicionada por diferentes factores como son la edad y el entorno médico del paciente, la maloclusión o malposición dental que se tenga que corregir, el estado del diente y del periodonto, la predisposición y las preferencias del paciente…
Tratamiento ortodóntico
Cuando hablamos de tratamiento ortodóntico se nos abren dos grandes posibilidades terapéuticas atendiendo a su tipo de fijación: la aparatología fija (que es aquella no extraíble) y serían los brackets, por excelencia, y la aparatología removible (o de quita y pon). Serían, por ejemplo, el alineador Invisalign® y la aparatología de resina y metal de uso generalmente nocturno).
La aparatología fija es efectiva durante las 24 horas del día , pero precisa de un entrenamiento del paciente en cuanto a la masticación y la higiene. Quienes la usan no pueden comer caramelos de consistencia semiblanda o chicle por suponer un peligro en la adhesión de los brackets y no pueden emplear hilo dental por ser portadores del arco tensor que dificulta su paso por el espacio interdental.
La aparatología removible, en cambio, nos permite una ingesta cómoda dado que la retiramos en las principales comidas y durante la higiene dental posterior , pero nos exige mucha constancia y perseverancia. Podemos tener grandes tentaciones de no usarla en más de una ocasión. Por ello requiere un compromiso y responsabilidad por parte del paciente.
Ortodoncia con o sin brackets
Dentro de la ortodoncia con brackets estarían los brackets de diferentes tipos de materiales . Dentro de la ortodoncia sin brackets tendríamos, por ejemplo, la aparatología removible de resina y metal y el alineador Invisalign®.
La estética influye
Atendiendo al punto de vista estético podríamos introducir dos grandes grupos de aparatología ortodóntica: la llamada ortodoncia invisible y la ortodoncia metálica.
La ortodoncia invisible es aquella fabricada en material transparente (tipo Invisalign®) o aquella no visible a simple vista (por ejemplo, los brackets colocados en la cara interna o lingual de los dientes, anclados en el interior de la arcada dentaria y por tanto no visibles en la cara expuesta de los dientes. Sobre todo, empleada en adultos profesionalmente activos).
La ortodoncia Invisalign® tiene la peculiaridad de ser removible e invisible. Es decir, de quita y pon y fabricada en material transparente (muy similar a las férulas empleadas para el bruxismo). Debe recambiarse cada 15 días aproximadamente para adaptarse al movimiento dental. Este tratamiento es de más larga duración.
La ortodoncia metálica (brackets metálicos) es estéticamente menos favorecedora, pero de alta resistencia, por ello se utiliza en pediatría. Fue la primera en comercializarse y posteriormente se lanzaron brackets elaborados con otros materiales más estéticos como la cerámica o porcelana (de color similar al diente, pero anclados a un arco tensor metálico. No cambian de color con el paso del tiempo) o el zafiro (prácticamente transparentes con arco tensor metálico o de teflón y que estéticamente serían los mejores). Existe un sistema con brackets metálicos, pero diferente al convencional, que es el llamado Sistema Damon. Emplea unos brackets metálicos especiales que se fijan al arco tensor directamente sin necesidad de las ligaduras elásticas de los brackets convencionales.
Tenemos que decir que la ortodoncia metálica con brackets es muy resolutiva y más económica que el resto de las opciones . Los brackets no metálicos confieren menor resistencia y, por tanto, mayor fragilidad y tienen un precio más elevado. Las alternativas son muy diferentes entre sí, pero cada una de ellas tiene un público determinado.
Elegir y acertar
La opinión o preferencia del paciente es relevante, pero no siempre se adapta a su necesidad terapéutica. Generalmente el paciente suele inclinarse por la opción más estética . Por ello tiene una gran demanda la ortodoncia invisible y removible. A estas alturas ya conoces que se trata de una ortodoncia de quita y pon y de color transparente, siendo el tratamiento Invisalign® la estrella de esta opción .
Sea cuál sea el tratamiento definitivo empleado, al finalizarlo se recomienda realizar un tratamiento retentivo. Normalmente consiste en la colocación de una férula metálica por la cara lingual o interior de la arcada que ayuda a mantener los dientes correctamente alineados.

Artículo especializado
Chequeo Preventivo Oncológico
Hoy en día, una parte importante de nuestro trabajo asistencial como médicos es el de la medicina preventiva, fomentando hábitos de vida saludables, como la dieta y la actividad física, y realizando en ocasiones pruebas de detección precoz en casos necesarios para poder prevenir enfermedades potencialmente graves o mortales. Algunas de estas enfermedades tienen un comienzo insidioso, con un periodo de tiempo prolongado durante el cual la persona permanece completamente asintomática, pese a que en su organismo ya se hayan producido cambios a nivel celular.
Es en estas ocasiones y en casos particulares en los que vale la pena llevar a cabo algunas pruebas que permitan detectar estas enfermedades en sus primeros estadios para poder tratarlas de inmediato. En el caso de las enfermedades oncológicas, este cribado preventivo puede ser de vital importancia, no para la población general, pero si en determinados pacientes en concreto.
No para todos los tipos de cáncer
Desde un punto de vista sanitario no es factible ni eficiente realizar un cribado de todos los posibles tipos de cáncer a toda la población sana. Para que la relación coste-beneficio sea tal que haga pertinente dicho cribado, la enfermedad tiene que cumplir una serie de requisitos:
Que sea una causa habitual de morbilidad y mortalidad.
Que sea detectable y tratable en un estadio temprano, cuando el paciente permanece asintomático.
Que se disponga de pruebas diagnósticas efectivas y eficaces.
Que la aplicación de un tratamiento temprano resulte mejor que el tratamiento en la fase manifiesta de la enfermedad.
Y que el daño potencial de la intervención sea menor que el del tratamiento no precoz.
Así pues, no se puede realizar un cribado poblacional de todos los tipos de cáncer porque eso sería inviable desde un punto de vista económico y porque muchos de estos tipos de tumores, pese a su potencial gravedad para la vida de los pacientes, no cumplen los requisitos mencionados. Por ejemplo, no sería ético realizar un cribado oncológico para un tumor concreto para el que no se dispone de un tratamiento o intervención que frene o trate dicho cáncer, sometiendo a la persona sana a un estado de estrés o angustia innecesario.
Programas de detección precoz
Sin embargo, en algunos casos sí que disponemos de programas sanitario de detección precoz de ciertos tipos de cáncer que cumplen los criterios mencionados anteriormente y en los cuales intervención precoz permite disminuir la morbilidad y la mortalidad de estas enfermedades oncológicas, lo cual, a su vez, permite reducir los costes sanitarios. Algunos de estos programas son:
Cribado del cáncer de mama mediante mamografías periódicas.
Cribado del cáncer de cuello de útero mediante las citologías anuales.
Cribado de pacientes con pólipos intestinales para detectar su malignización precoz.
Cribado de cáncer de colon y recto mediante detección de sangre oculta en heces (en estudio).
Las pruebas a realizar tienen que ser altamente sensibles y específicas, cómodas, que no supongan un coste elevado y que los médicos podamos interpretarlas con facilidad. Las ventajas de la detección precoz son muchas, ya que se reduce la tasa de mortalidad de estos tumores, aumenta la posibilidad de éxito de los tratamientos oncológicos, disminuyen las complicaciones y secuelas tanto de la enfermedad per se como de los propios tratamientos, y se recorta el coste asistencial al sistema sanitario.
Herencia
En algunos casos, algunos cánceres, como ciertos tipos de cáncer de colon, de mama o de ovario pueden tener un componente hereditario familiar relevante. En pacientes con familiares directos que hayan sufrido alguno de estos tipos de cáncer puede ser necesario y útil, siempre bajo supervisión médica, hacer algunas pruebas genéticas para detectar la presencia de los genes implicados en este tipo de tumores y, en caso positivo, realizar pruebas de cribado para esos cánceres.
¿Inconvenientes del diagnóstico precoz?
Con todo, el diagnóstico precoz de las enfermedades oncológicas no está exento de ciertos inconvenientes, como son la detección de falsos positivos (resultado positivo de la prueba sin que la persona esté enferma) o falsos negativos (resultado negativo de la prueba cuando la persona está realmente enferma), con las consecuencias anímicas y de salud que esto conlleva. Estas limitaciones dependen de las pruebas empleadas para la detección precoz del cáncer. Un falso positivo implicará llevar a cabo toda una serie de pruebas para confirmar el diagnóstico, con la carga emocional, física y económica que eso conlleva, mientras que un falso negativo supondrá que se perderá la oportunidad de tratar a una persona en estadios precoces de una enfermedad, con el consiguiente riesgo de que esta enfermedad progrese y luego no pueda tratarse o suponga un coste más elevado tanto para la salud del paciente como para el sistema de salud.
Algunas voces ponen en tela de juicio la utilidad de ciertas medidas de detección precoz, como es el caso de la valoración del PSA para detectar de manera precoz el cáncer de próstata. En ocasiones se diagnostican cánceres de próstata sin que se vaya a llevar a cabo ningún tratamiento activo y cuya evolución natural no va a acortar la vida del paciente. Sí es útil, no obstante, que a partir de los 40 años los hombres nos sometamos anualmente a un tacto rectal para poder palpar anomalías en la próstata, una exploración que conlleva un coste prácticamente nulo.
En conclusión
La detección precoz es una herramienta útil para luchar contra el cáncer y mejorar la salud de las personas desde un punto de vista global, pero no se puede ni se deben realizar pruebas para detectar todos y cada uno de los cánceres que existen y en todas las personas, sino en casos determinados y bajo la valoración de los profesionales de la salud.

Artículo especializado
Ortodoncia Invisible: Tipos y Ventajas
A pesar de la constante aparición de nuevos modelos de ortodoncia no se han desbancado los anteriores. Por ello, en la actualidad contamos con un amplio abanico de recursos terapéuticos que seleccionaremos cuidadosamente en función del paciente y de la patología a abordar. Si bien la ortodoncia metálica es menos estética , es mucho más resistente que la llamada invisible, por ello es muy frecuentemente empleada en edad infantil. Sin embargo, la opción invisible es muy empleada en adultos por el prejuicio estético que pudiera acarrear la ortodoncia metálica.
Nos centraremos en la llamada ortodoncia invisible por tratarse de la más recientemente lanzada al mercado. Existen dos grandes tipos de ortodoncia invisible comercializados: la ortodoncia lingual (basada en aparatología fija) y la ortodoncia con alineadores transparentes (que emplea aparatología removible o de quita y pon).
La ortodoncia lingual
La ortodoncia lingual es una ortodoncia no apreciable a simple vista por estar colocada en la cara posterior de los dientes, es decir por dentro de la arcada dental. Se la conoce como ortodoncia de incógnito. Emplea brackets más finos que la ortodoncia convencional. Se puede realizar con diferentes tipos de materiales. Su diseño está elaborado a medida para cada paciente empleándose tecnología avanzada mediante un programa informático que permite visualizar en tres dimensiones (3D). Al ser colocada en la boca requiere un tiempo de adaptación pues la lengua está en íntimo contacto con ella y los primeros días puede ocasionar incomodidad e incluso alguna pequeña lesión lingual por fricción.
Los alineadores invisibles
Los alineadores invisibles o transparentes (conocidos por el nombre comercial: Invisalign ®) constituyen la otra alternativa de la ortodoncia invisible. Es una técnica de ortodoncia de última generación que emplea unas férulas transparentes de material termoplástico, de gran resistencia y flexibilidad que deben ser renovadas periódicamente (normalmente cada 15 días).
La férula transparente se fabrica a medida y en su interior se colocan unos accesorios activos que permiten modificar el movimiento o la alineación dental hacia la posición deseada. Se deben llevar durante todo el día pudiéndose retirar en las principales comidas y para la higiene. Por ello durante el tratamiento es posible mantener una higiene dental exquisita, permitiendo incluso el uso de la seda dental (a diferencia de la ortodoncia dental anteriormente mencionada). Precisa visitas frecuentes al odontólogo pues debe recambiarse la férula con asiduidad hasta obtener la nueva posición dental perseguida.
Diferencias importantes entre ambas
A pesar de que ambas técnicas de ortodoncia son invisibles y de eficacia similar presentan algunas diferencias significativas. Así, mientras que la ortodoncia lingual emplea brackets y alambres (aparatología fija), el alineador invisible emplea una férula acrílica removible (que se puede retirar).
Como hemos mencionado, debemos señalar que la ortodoncia lingual, a pesar de emplear brackets de menor tamaño y grosor, requiere generalmente un periodo de adaptación que puede oscilar entre los 15 y los 20 días. Este sistema es fijo (no removible o de quita y pon). Al estar colocado en la cara interna de los dientes no ocasiona ninguna lesión aparente en el esmalte de la cara externa de los dientes (cara expuesta al abrir la boca). No olvidemos que la aparatología metálica convencional (brackets metálicos) puede causar con cierta frecuencia pequeñas lesiones (como descalcificación y pigmentación) en el esmalte de la superficie dental donde se ancla el bracket.
Otra de las diferencias radica en el grado de invisibilidad . Invisalign, al tratarse de una férula en la que se encaja la arcada dental, aun cuando es completamente transparente, puede llegar a apreciarse desde el exterior al incidir la luz sobre ella y producir algún tipo de brillo. Sin embargo, la ortodoncia lingual queda completamente oculta a la vista de otras personas.
Finalmente, una diferencia remarcable es el precio, siendo Invisalign la de precio más elevado. No obstante, la elección de una u otra deberá hacerse después de que el ortodoncista haya informado adecuadamente al paciente de las ventajas e inconvenientes de ambas técnicas sin obviar las otras posibilidades terapéuticas de las que disponemos y cuya experiencia y resultados son indiscutibles.
El repertorio es muy amplio. Asimismo, existen múltiples indicaciones para prescribir la ortodoncia. Me atrevería a decir que un alto porcentaje de la población tiene alguna indicación para llevar ortodoncia, siendo en la mayoría de los casos, la motivación estética la que induce al tratamiento. Como es evidente, es el odontólogo-ortodoncista quien debe valorar y estudiar cada caso de forma individualizada.

Artículo especializado
Enfermedades de Transmisión Sexual
Como su nombre indica, son enfermedades que se transmiten predominantemente mediante el contacto sexual. Es mejor llamarlas infecciones de transmisión sexual, pues hay casos en que el contagio comporta la condición de sujeto portador transmisor de esa enfermedad y no siempre provocan la enfermedad.
Cómo se producen
Los causantes de estas infecciones pueden ser virus, bacterias o parásitos. Se transmiten de persona a persona durante las relaciones sexuales incluyendo el sexo vaginal, anal y oral. Algunas de ellas por el intercambio de fluidos corporales, como la sangre o el semen , como los virus de la Hepatitis B y C, el VIH. En estos casos la prevención mediante el uso del preservativo en cualquier contacto sexual es eficaz. Pero en otros casos, como el herpes simple o el virus del papiloma humano la transmisión es por contacto piel con piel, por lo que el uso de preservativo no nos exime de contagiarnos de esos agentes infecciosos.
En algunas ocasiones la infección se puede adquirir por medios no sexuales que comporten contaminación con sangre infectada, como transfusiones de sangre o compartir jeringuillas, y también es posible la transmisión de madres infectadas a hijos durante el embarazo o el parto.
En cuanto a sintomatología es muy variada, depende del tipo de agente infeccioso. Pueden ser absolutamente asintomáticas y el portador no ser de ningún modo consciente de ser transmisor de esa enfermedad, como el caso del virus del papiloma. En otros casos pueden causar secreción vaginal o uretral acompañada de escozor o ardor genital, otras veces las infecciones provocan lesiones genitales como verrugas o úlceras… Pueden ser muy leves y otras muy graves, de algunas existe tratamiento y de otras no, pero, aunque no se puedan curar, existen tratamientos para controlar los síntomas de la enfermedad.
Clasificación según el agente causal
Como vemos no hay un patrón, así que para profundizar habrá que repasar una por una. Las agruparemos según su agente causal : virus, bacterias o parásitos, las más importantes son:
Víricas: este tipo de infecciones víricas no tienen tratamiento curativo.
Virus del papiloma humano : se contagia por el contacto piel con piel, afecta a las células del cuello uterino donde algunos serotipos más agresivos pueden llegar a causar un cáncer de cuello si no se diagnostica. Otros son causantes de las verrugas genitales o condilomas.
Virus del herpes simple : también transmisible por contacto con la piel, causa unas lesiones ulceradas en los genitales que son muy dolorosas, sobre todo la primera infección, pues después del contagio pueden ir recurriendo las lesiones periódicamente.
Molluscum contagiosum : pequeñas lesiones agrupadas redondeadas abultadas como la cabeza de un alfiler hasta el tamaño de una pequeña lenteja. También se contagian por contacto con otras lesiones y en este caso también es muy común en niños que entran en contacto con otros en las piscinas. Cuando se localizan en los genitales suelen ser por transmisión sexual.
Virus de las hepatitis B y C : se contagian por contacto con sangre o fluidos corporales de pacientes infectados. Pueden causar una grave afectación del hígado aguda o crónica.
Virus del SIDA (VIH) : mismo sistema de transmisión, provoca una profunda supresión del sistema inmunitario con lo que los pacientes afectados son mucho más susceptibles de sufrir infecciones y tumores. Fue una epidemia mortal, y actualmente es una enfermedad crónica bajo tratamiento médico.
Bacterianas: tienen tratamiento antibiótico y se puede curar la infección aguda completamente, pero en ocasiones dejando secuelas permanentes.
Sífilis: la primera manifestación de la sífilis es una úlcera que podemos encontrar en la mucosa de los genitales o la boca. El contagio es por contacto con esa úlcera. En fases posteriores da erupciones en todo el cuerpo y puede incluso evolucionar a una fase avanzada y grave con síntomas neurológicos.
Clamidia: frecuentemente no da síntomas. Cuando los presenta suelen ser secreción genital anormal, ardor, dolor pélvico, y se puede complicar con una infección del útero y las trompas llamada enfermedad inflamatoria pélvica que comprometa la fertilidad posterior de la mujer.
Gonococo: es parecida a la Chlamydia, aunque más frecuentemente presenta síntomas en forma de secreción purulenta por los genitales. También puede causar enfermedad inflamatoria pélvica
Parasitarias: con tratamiento curativo y de bajo nivel de gravedad.
Tricomonas: parásito microscópico genital que causa una importante picazón y secreción
Ladillas: una especie de “piojo”, visible, que vive en el pelo del pubis y pasa de un individuo a otro cuando los pelos del pubis se ponen en contacto.
Ya vemos que existe una gran variedad en todos los aspectos, y no los hemos citado todos… Sólo la abstinencia sexual o las parejas únicas y monógamas están a salvo de contagiarse. Pero, aunque el uso de preservativo no garantice en todos los casos la transmisión, sí que es efectivo en las más graves, así que es muy importante la regla de las “tres C”: “Condón en los Contactos Casuales”.
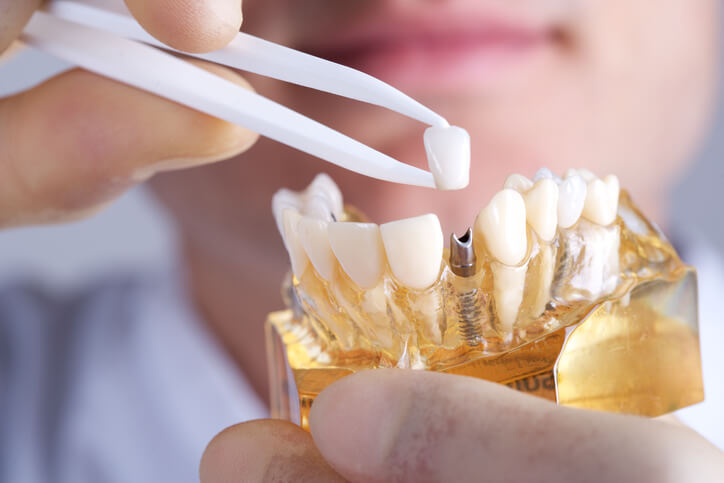
Artículo especializado
Implantología Dental: Colocación, Carga y Complicaciones
La implantología nació hace relativamente poco tiempo y constituye en la actualidad la principal herramienta de tratamiento en pacientes con pérdida parcial o total de dientes. En caso de pérdida total o absoluta de todas las piezas dentales se recurre a la colocación de unos implantes en la arcada que corresponda que nos permita anclar la dentadura completa fija, de forma que la percepción del paciente es que vuelve a tener su dentadura.
¿Qué indicaciones tiene?
Existen múltiples indicaciones en la actualidad para la colocación de implantes, ya sean unitarios o múltiples. Los implantes unitarios tienen una indicación prínceps en la reposición de un único diente sin afectar a los dientes contiguos. Hasta no hace demasiado tiempo para reponer un diente enfermo o perdido se colocaba una prótesis parcial fija (conocido popularmente como puente fijo) como opción prácticamente única. Se anclaba en el diente inmediatamente anterior y posterior al diente perdido de forma que era preciso implicar a dos dientes sanos para reponer el ausente. Otros pacientes preferían la opción de la prótesis removible (de quita y pon) que contenía el diente ausente y unos anclajes metálicos que abrazaban a los dientes contiguos. Si bien estos tratamientos no han desaparecido, podríamos decir que están en desuso , aunque puede ser un recurso para aquellos pacientes que presentan alguna o varias contraindicaciones para la colocación de implantes.
¿Cómo funciona un implante?
Como ya sabemos el implante colocado en la boca hace la función de una raíz dental fisiológica. Es decir, sostiene o aloja a la corona protésica dental (que equivaldría a la parte visible del diente en la boca). Por tanto, siempre que hablamos de la colocación de un implante nos referimos a la colocación del tornillo metálico en el interior del hueso (maxilar o mandibular) y siempre que hablamos de la carga del implante nos referimos a la colocación definitiva de la corona metálica sobre dicho tornillo.
Tipos de implantes
Respecto a la tipología de implantes podríamos diferenciar dos grandes grupos:
Los implantes de carga inmediata suponen una opción de gran reclamo comercial dado que implica la colocación del implante y su corona en el mismo acto quirúrgico (es decir, la colocación del tornillo del implante y la corona protésica coinciden en el tiempo). De esta forma el paciente sale de la clínica con el implante cargado con su corona el mismo día de la intervención. Como es evidente antes de la cirugía debe elaborarse la corona protésica por parte del laboratorio protésico para lo que necesitaremos la toma de impresiones y un registro oclusal del paciente.
Otro caso diferente sería el implante de carga diferida que se realiza en dos tiempos. En un primer tiempo se coloca el tornillo o implante en el hueso y se espera unas semanas hasta colocar la corona. Estos implantes persiguen una buena osteointegración (o correcta asimilación del implante por parte del hueso) antes de la carga del implante con su corona.
Ambas opciones son válidas y, a pesar de que cada odontólogo tiene su preferencia personal, es muy importante tener en cuenta el perfil del paciente para elegir la opción terapéutica más adecuada. Aunque se realiza un estudio y una planificación terapéutica podemos encontrarnos con un fracaso del implante (por muy diferentes motivos) en cuyo caso va a ser preciso su retirada y no podremos contemplar su reposición hasta un tiempo más tarde. Debemos indagar el motivo del fracaso.
¿Qué efectos secundarios puede tener un implante?
No olvidemos que un implante dental está realizado en un material biocompatible (normalmente de titanio) de calidad máxima y cuya integración en el hueso está extremadamente comprobada. Sin embargo, puede ocurrir que el paciente desarrolle una alergia o intolerancia al titanio, que el hueso no posea la calidad suficiente para integrar el implante o que la técnica o perfil del paciente no cumplan los objetivos esperados.
Existen problemas predecibles y solucionables tanto antes como durante y después de la colocación del implante. Otras complicaciones son, sin embargo, de mal pronóstico.
El procedimiento
Antes de la cirugía podemos encontrarnos con la necesidad de realizar una profilaxis antibiótica o de modificar la medicación crónica del paciente.
Durante la intervención y, a pesar de que se realiza un estudio de la calidad ósea antes de la cirugía (mediante un TAC) podemos encontrarnos con un hueso menos denso y/o de baja altura que puede comprometer la integración del implante. En estos casos se opta por la colocación de un relleno de hueso autólogo (obtenido del propio paciente) o artificial, con la finalidad de compensar la falta de hueso.
¿Complicaciones?
Tras la colocación del implante realizamos unos controles frecuentes y exquisitos para detectar cualquier posible complicación precoz o tardía.
La periimplantitis , como una de las complicaciones tardías más temidas. Consiste en la aparición de un proceso inflamatorio que afecta a los tejidos que rodean al implante (tanto a hueso como a tejidos blandos) y que ocasiona una pérdida de hueso que evidenciamos clínica y radiológicamente, pudiendo conllevar la pérdida tardía del implante.
Otra de las complicaciones frecuentes sería la mucositis periimplantaria que consiste en un proceso inflamatorio que afecta a las partes blandas circundantes al implante, pero no al hueso. Por tanto, si se detecta y trata adecuadamente no ocasiona la pérdida del implante.
Otras causas que pueden justificar el fracaso del implante pueden ser las inherentes al implantólogo o al paciente. Dentro de las causas asociadas al cirujano podríamos citar su inexperiencia o una técnica quirúrgica inadecuada. Respecto al paciente podríamos mencionar su entorno médico delicado o lábil (pacientes pluripatológicos, plurimedicados, osteoporóticos, inmunodeprimidos, etc…) como principal motivo de aparición de complicaciones.
De cualquier manera, la implantología es la responsable de la recuperación de la sonrisa en gran parte de la población senil en la actualidad. Es una opción de rehabilitación protésica definitiva y excelente.
 Savia
Savia