Otros contenidos

Contenido de salud
MIBG
Definición
Es una gammagrafía con MIBG (metayodobencilguanidina) o de la médula suprarrenal (órgano pequeño situado encima de cada riñón ) , que se utiliza tanto para el diagnóstico y seguimiento de los tumores neuroendocrinos y para valorar la respuesta al tratamiento administrado al paciente.
Se administra un radiofármaco o radioisótopo y se liga con MIBG, la cual hace visible la unión a las células tumorales y así se puede ver dónde está el tumor.
Es una alternativa para inducir la remisión (disminución o desaparición) del tumor y reducir la actividad hormonal del mismo.
Tipos de gammagrafías
No existen tipos de gammagrafía con MIBG, la exploración solo se realiza con este tipo de prueba diagnóstica. Sí se puede mencionar que hay dos métodos de marcadores o radiofármacos para hacer el rastro que son:
El MIBG-I123: es un medicamento o fármaco que contiene una forma de yodo radiactivo conjugado llamado I123-metayodobencilguanidina. Se usa para detectar ciertos tipos de tumores, como feocromocitomas (tumor funcionante que se origina en la glándula suprarrenal) y neuroblastoma (tumor propio de la edad pediátrica), y para diagnosticar los tumores referidos con anterioridad, así como estudio de extensión de los mismos.
El MIBG-I131 es un medicamento o fármaco que contiene una forma de yodo radiactivo conjugado llamado I131-metayodobencilguanidina. Se usa para detectar o tratar ciertos tipos de tumores y también se realiza después de una dosis terapéutica para el tratamiento de tumores secretores adrenales, permitiendo valorar las respuesta metabólica después del tratamiento.
Sirve para aliviar el dolor a causa del cáncer que se diseminó a los huesos, es posible que la radiación que emite ayude a destruir células cancerosas o a encontrar el lugar donde se encuentran.
Preparación
Para la preparación para la gammagrafía con MIBG, antes de realizar la prueba, hay que tener en cuenta:
No es necesario que el paciente acuda en ayunas.
Es necesario que el paciente informe a su médico si es alérgico a algún medicamento o a los contrastes con yodo.
También si está tomando algún medicamento como antidepresivo, ya que tendrá que suspenderlo días previo al examen.
Antes del procedimiento, se le administra un medicamento con yodo para proteger las tiroides y impedir que absorba el radiofármaco.
El paciente debe dejar en casa o retirar antes de entrar a la exploración las joyas, objetos que tengan metal y prótesis dentales, porque pueden interferir con la imagen.
Es posible que, tras la prueba, se le administre un laxante al paciente para ayudar a eliminar el radiofármaco a través de las heces y disminuir la toxicidad.
Cómo se realiza la gammagrafía con MIBG
La gammagrafía con MIBG se realiza inyectando un radioisótopo o radiofármaco (MIBG, yodo-131-metayodobenzilguanidina o yodo-123-metayodobenzilguanidina), por vía intravenosa. este compuesto se fija a las células de un tumor específico.
El paciente se acuesta en una mesa que se ubica bajo el escáner en la máquina llamada gammacámara.
Se obtendrán imágenes a las 4-6 horas y luego otras a las 24 horas, después de la inyección. Habitualmente se rastrea, es decir, se toman imágenes de cuerpo entero centradas en alguna zona determinada (tórax, abdomen), ya que se pretende ver qué zona del cuerpo capta el radiofármaco.
Es posible que el paciente tenga que regresar para toma de gammagrafías repetidas en un periodo de 1 a 3 días.
Complicaciones de una gammagrafía con MIBG
Las complicaciones de una gammagrafía con MIBG, son:
Existe una ligera exposición a la radiación con el radiofármaco. Es posible que el paciente sienta ligeras molestias cuando le inyecten el radioisótopo.
Las reacciones alérgicas al trazador son pocos comunes pero pueden presentarse.
Para evitar la posibilidad de riesgos severos es necesario que esta prueba no se realice en pacientes que tengan alergias al yodo ni en las pacientes que se encuentren en estado de embarazo o estén lactando.
También es importante para evitar complicaciones evitar el contacto con mujeres embarazadas y niños menores de 10 años al menos 24 horas después del examen.
Resultados
Los resultados de una gammagrafía con MIBG serán interpretados por un radiólogo especializado en pruebas diagnósticas en medicina nuclear, que luego remitirá un informe completo con las imágenes al médico que le solicitó el examen al paciente, el cual tendrá que valorar el diagnóstico y tratamiento más adecuado para el paciente.
Preguntas frecuentes
¿Qué es un rastreo corporal con MIBG?
Un rastreo corporal com MIBG es una prueba donde se administra un fármaco con una pequeña cantidad de radiactividad (radiofármaco) por vía intravenosa, para después obtener imágenes en un aparato llamado gammacámara.
¿Es dolorosa una gammagrafía con MIBG?
Una gammagrafía con MIBG no es dolorosa. A algunos pacientes les resulta molesto el hecho de tener que permanecer inmóviles durante el examen.
¿Cuánto dura una gammagrafía con MIBG?
La duración de una gammagrafía con MIBG es variable, puede tardar unos 30 minutos o menos para la toma de imágenes las primeras 3-4 horas, y luego el mismo tiempo para las imágenes de las 24 horas.
¿Qué es MIBG-I123?
El MIBG-I123 es un medicamento o fármaco que contiene una forma de yodo radiactivo conjugado, llamado I123-metayodobencilguanidina. Se usa para detectar ciertos tipos de tumores, como feocromocitomas (tumor de la médula suprarrenal de la glándula adrenal ) y neuroblastoma (células cancerosas a partir de los neuroblastos de la glándula suprarrenal, el cuello, el tórax o la médula espinal ) y para diagnosticar los tumores referidos con anterioridad, así como estudio de extensión de los mismos.
¿Qué es MIBG-I131?
El MIBG-I131 es es un medicamento o fármaco que contiene una forma de yodo radiactivo conjugado llamado I131-metayodobencilguanidina. Se usa para detectar o tratar ciertos tipos de tumores y también se realiza después de una dosis terapéutica para el tratamiento de tumores secretores adrenales, permitiendo valorar las respuesta metabólica después del tratamiento.
Sirve para aliviar el dolor a causa del cáncer que se diseminó a los huesos, es posible que la radiación que emite ayude a destruir células cancerosas o a encontrar el lugar donde se encuentran.
Contenido de salud
Estapedectomía
Definición
La estapedectomía es una cirugía mayor microscópica, que se usa para tratar la otoesclerosis (enfermedad por la cual se produce la fijación del estribo del oído, que en condiciones normales es un hueso que debería moverse libremente para que el oído trabajase correctamente).
Es una intervención que se realiza sobre la cadena de huesecillos del oído medio.
¿Cómo es una estapedectomía?
La estapedectomía es una cirugía que puede realizarse con anestesia local o bien con anestesia local y sedación. Los pasos de la cirugía son los siguientes:
Se procede a anestesiar el conducto auditivo externo.
Se realiza una incisión en la piel del conducto auditivo.
Se levanta la membrana timpánica (membrana que convierte las ondas sonoras en impulsos eléctricos interpretables por el cerebro).
Se retira el huesecillo estribo que articula con el yunque (cadena de huesecillos del oído medio que conecta el martillo y el estribo), y se pone una prótesis en su lugar.
Se comprueba el normal funcionamiento del estribo y se procede a suturar
¿Para quién está indicada?
La estapedectomía es una operación que está indicada para la osteoesclerosis, una enfermedad congénita en la cual se produce una fijación del estribo con el yunque, esto se traduce en una imposibilidad de transmisión del sonido hacia la cóclea (estructura en espiral del oído interno) a través de la ventana oval (membrana que recubre la entrada a la cóclea), dando lugar a sordera de transmisión.
¿Por qué se realiza?
La estapedectomía s e realiza porque al retirar el estribo que se encuentra fijado al yunque , y sustituirlo por una prótesis, se recupera la movilidad del mismo y esto permite una correcta transmisión del sonido.
Riesgos de una estapedectomía
Los riesgos de una estapedectomía son, además de los de una cirugía normal, los producidos por el este tipo de intervención, como son:
Hemorragias y hematomas en la zona de la incisión.
Infecciones de oído .
Vértigos (giro de objetos ) que se producen en casi todos los casos y suelen durar varios días.
Alteraciones del gusto : se producen porque se afecta el nervio por la cirugía, en raras ocasiones es una lesión permanente.
Parálisis del nervio facial : es rara, temporal y revierte con tratamiento en unos días.
Sordera : aunque el porcentaje de éxito de esta cirugía es del 90%, hasta un 1% de los pacientes pueden presentar sordera neurosensorial (afectación del nervio) tras la intervención.
Preparación
La preparación para una estapedectomía será:
Estudio audiométrico para asegurar que la sordera es causada por otoesclerosis, si fuera una sordera neurosensorial no está indicada este tipo de cirugía.
Analitica de sangre, electrocardiograma y radiología de tórax, así como valoración por parte de un anestesista.
No consumir fármacos antiinflamatorios durante los cuatro días previos a la cirugía.
Si el paciente toma fármacos anticoagulantes debe comunicárselo al médico.
Cómo es la recuperación de una estapedectomía
Tras la estapedectomía el paciente presentará vértigos que pueden tardar hasta una semana en desaparecer, por tanto, el ingreso en la clínica puede ser de entre 1 y 7 días, dependiendo de lo que tarden en desaparecer .
Durante los primeros 12 días el paciente deberá de estornudar con la boca abierta y evitar sonarse.
El paciente no debe de montar en avión hasta pasadas al menos tres semanas de la cirugía.
El paciente se podrá reincorporar a la actividad laboral cuando haya pasado un mes.
Resultados
Los resultado son satisfactorios, hasta el 90% de los pacientes van a recuperar la audición.
Un 1% de los pacientes no recuperan nada de la audición, en estos casos suele ser por daño de la conducción neurosensorial, que no se ve afectada por esta cirugía.
Los acúfenos (zumbido de oídos) no desaparecen con esta cirugía, aunque pueden ser menos audibles.
Preguntas frecuentes
¿Cuál es la diferencia entre una estapedectomía y una estapedotomía?
La diferencia entre estapedectomia o estapedotomia es la prótesis de estribo que se pone. En la estapedectomía se va a sustituir todo el estribo, se retira el hueso en su totalidad y se pone una prótesis, mientras que en la estapedotomia se retira una parte del estribo, que será sustituida por una prótesis conservando el resto del hueso.
¿Cuál es el tiempo de baja tras una estapedectomía?
El tiempo de baja tras una estapedectomía, si todo evoluciona de forma adecuada, será de entre tres y cuatro semanas, dependiendo de la actividad laboral del paciente
¿Cuánto tarda en hacerse una estapedectomía?
La cirugía de estapedectomía tarda en realizarse por el cirujano entre una y dos horas, dependiendo de las complicaciones anatómicas que se puedan encontrar.
¿Es dolorosa una estapedectomía?
La estapedectomía es una cirugía prácticamente indolora , puede presentarse molestia por el taponamiento que se sitúa en el conducto auditivo externo, pero no dolor. Si el paciente presenta dolor intenso deberá acudir a la clínica para ser valorado por el cirujano.
¿Recuperaré toda la audición?
La audición suele recuperarse hasta en un 90% de los casos, pero hasta un 1% de los pacientes tienen lesiones neurológicas asociadas que impiden la recuperación de la audición.
En estos casos no se conoce la razón por la cual no se recupera la audición , pero es independiente del tipo de prótesis usada y del profesional que realice la cirugía.
La recuperación auditiva, aunque puede ser percibida desde el primer momento, no será la máxima esperada hasta quince días después de la intervención.

Contenido de salud
Fibrinolisis
Definición
La fibrinolisis es el tratamiento mediante el cual se administra un fármaco por vía intravenosa con el objetivo de deshacer un trombo (coágulo) que se haya producido en un vaso sanguíneo (arteria), y está provocando una obstrucción de la circulación sanguínea y con ello, que a los tejidos no les llegue el oxígeno y los nutrientes necesarios para realizar sus funciones.
Si esta situación de obstrucción perdura en el tiempo sin tratamiento, los tejidos mueren .
¿Cómo es la fibrinolisis?
La fibrinolisis es un procedimiento médico que se realiza en el hospital y bajo estricta observación, En primer lugar se canaliza una vía venosa en una de las venas de los brazos para poder administrar de forma progresiva un fármaco fibrinolítico (que deshace el trombo) diluido en suero.
El procedimiento dura aproximadamente una hora. Posteriormente se mantiene en observación al paciente durante las siguientes 24 a 36 horas.
En otras ocasiones, por ejemplo en las situaciones de accidentes cerebrovasculares o ICTUS, se puede realizar una fibrinolisis endovascular o intraarterial, canalizando un catéter (pequeño tubo flexible). El catéter se introduce por una arteria (arteria femoral) hasta llegar al punto donde se encuentra el trombo, detectandolo mediante la realización de pruebas de imagen. Una vez situado el catéter en el punto exacto, se introduce el fármaco fibrinolítico de forma directa en el trombo para deshacer el coágulo. Este procedimiento se realiza bajo anestesia general o sedación según lo precise la situación clínica del paciente.
¿Para quién está indicada?
La fibrinolisis Está indicada en aquellos casos en los que el paciente ha sufrido un ICTUS o accidente cerebrovascular para intentar evitar un daño crónico en el cerebro.
También está indicada en el caso de que el paciente haya padecido un infarto de miocardio en el corazón.
En ambas circunstancias existen unos criterios determinados de edad, situación clínica y tiempo desde que se produjeron los primeros síntomas en el paciente, para que se pueda llevar a cabo la fibrinolisis.
Otra situación donde se puede aplicar es en el tratamiento médico de los trombos producidos en arterias de los miembros, que producen una isquemia (falta de sangre y muerte celular) aguda de estos .
¿Por qué se realiza?
La realización de una fibrinolisis tiene como objetivo la disolución del coágulo que ha provocado el infarto a nivel cerebral o cardíaco. Con ello se consigue que se reduzca en todo lo posible la afectación celular por el infarto, se mejore la función cardiaca o cerebral, y se prolongue la vida a corto y largo plazo del paciente.
En el caso de la indicación en las afectaciones vasculares de los miembros, se busca evitar la muerte de los tejidos y, con ello, que el paciente posteriormente pueda necesitar una amputación del miembro afectado.
Riesgos de una fibrinolisis
El riesgo específico de la realización de una fibrinolisis es el sangrado en cualquier parte del organismo, sobre todo en el cerebro o en el aparato digestivo.
En el corazón la reperfusión del tejido infartado (es decir, el paso de nuevo de la sangre al quitar el trombo), puede acompañarse de la aparición de arritmias cardiacas (alteración del ritmo de contracción del corazón).
La fibrinolisis puede provocar una respuesta paradójica como es que se produzcan espontáneamente nuevos trombos. Para prevenirlo la medicación fibrinolítica se asocia a otros fármacos que actúan en la coagulación de la sangre (antiagregantes plaquetarios y antitrombóticos).
Se han descrito en raras ocasiones la aparición de microembolización por colesterol o por troceamiento del propio trombo (por roturas de placas de colesterol en las paredes de la arteria en pequeños trozos o pequeños trombos resultantes de la disolución del principal, que son llevados por la sangre en el torrente sanguíneo hasta que paran en pequeños vasos con diámetros menores que su tamaño, lo que produce ahí una obstrucción al paso de sangre).
Otro de los riesgos a considerar es que a pesar del tratamiento, el coágulo no se consiga deshacer .
Preparación
Este tratamiento, por las circunstancias en las que el paciente se encuentra cuando es preciso, en la mayoría de los casos se administra estando ingresado de forma urgente en un hospital, o a nivel extrahospitalario por los equipos de urgencias extrahospitalarias en el trayecto de transporte en la UVI móvil hasta el hospital.
Antes de la aplicación del tratamiento fibrinolítico, los médicos se aseguran del diagnóstico de la patología que afecta al paciente mediante la exploración física y las pruebas complementarias (pruebas de imagen como TAC, ecografías etc.), análisis de sangre, electrocardiograma, y todas aquellas requeridas según los síntomas del paciente.
Se localiza así la existencia de un trombo en el sistema vascular y se descarta siempre antes que exista una hemorragia.
El paciente, o en el caso de que por su situación clínica no sea posible, sus familiares o acompañantes, deben informar a los médicos de las posibles enfermedades que padezca, los tratamientos habituales que realiza si los hubiera. y si tiene algún tipo de alergia a fármacos o contrastes.
Si el paciente precisa de la aplicación de anestesia general o sedación, será evaluado por un médico anestesista quien se encargará de su administración y el seguimiento de su efecto durante todo el proceso.
Cómo es la recuperación de una fibrinolisis
Tras la aplicación del tratamiento, el paciente debe estar en estricta vigilancia en las siguientes horas con control de sus constantes vitales (tensión arterial, frecuencia cardíaca, etc.), así como los síntomas que presenta, para poder detectar de forma precoz si existe algún tipo de efecto secundario posterior al tratamiento, así como vigilar la evolución natural de la enfermedad que le ha sobrevenido al paciente y los efectos del resto de los tratamientos aplicados.
Pasadas las primeras 24 horas y hasta un máximo de 72 horas tras la aplicación y evaluación de la fibrinolisis, el paciente permanecerá en ingreso hospitalario dependiendo más del proceso de recuperación de la patología que le ha afectado, que del propio tratamiento fibrinolítico aplicado.
Resultados
Los resultados tras la aplicación del tratamiento fibrinolítico se observan por medio de la realización de pruebas de imágen al paciente. En ellas se determina la desaparición del coágulo que ha producido la obstrucción del vaso sanguíneo , y la afectación real de los tejidos tras la recuperación del flujo sanguíneo (secuelas del tiempo que han estado sin oxígeno, tejido que ha muerto de forma irreversible, persistencia del trombo, etc.).
Estas pruebas se realizarán en los días sucesivos tras la administración del tratamiento, mientras el paciente permanece ingresado en el hospital recuperándose de la patología que le ha afectado, y sus resultados le son transmitidos por el equipo médico que le trate.
Preguntas frecuentes
¿Qué es la actividad fibrinolítica?
Se trata de mecanismo de acción de los fármacos administrados para realizar la fibrinolisis, o la propia actividad fibrinolítica que de forma fisiológica y natural tiene el organismo, que consiste en la disolución de la fibrina (sustancia que forma parte de la estructura de los coágulos) y con ello la alteración la coagulación de la sangre.
¿Cómo actúa la plasmina?
La plasmina es una sustancia del sistema fibrinolítico de la sangre que interviene en la destrucción de la fibrina, es decir de la sustancia (proteína) que forma la estructura de los coágulos de la sangre, evitando que se produzcan o destruyéndolos.
¿Qué es el plasminógeno?
El plasminógeno es un precursor de la plasmina. Es una sustancia (glucoproteina) que se forma en el hígado y está presente en el torrente sanguíneo y el tejido extracelular. Forma parte del sistema propio que tiene la sangre para el control de la coagulación de la sangre y al activarse se transforma en plasmina.
¿Cuáles son los antifribinolíticos?
Los fármacos antifibrinolíticos o antitrombolíticos son medicamentos que favorecen el mecanismo de coagulación de la sangre, inhiben la degradación de fibrina y fibrinógeno (precursor de la fibrina). Se utilizan para ayudar a la coagulación de heridas y sangrados corporales.
¿Qué es un medicamento trombolítico?
Los medicamentos trombolíticos o fibrinolíticos son compuestos que tienen la capacidad de favorecer de forma directa o indirecta el mecanismo de la fibrinolisis, mediante la activación del plasminógeno.

Contenido de salud
Orzuelo Tratamiento
Definición
El orzuelo se produce ante la inflamación e infección del folículo piloso (parte de la piel de donde crece el vello, en este caso las pestañas) que produce un abultamiento en el borde del ojo.
Dicho extremo adquiere un color rojizo y provoca dolor en el ojo, dificultando su apertura y con molestias de visibilidad.
Es una infección que suele afectar a un solo ojo, y que tiene un proceso de desarrollo y curación muy breve, en unos 4 días ha desaparecido.
¿Cómo es el tratamiento del orzuelo?
El orzuelo generalmente no requiere de un tratamiento muy exhaustivo, ya que en pocos días desaparece, y se suele tratar con un aumento de la higiene del ojo mediante el uso de gotas de suero fisiológico.
No obstante, si el paciente acude al médico para su evaluación y tratamiento, lo más habitual es que le prescriban:
Cremas antibióticas: para aliviar la inflamación y agilizar la recuperación. El médico puede recetar antibiótico tópico en crema para aplicar encima del párpado. También en algunos casos se suele recetar en forma de gotas.
En algunos casos en los que el orzuelo no desaparece, se realiza una pequeña intervención quirúrgica:
Cirugía del orzuelo: este tipo de tratamiento solo se aplica en casos en los que el orzuelo permanece en el tiempo y es incómodo y doloroso para el paciente. De forma que mediante la cirugía se alivia la presión. Esta intervención quirúrgica es muy sencilla, se realiza un leve corte en el el orzuelo para drenar el pus, lo que acelera el proceso de curación, así como minimiza el dolor.
Riesgos del tratamiento del orzuelo
Debido a que el tratamiento a seguir suele ser básico mediante la higiene ocular, los riesgos son mínimos.
Si se emplean cremas antibióticas, debe comunicar al médico si padece algún tipo de alergia hacia algún antibiótico en particular, y hacia los corticoides, que generalmente es de los que están compuestas.
Y por último, si se aplica la cirugía el riesgo es mínimo, ya que la incisión es ínfima, similar a un pequeño pinchazo con un alfiler, de forma que se extrae el pus. No requiere puntos ni sedación, en algunos casos se aplica anestesia local.
Preparación
El tratamiento frente a un orzuelo no conlleva una preparación, simplemente debemos tener en cuenta en nuestra rutina diaria la importancia de mantener una buena higiene de los ojos y evitar tocarlos en exceso, y menos aún con las manos sucias.
Si el paciente observa síntomas de un orzuelo debe limpiarlo con abundancia de agua y jabón y siempre con las manos previamente lavadas, después secarlo con una gasa y acudir al médico si lo considerase necesario.
Precauciones a considerar cuando se tiene un orzuelo
En caso de que un paciente tenga un orzuelo:
No debe tocarse el ojo, ya que rascarse puede provocar que el pus se reviente y se propague la infección, siendo esta mayor.
La persona con orzuelo debe limpiarse el ojo utilizando gasas esterilizadas y dosis de suero fisiológico. Antes de lavarse el ojo, el paciente debe lavarse las manos para que estén limpias y no exista el riesgo de aumentar la infección.
El paciente debe evitar el uso de maquillajes y cremas cerca del orzuelo, ya que pueden incrementar la infección, y afectar al proceso de recuperación.
Si el paciente lleva gafas o lentillas debe evitar usarlas, ya que pueden estar infectadas de la bacteria y puede volver a contagiarse.
Si el médico le ha indicado el uso de cremas o gotas antibióticas debe aplicarlas después de haber lavado correctamente el ojo y con las manos limpias.
En caso de haberse sometido a una cirugía, el médico le dará unos pasos más concretos a seguir.
Resultados
Si el paciente sigue las indicaciones médicas, así como la higiene ocular, el orzuelo a lo largo de una semana debe de haber desaparecido. En caso contrario debe acudir nuevamente al centro hospitalario para valorarlo y ver otros tratamientos.
Si se ha sometido a una intervención para eliminar el orzuelo, debe seguir una correcta curación del ojo, acudir a revisión para controlar que no se infecte el corte, y observar que el proceso de curación vaya avanzado.
Preguntas frecuentes
¿Se puede pegar un orzuelo?
Sí, a pesar de que podemos desarrollar un orzuelo sin contaminación externa, el contacto con alguien que lo padece nos puede hacer desarrollar la infección.
¿Cuáles suelen ser las causas de un orzuelo?
El orzuelo es una infección bacteriana por estafilococos. Todo el mundo en su organismos lo tiene y en algunos casos se desarrolla, la causa principal suele ser una mala higiene del ojo.
También puede ocasionarse por una mala alimentación, deshidratación o tocarse mucho los ojos, entre otras causas.
¿Qué es un orzuelo interno?
El orzuelo interno es una variación más grave que el orzuelo normal o externo. Se produce en la zona central del párpado, en la glándula Meibomio, y requiere acudir al médico para su evaluación y tratamiento.
¿Qué remedios caseros hay para el orzuelo?
Hay numerosos remedios caseros para el tratamiento de orzuelos, pero es el del ajo el más popular. Consiste en machacar un par de dientes de ajo y aplicar el jugo resultante sobre el parpadeado, con mucho cuidado para que no entre nada dentro del ojo. Sus propiedades aliviarán el dolor de la infección y limpiarán la zona de bacterias.

Contenido de salud
Radiodiagnóstico
Definición
El radiodiagnóstico es un método basado en la obtención de imágenes mediante pruebas con radiación ionizante o no, para establecer el diagnóstico del paciente .
Hazte una prueba de radiodiagnóstico sin esperas. En Savia contamos con los mejores centros y especialistas. Cómprala ahora aquí
Este tipo de diagnóstico se emplea frecuentemente en el tórax, abdomen, cervicales o para el aparato urinario, entre otros. Se suele emplear sobre todo para confirmar el diagnóstico y concretar las dolencias del paciente, pudiendo aplicar un tratamiento más completo.
¿Cómo es un radiodiagnóstico?
El radiodiagnóstico utiliza las herramientas que nos permiten obtener imágenes macroscópicas del organismo del paciente con diferentes técnicas de radiación ionizante o no, para una vez obtenidos los resultados el médico determine un diagnóstico. Las técnicas más utilizadas para el radiodiagnóstico son:
Resonancia Magnética: la RM (Resonancia Magnética) es una de las técnicas más avanzadas que existen a día de hoy en cuanto a la radiología. Permite obtener imágenes pero sin aplicar radiación (rayos x) al cuerpo humano. Se realiza mediante imanes y ondas potentes introduciendo al paciente en un tubo cerrado o semicerrado, donde debe permanecer inmóvil durante los 20-45 minutos que dura la prueba.
Radiografía: este tipo de prueba se realiza mediante la aplicación de rayos X a la zona del paciente a diagnosticar para evaluar las posibles alteraciones. Los rayos X atraviesan los distintos tipos de tejido del cuerpo humano que se reflejan en diferentes tonalidades de grises, según su composición. Con la radiografía se pueden observar fracturas, tumores y esguinces, entre otras lesiones. El paciente debe colocarse en la posición indicada según la zona que se debe diagnosticar, con un peto de plomo para disminuir la radiación en el resto del cuerpo, y permanecer inmóvil hasta que se tomen las imágenes, durante unos 5 minutos.
¿Para quién está indicado?
Para aquellas personas cuyas posibles lesiones puedan observarse mediante imágenes del interior del organismo, como roturas, fisuras, lesiones, presencia de tumores, etc.
¿Por qué se realiza?
Mediante el radiodiagnóstico se obtienen imágenes del interior del cuerpo humano, de manera que se puede ver con mayor claridad donde está la lesión y diagnosticarla para tratarla.
Hazte una prueba de radiodiagnóstico sin esperas. En Savia contamos con los mejores centros y especialistas. Cómprala ahora aquí
Riesgos del radiodiagnóstico
El radiodiagnóstico se realiza en muchos casos con técnicas que emplean rayos X, por tanto el paciente recibe radiación. No obstante esa radiación a la que se somete no tiene riesgo para su salud, ya que es mínima y se aplica de manera puntual.
Este tipo de diagnóstico está contraindicado en mujeres embarazadas, ya que la radiación podría afectar al desarrollo del feto.
Por otra parte, el técnico de rayos se saldrá de la sala cuando se emita la radiación al paciente, ya que en su caso la exposición a los rayos X es diaria y sí podría dañar su salud.
Preparación
Para obtener el radiodiagnóstico, primero el paciente debe realizarse la prueba radiológica indicada de la zona a diagnosticar. Deberá ponerse una bata hospitalaria para realizarla, quitarse todos los objetos metálicos, y en caso de que sean placas internas comunicárselo al técnico de rayos.
En caso de necesitar contraste se le pedirá al paciente acudir en ayunas a la prueba.
Cómo es la recuperación de un radiodiagnóstico
Las pruebas realizadas suelen ser poco o nada invasivas, por lo que la recuperación en cuanto a la prueba realizada es inmediata.
No obstante, hay ocasiones en las que se debe aplicar contraste o isótopos radioactivos, por lo que el paciente deberá beber mucha agua en las horas siguientes para eliminarlo del cuerpo, y a su vez evitar el contacto con niños y mujeres embarazadas para evitar riesgo.
Resultados
La base del radiodiagnóstico es la aplicación de técnicas de obtención de imágenes, de las cuales la mayoría de ellas necesitan un periodo de tiempo para ser evaluadas por el especialista y determinar un primer diagnóstico, que después junto con las imágenes obtenidas se le envían al médico para dar su propio diagnóstico y comunicárselo al paciente.
Por tanto, los resultados de radiodiagnóstico suelen tardar entre 1 semana y 20 días.
Muchas veces el radiodiagnóstico va acompañado de pruebas complementarias como una analítica de sangre.
Preguntas frecuentes
¿Quién me dará mi radiodiagnóstico?
Los resultados de las pruebas de radiodiagnóstico deberán recogerse en el área de radiología del centro médico, donde aparte de las imágenes se incluirá un informe del especialista que lo ha valorado. Estos resultados los deberá llevar al médico que los solicitó y será él quien le de el radiodiagnóstico final.
¿Cuánto se tarda en obtener un radiodiagnóstico?
Los resultados de radiodiagnóstico se obtienen en función del tipo de prueba radio-diagnóstica que se apliquen, de forma que si son radiografías pueden obtenerse al momento, otras más específicas como la resonancia magnética puede tardar entre 1 semana y 20 días.
¿Qué es un técnico de radiodiagnóstico?
Un técnico de radiodiagnóstico en el profesional que desarrolla su puesto de trabajo en el departamento de diagnóstico por Imagen del hospital, prestando su servicio en las diferentes áreas de radiología (Rayos X, TAC, Resonancia Magnética, Ecografías o Medicina Nuclear). Para ello ha tenido que realizar una formación de grado superior.
Se encargan de supervisar que la toma de las imágenes se realicen correctamente, colocando a los pacientes en las posiciones más idóneas para incrementar la exactitud de la imagen a obtener.
Hazte una prueba de radiodiagnóstico sin esperas. En Savia contamos con los mejores centros y especialistas. Cómprala ahora aquí

Contenido de salud
Tratamientos del Cáncer de Pulmón
Definición
El tratamiento del cáncer de pulmón es un conjunto de técnicas y fármacos aplicados al paciente con la intención de eliminar el tumor, disminuir su crecimiento y reducir los síntomas que provoca.
La indicación del tipo de tratamiento requerido para cada paciente se evalúa de forma multidisciplinar, con la participación de varios especialistas médicos (médico oncólogo, cirujano torácico, médico especialista en radioterapia… etc.)
¿Cómo es el tratamiento del cáncer de pulmón?
El tratamiento del cáncer de pulmón se basa en la aplicación de tres pilares básicos: cirugía, radioterapia y quimioterapia. La combinación y el momento de aplicación de cada uno de estos tratamientos varían según el tipo de tumor y la extensión que tenga este.
Cirugía: se puede realizar una lobectomía (extirpación de uno de los lóbulos o partes en las que se divide el tejido pulmonar), cuando el tumor está en una fase muy inicial. Otra opción en esas situaciones es realizar una segmentomía, que es la resección de parte de un lóbulo pulmonar, cuando las circunstancias físicas del paciente determinan que no aguantaría retirar más tejido pulmonar.
Estas cirugías se pueden realizar por medio de una toracotomía, cirugía abierta en la que se hace una incisión grande en el tórax. Está tomando protagonismo de forma progresiva la cirugía vid eoasistida, conocida como VATS ( Video-Assisted Thoracic Surgery ), con mayores ventajas para el paciente (menos dolor, mejor preservación de función pulmonar y menos estancia hospitalaria), ya que se realiza con pequeñas incisiones en la pared del tórax y presenta iguales resultados en supervivencia.
Otra posibilidad quirúrgica, según lo avanzado de la enfermedad, es la neumonectomía (resección de un pulmón).
En la cirugía también se extraen los ganglios linfáticos regionales (estaciones del sistema de defensa en forma nodular).
A nivel paliativo (no curativo), se pueden realizar intervenciones de extracción de metástasis (crecimiento de tumor en otros sitios del organismo) a nivel cerebral, a veces combinado con la radioterapia.
Quimioterapia : la aplicación de una asociación de varios fármacos quimioterápicos se ha visto que es más eficaz en el tratamiento. La quimioterapia se utiliza de forma neoadyuvante (antes de la cirugía), a veces junto con la radioterapia, para disminuir el tamaño del tumor y posibilitar que este sea resecable (que se pueda operar), o de forma adyuvante (después de la cirugía), aumentando el éxito de eficacia del tratamiento. Por último, se utiliza en pacientes con tumores inoperables combinada con la radioterapia.
Radioterapia: al igual que la quimioterapia, es una técnica terapéutica utilizada según la evolución de la enfermedad, antes de la cirugía y después de esta, también en tumores no resecables como tratamiento asociado a la quimioterapia, y como tratamiento paliativo (no curativo) cuando la enfermedad está extendida y existe metástasis en cerebro, huesos… etc.
Nuevas terapias dirigidas: se recogen aquí nuevos tratamientos que en los últimos años se han desarrollado con distintos fármacos, que tienen una acción más selectiva en pacientes que presentan en el estudio del tejido tumoral, la presencia de distintas mutaciones (alteraciones de los genes), o expresión de receptores específicos en la membrana celular (anticuerpos monoclonales antiangiogénicos, inhibidores de la enzima tirosin-kinasa… etc.) Este tipo de terapias se pueden administrar de forma conjunta con la quimioterapia o radioterapia en pacientes seleccionados.
¿Para quién está indicado?
La indicación del tratamiento del cáncer de pulmón viene determinada por las características de las células que producen el tumor. Así, el esquema de tratamiento se aplica según se trate de tumores llamados microcíticos o no microcíticos, por las diferencias en la respuesta al tratamiento, y en la evolución y localización del tumor.
De forma general se puede decir que siempre que la enfermedad está limitada, se intenta un tratamiento quirúrgico de la lesión tumoral, con aplicación antes y después de la operación de quimioterapia y/o radioterapia, según las características del tumor y de la clasificación de su estadio (clasificación TNM de extensión del tumor).
El tratamiento de tumores no operables será con quimioterapia y radioterapia de forma conjunta o secuencial, con intención inicial curativa, y cuando la enfermedad es extensa, de forma paliativa para mejorar la sintomatología y el pronóstico de vida.
Se asociará a las terapias moleculares dirigidas cuando el tipo de tumor así lo permita.
¿Por qué se realiza?
El tratamiento del cáncer de pulmón se realiza con fines curativos y paliativos, con el fin de aumentar la supervivencia y calidad de vida de los pacientes, teniendo en cuenta que el cáncer de pulmón es la primera causa de muerte por un tumor, cuya supervivencia media a los 5 años es del 15%.
Riesgos del tratamiento de cáncer de pulmón
Los riesgos del tratamiento del cáncer de pulmón van asociados a la aplicación de cada técnica terapéutica, cirugía, radioterapia… etc.
La cirugía del cáncer de pulmón es una operación compleja que puede llegar a tener un riesgo vital importante. Los riesgos dependen de la extensión de la cirugía y de la salud de base del paciente: sangrado o hemorragia, infección de la herida quirúrgica, infección del tejido pulmonar exento de tumor (neumonía), dolor en la zona de incisión, fatiga posterior a la cirugía… etc.
Por la zona de aplicación de la radioterapia, uno de los riesgos que puede tener este tratamiento es la aparición de esofagitis (inflamación del tejido del esófago), que dificulta la deglución, o neumonitis (inflamación del tejido pulmonar exento de tumor), que llevará a poder tener mayores problemas en la respiración.
La quimioterapia puede producir síntomas iniciales como náuseas, vómitos, dolores musculares y articulares, cansancio, diarrea o estreñimiento, alteración en la producción de células de la sangre por la médula ósea… etc.
Preparación
El paciente debe firmar un documento, consentimiento informado, en el que se le explica el tratamiento, sus riesgos y alternativas.
Además, debe informar al médico de las posibles enfermedades que padezca, alergias a medicamentos o tratamientos crónicos que toma, así como de si es portador de marcapasos o de alguna prótesis.
Antes de la cirugía, se le realiza un estudio preanestésico con radiografía de tórax, analítica de sangre y electrocardiograma, que es evaluado por el médico anestesista.
Debe mantener un ayuno de 8 horas antes de la intervención quirúrgica.
No debe llevar elementos metálicos para la realización de la cirugía o aplicación de la radioterapia.
Antes de la administración de cada ciclo de quimioterapia, el médico evalúa cómo están las defensas del paciente y si tiene anemia (falta de glóbulos rojos), determinando así si se le puede administrar la siguiente dosis quimioterápica.
Cómo es la recuperación del tratamiento de cáncer de pulmón
La recuperación de los tratamientos aplicados es muy progresiva, debido a la importante función que realizan los pulmones para el organismo. La mayor limitación que se puede presentar es que la función de la respiración pulmonar disminuye, tanto por el propio cáncer, como por los tratamientos aplicados para su destrucción. Eso lleva a que el paciente pueda llegar a tener limitaciones en cuanto al desarrollo de su vida habitual, en mayor o menor grado según la afectación del tumor y las patologías pulmonares que puedan afectar al paciente antes del diagnóstico del tumor, como la enfermedad pulmonar obstructiva crónica (EPOC).
Además, la cirugía del cáncer de pulmón es una operación importante que precisa de un tiempo de recuperación de en torno a 2-3 meses.
Así mismo, ha de tenerse en cuenta que los efectos secundarios de la quimioterapia y la radioterapia, muchas veces aplicadas de forma conjunta, pueden aparecer incluso una vez finalizados los tratamientos, lo que puede repercutir en la recuperación real del paciente. Estos tratamientos, además, se administran por ciclos en períodos largos de tiempo, lo que hace que la recuperación real del paciente se tenga que realizar de forma muy progresiva.
Resultados
Los resultados de la efectividad del tratamiento se van evaluando por el médico oncólogo según avanza el tratamiento. Para ello se realizan nuevas pruebas de imagen como TAC, resonancia magnética, gammagrafía ósea… etc. cuyos resultados el médico explica al paciente en las sucesivas consultas de revisión.
A pesar de la intención curativa y del aumento de esperanza de vida de los tratamientos utilizados, por el momento, el cáncer de pulmón sigue siendo la primera causa de muerte por cáncer. La supervivencia media a los 5 años es del 15%.
Preguntas frecuentes
¿Cuáles son los factores de riesgo que pueden causar cáncer de pulmón?
El tabaco es principal factor de riesgo para el desarrollo de un tumor pulmonar.
Otros factores que pueden influir en el desarrollo del cáncer de pulmón son: patología pulmonar previa, factores medioambientales (exposición a asbesto, gas radón… etc.), sexo (varones, aunque está aumentando en mujeres), predisposición genética (se sabe que existe pero no se conocen con exactitud los distintos mecanismos de transmisión hereditaria), haber recibido radioterapia previa, consumición importante de alcohol… etc.
¿Cómo se detecta el cáncer de pulmón?
El diagnóstico se realiza mediante:
Pruebas de imagen como la radiografía de tórax, el TAC… etc.
Visión directa del tumor mediante fibrobroncoscopia o mediastinoscopia (introducción de un tubo flexible con una cámara por la boca o mediante una incisión en el tórax respectivamente) o para toma de una muestra de tejido mediante estas.
Toma de biopsias (muestra de tejido) mediante la realización de punción transparietal (a través de la pared torácica) para su análisis en el laboratorio.
Análisis de la presencia de células tumorales en el esputo o en el derrame pleural (cuando existe líquido en la pleura, que es una membrana que recubre los pulmones).
¿Cómo es el marcador tumoral para el cáncer de pulmón?
No existe un marcador tumoral específico para ayudar al diagnóstico del cáncer de pulmón.
¿Cómo se puede prevenir el cáncer de pulmón?
La abstención tabáquica es el mejor modo de prevención del cáncer de pulmón, ya que aproximadamente el 85-90% de los casos son atribuibles al tabaco.
Contenido de salud
Lifting Facial
Definición
El lifting facial es un tratamiento quirúrgico para tensar los músculos del cuello y de la cara y proceder a retirar el exceso de piel que el envejecimiento ha producido.
¿Cómo es un lifting facial?
El cirujano, tras la inyección de un anestésico local junto con un proceso de sedación, procederá a hacer una incisión quirúrgica, que irá por todo el borde frontal del pelo y se extenderá hasta la zona de detrás de las orejas; este tipo de incisión permite que la cicatriz no sea visible con posterioridad.
Posteriormente se tensarán las capas musculares faciales y se retira el tejido sobrante , por último, procederá a cerrar incisión con puntos de sutura.
¿Para quién está indicado?
Está especialmente indicada para personas mayores de 45 años que desean recuperar un rostro más joven, devolviendo la vitalidad perdida con el paso del tiempo.
¿Por qué se realiza?
Con la exposición al sol, los agentes externos y el paso del tiempo, aparecen surcos y pliegues en la cara y el cuello que hacen perder expresividad y definición en el rostro.
Riesgos del lifting facial
Entre los riesgos del lifting facial algunos son inherentes a cualquier cirugía, entre ellos:
Infecciones : suelen ser en puntos concretos, se acompañan de inflamación, enrojecimiento y mayor sensibilidad de la zona; en muchos casos un tratamiento con antibióticos será suficiente para solucionar el problema.
Reacciones a la anestesia : como náuseas y vómitos o malestar general, que suelen desaparecer en pocas horas.
Hematomas : se pueden producir por el sangrado bajo la piel; en algunos casos, si el hematoma es muy intenso, se puede necesitar intervenir para parar la pérdida de sangre.
Pérdida de sangre excesiva : complicación no muy frecuente ya que se suele ver con rapidez por parte del cirujano.
Puede haber problemas como lesión de los nervios , problemas de cicatrización en la piel y problemas como hormigueo; todos estos problemas suelen desaparecer en un corto espacio de tiempo.
Pese a las posibles complicaciones, la cirugía de lifting se considera una cirugía segura.
Preparación
Entre las normas esenciales para la preparación previa a un lifting está el que si usted es fumador, debe de dejarlo al menos con dos meses de antelación de someterse a esta cirugía, esto evitará posibles complicaciones en la cicatrización.
La alimentación debería de ser variada, pobre en grasas y absteniéndose de beber alcohol en los días previos a la intervención.
Durante un periodo de al menos quince días antes y después de la cirugía, deberá de evitar tomar fármacos antiinflamatorios o aspirinas, ya que aumentan el riesgo de sangrado, y por supuesto si usted está en tratamiento con anticoagulantes de cualquier tipo deberá de ponerlo en conocimiento de su cirujano.
Cómo es la recuperación del lifting facial
Al salir de la clínica deberá de ir acompañado de una persona responsable y en la primera semana sería bueno contar con la ayuda de alguien.
Es normal que durante las primeras noches el paciente presente dolor moderado que se controlará con analgésicos.
Igualmente, durante los primeros días es normal que sienta la piel acolchada, esto desaparece tras unas jornadas; igualmente el rostro presentará hinchazón en estos primeros días, eso último se puede prolongar hasta dos semanas, siendo recomendado durante este tiempo no trabajar, ni realizar ejercicios importantes.
Tras tres semanas es normal poderse incorporar a la vida laboral y social sin otros problemas sobreañadidos.
Resultados
En general deja el óvalo de la cara sin que se note el paso del tiempo, las cicatrices son prácticamente imperceptibles.
Elimina flacidez y las arrugas antiestéticas y da un resultado de una gran naturalidad.
Preguntas frecuentes
¿Cuánto cuesta hacerse un lifting facial ?
El coste de un lifting facial puede estar entre los 4.000 y los 6.000€ , dependiendo de si es para rejuvenecer una parte concreta o el rostro completo y si lleva asociado la blefaroplastia.
¿ Cuál es el efecto lifting ?
El Efecto lifting es el efecto que se consigue de rejuvenecimiento del rostro con tratamientos no quirúrgicos, que puede ser desde los hilos tensores, procedimientos de láser o incluso radiofrecuencia facial.
¿ Qué es el mesolifting facial ?
EL mesolifting es el uso de la mesoterapia para el tratamiento del envejecimiento facial, esta técnica consiste en la inyección de fármacos en la dermis (capa intermedia de la piel), las sustancias que se inyectan son de forma personalizadas adaptada para cada paciente.
¿ Se usa el lifting facial para el acné ?
Realmente el lifting es un tratamiento antienvejecimiento y por tanto no es una intervención adecuada para el acné, hay otras técnicas que pueden mejorar las cicatrices del acné, un tratamiento más adecuado, por ejemplo, puede ser el ácido hialurónico.
Contenido de salud
Cirugía Codo de Tenista
Definición
La cirugía de codo de tenista es la operación que se usa para reparar un tendón dañado por movimientos fuertes y repetidos del codo. La zona que suele dañarse es la parte externa del codo.
¿Cómo es la cirugía de codo de tenista?
La cirugía de codo de tenista generalmente se realiza de forma ambulatoria sin que el paciente quede ingresado en el hospital.
En caso de cirugía abierta se procede a poner anestesia local además de sedación y se realiza una incisión en la parte externa del codo, dejando el tendón a la vista. El cirujano procede a raspar el tendón o bien suturar si este estuviera parcialmente roto. También se puede suturar hacia otro tendón cercano para reforzarle.
En caso de cirugía artroscópica se procede a hacer dos o tres incisiones tras haber sedado al paciente y haberle puesto anestesia local. Con el artroscopio (un tubo con una cámara) se verá la articulación en una pantalla y el cirujano procederá con el aparataje que se introduce en las otras incisiones a raspar o suturar el tendón según sea necesario.
¿Para quién está indicada?
La cirugía de codo de tenista está indicada cuando tras haber realizado un tratamiento conservador a base de rehabilitación y antiinflamatorios no se ha logrado una mejoría del proceso.
Entre los tratamientos conservadores se encuentran:
Poner antiinflamatorios por vía oral o corticoides en infiltración.
Hacer reposo deportivo de la actividad que produjo la lesión.
En casos producidos por el trabajo puede ser necesario el cambio de la posición de los elementos del espacio laboral.
Ejercicios de fisioterapia y férulas de descarga (media escayola que permite mantener la articulación sujeta) que pueden ayudar para mejorar el dolor.
Cuando todo esto fracasa se debe pensar en la cirugía.
¿Por qué se realiza?
La cirugía de codo de tenista se realiza para recuperar la función de esta articulación y mejorar el dolor mediante:
sutura del tendón cuando está parcialmente o totalmente roto.
raspado del tendón cuando se encuentra inflamado para conseguir bajar la inflamación.
Riesgos de la cirugía de codo de tenista
Los riesgos de la cirugía de codo de tenista son los inherentes a cualquier cirugía:
En primer lugar, hematomas (moretones) o sangrados en la zona quirúrgica; para esto es conveniente no tomar AINES (antiinflamatorios no esteroides como el ibuprofeno), ni anticoagulantes los días previos a la cirugía. Si el paciente está anticoagulado debe de comunicárselo al cirujano.
Infecciones en las zonas quirúrgicas, si bien normalmente ceden con tratamiento antibiótico sin otras complicaciones.
En las cirugías no artroscópicas puede ocurrir que se produzca una cicatriz antiestética o bien que presente una cierta retracción de esta.
En algunas ocasiones, a pesar de que la recuperación suele ser satisfactoria, se puede producir una pérdida de fuerza muscular que no se recupera totalmente a pesar de la rehabilitación.
Preparación
La preparación de la cirugía es bastante sencilla:
El paciente deberá guardar un ayuno de entre 8 y 12 horas.
No deberá fumar en las horas previas a la cirugía.
No consumir medicamentos sin consultar al cirujano, en especial antiinflamatorios y anticoagulantes.
Cómo es la recuperación de una cirugía de codo de tenista
La recuperación total de la cirugía de codo del tenista es relativamente larga:
En los días posteriores a la cirugía el paciente presentará dolor que se aliviará por medio de analgésicos. Este dolor puede durar unos tres o cuatro días.
Tras estos días de dolor más intenso puede que el dolor se mantenga de modo más leve hasta seis meses tras la cirugía, pero lo normal serían unos cuatro meses.
Cuando se retire el vendaje el paciente podrá comenzar a hacer pequeños movimientos de estiramiento del codo que posteriormente van a ir aumentando; a partir de tres o cuatro semanas el paciente podrá comenzar con los ejercicios de rehabilitación, y tras cuatro o seis meses podrá volver a su actividad normal.
Resultados
Los resultados de la cirugía de codo de tenista suelen ser buenos.
Puede haber hasta un 20 % de complicaciones derivadas de la cirugía en las primeras semanas.
En general los pacientes pueden realizar su vida normal pasados unos tres o cuatro meses, y reincorporarse a su trabajo o al deporte pasados unos 6 meses.
Se considera que se recuperan totalmente hasta el 80 o 90 por ciento de los pacientes, en el resto puede quedar como resultado una cierta pérdida de fuerza muscular.
Preguntas frecuentes
¿Qué es el codo de tenista?
El codo de tenista es la inflamación del tendón extensor radial corto (tendón que se encarga de la extensión del codo) y del extensor común (tendón que se encarga de extender la muñeca y los dedos).
Se produce por los movimientos repetidos con fuerza de esta musculatura.
¿El codo de tenista es lo mismo que la epicondilitis?
Epicondilitis y codo del tenista son una forma diferente de llamar a la tendinitis (inflamación) de los tendones del codo. El nombre de codo de tenista se deriva de los deportes de raqueta donde el movimiento repetido da lugar a esta lesión. El de epicondilitis deriva de que el tendón se inserta en la zona del hueso húmero llamada epicóndilo, y en general es donde se inicia el dolor.
¿Me pueden quedar secuelas después de este tipo de cirugía?
La cirugía de codo de tenista es una cirugía que puede dejar algún tipo de lesión. Se puede producir un daño del paquete neuromuscular, aunque no es frecuente, que provoque una pérdida de la fuerza muscular y de la sensibilidad.
En algunos casos, es necesario reintervenir ya que las cicatrices pueden dejar adherencias que dificultan la movilidad.
¿ Cuál es el tiempo de recuperación de una cirugía de codo de tenista?
El periodo de recuperación tras una cirugía de codo de tenista comienza tras un periodo de inmovilización con férula (se trata de una inmovilización de escayola) de unos quince días. Es entonces cuando el paciente empezará un periodo de ejercicios de rehabilitación que le permitirán volver a una vida normal en aproximadamente un mes.
La recuperación completa y el retorno al trabajo será de entre 4 y 6 meses.
¿Podré hacer deporte después?
En la mayoría de los casos, en aproximadamente cuatro meses se podrá a comenzar a entrenar y realizar deporte de carácter no competitivo.
No será hasta pasados seis meses que se pueda comenzar a hacer un deporte de tipo competitivo.

Contenido de salud
Tratamiento del Cáncer de Colon
Definición
El tratamiento del cáncer de colon consiste en la aplicación de todos aquellos procedimientos destinados a conseguir la curación, disminuir los síntomas producidos por el tumor, y aumentar la calidad y esperanza de vida del paciente que lo padece. Para ello, intervienen varios especialistas médicos que, en conjunto, organizan el tratamiento integral del paciente (oncólogo, cirujano, especialista en medicina digestiva, médico de familia, etc.).
¿Cómo es el tratamiento para el cáncer de colon?
El tratamiento del cáncer de colon comprende las siguientes medidas:
Cirugía : puede realizarse por vía laparoscópica (mediante pequeñas incisiones en el abdomen y la introducción de un instrumental con una cámara y el material necesario para realizar la operación), o mediante cirugía abierta (realizar una incisión mayor en la pared abdominal).
Con ella se aborda la extirpación del tumor o de parte del intestino grueso donde esté localizado el tumor (colectomía o hemicolectomía), la extirpación de metástasis (crecimiento de lesiones tumorales en sitios diferentes del cuerpo, por ejemplo, en el hígado), o para solventar complicaciones derivadas de la progresión del tumor (por ejemplo, una obstrucción intestinal).
Quimioterapia : aplicada como tratamiento adyuvante, es decir, para ayudar a conseguir mejores resultados de curación tras la cirugía, o de forma paliativa (no curativa), en pacientes que se pueden beneficiar con un aumento de su calidad y esperanza de vida.
Radioterapia : se utiliza antes de la cirugía en lesiones rectales grandes para disminuir el tamaño del tumor, o después de la cirugía para reducir la posibilidad de reaparición del tumor. También, como tratamiento paliativo en pacientes con metástasis óseas que tengan mal control del dolor.
Inmunoterapia mediante administración de anticuerpos monoclonales: sustancias químicas que se unen selectivamente sobre las células del tumor para su destrucción.
¿Para quién está indicado?
Según la extensión y características del tumor se realiza la indicación de uno u otro tratamiento. En general, para tumores con extensión local, se utiliza siempre la cirugía y, dependiendo de la localización y del estadío concreto del tumor (clasificación de su extensión), se aplica quimioterapia y/o radioterapia.
En la enfermedad avanzada, se utilizan los tratamientos de forma siempre paliativa: cirugía para resección de metástasis o solución de complicaciones derivadas del tumor, y quimioterapia o radioterapia, para mejorar o aumentar la calidad de vida del paciente y reducir los síntomas.
¿Por qué se realiza?
El tratamiento del cáncer de colon se realiza con fines curativos (conseguir erradicar el tumor) y/o paliativos (mejorar de los sÍntomas que produce el tumor).
Riesgos del tratamiento para el cáncer de colon:
Los riesgos del tratamiento para el cáncer de colon son los específicos de cada técnica o fármaco aplicado:
cirugía (colectomía o hemicolectomía, resección de metástasis, etc.), riesgo de infecciones o hematomas.
quimioterapia, tolerancia a los fármacos y a los efectos adversos de los mismos.
Preparación
Según el tipo de tratamiento a aplicar, el médico le especificará al paciente si debe realizar algún tipo de preparación concreta.
El paciente deberá firmar un consentimiento informado en el que se le explique el tratamiento, sus riesgos y alternativas.
Igualmente, el paciente deberá informar al médico de las posibles enfermedades que padezca, alergias a medicamentos o tratamientos crónicos que tome. También de si es portador de marcapasos o de alguna prótesis.
Antes de la cirugía, se le realizará un estudio preanestésico con radiografía de tórax, analítica de sangre y electrocardiograma, que será evaluado por el médico anestesista. Deberá mantener un ayuno de 8 horas antes de la intervención.
No deberá portar elementos metálicos para la realización de la cirugía o aplicación de radioterapia.
Antes de la administración de cada ciclo de quimioterapia, el médico evaluará cómo están las defensas del paciente y si tiene anemia (falta de glóbulos rojos). Determinará así, si se le puede administrar la siguiente dosis.
Cómo es la recuperación del tratamiento para el cáncer de colon
Después de cada tratamiento el paciente necesitará “recuperar fuerzas”. Los tratamientos son agresivos y no están exentos de efectos secundarios. Estos pueden presentarse en cualquier etapa del tratamiento y persistir incluso cuando ya se haya finalizado. Todos los efectos secundarios son valorados y tratados de forma específica por el médico oncólogo y el médico de familia.
Habitualmente, los efectos secundarios y la recuperación tras la quimioterapia y la radioterapia suelen estar acotados en el tiempo y desaparecer. La repercusión más importante y definitiva que puede presentarse se dará tras la cirugía, ya que, después de extraer el tumor y parte del intestino grueso, el paciente deberá usar una colostomía para el desecho de las heces (bolsa externa que lleva en el abdomen pegada para recoger las heces, que salen por un orificio en su pared realizado artificialmente por cirugía).
A veces, durante todo el proceso y la recuperación, el paciente precisará de apoyo psicológico que le ayudará a gestionar la enfermedad y la repercusión de esta en su vida.
Resultados
El éxito del tratamiento se evaluará según el estado del paciente y los fines con los que se ha aplicado.
El médico oncólogo realizará controles con repetición de pruebas de imagen (escáner o TAC, ecografía…etc.) o control de marcadores tumorales (sustancias que aumentan en la sangre de forma más o menos específica cuando existen tumores), para ver el cambio del estado del tumor o su desaparición tras la aplicación de los tratamientos. Después de la cirugía, se recomendará realizar una colonoscopia al año y, posteriormente, cada 2 – 3 años.
Los resultados de estos controles le serán explicados al paciente en las sucesivas consultas de revisión con el oncólogo .
Preguntas frecuentes
¿Cuáles son las causas del cáncer de colon?
La causa de todos los tumores del cuerpo es una mutación, o alteración del material genético de una célula, que hace que empiece a multiplicarse sin control. Sin embargo, hay factores que pueden ayudar a que se desencadene. Factores ambientales y clínicos que pueden influir en su desarrollo:
La dieta rica en grasas saturadas, pobre en fibras (fruta y verduras), donde abundan las carnes rojas, junto con un estilo de vida sedentario y el consumo de tabaco y alcohol.
Un 20% de los tumores de colon tienen una predisposición genética: el riesgo de padecer cáncer colorrectal se multiplica por 2 o 3 cuando existe un familiar de primer grado diagnosticado de cáncer de colon.
El padecer alguna enfermedad inflamatoria intestinal como colitis ulcerosa o enfermedad de Crohn, puede hacer que se desarrolle el tumor.
En más del 90% de los cánceres de colon esporádicos existe una lesión precursora en el colon (un pólipo).
¿Cómo se detecta el cáncer de colon?
La detección del cáncer de colon se realiza con el estudio de:
Síntomas que el paciente puede presentar: sangrado con las heces, alteración del ritmo intestinal con diarrea y estreñimiento, dolor abdominal, pérdida de peso…etc.
Exploración física: palpación de alguna masa en el abdomen o recto.
Alteraciones en las pruebas diagnósticas: analítica de sangre (aparición de anemia, alteración de las enzimas hepáticas, elevación de marcadores tumorales…etc.), determinación de sangre oculta en heces (que obliga a hacer una prueba de imágen para concretar el diagnóstico), realización de una colonoscopia (permite localizar el tumor), realización de otras pruebas de imagen (TAC, resonancia… etc.) que sirven para ver la extensión del tumor.
¿Cómo es el marcador tumoral para el cáncer de colon?
Los marcadores tumorales (sustancias que pueden ayudar al diagnóstico, seguimiento y control post-tratamiento del cáncer de colon), son el CEA y el CA 19.9 determinados en una analítica de sangre .
¿Cómo se puede prevenir el cáncer de colon?
La prevención del cáncer de colon se puede realizar modificando los factores ambientales que pueden favorecer que se desencadene la enfermedad, por ejemplo con una adecuada alimentación.
En la población general se aconseja seguir una dieta normocalórica, baja en grasas saturadas, rica en fibras, frutas, verduras, legumbres y donde no abunde el consumo de carnes rojas. Evitar el consumo de tabaco y el alcohol. Puede ejercer un efecto protector la ingesta de vitaminas antioxidantes (vitamina A, C y E), betacarotenos, ácido fólico, calcio y selenio. Se debe hacer ejercicio físico evitando el sedentarismo.
La influencia genética no se puede modificar. Las personas con antecedentes familiares de cáncer de colon, deben realizarse los controles preventivos de diagnóstico precoz establecidos (colonoscopias periódicas).
Los pacientes que padezcan enfermedades inflamatorias intestinales deben seguir, igualmente, un control médico y los tratamientos adecuados para prevenir la posible aparición de cáncer de colon.
Contenido de salud
Tratamiento Cáncer de Piel
Definición
El tratamiento del cáncer de piel se basa en la aplicación de una serie de técnicas quirúrgicas y no quirúrgicas , de manera que, pudiendo utilizar una técnica o ambas, podamos conseguir la curación, disminuir el crecimiento del tumor y aumentar la calidad de vida y supervivencia del paciente.
Los especialistas médicos que pueden intervenir en el seguimiento de estos tratamientos dirigidos al paciente son el dermatólogo, el oncólogo y el médico de familia.
¿Cómo es el tratamiento para el cáncer de piel?
Los tipos de tratamiento que se pueden utilizar en las distintas variantes del cáncer de piel son:
Cirugía: consiste en la extirpación de la lesión tumoral incluyendo los márgenes de tejido que rodea al tumor y que a simple vista aparentan estar libres de enfermedad. Las técnicas quirúrgicas que se pueden utilizar son varias: excisión simple, cirugía micrográfica de Mohs (cirugía controlada por microscopio, con resección progresiva de las capas de piel afectadas por el tumor), escisión mediante rasurado, dermoabrasión (mediante aplicación de calor), criocirugía (mediante aplicación de frío con nitrógeno líquido), cirugía con láser, o electrodisecación (aplicando corriente de alta frecuencia).
Si se sospecha la posible de afectación ganglionar (nódulos del sistema inmune), por medio del estudio del ganglio centinela (estudio del primer ganglio de la región afectada), se extirpará también toda la cadena ganglionar correspondiente a la región donde esté el tumor.
Radioterapia : aplicación de distintos tipos de radiación, sobre todo rayos X, para destruir las células tumorales. Se utiliza en ocasiones antes de la cirugía para reducir el tamaño del tumor o como terapia paliativa (no curativa), en los casos de enfermedad avanzada.
Quimioterapia: utilizada en el tipo de cáncer de piel llamado melanoma, habitualmente de forma paliativa. En los tumores no melanomas se utiliza un fármaco (5-fluorouracilo) de aplicación tópica (en forma de crema o loción), y por vía endovenosa en aquellos casos en los que haya afectación de otros órganos.
Terapia fotodinámica: se aplica una crema que contiene un fármaco que es captado por las células tumorales y que, tras la aplicación de la luz de una lámpara especial, elimina esas células tumorales. Se puede utilizar para el tratamiento de los tipos de cáncer de piel no melanoma.
Terapia biológica o inmunoterapia: se activa al sistema inmunológico para que actúe contra las células cancerígenas y así tratar el tumor. En los tipos de cáncer no melanoma se utiliza la aplicación tópica con un fármaco específico. En el melanoma también se utiliza esta terapia, habitualmente en los casos de enfermedad evolucionada.
Terapias dirigidas: son tratamientos farmacológicos destinados de forma específica a actuar directamente en determinadas moléculas que intervienen en el crecimiento tumoral. En el melanoma, este tipo de terapias se utiliza sobre todo en estadios avanzados de la enfermedad.
¿Para quién está indicados?
Los tratamientos del cáncer de piel están indicados para aquellos pacientes con lesiones cancerígenas en la piel. Según el tipo de tumor, afectación que tenga y la evolución o estadio en que se encuentre ese tumor, será el dermatólogo y/u oncólogo el que tome la decisión sobre qué tipo de tratamiento aplicar.
Generalmente, se puede dividir el cáncer de piel en melanoma y no melanoma. Existen otros tipos de tumores que pueden afectar a la piel y que pueden ser enfermedades tumorales que afecten a la vez a otros órganos.
En todas las lesiones la primera indicación de tratamiento es la cirugía, siempre que la extensión del tumor lo permita.
El los melanomas, habitualmente la utilización de otro tipo de terapias como la inmunoterapia, las terapias dirigidas, la radioterapia o la quimioterapia, se utilizan en estadios avanzados.
¿Por qué se realiza?
El objetivo del tratamiento para el cáncer de piel es curativo y/o paliativo según la repercusión y extensión del tumor en el organismo.
Riesgos del tratamiento para el cáncer de piel
Los riesgos de los procedimientos varían según el tipo de tratamiento empleado :
La mayoría de los riesgos quirúrgicos son infección, sangrado, presencia de una cicatriz…etc. Si se realiza la extracción de los ganglios linfáticos puede aparecer linfedema en la zona (acúmulo de líquidos en los tejidos).
La radioterapia puede producir irritaciones en las zonas próximas a su aplicación con aparición de enrojecimiento en la piel como “quemaduras” y/o irritación de las mucosas (revestimiento de las cavidades del cuerpo como la boca… etc.).
Dentro de los riesgos de la quimioterapia están las náuseas y vómitos, la pérdida de pelo, los dolores musculares y articulares, la falta de apetito, las alteraciones de las células de la sangre…etc.
Preparación
El paciente deberá firmar un consentimiento informado en el que se le explique el tratamiento que se le va a aplicar, así como sus riesgos y alternativas.
Antes de iniciar la terapia indicada, el paciente deberá informar al médico de las posibles enfermedades que padezca, alergias a medicamentos o tratamientos crónicos que tome. También de si es portador de marcapasos o de alguna prótesis.
Antes de la cirugía, cuando sea precisa la administración de anestesia general, se le realizará un estudio preanestésico con radiografía de tórax, analítica de sangre y electrocardiograma, que será revisado por el anestesista. Deberá mantener un ayuno de 8 horas antes de la intervención en el caso de utilizar anestesia general.
No deberá portar elementos metálicos para la realización de la cirugía o aplicación de radioterapia.
Antes de la administración de cada ciclo de quimioterapia, el médico evaluará cómo están las defensas del paciente y si tiene anemia (falta de glóbulos rojos). Determinará así si se le puede administrar la siguiente dosis.
Cómo es la recuperación del tratamiento para el cáncer de piel
A todos los pacientes se les recomienda tener una adecuada higiene del área tratada. Evitar el sol y usar fotoprotector alto.
Según la extensión de las lesiones de la piel y su localización, la recuperación tras la cirugía será más o menos rápida. En ocasiones, para el cierre de la herida quirúrgica se realizan injertos o colgajos, obteniéndose piel de otras zonas del organismo, lo que conlleva la ampliación de la cirugía y del periodo de recuperación tras esta.
Los pacientes deben cumplir un seguimiento, realizado por parte del dermatólogo o el equipo de atención primaria, para la realización de las curas de la herida quirúrgica y la extracción de los puntos de sutura pasados aproximadamente 10 días .
La recuperación de los tratamientos con radioterapia es a más largo plazo, ya que sus efectos secundarios se presentan no solo en el momento del tratamiento, sino también a posteriori.
En general, salvo que la enfermedad esté más extendida, la recuperación de los tratamientos aplicados es buena, y habitualmente el paciente puede realizar sus actividades cotidianas en las primeras 4 – 6 semanas después del tratamiento.
Resultados
Usualmente, tras la extirpación de la lesión mediante cirugía, se realiza un estudio del tejido extraído en el laboratorio de anatomía patológica para confirmar el diagnóstico. Además, se comprueba que se ha hecho una extracción con márgenes de seguridad, es decir, que el tejido próximo a la lesión que se ha extraído está libre de tumor.
Los resultados de ese análisis se le dan al paciente en las consultas sucesivas de revisión, donde, además, se evalúa la recuperación del paciente tras los tratamientos administrados.
El cáncer de piel no melanoma resulta curable en el 90% de los casos si se realiza un tratamiento temprano. La tasa de éxito del tratamiento del melanoma depende del estadio donde se encuentre el tumor en el momento del diagnóstico.
Tras el tratamiento, el dermatólogo pactará las revisiones precisas dependiendo de las características del tumor y la localización, pudiendo variar entre trimestrales o anuales y bianuales.
Preguntas frecuentes
¿Cómo se presenta el cáncer de piel?
El cáncer de piel se presenta con lesiones dérmicas que pueden ser diferentes según el tipo de cáncer. Así, puede existir un cáncer en una “mancha” de la piel que sea de bordes irregulares, crezca rápido, con distintos tonos en su coloración, en la que puedan aparecer ulceraciones… etc. A veces se presenta a modo de nódulos o elevaciones redondeadas, con aparición de descamación o costras y/o sangrados.
¿Cómo es un melanoma?
El melanoma es un tumor derivado de unas de las células de la piel llamadas melanocitos , que puede aparecer en cualquier región de la piel, más frecuentemente donde existen lesiones previas. Es el tumor cutáneo más agresivo por su capacidad de producir metástasis (crecimiento de tumor en otros sitios del organismo).
¿Cuáles son los factores de riesgo que pueden causar cáncer de piel?
Los principales factores de riesgo para padecer cáncer de piel son:
La exposición al luz ultravioleta a lo largo de la vida.
La exposición a radiaciones ionizantes (como las que se utilizan para hacer radiografías).
Padecer enfermedades que causan disminución de las defensas, como el SIDA, el uso crónico de tratamientos con esteroides o el tratamiento inmunosupresor de los pacientes con trasplantes de órganos, que favorecen la supresión del sistema inmune (sistema de defensa).
Tener enfermedades inflamatorias crónicas de la piel.
Las personas de raza blanca tienen 20 veces más riesgo de padecer melanoma que las de raza negra.
Tener antecedentes de melanoma en la familia. Aproximadamente el 10% de todas las personas con melanoma tienen antecedentes familiares.
Tener lesiones precursoras como lunares.
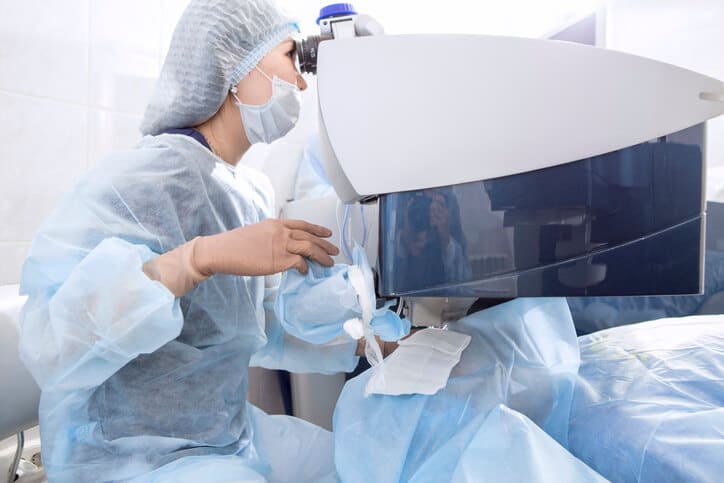
Contenido de salud
Sobre cirugía refractiva
Definición
La cirugía refractiva es el conjunto de técnicas y procedimientos quirúrgicos que tienen como finalidad eliminar, o minimizar, las diferentes patologías oculares como son la miopía (mala visión de lejos), hipermetropía (mala visión de cerca), el astigmatismo . De esta forma, el paciente puede reducir el uso de gafas o lentes de contacto e incluso no volver a usarlos.
¿Cómo es la cirugía refractiva?
En la cirugía refractiva existen varias técnicas que se pueden utilizar para realizar este procedimiento, y que van depender del tipo de patología ocular que tenga el paciente.
Esta intervención se realiza de dos formas:
Cirugía láser: trata de modificar la forma de la córnea mediante un denominado (Excimer). La técnica más utilizada es la cirugía Lasik, y la más recomendada por los oftalmólogos debido a su rapidez y sencillez. Consiste en tallar una fina lámina en la superficie corneal con un instrumento diseñado para este tipo de intervenciones llamado microqueratomo.
Una vez tallado se levanta esa fina capa de tejido corneal y se aplica el láser excimer, el cual utiliza un rayo láser para moldear la córnea, durante un periodo de tiempo de 5 a 45 segundo. El láser dispone de un mecanismo de seguridad conocido como eye-tracker, que permite que los impactos se dirijan sólo a las partes de la córnea que debe ser remodelada para corregir el efecto refractivo.
Una vez que el láser ha realizado su función se vuelve a colocar la fina capa corneal sin necesidad de aplicar puntos de sutura.
Lentes intraoculares fáquica (ICL): Es una lente que se implanta en el interior del ojo sin necesidad de extraer el cristalino transparente del mismo. Se realiza para el paciente que tiene contraindicado el láser y en aquellos pacientes que tienen graduaciones altas.
Es una intervención que se hace de forma rápida, sencilla e indolora. La intervención dura alrededor de cinco o diez minutos, se realiza con anestesia tópica (gotas), por lo que no es necesario cubrir el ojo al finalizar la operación.
¿Para quién está indicada?
La cirugía refractiva está indicada para:
Personas con defectos refractivos que quieren reducir o eliminar la dependencia de las gafas o lentes de contacto.
Eliminar la graduación de los ojos, que va a depender del número de dioptrías que tenga cada paciente.
Compensar la pérdida de la capacidad de acomodación del cristalino, que produce los problemas para enfocar de cerca.
¿Por qué se realiza?
La cirugía refractiva s e realiza para eliminar las diferentes patologías oculares refractivas. Para modificar el estado refractivo del ojo con el propósito de eliminar o reducir el uso de gafas, de modo que los pacientes puedan mejorar su calidad de vida .
Riesgos de la cirugía refractiva
En la cirugía refractiva existen algunos riesgos como son:
Infección.
Inflamación.
Posible abombamiento de la córnea.
Posibles efectos secundarios como halos o destellos son mayormente transitorios.
El riesgo más común es el ojo seco, que generalmente desaparece pasados unos meses, durante este tiempo se recomienda el uso de gotas lubricantes.
Preparación
La preparación para la cirugía refractiva empieza con una primera consulta médica con el oftalmólogo, donde se comprobará que el paciente cumple todos los requisitos para poder ser intervenido quirúrgicamente.
Se le realizará al paciente una serie de pruebas oftalmológicas para determinar qué tipo de intervención es la más adecuada.
El médico le hará al paciente algunas pruebas para medir la agudeza visual, la refracción o número de dioptrías de miopía, hipermetropía, astigmatismo o presbicia y la presión intraocular.
En el caso de utilizar láser, también debe hacerse una topografía, o sea una medición de la curvatura y grosor de la córnea, y un estudio de la histéresis corneal, es decir, del grado de resistencia y elasticidad de este tejido.
El mismo día de la operación el médico cita antes al paciente en consulta para repetir las pruebas diagnósticas, y confirmar que no haya cambios respecto a la visita preoperatoria, de modo que el ojo pueda ser intervenido.
Cómo es la recuperación de la cirugía refractiva
Durante las primeras horas de recuperación de una cirugía refractiva después de la intervención, el paciente puede notar ligeras molestias como escozor o lagrimeo y, al cabo de varias horas comenzará a percibir la recuperación visual sin necesidad de depender de las gafas o las lentillas.
Tras terminar el procedimiento es conveniente que el paciente descanse y permanezca el mayor tiempo posible con los ojos cerrados, en un ambiente con poca luz.
El paciente debe aplicarse los medicamentos oculares que le indique el oftalmólogo.
Es necesario que el paciente pueda asistir acompañado el día del procedimiento porque la vista estará un poco distorsionada, algo borrosa y nublada, por lo que no se le permitirá conducir.
El paciente podrá incorporarse a sus actividades de la vida diaria 48 horas después de la intervención.
Se recomienda al paciente usar gafas de sol los primeros tres días para evitar frotarse los ojos.
Resultados
Como resultado de la cirugía refractiva la nitidez de la visión mejora considerablemente , y se reducen o se eliminan totalmente las enfermedades refractivas como la miopía, astigmatismo e hipermetropía. El paciente no tendrá que depender del uso de gafas o lentes de contacto para poder ver correctamente.
Preguntas frecuentes
¿Cuánto cuesta la operación de la vista?
La operación de la vista cuesta los mismo sin importar el problema de refracción que se vaya a corregir. El precio de la intervención está más relacionado con la técnica que utilice el oftalmólogo para corregir el problema visual. Esta operación puede costar alrededor de 700 a 900 euros por ojo .
¿Qué es una cirugía con Excimer Láser?
La cirugía de Excimer Láser o láser de excímeros es una técnica quirúrgica para tratar las patologías oculares o defectos refractivo . Es un tipo de láser que genera una luz ultravioleta, invisible y fría que, en vez de cortar o quemar, crea suficiente energía como para separar las moléculas de los tejidos. El láser excimer es el apropiado para tratar miopías de entre 1 y 10 dioptrías e hipermetropías de entre 1 y 5 dioptrías, con o sin astigmatismo.
¿Qué es la queratotomía radial?
La queratotomía radial es una operación para corregir la miopía. Implica hacer cortes diminutos en la córnea para ampliarla. Esto puede ayudar a mejorar la visión de lejos. Consiste en hacer incisiones profundas en forma radial, como la llanta de una bicicleta, usualmente toma de 4 a 8 incisiones usando una cuchilla de diamante .
¿Qué es la cirugía fotorrefractiva?
La cirugía fotorrefractiva es una cirugía que permite cambiar de manera permanente la forma de la córnea, a través de un láser ultravioleta que corrige las curvaturas corneales. Especialmente indicado en la corrección de Miopía o Astigmatismo .
¿Qué es PRK en oftalmología?
Un PRK es la cirugía refractiva que consiste en las separación del epitelio, que es la capa más superficial de la córnea, empleando una solución especial alcohólica. A continuación se aplica el láser excimer para corregir la curvatura de la córnea y eliminar el defecto refractivo .

Contenido de salud
Cistectomía Radical
Definición
Es una intervención que consiste en la extirpación de la vejiga. Se realiza para tratar un tumor maligno , y se hace principalmente con la intención de curar el cáncer. Este procedimiento también crea una nueva vía para que la orina salga del cuerpo.
¿Cómo es la cistectomía radical?
En la cistectomía radical el cirujano realiza una extracción completa de la vejiga. En el caso del hombre también extirpa la próstata y las vesículas seminales. En la mujer implica extirpar junto con la vejiga el útero, los ovarios y parte de la vagina.
El especialista le puede recomendar al paciente los siguientes tipos de cirugía:
Cirugía abierta : este procedimiento requiere una sola incisión en el abdomen para acceder a la pelvis y la vejiga.
Cirugía laparoscópica : es una cirugía mínimamente invasiva, donde el cirujano realiza varias incisiones pequeñas en el abdomen por las que se insertan herramientas para entrar a la cavidad abdominal y realizar la cirugía.
Cirugía robótica : este tipo de cirugía es también mínimamente invasiva, el cirujano se sienta frente a una consola y opera las herramientas quirúrgicas en forma remota.
El procedimiento de la cistectomía radical se realiza bajo anestesia general, por lo que el paciente estará completamente dormido. El cirujano hace una incisión en el abdomen, más grande para la cirugía abierta, o varias incisiones pequeñas para la cirugía robótica o mínimamente invasiva.
Después se procede a extraer la vejiga junto con los ganglios linfáticos cercanos. Es posible que se deba extraer también otros órganos ubicados cerca de la vejiga, como la uretra, la próstata y las vesículas seminales en los hombres; y la uretra, el útero, los ovarios y parte de la vagina en las mujeres.
Después de extraer la vejiga, se deben reconstruir las vías urinarias con el fin de permitir que se libere la orina del cuerpo. Existen varias opciones:
El Conducto ileal: el cirujano utiliza un parte del intestino delgado para crear un tubo que se une a los uréteres, y conecta a los riñones dando salida a la pared abdominal (estoma).
Reconstrucción de neovejiga: el cirujano utiliza una porción más larga del intestino delgado para crear un reservorio con forma de esfera que se convierte en la nueva vejiga.
Depósito urinario continente: el cirujano utiliza una parte del intestino para crear un pequeño depósito dentro de la pared abdominal. A medida que el paciente produce orina, el depósito se llena y se utiliza una sonda para vaciar el reservorio varias veces al dia.
El objetivo de una derivación urinaria es facilitar el almacenamiento seguro y la eliminación oportuna de orina después de una extracción de vejiga.
¿Para quién está indicada?
La cistectomía radical está indicada para:
Pacientes con un cáncer que comienza en la vejiga, o lesiones circundantes, y crece hasta afectar a la misma.
Pacientes con defectos de nacimiento que afectan al sistema urinario.
Pacientes con trastornos neurológicos o inflamatorios que afectan el sistema urinario.
¿Por qué se realiza?
La cistectomía se realiza para tratar el cáncer de vejiga invasivo o no invasivo . También se puede realizar para tratar otros tumores pélvicos, como cáncer de colon, de próstata o de endometrio avanzado, y algunas afecciones no cancerosas o benignas, como anomalías congénitas o cistitis intersticial.
Riesgos de la cistectomía radical
Entre los riesgos de la cistectomía radical están:
Infección.
Apertura de los puntos de sutura.
Fístulas temporales o permanentes.
Defectos estéticos derivados de algunas de las complicaciones anteriores o procesos cicatriciales anormales.
Intolerancia a los materiales de sutura, que puede precisar reintervención para su extracción.
No conseguir la extirpación de la vejiga o que persistan los síntomas previos total o parcialmente.
Hemorragia, tanto durante el acto quirúrgico como en el postoperatorio, de intensidad y gravedad variables.
Parálisis intestinal pasajera o persistente.
Obstrucción y fístulas intestinales que pueden precisar una nueva intervención.
Preparación
En la preparación de la cistectomía radical el paciente debe seguir las indicaciones de su médico antes de la cirugía.
El paciente será sometido a un examen físico completo para que así el médico se asegure de su estado de salud. El examen físico puede ir acompañado de analiticas de sangre, electrocardiogramas y algunas otras pruebas diagnósticas.
Es importante que el paciente informe al médico si está tomando alguna medicación y si es alérgico. Ya que en ocasiones puede que le indique que debe dejar de tomar algunos medicamentos antes de la cirugía.
El paciente no debe tomar medicación que pueda afectar la coagulación sanguínea como las aspirinas (medicamentos anticoagulantes), para evitar riesgos de sangrados excesivos.
Se recomienda que el paciente deje de fumar y tomar alcohol días antes de la cirugía.
El paciente debe estar en ayunas 8 horas antes del procedimiento.
Cómo es la recuperación de la cistectomía radical
En la recuperación de la cistectomía radical el postoperatorio normalmente es de tres semanas . Durante ese tiempo se irá retirando la alimentación por sueros, las sondas o drenajes se retirarán cuando el médico considere oportuno.
En ocasiones hay que utilizar una sonda, que puede ser molesta, a través de la nariz para aspirar los gases y los jugos gástricos, con el fin de permitir la mejor cicatrización de las suturas en el intestino.
Los intestinos tienden a ser la última parte en volver a funcionar después de la cirugía, por lo que es posible que el paciente tenga que permanecer en el hospital hasta que los intestinos estén nuevamente listos para absorber líquidos y nutrientes. El tiempo estimado de esta recuperación es de cinco a seis días.
En las primeras seis a ocho semanas después de la cirugía, es posible que el paciente deba limitar sus actividades cotidianas, como levantar objetos pesados, conducir, bañarse, y regresar al trabajo. Además, durante algunas semanas posteriores a la cirugía, el paciente podría presentar algún dolor o molestias alrededor de las incisiones.
Resultados
Como resultado de la cistectomía radical se consigue controlar el cáncer de vejiga en un buen número de pacientes. La calidad de vida después de la operación depende de la técnica de reconstrucción empleada. Si se ha podido reconstruir la vejiga (neovejiga) el paciente puede llegar hacer una vida completamente normal . En ocasiones cuesta adaptarse a las nuevas formas de conducción de la orina. Los resultados pueden ser mejorados añadiendo otros tratamientos como la quimioterapia, si fuese necesario.
Preguntas frecuentes
¿Qué es una resección transuretral de vejiga?
La resección transuretral de vejiga es una operación que se realiza tanto para el diagnóstico como para el manejo del cáncer de vejiga. Durante la cirugía, el urólogo inserta en la vejiga, a través de la uretra, un tubo delgado con luz llamado cistoscopio, para examinar el revestimiento de la vejiga. Después el urólogo toma muestras del tejido, puede extirpar una parte, o la totalidad del cáncer de vejiga a través de este tubo.
¿Qué es una urostomía?
Una urostomía es una abertura en la barriga o pared abdominal hecha mediante cirugía. Sirve para desviar la orina fuera de la vejiga que está enferma o que no funciona correctamente.
¿Qué es una bolsa de urostomía?
Una bolsa de urostomía es una bolsa especial que se utiliza para recoger la orina después de una cirugía de vejiga . La bolsa se fija a la piel alrededor del estoma (el agujero desde donde sale la orina.).
¿Qué es el Bricker?
El bricker es una de las técnicas para la derivación urinaria más comunes. Se logra mediante la conexión de los uréteres a un segmento aislado de intestino de aproximadamente 10 cm, en el cual uno de sus extremos se cierra y el otro se exterioriza a través de la piel para formar un estoma , el cual es conectado a un anillo de plástico que se adhiere a la piel mediante pegamento, y sobre el cual se inserta una bolsa de plástico que se cambia cada vez que se llena.
¿Qué es una ureterostomía?
La ureterostomía consiste en la derivación de la orina que producen los riñones, uniendo el uréter a la piel del abdomen. Esta derivación puede hacerse de manera permanente o de forma provisional, hasta que se recupere la normalidad de la vía.
Contenido de salud
Ecoendoscopia
Definición
La ecoendoscopia es una prueba diagnóstica que se caracteriza por la combinación de endoscopia y ecografía .
El ecoendoscopio combina la visión mediante cámara y ultrasonidos. Esto permite ver la superficie por donde vamos pasando con la cámara y, de forma alternativa, la profundidad por medio de la ecografía.
Ambas visiones no pueden ser simultáneas, sino que se van alternando. Cuando funciona la parte de cámara se ven imágenes directas de la superficie, si se pone en marcha el ecógrafo pueden verse las zonas profundas como en una ecografía.
Preparación
La preparación de la ecoendoscopia será diferente según la zona a examinar.
Si se trata de una ecoendoscopia alta, el paciente deberá de permanecer en ayuno desde 8 horas antes de realizar la prueba. No deberá tomar fármacos antiinflamatorios durante los tres días anteriores a la misma, y si está tomando anticoagulantes, deberá de advertir a su médico, ya que si se realizara una biopsia de algún tejido este podría sangrar.
Si por el contrario la ecoendoscopia es de la zona baja, intestino grueso o colónica, el paciente deberá hacer una dieta pobre en residuos durante los tres días previos a la prueba (no deberá de comer patatas, ni verduras, ni fruta). El día antes de la prueba solo deberá tomar caldos desgrasados y líquidos, aunque puede tomar zumos si son colados. Así mismo, el día de la prueba le pueden mandar laxantes orales y si fuera necesario le pueden recomendar ponerse un enema (introducción de un líquido a través del ano para limpiar el intestino grueso). Se mantendrá por parte del paciente ayunas de al menos seis horas. En este tipo de endoscopia, el paciente no deberá de tomar fármacos antiinflamatorios, y si el paciente toma anticoagulantes, deberá de advertir al médico.
En ambos casos le pueden pedir una analítica de sangre para ver previamente como está la coagulación sanguínea, por si le hacen una biopsia (la biopsia es la toma de una muestra de tejido para proceder a analizarla).
Cómo se realiza una ecoendoscopia
La realización de la ecoendoscopia será como la de una endoscopia, ya que en sí lo único que varía es que el endoscopio es un aparataje más complejo.
De ser una ecoendoscopia alta, tras tumbar al paciente en la camilla, se le pedirá que se ponga de lado. Se le dará un spray anestésico para tratar de anestesiar la garganta y que no se produzca el vómito. También se le pondrá una vía intravenosa por la cual se le suministrará el sedante para producir una sedación que le impida sentir dolor.
También se le controlará el ritmo cardiaco y se medirá el nivel de oxígeno en sangre a través de un aparato llamado pulsioxímetro, que se coloca en un dedo.
Tras estar sedado el paciente, se procederá a introducir el endoscopio a través de la boca. El ecoendoscopio lleva en la punta tanto un emisor de ultrasonidos como una cámara endoscópica, de esta forma el médico podrá alternar la visión a través de uno u otro sistema. Esto le permitirá al especialista valorar el interior de esófago, el estómago y el duodeno. Por otro lado, visualizará mediante el ecógrafo los órganos cercanos como pulmones, mediastino ( espacio medio de la caja torácica, entre las dos pleuras, la columna vertebral y el esternón ) y páncreas.
En el caso de una endoscopia baja, el proceso inicial es el mismo, pero procederán a introducir el endoscopio a través del ano, para visualizar el colon.
Se podrán visualizar órganos cercanos como próstata, páncreas e hígado mediante el ecógrafo además del intestino.
Complicaciones de una ecoendoscopia
Las complicaciones como sangrado, infección o pancreatitis son raras en una ecoendoscopia, se producen en menos de 1% de los casos y que no requieren ingreso salvo la pancreatitis( inflamación del páncreas).
Otras complicaciones más graves pueden ser la perforación , que se puede producir en cualquier órgano por el que se pase, esto es, esófago, estómago, duodeno o colon. Esta complicación es muy poco frecuente, sin embargo, es muy grave y puede dar lugar a que se tenga que realizar cirugía de urgencia para reparar el daño.
Si el paciente presenta vómitos de sangre, heces negras, dolor abdominal, dolor de pecho, o se encuentra con fiebre de más de 38, deberá de acudir al médico.
Resultados
Los resultados de la parte visual de una ecoendoscopia, entendiendo como tal la que capta la camara directamente, serán inmediatos, se puede ver una úlcera, una gastritis, esofagitis u otras alteraciones en la parte superficial de los órganos.
Si se toman biopsias o se retiran pólipos estos resultados estarán en el médico en aproximadamente 15 días .
Los resultados de la parte ecográfica se demorarán también unos quince días, ya que es normal que el médico que realice la prueba quiera valorar las imágenes con mayor profundidad, realizando el informe pertinente. Tras ello su médico decidirá si con esta prueba es suficiente o precisará de otras pruebas complementarias.
Preguntas frecuentes
¿Cuánto se tarda en hacer una endoscopia?
Si se trata de una endoscopia la duración será de aproximadamente entre 30 y 40 minutos . En algunos casos puede ser algo más larga dependiendo del número de biopsias que se puedan hacer.
¿Es dolorosa una ecoendoscopia?
La ecoendoscopia no es una prueba dolorosa, de todas formas, para evitar el dolor y sobre todo la molestia que supone , antes de realizarse este tipo de prueba procederán a sedar al paciente, esto evitará el dolor durante la misma. Tras la realización de la misma no se presenta dolor, si este ocurriera el paciente deberá ponerse en contacto con su médico.
¿Cuál es la diferencia entre una ecoendoscopia y una endoscopia?
Podemos definir la ecoendoscopia como una prueba doble que mezcla la ecografía y la endoscopia .
La realización de la prueba para el paciente será la misma: se introduce a través del ano o bien de la boca un endoscopio flexible, que lleva no solo la cámara de endoscopia sino también una sonda de ultrasonidos, por tanto el médico podrá ver directamente la mucosa (zona superficial del sistema digestivo) de la zona por donde pasa, y por la ecografía la profundidad de este órgano y los órganos adyacentes .
En la endoscopia el médico introduce también una sonda flexible , pero aquí solo va la cámara de endoscopia, que permite ver la superficie de la zona por donde está pasando, pero no ve los órganos adyacentes, ni la profundidad del tubo digestivo (esofago, estomago, duodeno, intestino delgado e intestino grueso).
¿Tengo que ir acompañado?
Sí, el paciente debe ir acompañado a la prueba. Tras la sedación puede encontrarse algo mareado y no deberá conducir hasta pasadas varias horas.
Contenido de salud
Periodoncia
Definición
La periodoncia es la rama de la medicina dental que se encarga de la prevención, diagnóstico y tratamiento de las enfermedades periodontales. Las enfermedades periodontales son aquellas que se producen por la acumulación de placa bacteriana en la cavidad bucal, lo que genera enfermedades como la gingivitis o el sarro en los dientes y encías.
Por tanto, la periodoncia se basa en la limpieza bucal, la promoción y educación en la salud dental del paciente.
¿Cómo es una periodoncia?
Si el paciente no ha realizado un correcto cuidado dental, la acumulación de sarro y placa bacteriana debajo de la encía genera la creación de bolsas periodontales, que pueden dañar la raíz y el hueso de los dientes, requiriendo por tanto de técnicas de periodoncia.
Estos síntomas generan, sobre todo, gingivitis y periodontitis, lo que generalmente requiere de un proceso periodontal dividido en dos fases. La primera consiste en raspar y alisar la raíz del diente para eliminar las bolsas periodontales junto con la placa bacteriana y el sarro. La segunda fase es una intervención quirúrgica, llamada curetaje, que consiste en lo mismo, pero a rasgos más internos de las encías y dientes.
Si las enfermedades bucales que presenta el paciente están demasiado avanzadas, la periodoncia puede requerir de cirugía periodontal más avanzada para solventar el problema, e incluso en algunos casos cirugía regenerativa para crear nuevamente el hueso del diente dañado.
¿Para quién está indicada?
Es recomendable que los pacientes que padecen sangrado de encías, movilidad en los dientes, halitosis (mal aliento), dientes más largos o retracción de las encías, acudan a revisiones periodontales ante la posibilidad de necesitar iniciar un tratamiento.
Las personas fumadoras o diabéticas también deben acudir a revisarse los dientes para prevenir la periodontitis. Además, el desarrollo de enfermedades periodontales también está relacionada con la genética, por lo que se recomienda a aquellos pacientes con antecedentes de enfermedades periodontales acudir a las revisiones.
¿Por qué se realiza?
Las enfermedades periodontales acaban ocasionando la pérdida de los dientes del paciente, por ello, es importante acudir frecuentemente a las revisiones y realizar la periodoncia en caso necesario, ya que esto aumenta la probabilidad de que el paciente no los pierda.
Además, el paciente notará una mejoría en su salud bucal reduciendo tanto el sangrado de encías como la movilidad dental y la halitosis.
Riesgos de una periodoncia
Los tratamientos periodontales son intervenciones sencillas que no presentan riesgos ni complicaciones en su realización.
Además, se aplica anestesia local al paciente para que no tenga molestias ni dolor durante su realización.
Preparación
Al ser un procedimiento sencillo el paciente no necesita una preparación exhaustiva para la periodoncia, simplemente acudir a la hora citada con los dientes cepillados, y tener en cuenta que las horas próximas serán molestas.
Si el médico le indicó alguna medicación previa debe haberla seguido e indicar la alergia a posibles medicamentos o anestesia.
Cómo es la recuperación de una periodoncia
En función del tratamiento aplicado y el estado del paciente así será su recuperación.
Generalmente, las horas siguientes a la periodoncia, cuando se pase el efecto de la anestesia, el paciente empezará a notar molestias y dolores, que pueden durar hasta dos o tres días.
Este tratamiento no presenta alteraciones en la vida diaria del paciente, pero sí deberá cepillarse los dientes con mayor suavidad los días posteriores al raspado de las encías y dientes. Además, podrá presentar un sangrado bucal posterior debido al tratamiento.
En caso de que el médico se lo haya indicado, el paciente debe seguir el tratamiento con medicamentos, y es recomendable no fumar hasta las 48 horas siguientes.
Resultados
Si la primera fase del tratamiento de la periodoncia se completa con éxito, el paciente conseguirá restablecer su salud bucal, reduciendo los sangrados y la movilidad de los dientes. Además, en caso de halitosis, se reducirá el mal aliento.
Tras el tratamiento, el paciente debe establecer un cuadro de revisiones periodontales para mantener el cuidado de la boca.
En caso de que el tratamiento no finalice con éxito, se iniciará la segunda fase, que requiere de una intervención quirúrgica mediante el curetaje para un rasgado más profundo.
Se pueden repetir las fases tras cinco meses aproximadamente si fuera necesario.
Preguntas frecuentes
¿Cuánto cuesta una periodoncia?
Aproximadamente el precio de periodoncia por cuadrante es de unos 80€. Teniendo en cuenta que la boca se divide en 4 cuadrantes saldría el tratamiento periodontal completo a unos 320€.
¿Es dolorosa una periodoncia?
No. El tratamiento se realiza con anestesia local y por tanto es indoloro para el paciente.
¿Cuánto se tarda en hacer una periodoncia?
El tratamiento se realiza en unas dos sesiones, en función de los cuadrantes que se deban tratar.
Cada sesión tiene una duración aproximada de dos horas.
¿Es lo mismo que un curetaje?
No. El curetaje es la segunda fase de la periodoncia, que consiste en una intervención quirúrgica para eliminar el sarro de la parte interna de la cavidad bucal y también elimina tejido blanco. Solo se realiza en los pacientes que tras la primera fase del tratamiento lo necesitasen.
La primera fase consiste en el raspado y alisado de los dientes sin intervención quirúrgica.
Contenido de salud
Sonda Nasogástrica
Actualizado el 29-06-2022
El estado nutricional es un aspecto esencial relacionado con la salud de las personas que se ve comprometido cuando no hay una buena alimentación. La colocación de una sonda nasogástrica es un método para poder alimentar a aquellos individuos con pérdidas prolongadas de apetito o problemas para deglutir la comida, cuando no se puede lograr la ingesta adecuada de alimentos y agua por la vía oral. Con este método se evita la desnutrición y deshidratación.
¿Qué es una sonda nasogástrica?
Se trata de una sonda especial que lleva alimentos y medicamentos al estómago a través de la nariz. Además de alimentar, la colocación de una sonda nasogástrica tiene otras indicaciones:
Aspiración de secreciones gastroduodenales en caso de dificultad en el vaciamiento del estómago o fallo en el transito intestinal.
Lavado de estómago, para estudio o eliminación del contenido gástrico (como sustancias tóxicas o sangre en caso de hemorragias).
Prevención de broncoaspiración en enfermos con bajo nivel de conciencia o problemas de deglución.
Tipos de sondas nasogástricas
Existen diversos tipos de sonda nasogástricas. Los más utilizados incluyen:
La sonda de Levin . Es una sonda de polivinilo de una sola luz, con un extremo distal que termina en punta roma con orificio concéntrico y con 4 perforaciones a diferentes niveles. Puede permanecer máximo de 7 a 10 días. Son usadas para alimentación, infusión de medicamentos, aspiración de contenido intestinal y en hemorragias gástricas.
La sonda gástrica de Salem . Está hecha de PVC atóxico, apirógeno, termosensible y ligeramente siliconado. Presenta una doble vía de entrada. Una para aire y otra para drenaje y extraer el contenido gástrico con la ayuda de un aspirador. Se usan por corto tiempo, tanto para alimentar como aspirar contenido gástrico.
La sonda Freka . Es de poliuretano transparente, flexible y resistente con calibre reducido y se puede utilizar por un tiempo más prolongado (hasta 8 semanas).
¿Cómo se coloca una sonda nasogástrica?
Antes de colocar la sonda, se debe explicar la maniobra al paciente, ya que se necesita de su colaboración. Se trata de un procedimiento no doloroso, aunque puede llegar a molestar.
El paciente debe colocarse en una posición adecuada −conocida como posición de Fowler − la cual consiste en estar semisentado en la cama para relajar la musculatura abdominal y facilitar la entrada de la sonda.
Para saber la longitud de la sonda que se necesita, se suma la distancia desde la nariz al lóbulo de la oreja, y desde este hasta el final del esternón. Para un adulto, la longitud habitual es de unos 50 cm.
Se aplica lubricante en los últimos 15 cm de la sonda y se introduce por una de las fosas nasales, en la más permeable, con el paciente colocado en la posición de Fowler. Se Introduce la sonda horizontalmente, para evitar que tropiece con los cornetes. Se va empujando la sonda poco a poco, mientras el paciente realiza la maniobra de tragar.
Cuando se llega a la longitud medida anteriormente se detiene la introducción de la sonda y se comprueba si está bien colocada, insuflando 50 cc de aire al estómago con una jeringuilla, que es detectado con la ayuda de un fonendoscopio, escuchándose un sonido de borboteo característico en el abdomen.
Se puede aspirar el contenido gástrico una vez confirmada la posición y deberá fijarse a la nariz con un esparadrapo.
Cuidados de la alimentación por sonda
Es importante aprender a cuidar de la sonda y de la piel alrededor de la nariz para evitar la irritación.
Es importante tener en cuenta algunas recomendaciones:
Lavar las manos con agua y jabón y limpiar la sonda solo con agua tibia permitirá prevenir posibles complicaciones.
Al momento de recibir el alimento o medicamento, el paciente debe estar semi sentado, a unos 30 o 45 grados de inclinación. Puede ayudarse con almohadas o cojines.
Para evitar malestar estomacal en el paciente es importante regular la velocidad con la que el alimento pasa a través de la sonda.
Si la sonda se obstruye, se debe pasar agua tibia (50 ml aproximadamente) con una jeringa, a través de ella.
Los alimentos deben ser suministrados a temperatura ambiente.
Para cuidar de la piel alrededor de la nariz se debe limpiar la piel alrededor de la sonda con agua caliente y una toalla limpia después de cada alimentación. Se deben retirar con cuidado costras o secreciones de la nariz.
Complicaciones de la sonda nasogástrica
Una de las complicaciones más frecuentes es una mala introducción de la sonda que acabe con ella en el aparato respiratorio. En estos casos habrá que reintroducirla correctamente. Esta circunstancia se puede dar en pacientes con estado neurológico comprometido y reflejo de tos disminuido.
En los pacientes que mantienen la sonda nasogástrica por un largo periodo de tiempo pueden presentarse obstrucciones y necesitar de servicios de enfermería a domicilio .
Otras complicaciones incluyen:
Al introducir la sonda por primera vez se pueden dar arcadas, náuseas o vómitos.
Sangrado de la nariz al roce con la sonda.
Movilización de la sonda y salida del estómago.
Menos frecuentemente se pueden dar lesiones, perforaciones y ulceraciones en el tracto laringo-esofágico y la broncoaspiración.
Preguntas frecuentes
¿Cuánto tiempo se puede tener una sonda nasogástrica?
El uso de sonda nasogástrica tiene una duración prevista menor de 4-6 semanas. Si la necesidad de nutrición enteral va a ser superior a este plazo, se recomiendan el recambio de la sonda o realizar otros métodos de alimentación como una enterostomía.
¿Qué tipos de alimentación se dispensan por sonda nasogástrica?
La alimentación por sonda nasogástrica puede ser natural o enteral:
Alimentación natural . A través de la sonda nasogástrica se suministra alimentación en forma de purés o líquidos naturales, en personas que tienen dificultades para deglutir.
Alimentación enteral . Se utiliza en personas con necesidades especiales de alimentación y suplementación farmacológica con una composición estandarizada de diferentes nutrientes, especialmente compuestos proteicos. Suele darse en personas que tienen problemas de deglución y que además necesitan un aporte calórico y nutricional.
¿Cómo se llama la sonda que va por la boca?
Las sondas que se introducen a través de la boca son conocidas como sondas bucogástricas o gástricas. Son poco utilizadas y están indicados cuando no es posible utilizar una sonda nasogástrica por la existencia de lesiones nasales o lesiones en la base del cráneo.

Contenido de salud
Endoscopia Traumatológica
Definición
La endoscopia traumatológica es un método de visualización de cualquier espacio fuera de la articulación .
Se trata de una técnica mínimamente invasiva que permite introducir el instrumental médico necesario, el endoscopio que es un tubo largo y flexible con una cámara en un extremo que se proyecta en una pantalla.
Tipos de endoscopias traumatológicas
La endoscopia de traumatología es una única técnica de visualización no de una articulación como tal, sino de sus zonas externas como vainas tendinosas (estructura que recubre a los tendones) y bursas (bolsa que contienen líquido sinovial).
La endoscopia se puede realizar según la zona a tratar:
Hombro : se pueden realizar del espacio subacromial (este espacio se sitúa entre la escápula y la cabeza del húmero), la bursa de esta articulación o las tendinitis del bicipital (inflamación del tendón del bíceps).
Codo : podemos tratar tanto las bursas como el canal del nervio cubital o radial (lugar donde se sitúan los nervios cubital y radial).
Caderas : bursitis (inflamación de la bursa) y síndrome del piramidal (adormecimiento de los glúteos por pinzamiento del nervio ciático) será lo más común en este tipo de cirugía endoscópica.
Tobillos : bursas y cirugía de peroneos.
Columna : se está operando por este método las fibrosis que se producen sobre cirugías antiguas de hernias discales.
Preparación
La preparación para una endoscopia traumatológica requiere que el paciente sea valorado por un anestesista, para ello será necesario un electrocardiograma y una analítica. El paciente indicará al médico si toma alguna medicación que esté contraindicada como los antiinflamatorios y anticoagulantes .
El paciente se tumbará en la camilla, se le administrará anestesia local, en algunos casos se requiere sedación, y se desinfectará la zona a tratar con antisépticos. Después se realizarán unas incisiones por donde se introducirá el endoscopio.
El paciente debe acudir siempre acompañado y en ayunas.
Cómo se realiza la endoscopia traumatológica
La endoscopia de traumatología se realiza de dos maneras:
Cirugía artroscópica: a través de una pequeña incisión se introduce el endoscopio, el médico visualiza de manera nítida el interior de la articulación e identifica si hay lesiones y si es preciso realizar otras incisiones por donde introducir el material necesario para su reparación (suero, pinzas, bisturí, suturas o suero fisiológico )
Cirugía de mínimo abordaje: a través de varias incisiones se realizan intervenciones óseas o de partes blandas.
Complicaciones de la endoscopia traumatológica
Las complicaciones más frecuentes de una endoscopia de traumatología son hematomas (moretones) o hemorragias, infecciones en las heridas quirúrgicas y molestias postoperatorias. Ante cualquier síntoma, el paciente debe acudir a su médico para poner tratamiento.
Resultados
En general los resultados de una endoscopia tramatológica suelen ser satisfactorios.
Al ser una cirugía poco invasiva la recuperación es más rápida , con lo cual el periodo de recuperación será mucho menor y, por tanto, la incorporación a la vida normal tardará menos en realizarse.
Siempre hay que tener en cuenta que, dependiendo de la zona intervenida la recuperación será más o menos lenta.
Preguntas frecuentes
¿En qué se diferencia una endoscopia de traumatología de una endoscopia normal?
El principio de una endoscopia de traumatalogía y una endoscopia normal es el mismo: introducir una cámara endoscópica en el interior de una cavidad del cuerpo y proceder a visualizar la patología que en ella exista, operar si es necesario, o tomar muestras de tejidos que se puedan analizar.
En las endoscopias digestivas, el tubo se introduce a través del esófago hasta el estómago si es una endoscopia alta, o a través del ano hasta el colon si es una endoscopia baja (en estos casos no son necesarias las incisiones).
En caso de endoscopias abdominales, para valorar vesícula, hígado o bien el útero y los ovarios, será necesario hacer pequeñas incisiones para introducir el endoscopio y el material quirúrgico.
¿Es dolorosa?
La endoscopia no es dolorosa o, mejor dicho, lo es mínimamente. De todas formas, siempre se procede a poner anestesia local en las zonas de las incisiones, puede ponerse también anestesia regional en una zona más amplia, si el cirujano considera que por el tipo de intervención el proceso va a ser más doloroso o incómodo, se procederá a sedar al paciente durante el tiempo de la cirugía.
El dolor postoperatorio dependerá de la zona tratada y de lo grande que sea la lesión, pero en general el dolor se controla bien con analgésicos habituales.
¿Requiere pre y post operatorio?
En general, la endoscopia traumatológica sí requiere un estudio preoperatorio con analítica, electrocardiograma y valoración por un anestesista, ya que en algunos casos, como en el de la cirugía de columna, se procederá a anestesiar de forma general al paciente, y en otras se procederá a darle anestesia local con sedación. En ambos casos es necesario este estudio, que también nos permitirá valorar si la coagulación es correcta, y minimizar los riesgos de sangrado operatorio.
Respecto al postoperatorio, este dependerá de la intervención que se ha realizado y la zona en la cual se realiza la cirugía. En general el paciente se podrá ir a casa en las primeras doce horas si se ha aplicado anestesia local con sedación, y en las primeras 24 horas si el paciente es sometido a anestesia general.
La recuperación articular dependerá de la intervención realizada, en general se recomienda unos días de reposo articular, que pueden oscilar entre una semana y quince días, pudiéndose extender algo más si la cirugía es más compleja.
¿ Debo de ir acompañado/a?
El paciente siempre debe ir acompañado cuando se vaya a someter a un proceso endoscópico, a pesar de que le den de alta en las primeras 12 horas, ya que cuando salga de la clínica se puede encontrar algo mareado o tener dificultades para moverse, y no deberá conducir en ningún caso.
Contenido de salud
Transplante de Córnea
Definición
El trasplante de córnea es una intervención quirúrgica que consiste en sustituir la córnea dañada del paciente por otra sana del banco de donantes.
La córnea es la lente transparente del ojo que se encuentra en la parte más externa en la zona delantera del globo ocular.
El trasplante de córnea es uno de los más habituales, y suele denominarse bajo el nombre de queratoplastia.
¿Cómo es un trasplante de córnea?
Ante la posibilidad de que la córnea del paciente esté dañada, bien por hinchazón o porque han aparecido cicatrices, esta deja de cumplir su funcionalidad, provocando en el paciente la visión borrosa.
Cuando esto ocurre, se debe realizar un trasplante de córnea, el cual se realiza a través de las instituciones oficiales o bancos de ojos, proviniendo el tejido de un donante fallecido.
La córnea que se va a trasplantar es sometida a diferentes análisis para comprobar su estado y compatibilidad con el paciente, la cual puede conservarse sin sufrir deterioro hasta 15 días.
Como primer paso al paciente se le administra anestesia local para evitar el dolor, después se extraerá una pequeña parte de la córnea dañada, y se sustituirá con el nuevo tejido de la córnea donada, sustituyendo las capas.
¿Para quién está indicado?
El trasplante de córnea es una intervención quirúrgica que se indica en aquellos pacientes que tienen dañada la visión y no pueden corregir su alteración con otros procesos, y/o cuando la inflamación muscular del globo ocular no desaparece con medicamentos o el uso de gafas especiales.
Se realiza sobre todo si la córnea está abultada en su curvatura y/o presenta cicatrices.
¿Por qué se realiza?
Cuando el paciente tiene una visión borrosa debido a la inflamación o cicatrices que presenta la córnea, y no se consigue corregir con gafas ni otros procedimientos, se realiza el trasplante de córnea para recuperar la visión normal.
Riesgos de un trasplante de córnea
Al ser un trasplante, este tipo de intervención quirúrgica está sometida a la existencia de un posible rechazo inmunológico. También se puede dar una pérdida de visión y sensibilidad a la luz.
Además, tras el trasplante pueden aparecer síntomas menos leves como la inflamación, infección, dolor, molestias y sangrado.
En relación con la anestesia, suele ser local, por lo que el riesgo en este ámbito se disminuye .
Preparación
Antes de la realización del trasplante, el médico analizará las características de la córnea dañada del paciente para sustituirla por una similar y reducir el riesgo de rechazo.
La preparación está condicionada a la disponibilidad de córneas de donantes, por lo que el proceso de espera puede ser más o menos largo.
Normalmente no requiere ingreso nocturno.
Cómo es la recuperación de un trasplante de córnea
Tras el trasplante, el paciente deberá permanecer unas horas en observación, siendo muy rara la ocasión en la que deba quedarse ingresado.
Los días posteriores deberá seguir las indicaciones de su médico, siendo las más comunes:
Aplicar medicamentos en formato de gotas en los ojos y por vía oral.
Tapar el ojo con una gasa y gafas solares.
No frotar el ojo trasplantado.
Retomar poco a poco las actividades del día a día que puedan dañar el ojo.
Posteriormente deberá fijar revisiones oftalmológicas periódicas.
Resultados
Tras el trasplante, el ojo permanece hinchado unos días, por lo que habrá que esperar a que se reduzca la inflamación y el ojo se acostumbre a la nueva córnea para poder comprobar los resultados. Este periodo de tiempo puede abarcar desde varios días hasta unos meses.
En caso positivo, el paciente recuperará la visión perdiendo el carácter borroso, requiriendo en algunos casos un ajuste posterior ante la posible necesidad de tener que usar lentes de contacto.
En caso negativo, el organismo del paciente rechazará el implante, provocando la pérdida de la visión o requiriendo un nuevo trasplante.
Preguntas frecuentes
¿Puede existir rechazo ante un trasplante de córnea?
Sí. Aunque la probabilidad es pequeña, puede darse un rechazo a la córnea trasplantada. A medida que pasa el tiempo la probabilidad de rechazo disminuye.
No obstante, el rechazo se puede presentar de forma inesperada en cualquier momento.
¿Cuánto cuesta un trasplante de córnea?
El trasplante de córnea varía de precio. Si se realiza por la seguridad social o lo cubre el seguro médico privado del paciente, no tiene gastos.
En caso contrario, variará el precio según la clínica, rondando los 4.500 €.
¿Recuperaré mi visión total tras un trasplante de córnea?
El proceso de recuperación de la vista tras el trasplante de córnea es distinto en cada paciente, en función de su organismo y del motivo de trasplante.
Es un proceso de recuperación lento, que en la mayoría de los casos aporta un resultado positivo, superando el 50% de recuperación de visibilidad. Por lo que la visión total se podrá recuperar según el caso de cada paciente.
¿Cuánto dura un trasplante de córnea?
El trasplante de córnea dura entre media hora y una hora y media .
¿Es doloroso el trasplante de córnea?
El trasplante de córnea se realiza con anestesia local, por lo que durante la intervención el paciente no siente dolor. Sin embargo, tras ella el paciente puede tener molestias.
Contenido de salud
Tratamiento de Cáncer de Mama
Definición
El tratamiento del cáncer de mama consiste en la aplicación de una serie de procedimientos con el fin de curar la enfermedad, reducir el tamaño del tumor y disminuir los síntomas, aumentando con ello la esperanza y calidad de vida de la paciente.
¿Cómo es el tratamiento del cáncer de mama?
Los tratamientos que se pueden aplicar son:
Cirugía: según la afectación por el tumor que tenga la paciente, se puede realizar la extirpación del tumor (lumpectomía o mastectomía parcial), o la resección de la mama completa (mastectomía), que puede ir acompañada de la extirpación de los ganglios linfáticos axilares (estaciones en forma nodular del sistema de defensa del cuerpo), cuando están afectados por el tumor.
Quimioterapia: se utiliza de forma neoadyuvante, es decir, administrada previamente a la cirugía con el fin de disminuir el tamaño del tumor, o de forma adyuvante, tras la cirugía, lo que reduce el riesgo de reaparición del tumor.
Radioterapia: se aplica en la mayoría de los casos tras la cirugía, ya que reduce y retrasa de manera significativa la recurrencia del cáncer de mama y la mortalidad por él. También se puede usar para tratar el dolor que producen las metástasis óseas (la metástasis es el crecimiento de tumor en otros sitios del organismo, en este caso en el hueso), o como tratamiento paliativo (no curativo), para disminuir los síntomas que produce la extensión del tumor (por ejemplo, la compresión de la médula espinal cuando hay metástasis en las vértebras).
Hormonoterapia: se trata de la administración de fármacos por vía oral o vía intramuscular que actúan modificando la acción de hormonas (sustancias químicas que ejercen su acción sobre las células modificando su conducta, influyendo en su crecimiento o en el metabolismo). Para que estos fármacos puedan hacer su efecto, las células tumorales deben tener receptores hormonales. Se puede utilizar este tipo de tratamiento antes de la cirugía (de forma neoadyuvante), para reducir el tamaño del tumor, durante 3-6 meses, o tras la cirugía o radioterapia (adyuvante), administrándolo entre 5-10 años.
Anticuerpos monoclonales: sustancias químicas que se unen selectivamente sobre las células del tumor, que presentan unos receptores específicos en su exterior (HER2) para su destrucción.
¿Para quién está indicado?
La indicación de la combinación y pautas de aplicación de los distintos tratamientos viene dada por la extensión que tenga el tumor, sus características y la afectación de distintas partes del organismo por él. Según el estudio diagnóstico de esa extensión, se realiza una clasificación llamada TNM (hace referencia a Tumor, Nódulos, Metástasis).
En general, en fases muy precoces del cáncer de mama, está indicada la cirugía con radioterapia y, si el tumor tiene receptores hormonales, hormonoterapia.
En fases algo más avanzadas pero todavía tempranas, se realiza también cirugía (mastectomía), acompañada frecuentemente de la extirpación de los ganglios linfáticos. La quimioterapia se administra antes de la cirugía en tumores de mayor tamaño y después de la cirugía casi siempre. Después de la quimioterapia, se aplicará hormonoterapia o anticuerpos monoclonales, según el tipo de tumor.
En los estadíos avanzados de la enfermedad, se trata con hormonoterapia y anticuerpos monoclonales, según las características del tumor, más quimioterapia. Se administrará radioterapia paliativa en casos de metástasis óseas.
¿Por qué se realiza?
Los distintos protocolos de tratamiento que existen, y a los que se someten las pacientes según el grado de afectación del organismo por el tumor, se aplican con un fin curativo, siempre que sea posible, o paliativo, cuando no se puede conseguir la eliminación completa del tumor, pero se intenta disminuir su progresión y aliviar los síntomas.
Riesgos del tratamiento de cáncer de mama:
Los riesgos del tratamiento del cáncer de mama son los específicos de la aplicación de cada procedimiento (operación del cáncer de mama o mastectomía, quimioterapia, radioterapia…etc).
A parte de los distintos riesgos más concretos de cada técnica, vale la pena resaltar dos consecuencias o efectos secundarios importantes que pueden padecer las pacientes. Por un lado, la necesidad, si así lo desean, de realizarse una reconstrucción mamaria después de la extirpación de parte o todo su seno. Y por otro, la posible aparición, si se han extirpado los ganglios linfáticos de la axila, de un linfedema (acumulación de líquido en los tejidos blandos) en el brazo.
Preparación
Para cada tipo de terapia hay un manera diferente de preparación. El médico explica antes de su aplicación, todos los términos de preparación para cada tratamiento.
Un requerimiento común para todos los procedimientos es que la paciente debe firmar un consentimiento informado en el que se le explica el tratamiento, sus riesgos y alternativas.
Igualmente, la paciente debe informar al médico de si padece alguna otra enfermedad, la posibilidad de padecer alergias a medicamentos, o si toma fármacos de forma crónica. Debe comunicar también si es portador de marcapasos o de alguna prótesis.
Antes de la cirugía, el médico anestesista evalúa a la paciente y se le realiza un estudio preanestésico con radiografía de tórax, analítica de sangre y electrocardiograma.
La paciente debe mantener un ayuno de 8 horas antes de la intervención, y no debe portar elementos metálicos para la realización de la cirugía o aplicación de radioterapia.
Antes de la administración de la quimioterapia, se le realiza a la paciente una analítica de sangre para valorar cómos están sus defensas o si tiene anemia.
Cómo es la recuperación del tratamiento de cáncer de mama
Durante el tratamiento y después de él las pacientes pueden sufrir cambios tanto en su imagen corporal como en su estilo de vida en todos los niveles (laboral, de pareja…etc.). Dentro de la recuperación, tras el tratamiento del cáncer de mama, han de tenerse en cuenta estas secuelas físicas y también psicológicas producidas en las pacientes.
Por ello, en el periodo de recuperación se considera la aplicación de tratamientos fisioterápicos para la recuperación física, así como estéticos como la reconstrucción mamaria. A nivel psicológico es importante que la paciente realice un seguimiento con profesionales durante todo el proceso si así lo precisa.
Resultados
El médico oncólogo realiza el seguimiento y ve la evolución y éxito del tratamiento aplicado. Para ello se le realizan a la paciente pruebas de imagen diagnósticas de forma periódica y, en ocasiones, análisis de sangre con determinación de marcadores tumorales (sustancias que aumentan en la sangre en presencia del tumor).
En general, después del finalizar el tratamiento, se realizan controles cada 6-12 meses durante 5 años y a continuación anualmente. La paciente se hace una mamografía cada 12 meses, o cada 6-12 meses post radioterapia, si se conserva la mama. Durante 5 años tras el tratamiento, las mujeres de 50 años o mayores continúan realizándose las mamografías que se efectúan dentro del programa de cribado, o diagnóstico precoz del cáncer de mama, llevado a cabo por las comunidades autónomas. Las mujeres de edad inferior a 50 años continúan con mamografía anual hasta su inclusión en el programa de cribado.
Preguntas frecuentes
¿Cuáles son las causas o factores que pueden favorecer el cáncer de mama?
En el 80% de los casos no se identifica un factor causal aparente, se cree que tiene un origen multifactorial. Hay una serie de factores de riesgo identificados como:
Sexo femenino, mayor de 50 años y raza blanca.
Tener familiares de primer grado con cáncer de mama.
Presentar alteraciones en los genes específicas (mutaciones).
Tener antecedentes personales de patología mamaria.
Radiación (con rayos X) previa de la mama.
Factores hormonales y reproductivos (tener la menstruación en edad temprana, la menopausia tardía, no tener hijos…etc.).
Factores dietéticos: obesidad, dieta rica en grasas, alcohol.
¿Cómo se detecta el cáncer de mama?
El cáncer de mama se detecta mediante la realización de:
Exploración física: palpación de masas sospechosas en las mamas o en la región axilar que indique la conveniencia de realizar pruebas de imagen.
Mamografía: detecta masas sospechosas con forma irregular, microcalcificaciones y alteración de la densidad mamaria.
Ecografía mamaria: se usa como prueba de imagen complementaria a la mamografía, para diferenciar las lesiones sólidas y quísticas (con contenido líquido).
Resonancia magnética mamaria: usado para valorar posibles recurrencias del tumor tras el tratamiento con cirugía.
Biopsia: estudio en laboratorio de anatomía patológica de un fragmento de tejido tumoral para la determinación de sus alteraciones y el tipo de tumor.
Analítica con marcadores tumorales (sustancias que aumentan en la sangre en presencia del tumor) CEA y CA 15.3.
¿Cómo es el marcador tumoral para el cáncer de mama?
Los marcadores tumorales (sustancias que aumentan de forma específica si se desarrolla un tumor), que se determinan en una analítica de sangre para la ayuda en el diagnóstico y control después del tratamiento de un cáncer de mama, son el CEA y CA 15.3.
¿Cómo se puede prevenir el cáncer de mama?
El cáncer no se puede prevenir pero sí se puede influir en los factores que pueden aumentar el riesgo de desarrollar un cáncer de mama a lo largo de la vida como:
Evitar el tratamiento hormonal sustitutivo tras la menopausia.
Si se tienen familiares afectados por cáncer de mama, someterse un consejo genético con el estudio de la posible presencia de mutaciones (alteraciones) en algunos genes, como los BRCA-1 y BRCA-2, relacionados con el cáncer de mama.
Si se tienen esas alteraciones genéticas, realizar los controles diagnósticos de imagen y en algunos casos, tratamientos preventivos como la mastectomía (extirpación de los senos).
Realizar ejercicio y una dieta sana y variada pobre en grasas.
Evitar el alcohol y el tabaco.
 Savia
Savia