Otros contenidos

Contenido de salud
Cultivo de Esputo
Definición
El cultivo de esputo (líquido espeso que se produce en el árbol respiratorio cuando existe infección) es una prueba utilizada para detectar la presencia de microbios que pueden causar una infección en el aparato respiratorio . Pare ello se deja reaccionar el esputo con un medio apropiado para que se desarrollen las bacterias y hongos llamado caldo de cultivo.
Tipos de cultivos de esputo y examen en fresco
El cultivo es una prueba diagnóstica de laboratorio en la que se deposita el esputo en diferentes caldos de cultivo y observar el crecimiento de microbios. Previamente a cultivar el esputo se suele realizar una tinción de gram (sustancia que tiñe algunas bacterias) que permite ver dos tipos de bacterias: gram positivas las que se tiñen y gram negativas las que no; también se puede hacer una tinción especial para las bacterias que producen tuberculosis, lo que permitirá orientar el cultivo y hacer tratamientos más precoces .
Preparación
La preparación para el cultivo de esputo es sencilla pero tiene algunas consideraciones importantes:
La muestra debe de ser de primera hora de la mañana.
Se debe entregar en el laboratorio antes de pasadas dos horas de su recogida.
Se recogerá en un bote estéril.
Es conveniente enjuagarse la boca con agua previamente para evitar la contaminación con las bacterias que pueden estar en la misma.
Para conseguir el esputo se debe toser fuerte, ya que es necesario que salga el producto de desecho de los bronquios y no de la faringe, donde puede haber restos de saliva.
En aquellos casos en que la producción de esputo es muy pequeña se puede estimular su obtención mediante un aerosol con suero hipertónico, que le ayudará a provocar la tos; en algunos casos el técnico le puede dar una serie de palmadas en la espalda para conseguir arrancar el esputo de los bronquios.
Cómo se realiza un cultivo de esputo
Una vez que el paciente entrega el esputo en el laboratorio se divide. Una pequeña parte se examina en fresco, esto permite ver si es de buena calidad, no presenta saliva que enmascare el estudio por la multitud de gérmenes que hay en la cavidad bucal, y que no tienen por qué producir enfermedades pulmonares .
Tras validar la muestra se procede a teñir el esputo con sustancias especiales que nos permitirán clasificar las bacterias y ponerlas en el caldo de cultivo adecuado.
En caso de reconocerse el bacilo de la tuberculosis (agente causante de la tuberculosis) permitirá comenzar con un tratamiento adecuado, ya que en estos casos es muy importante empezar con el mismo de forma precoz.
Una vez se tiñen las bacterias se colocará el esputo en un caldo de cultivo (es una sustancia que permite crecer de forma rápida a las bacterias) y eso permitirá que crezcan y poder identificarlas en el laboratorio.
Complicaciones de un cultivo de esputo
En principio un cultivo de esputo no presenta ninguna complicación en su realización, puede ser difícil de conseguir la muestra y, como en toda prueba de laboratorio, pueden dar un porcentaje de falsos positivos, por contaminación en la extracción si la muestra tardó mucho tiempo en procesarse, o falsos negativos por la misma causa .
Resultados
Los reultados pueden demorarse durante un tiempo según el ritmo de crecimiento de los microorganismos en el cultivo. En el caso de la tuberculosis son hasta cuatro semanas, al ser bacilos de crecimiento lento.
En bacterias como neumococo y haemophilus los resultados están en unos quince días.
Preguntas frecuentes
¿Qué es la prueba de BK?
La prueba de BK es la búsqueda del bacilo de KOCH, o bacilo tuberculoso en el esputo. Este se hace mediante una tinción especial con ácido-alcohol que colorea de forma muy intensa de color rojo brillante los bacilos de la tuberculosis .
Esta prueba va a permitir iniciar de forma precoz el tratamiento de la tuberculosis, aunque después se realice un cultivo para tratar de identificarlo y conocer la sensibilidad específica del bacilo a los antibióticos
¿Qué es Baar de esputo?
El BAAR de esputo es la tinción para los Bacilos Ácido Alcohol Resistentes, de ahí sale el acrónimo, y se hace por ser una característica típica de las células tuberculosas que por su recubrimiento de lípidos (moléculas grasas) en su pared son resistentes a la decoloración con ácido alcohol. Se añade otra sustancia después, que colorea estas células de color rojo intenso, en tanto que el resto aparecen decoloradas de un color azul pálido, para permitir reconocer de forma rápida y eficaz las bacterias tuberculosas en la muestra.
¿Qué es la baciloscopia y cómo se realiza?
La baciloscopia es la observación del bacilo de Koch o bacilo tuberculoso en la muestra directa. Puede ser de esputo si se sospecha de una tuberculosis pulmonar, también puede ser orina si se sospecha de una tuberculosis renal, o incluso pus si sospecha de un absceso tuberculoso .
El problema de esta prueba es que puede dar negativa a pesar de haber infección si no conseguimos coger bacterias en la muestra, por eso se suele pedir tres muestras de días diferentes, y también se hará cultivo posterior de la muestra en un medio adecuado.
¿Qué es el esputo de la tuberculosis?
El esputo en la tuberculosis es la secreción, a modo de flema , que se produce en los pulmones de las personas que presentan tuberculosis.
Está compuesta por un material de aspecto mucoso que se produce en los bronquios como defensa ante la enfermedad que el paciente está sufriendo .
¿Qué significa la palabra esputo?
La palabra esputo se refiere de forma más técnica a la flema que se produce por un proceso infeccioso pulmonar . Está compuesta por un material mucoso que se produce en los bronquios como sistema de defensa ante la presencia de bacterias y que el organismo intenta eliminar a través de la tos.

Contenido de salud
Vacuna Pentavalente
Definición
La vacuna pentavalente, también llamada quíntuple, es una vacuna combinada que protege al paciente ante 5 enfermedades:
Tosferina : enfermedad grave en las vías respiratorias y muy contagiosa.
Difteria : infección grave producida por una bacteria que afecta a la nariz y garganta.
Tétanos : enfermedad bacteriana que afecta al sistema nervioso central y entra en el organismo por heridas o cortes en el cuerpo.
Haemophilus influenzae del tipo B : esta bacteria ocasiona diferentes enfermedades, desde problemas cutáneos hasta infecciones graves como la meningitis.
Hepatitis B : infección vírica que afecta al hígado y se transmite por fluidos corporales o por la sangre de las personas infectadas.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
¿Cómo es la vacuna pentavalente?
La vacuna pentavalente combina cinco antígenos, de manera que se inyectan en el organismo del paciente los gérmenes muertos de la tosferina, difteria y tétanos, y la cápsula específica del germen de la hepatitis B y la del Haemophilus influenzae de tipo b.
Consta de 3 dosis, que se deben aplicar al niño en los primeros meses de vida, a los 2, 4 y 6 meses, pasando un periodo de tiempo mínimo de 8 semanas entre cada dosis.
Las dosis de la vacuna son una combinación de la vacuna tetravalente (difteria, tétanos, tosferina y hepatitis B) y la vacuna Haemophilus influenzae tipo b.
Se aplica por vía intramuscular profunda, y se puede administrar de manera simultánea con otras vacunas , pero aplicándolas en zonas del cuerpo diferentes.
¿Para quién está indicada?
La vacuna pentavalente debe administrarse en niños desde los dos meses hasta los 7 años, siendo recomendable administrársela entre los 2 y los 6 primeros meses de vida, con un espacio de 8 semanas entre las 3 dosis .
¿Por qué se administra?
Mediante la vacuna pentavalente el paciente adquiere los anticuerpos necesarios para quedar inmunizado ante estas enfermedades.
Por lo que se recomienda que el paciente complete las 3 dosis en la infancia y el recuerdo cada 10 años de la vacuna contra el tétanos (Td).
Riesgos de la vacuna pentavalente
La vacuna pentavalente puede provocar efectos secundarios en la zona local donde se aplica la inyección , inflamándose o con una alteración cutánea como un eritema (enrojecimiento de la piel debido al aumento de la sangre contenida en los capilares). Además, pueden aparecer síntomas febriles o malestar general en los días siguientes a su aplicación.
En algunos casos, puede darse una reacción alérgica a algunos de los componentes de la vacuna, lo que puede provoca en el paciente un shock anafiláctico, y es necesario acudir a urgencias.
Si la sintomatología se alarga más de tres días , los síntomas se agravan o aparecen otros efectos secundarios debe acudir al centro médico.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
Preparación
No hay una preparación específica, simplemente si el paciente se encuentra enfermo o con fiebre días previos a la vacunación es recomendable posponerla.
Además, deberá solicitar cita previa con anterioridad y planificar las dosis siguiendo el calendario de vacunación.
Cómo es la recuperación de la vacuna pentavalente
Tras las 24 horas siguientes a la administración de cada dosis de la vacuna pentavalente, pueden aparecer efectos secundarios.
Ante el dolor local por la inyección aplicar frío, y en caso de fiebre o dolor intenso tomar antiinflamatorios o paracetamol.
Resultados
Mediante la aplicación de tres dosis al paciente se consigue una protección ante la difteria y el tétanos de casi un 100% , para la hepatitis B entre un 95% – 98 %, para la tosferina más de un 80% y para las enfermedades tipo b más del 95%.
Preguntas frecuentes
¿Cuál es la vacuna pentavalente DPT – HB + Hib?
La vacuna pentavalente DPT – HB + Hib es una vacuna combinada que protege al paciente de la difteria, tosferina, tétanos, hepatitis B y enfermedades de tipo B.
Se basa en la mezcla de la vacuna tetravalente, que inmuniza ante la difteria , tosferina, hepatitis B y tétanos, con la vacuna contra la Haemophilus influenzae de tipo B.
¿Qué es una vacuna acelular?
Las vacunas acelulares son aquellas que, a diferencia de las tradicionales, no inyectan en el organismo del paciente el germen muerto o debilitado, sino que son vacunas elaboradas a partir de los antígenos purificados seleccionados para realizar la respuesta inmune ante la enfermedad para la que se aplica .
¿Dónde se aplica la DPT?
La DPT, es una vacuna celular que introduce el germen muerto o debilitado que provoca las enfermedades en el organismo del paciente, inmunizándolo ante el tétanos, la tosferina y la difteria.
Se aplica vía intramuscular bien en el brazo o en el muslo.
¿Cuál es la vacuna DTPA?
La DTPa es la vacuna contra el tétanos, difteria y tosferina acelular de carga estándar que se recomienda suministrar a los niños en 5 dosis: a los 2,4,6,15 y 18 meses; y una sexta dosis antes de los 6 años.
¿Qué es la TD?
La Td es la vacuna del tétanos en versión adulta, ya que solo se debe aplicar a partir de los 7 años, y se emplea como vacuna de recuerdo cada 10 años.
De manera que el paciente la recibe de forma preventiva ya que las dosis administradas anteriormente van perdiendo efectividad con el tiempo.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
Contenido de salud
Vacuna Meningococo
Definición
Se entiende por vacuna, cualquier preparación destinada a generar inmunidad (defensas de recuerdo) contra una enfermedad estimulando la producción de anticuerpos (que son proteínas del sistema inmune que reconocen el microorganismo que produce la enfermedad, activando al sistema inmune para que lo destruya).
Dentro de las vacunas contra el Meningococo, hay que distinguir la existencia de dos tipos de vacunas para dos tipos de Meningococo: La vacuna del Meningococo C y la vacuna del Meningococo B. Ambas vacunas van destinadas a provocar una reacción inmunológica controlada contra una bacteria, el Meningococo ( Neisseria meningitidis ), de las que existen en la naturaleza 13 tipos o serogrupos. Los que más frecuentemente producen enfermedad meningocócica son los serogrupos A, C, B, W e Y, en nuestro medio sobre todo el C y el B.
Estas bacterias pueden producir la Meningitis meningocócica que es una enfermedad grave que afecta a las membranas que cubren el cerebro y la médula espinal, que puede producir importantes daños cerebrales e incluso la muerte.
Existen 2 tipos de vacunas del meningococo C :
La vacuna de polisacáridos MENCEVAX® ACYW (laboratorio Glaxo Smith Kline) para los serogrupos A, C, Y, W 135, cuyo uso en España es muy limitado al ser superada por otras vacunas.
Las vacunas conjugadas, éstas últimas más eficaces y pueden ser frente al serogrupo C , (MENJUGATE KIT® (laboratorio GSK), NEISVAC-C® (Pfizer) y MENINGITEC® (Nurón Biotech)); o frente a los serogrupos A, C, Y y W135, ( MENVEO® (laboratorio GSK) y NIMENRIX® (Pfizer)), que sólo se utilizan en circunstancias especiales como viajes a zonas en las que predominan otros serogrupos diferentes al C, (por ejemplo, meningococo del serogrupo A en África).
También existen dos vacunas del meningococo B : La vacuna TRUMENBA® (laboratorio Pfizer), con respuesta inmune demostrada contra 4 cepas del serogrupo B usada en EE.UU. Y por otro lado, la vacuna BEXSERO® que protege frente a la enfermedad meningocócica invasiva producida por el subgrupo B.
¿Cómo es la vacuna contra el Meningococo?
Cada dosis de vacuna se administra por medio de una inyección intramuscular , en bebés en región superior del muslo y en niños mayores y adultos en región superior del brazo. En personas con problemas de la coagulación de la sangre se pueden administrar de forma subcutánea profunda.
¿Para quién está indicada?
Vacunas contra Meningococo C:
En España las tres tipos de vacunas conjugadas monovalentes (es decir, las que actúan contra el subgrupo C : MENJUGATE KIT®, NEISVAC-C®, MENINGITEC® ), se pueden utilizar para administrar dentro de la pauta de vacunación del calendario sistemático infantil. Se recomiendan las pautas de administración siguiente: 1 o 2 dosis en el primer año de vida (a los 4 meses solamente o a los 2 y 4 meses, según la vacuna utilizada), 1 dosis de refuerzo a los 12 meses y 1 dosis a los 12 años.
Además se recomienda la vacunación de todos los adultos que deberían estar vacunados ya y no lo están, según las recomendaciones oficiales de cada comunidad autónoma, con esta vacuna conjugada monovalente en una única dosis.
Respecto a la vacuna conjugada frente a los serogrupos A, C Y y W135 ( MENVEO® , NIMENRIX® ), se recomienda la vacunación de los adolescentes y adultos que vayan a viajar o residir en países en los que haya alta incidencia de la enfermedad meningocócica producida por estos serogrupos (África, Sudamérica y Asia).
Dentro de las recomendaciones de la Asociación Española de Pediatría, está el que a los niños de 12 años se les vacune con la vacuna conjugada de sólo un serogrupo de meningococo C o si no, se pueda administrar la vacuna conjugada frente a los tres serogrupos (A, C, Y y W135), como ya hacen en otros países (Austria, Grecia, Reino Unido, provincias de Canadá). Esta posibilidad de la vacuna frente a los tres serogrupos no está incluida de momento en el calendario oficial de vacunación, es decir, no está financiada por la Seguridad Social de forma generalizada, pero se puede informar a los padres de los pacientes que deseen ampliar de forma individual el espectro de vacunación.
La Seguridad Social sí cubre la vacunación con la vacuna conjugada frente a los serogrupos A, C, Y y W135 en situaciones de riesgo. En estos casos se puede vacunar con la conjugada monovalente (serogrupo C) o con la tetravalente (serogrupo A, C, Y, W135). Estos grupos de riesgo comprenden: personas sin bazo, personas con alteraciones de la sangre (déficit de factores del complemento), episodio previo de padecimiento de enfermedad meningocócica por cualquier serogrupo del meningococo y las personas que han tenido contacto directo y continuado con enfermos de meningitis C serogrupo A, Q o Y.
Los pacientes con infección del virus de la inmunodeficiencia humana (VIH) se vacunarán con dos dosis separadas como mínimo de 8 semanas entre sí, sólo si en un momento dado precisan vacunarse con otra vacuna por otros motivos. No está indicada de rutina en ellos.
Vacunas contra Meningococo B:
La vacuna conjugada antimeningocócica B que está autorizada en España es la Bexero ®. N o está incluida en calendario vacunal en nuestro país. Se recomienda la vacunación en personas con riesgo de padecer la enfermedad, como personas con alteraciones del sistema inmune, pesonas que no tienen bazo, pacientes que han pasado una enfermedad por meningococo y en los casos de personas que han mantenido contacto con personas enfermas por meningococo.
La Asociación Española de Pediatría, recomienda a través de su comité asesor de vacunas, la incorporación de la vacuna en el calendario vacunal infantil, siguiendo esta pauta: en la primovacunación en lactantes administrar una dosis a los 2, 4, y 6 meses de edad, guardando un intervalo de dos semanas respecto al resto vacunas del calendario vacunal financiado. La dosis de refuerzo, en el caso de los primovacunados en el primer año de vida, se administrará entre los 13 y los 15 meses, para evitar su coincidencia con la vacuna antimeningocócica C conjugada.
¿Por qué se realiza?
Con la vacunación se previenen complicaciones infecciosas graves de una enfermedad importante que puede tener repercusiones neurológicas de por vida o incluso, desencadenar en la muerte del paciente .
Riesgos de la vacuna contra el Meningococo
Las vacunas contra el meningococo C y B normalmente desencadenan reacciones locales leves y fiebre autolimitada. En raras ocasiones producen reacciones alérgicas graves.
Preparación
No requiere una preparación especial, como todas las recomendaciones en las vacunas no se debe administrar cuando aparece fiebre alta o patologías infecciosas agudas .
Se debe informar siempre de cualquier medicación o enfermedad que tenga el paciente al médico antes de su vacunación.
En el caso de adquisición en la farmacia de alguna de las vacunas hay que tener en cuenta que no se debe perder la cadena de frío en su conservación, debiendo de mantener la vacuna en una temperatura entre 2○ C y 8○ C
Cómo es la recuperación de la vacuna de meningococo
Habitualmente tras la administración de las vacunas pueden aparecer una serie de síntomas:
Con las vacunas contra el meningococo C de polisacárido s aparece frecuentemente enrojecimiento de la zona de inyección, también puede aparecer fiebre y en casos muy raros reacciones alérgicas que pueden ser graves.
Con las vacuna contra el meningococo C conjugada puede aparecer enrojecimiento, dolor e induración (leve “endurecimiento” local de la piel) en los siguientes dos días a la administración. Además puede aparecer fiebre y sensación distérmica, es decir escalofríos, tiritona.
Con la vacuna contra el meningococo B puede aparecer enrojecimiento, dolor, hinchazón e induración en el lugar de su administración. En los bebés y niños pequeños puede aparecer irritabilidad, falta de apetito, fiebre, somnolencia, diarrea o vómitos y erupción en la piel. Se les puede administrar Paracetamol para disminuir la fiebre y el malestar. En niños mayores, adolescentes y adultos se puede asociar la aparición de dolores musculares y de las articulaciones, dolor de cabeza y malestar general.
Resultados
Desde la introducción de la vacunación del meningococo del subgrupo C , han descendido en un 87% los casos de meningitis producidos por este subgrupo de bacteria.
En el caso de la vacuna contra el meningococo B protege de la afectación que esta bacteria puede causar (meningitis o sepsis (infección generalizada en sangre)) cuya aparición es poco frecuente pero muy grave si se presenta (uno de cada 10 personas afectadas mueren).
Preguntas frecuentes
¿Cuántas son las dosis de Bexsero?
Bexsero es una de las vacunas contra el meningococo B. Se recomienda administrar esta vacuna separada del resto de vacunas inyectables del calendario vacunal infantil, dejando pasar entre cualquier otra vacuna del calendario y Bexsero como mínimo 15 días. Una pauta recomendada puede ser: una dosis a los 2 meses, a los 4 y a los 6 meses, la dosis de refuerzo en lo vacunados durante el primer años de vida, se administra entre los 13 y los 15 meses.
¿Cuánto cuesta la vacuna del meningococo?
La vacuna del meningococo C está financiada por la Seguridad Social dentro del calendario sistemático infantil. La vacuna del meningococo B (Bexsero) tiene un precio aproximado en actualidad de 106 euros cada dosis recomendada.
¿Cuál es la vacuna de la meningitis C?
Existen 2 tipos de vacunas del meningococo C: la vacuna de polisacáridos y las vacunas conjugadas, éstas últimas más eficaces y pueden ser frente al serogrupo C o frente a los serogrupos A, C, Y y W135.
¿Qué es la vacuna triple viral?
La vacuna llamada Triple Vírica va destinada a provocar una reacción inmunológica controlada contra tres tipos de virus: el del Sarampión, el de la Rubéola y el de la Parotiditis.
¿Cómo se transmite el virus del neumococo?
La transmisión se produce de una persona a otra por contacto cercano a través de las secreciones respiratorias cuando se tose o estornuda.

Contenido de salud
PCR
Definición
La reacción en cadena de la polimerasa (la enzima capaz de transcribir o replicar ácidos nucleicos), recibe la abreviatura de PCR.
Es una técnica científica basada en amplificar partes concretas del ADN en un laboratorio, para detectar aquellos gérmenes que se encuentran en el organismo y ante otras pruebas pasan desapercibidos.
¿Cómo es un PCR?
La reacción en cadena de la polimerasa (PCR) es un proceso que se desarrolla en un laboratorio, por tanto, una vez que se extraiga la muestra a analizar el paciente puede recuperar su vida con normalidad.
Los pasos de una PCR son:
Extracción del ADN de la muestra recogida al paciente.
Se eleva la temperatura a 100 grados, para que se separen las dos cadenas de ADN.
Se suministra a la muestra de ADN el cebador (indicador) específico a la enfermedad que queremos estudiar.
Al enfriar la muestra, el cebador se une al ADN en estudio, y empieza a funcionar la polimerasa, que duplica el ADN.
Este proceso se repite cada vez que termina un ciclo para obtener duplicaciones de las cadenas de ADN previas, y así obtener el ADN amplificado y realizar el estudio de genético más fácilmente.
¿Para quién está indicado?
La PCR no está contraindicado para ningún paciente, incluso a veces se utiliza en mujeres embarazadas y en periodo de lactancia como un control periódico .
En caso de que el médico lo solicite, será porque el análisis del ADN es necesario para diagnosticar y estudiar la enfermedad que tiene el paciente.
¿Por qué se realiza?
Con el empleo de la reacción en cadena de la polimerasa (PCR) se consigue amplificar el ADN y poder determinar los gérmenes diminutos que están en el organismo del paciente.
Por tanto, permite un estudio genético más fácil y rápido.
Riesgos del PCR
Al ser técnica científica de laboratorio, los riesgos son casi nulos .
Las únicas complicaciones que se pueden ocasionar son a la hora de extraer del cuerpo del paciente la biopsia o las células de la sangre a analizar.
Como último posible riesgo, obtener un falso positivo o negativo y aplicar un tratamiento inadecuado .
Preparación
Si el paciente toma medicamentos de manera habitual debe comunicárselo al médico, ya que puede ser necesario suspenderlos hasta que se realice la extracción para la PCR, ya que puede alterar o afectar en los resultados de la prueba.
Generalmente, al realizar la extracción para el ADN, se suele realizar una analítica, por lo que el médico puede pedirle al paciente que acuda en ayunas.
Cómo es la recuperación de un PCR
La PCR se realiza en un laboratorio, de forma que, tras la extracción del material rico en ADN para realización de la prueba , el paciente deberá seguir las indicaciones médicas según el tipo de tejido o célula que se le haya extraído, según sea de una extracción de la sangre o de una biopsia.
Resultados
Los resultados de una PCR se muestran en valores numéricos, pero estos son distintos para cada microorganismo, pudiendo resumirse el resultado en un positivo o negativo .
En caso positivo será porque se ha encontrado el ADN mutado o la presencia de los gérmenes específicos que se buscaban.
Suelen tardar aproximadamente un mes, y el paciente debe acudir nuevamente a la consulta médica, ya que los resultados los ha de interpretar un médico.
Preguntas frecuentes
¿Cómo se produce la reacción en cadena de la polimerasa?
La muestra de ADN que se extrae del paciente se eleva a 100 grados para que el ADN se divida en dos partes , y mediante su enfriamiento y la administración del cebador específico y la polimerasa, se amplifica el ADN duplicándose, para analizarlo de manera más sencilla.
¿Qué es la CPR RT?
RT proviene del inglés Reverse Transciption, por lo tanto, CPR RT en español significa Reacción en Cadena de la Polimerasa con Transcriptasa Inver sa.
En este tipo de CPR, se emplean genomas de ARN para formar las cadenas de ADN, mediante la administración de la enzima transcriptasa inversa. Se suele emplear para estudiar genomas de retrovirus como el VIH o virus como el de la gripe.
¿Qué es PCR cuantitativa en tiempo real?
La PCR cuantitativa o en tiempo real, desarrolla el proceso de la misma manera que una PCR convencional, pero en este caso se añaden sustancias fluorescentes .
De esta manera se mide el resultado según la luz que se va produciendo de manera simultánea cuando se añaden las sustancias con fluoruro, por tanto, cuanta más luz mayor presencia del ADN buscado.
¿Qué es la PCR anidada?
La PCR anidada, es otra variante de la PCR que permite amplificar muestras de ADN pequeñas en muchísimos fragmentos .
Para ello se realiza en dos fases, en la primera se amplifica con cebadores (indicadores) externos, y después con los cebadores internos, de manera que incrementa la capacidad de detectar la presencia del germen o ADN mutado.
¿Qué es la proteína C reactiva?
La proteína C reactiva también se abrevia como PCR, pero en este caso es producida de forma natural por el hígado cuando hay una inflamación en el cuerpo.
La proteína C reactiva pertenece a un grupo de proteínas: “reaccionantes de fase aguda” , que son proteínas inflamatorias llamadas citocinas y son producidas por los glóbulos blancos ante una inflamación en el cuerpo.
Contenido de salud
¿Qué es el Prick Test?
Definición
El Prick test, es un conjunto de pruebas cutáneas de la alergia, que se realizan en la piel del paciente para determinar aquellas sustancias a las que puede presentar alergias, mediante la exposición cutánea al alérgeno.
Para identificar dichos alérgenos, se puede analizar de dos formas:
En laboratorio : se miden las sustancias que aparecen en la sangre ante diversos alérgenos, observando la creación o no de anticuerpos.
In vivo : de forma que se suministran cutaneamente diferentes alérgenos en la piel del paciente, hay tres tipos:
Hipersensibilidad inmediata: consisten en la punción de la piel suministrando una dosis controlada del alérgeno. Se examina la reacción a los 15 minutos. Se le denomina prick test.
Hipersensibilidad tardía: consiste en la administración de un parche con el alérgeno, y examinar la reacción a las 48 horas. También reciben el nombre de patch test o pruebas epicutáneas.
Provocación: No se administran cutaneamente si no mediante vía nasal, bronquial, oral o conjuntival, el alérgeno al paciente. De manera que se diagnostican alergias derivadas que afectan a las vías respiratorias, nasales, etc.
Preparación
Consiste en una prueba ambulatoria que no requiere ingreso hospitalario.
El médico indicará al paciente cuando debe dejar de tomar antihistamínicos o corticoides antes de la prueba, ya que los resultados pueden aparecer alterados al minimizarse las reacciones a los alérgenos.
Cómo se realiza el prick test
Las pruebas de alergia como el prick test se suelen realizar en los servicios de alergología. Allí el paciente entrará en la consulta, y bien en la zona interior del brazo o en la espalda se procederá a iniciar el prick test.
Se suministrarán varias gotitas de los diferentes alérgenos, y mediante una leve punción se levantará la piel para que la gota penetren cutaneamente .
Al lado de cada gota suministrada se pondrá una marca para identificar cada tipo de alérgeno.
El médico pedirá al paciente que espere 15 minutos para ver si se produce reacción, la cual se verá en caso de que aparezca enrojecimiento, picor y una pápula (pequeña ampolla que se resuelve espontáneamente) en la zona del pinchazo.
En caso de que se realice el patch test, se aplicará el parche al paciente y este deberá volver a las 48 horas para ver los resultados.
Complicaciones del prick test
El prick test es una prueba de la alergia muy segura , ya que las dosis administradas son pequeñas y no suelen producir más que una alteración cutánea de la zona con la aparición de sarpullidos y/o pápulas.
No obstante, en caso de que la reacción alérgica que sufra el paciente sea muy aguda, puede producirle un shock anafiláctico, por ello es necesario realizar las pruebas en los servicios de alergología para que el paciente no corra ningún riesgo y sea tratado con rapidez en caso necesario.
Resultados
Los resultados se obtienen el mismo día que se realiza el Prick Test. Tras los 15 minutos de espera, el paciente vuelve a la consulta y se observa el tamaño de las pápulas y las zonas enrojecidas, en caso de que se hayan producido.
Los resultados del Prick Test pueden ser por tanto:
Negativo: en caso de que no exista pápula o el eritema (enrojecimiento de la piel) sea menor de 1 mm.
Positivo: en función del tamaño de la pápula y el eritema, puede ser:
Un positivo (+): cuando el eritema no supera los 3 mm y la pápula es muy pequeña o inexistente.
Doble positivo (++) : cuando la pápula tiene unos 3 mm de diámetro y el eritema no llega a los 5 mm.
Triple positivo (+++): Cuando la pápula es de más 3 mm de diámetro, junto con el eritema.
Si se realiza la prueba del parche, Patch Test se interpretarán los resultados a las 48 horas de la misma manera.
Preguntas frecuentes
¿Es lo mismo prick test que las pruebas cutáneas?
El prick test es un tipo de prueba cutánea, por lo que no son completamente lo mismo ya que hay otros tipos de pruebas cutáneas como el patch test .
¿Qué es el IgE en sangre?
El IgE, llamado inmunoglobulina E, es un anticuerpo que se genera en la sangre del paciente ante la presencia de diversos alérgenos.
Es la base de las pruebas de la alergia que se realizan en los laboratorios mediante la extracción de sangre .
¿Qué es la prueba intradérmica?
Es el proceso mediante el cual el paciente recibe la sustancia del alérgeno mediante una punción en el brazo o espalda, de manera que el alérgeno queda bajo la superficie de la piel, por lo que recibe el nombre de intradérmica .
¿Qué es la inmunoglobulina E?
Ante la posibilidad de que una persona tenga alergia a una sustancia en concreto, se realiza el análisis de la inmunoglobulina E (IgE).
Esta prueba se basa en suministrar la sustancia alérgena en la sangre, y esperar a que el sistema inmunológico produzca anticuerpos, que se denominan inmunoglobulina E .
Cada alérgeno necesita una inmunoglobulina E distinta, y se encuentra en los pulmones, piel y membranas mucosas.
¿Qué es la inmunoglobulina M?
La inmunoglobulina M (IgM), es el primer anticuerpo que genera el sistema inmunológico ante una infección . Se encuentra en mayor abundancia en el líquido linfático y la sangre.
Contenido de salud
Tacto Rectal
Definición
El tacto rectal es una prueba médica, basada en una exploración física que realiza directamente el médico sin el uso de utensilios, introduciendo un dedo de la mano por el ano del paciente para palpar la zona.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
El médico usará guantes y lubricante para facilitar la penetración.
Esta prueba se emplea como un examen DRE físico previo, ante la posibilidad de que el paciente tenga algún tipo de enfermedad como:
Fecaloma : acumulación excesiva de heces en el recto, que el paciente no puede expulsar. Mediante el tacto rectal se puede afirmar esta patología e incluso movilizar las heces. Cáncer de próstata: este tipo de cáncer no tiene una sintomatología externa, por lo que la única forma de diagnóstico precoz es mediante el tacto rectal, valorando ni existen nódulos rígidos o no. Prostatitis : es la infección de la próstata al padecer alguna infección de la orina. Si se produce dolor en el tacto rectal, puede ser debido a la infección. Hemorroides : mediante el tacto rectal se valoran la existencia de hemorroides internas y el tamaño de las externas. Fisura anal: el tacto rectal permite evaluar si existen o no fisuras, y en caso de que existan determinar su gravedad para aplicar un tratamiento. Rectorragia : patología en la cual se expulsa sangre por el ano, bien con las heces o sola. Mediante el tacto rectal se observa el color de la sangre, para ver de qué zona proviene el sangrado. Enfermedad de Crohn : con esta enfermedad se producen fístulas anales, que son canales que se forman entre el recto interno y el ano.
Preparación
El tacto rectal se realiza de forma ambulatoria en un momento determinado durante una consulta con el médico, de manera que no requiere ningún tipo de preparación.
Bien es importante, indicarle al médico si toma algún medicamento de forma constante y los últimos alimentos ingeridos por si el color de las heces no es el habitual.
Cómo se realiza un tacto rectal
Previamente al inicio de la prueba el médico te indicará en qué consiste el proceso, y si estás de acuerdo en realizarlo.
El paciente deberá quitarse la parte inferior de la ropa y colocarse en la camilla tumbado en forma fetal, con las rodillas dobladas al pecho y rodeandolas con los brazos, o bien tumbado bocarriba con las piernas en alto.
El médico se pondrá un guante en cada mano, y en el dedo índice que vaya a usar para el tacto rectal aplicará lubricante. Antes de iniciar el tacto, observará la parte exterior el ano para ver si existe alguna alteración importante.
Después, te avisará e introducirá el dedo índice lubricado por el ano lentamente, tocando el recto en la zona interior para ver si hay masas que dificulten el acceso. Además, palpará la próstata o pared vaginal, según sea hombre o mujer el paciente.
Por último, girará el dedo para examinar la pared trasera del recto, y a continuación sacará el dedo lentamente. Una vez fuera, en caso de que se haya manchado por las heces, observará el color de éstas, por si no fuera el habitual o tuvieran sangre.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Complicaciones de un tacto rectal
El tacto rectal es una prueba sencilla, que se basa en una exploración física. La única complicación que se puede producir durante su realización es la posibilidad de rasgar la mucosa rectal.
Si es cierto, que el tacto rectal no debe realizarse en pacientes que tengan enfermedades anales graves, como hemorragia intensa o un trombo de hemorroide, sobre todo para no producir un mayor dolor en el paciente.
Resultados
Los resultados del tacto rectal se obtienen en el momento, el médico redactará un informe en el que se detalla la exploración, indicando lo observado en el ano, próstata o pared vaginal, y a lo largo del recto.
Generalmente, esta prueba se realiza para descartar posibles enfermedades o como prueba previa para indicar la realización de otras, como una sigmoidoscopia o biopsia.
Preguntas frecuentes
¿Duele un tacto rectal?
El tacto rectal es un procedimiento molesto, y en caso de molestia excesiva se debe a que estará inflamada alguna zona.
El médico intentará que sea lo menos molesta posible con la lubricación del dedo índice a introducir, además la palpación no supera los 25 segundos.
¿Se suele realizar el tacto rectal en mujeres?
Si. Ante cualquier anomalía que pueda presentar por sus síntomas.
La exploración es igual que la del hombre, pero en vez de palpar la próstata el médico analiza la pared vaginal. Además, es un proceso que también se aplica en la consulta del ginecólogo para palpar los órganos sexuales de la mujer.
¿Pueden realizarme un tacto rectal si tengo hemorroides?
Ante la presencia de hemorroides en el paciente, y sobre todo si están muy inflamadas, se suele evitar realizar un tacto rectal ya que puede agravar el dolor en el paciente.
¿Cuánto dura un tacto rectal?
Aunque al detallar el proceso del tacto rectal parezca que la prueba es larga, la palpación interna que realiza el médico en la prueba dura apenas unos 25 segundos.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Contenido de salud
Terapia Neural
Definición
Es considerada una técnica de medicina alternativa basada en neutralizar las irritaciones de la redes nerviosas que alteran el sistema neurovegetativo mediante inyecciones en puntos específicos según la zona a tratar restableciendo un nuevo equilibrio en el cual, el dolor, y otras alteraciones desaparezcan .
Esta terapia tiene su origen en Alemania donde se lleva practicando desde hace unos 25 años.
La terapia basa su efectividad en la correcta inyección de microdosis de un anestésico local con fines terapéuticos.
¿Cómo es la terapia neural?
El tratamiento consiste en hacer microinyecciones de anestésicos locales , generalmente la procaína, en puntos dolorosos, cicatrices, glándulas o nervios periféricos con la intención de restablecer una mejor biología y de esta forma hacer desaparecer el dolor.
¿Para quién está indicada?
Estará indicada para cualquier tipo de dolor agudo siempre y cuando este no esté producido por un proceso infeccioso.
En otros tipos de procesos como:
Dolores crónicos como puede ser migrañas, cefaleas, dolores en pequeñas o grandes articulaciones, dolores menstruales, etc.
Alteraciones del sueño y mareos.
Enfermedades de la piel como alopecia, eccemas y alergias en la misma.
Problemas digestivos como digestiones pesadas, gastritis, diarreas, etc.
Problemas hormonales y del ciclo menstrual
¿Por qué se realiza?
Se realiza como terapia que permite regular y equilibrar el sistema nervioso vegetativo por medio de microdosis de procaína (la procaína es un anestésico local) en los puntos dolorosos o en cicatrices o ganglios con el fin de restablecer el orden biológico que ha alterado enfermedad y conseguir así la curación.
También se considera que restablece el equilibrio entre el sodio y el potasio celular ayudando a la célula a recuperar su nivel energético de base. (El sodio y el potasio son dos sustancias que se encuentran en diferentes concentraciones dentro y fuera de la célula).
Parece que las inyecciones actúan bajando la actividad si las células están hiperestimulada y al revés estimulandolos si por el contrario están hipoestimulación.
Riesgos de la terapia neural
Los mayores riesgos vienen dados por la posibilidad de alergia al anestésico procaina ; en algunos casos los médicos deciden hacer una pequeña inyección intradérmica en el brazo para probar que usted no sea alérgico al fármaco que se le va a poner.
Puede tener pequeñas zonas de sangrado por la inyección, por lo que es importante que comunique a su médico si toma antiinflamatorios o anticoagulantes.
Preparación
La preparación es tan solo la desinfección de la piel y elegir bien el punto a tratar pero tiene una serie de contraindicaciones en su uso que se debe de conocer.
No podrá ser usado en persona con bloqueo auricular completo, persona con cardiopatías descompensadas, hipotonías graves y en los brotes de miastenia gravis.
Cómo es la recuperación de una sesión de terapia neural
La recuperación es buena. Tras la sesión, el paciente suele ya tener menor dolor en las primeras horas de la aplicación con lo cual mejorará rápidamente de su dolor crónico y de las alteraciones psicológicas que esto produce.
Resultados
Aunque los resultados son positivos, si tras las primeras sesiones el dolor no ha mejorado se debe de considerar la posibilidad de que exista un campo interferente que puede ser no el que duele pero si el que produce el dolor a distancia ; en muchos caso los tratamientos odontológicos pueden crear distorsiones que producen dolor a distancia por el desequilibrio que producen. Se suele comenzar el tratamiento por las zonas más superficiales y se podrá profundizar si el sistema superficial no nos muestra una clara mejoría.
Preguntas frecuentes
¿Cómo es la terapia neural para la próstata?
La terapia neural para la prostata esta indicada en casos de dolor prostático y de prostatitis, en estos casos la inyección se va a realizar a nivel de la zona suprapúbica evitando se produzca daño a nivel de la vejiga; este tratamiento puede servir también para el tratamiento de la vejiga neurógena.
¿Cómo es la terapia neural para la migraña ?
El primer caso de uso de terapias neurales fue para la migraña. Esto permitió descubrir que ciertas cicatrices pueden producir alteraciones en el sistema nervioso que pueden dar lugar a migrañas. Se suele aplicar un tratamiento segmentario y del campo de interferencia a las cicatrices realizadas tras cesáreas, en los polos amigdalares, en zonas de tiroides y en segmentos abdominales; también puede producirse por la mala posición en los terceros molares o cicatrices en zonas del cráneo.
¿Cómo es la terapia neural para la ansiedad?
Consiste en la aplicación de procaína en aquellos puntos en que el paciente refiere sentir su ansiedad, en la mayoría de los casos estos puntos estarán localizados en la zona del tórax o en la parte alta del abdomen.
Las inyecciones en esta zona mejoran la sensación de ansiedad del paciente al actuar como regulador biológico.
¿Deja cicatrices la terapia neural?
Las agujas que se usan para inyección serán las más finas posibles y por tanto no dejarán lesión alguna en el punto de inyección , los primeros días podremos ver el punto de inyección que desaparece tras 48 horas.
¿Tiene efectos secundarios la terapia neural?
No, en general el único efecto secundario será el derivado de una posible reacción alérgica por el anestésico que se haya usado . El usar muy pequeña cantidad de anestésico hace que los efectos secundarios no aparezcan.
Contenido de salud
Vacuna Fiebre Amarilla
Definición
La fiebre amarilla es una enfermedad vírica, propia de países tropicales, que se transmite por la picadura de mosquitos infectados .
Sus síntomas aparecen entre los 3 y 6 días después de la picadura del mosquito, provocando en el paciente escalofríos, fiebre, dolores de cabeza y musculares. La sintomatología del paciente infectado puede agravarse con la inflamación del hígado y la presencia de hemorragias nasales, digestivas y oculares, siendo letal en algunos casos.
El nombre de fiebre amarilla se debe a la ictericia, un color amarillento en la piel y las mucosas del paciente cuando contrae la enfermedad , debido al aumento de la bilirrubina en sangre.
¿Cómo es la vacuna de la fiebre amarilla?
La vacuna de la fiebre amarilla, consta de una sola dosis que se inyecta vía intramuscular o subcutánea al paciente.
Aunque los efectos de la vacuna se estiman que sean de por vida, se recomienda poner un recuerdo cada 10 años para prevenir la posibilidad de infección ante esta enfermedad vírica .
Se puede administrar de manera simultánea con otras vacunas, a excepción de la triple vírica, con la cual deben de pasar un mínimo de 4 semanas entre la administración de ambas, para evitar que una interfiera en la otra.
¿Para quién está indicada?
Esta vacuna se puede administrar a personas desde los 9 meses a los 60 años de edad , siendo indicada para aquellas personas que van a viajar o vivir en zonas donde el riesgo de contagio es muy elevado, sobre todo en las zonas tropicales de Sudamérica y África.
¿Por qué se administra?
El riesgo de infección por fiebre amarilla en áreas de transmisión es muy elevado, por ello al tratarse de una vacunación sencilla y segura que consta de una dosis, se deben vacunar los habitantes o viajeros de dichas zonas.
Riesgos de la vacuna de la fiebre amarilla
Esta vacuna, al igual que las demás puede provocar sintomatología local como la inflamación de la zona inyectada así como malestar general o fiebre.
Supone un riesgo, y por tanto está contraindicada en pacientes:
Que padecen alergia a la fructosa, o cualquier otro compuesto de la vacuna.
Menores de 6 meses y mayores de 60 años, al ser el riesgo de complicación mayor.
Mujeres embarazadas, ya que podría infectar al feto.
Durante la lactancia, ante la posibilidad de infectar al niño a través de la leche materna.
Preparación
Al ser una vacuna indicada en la mayoría de los casos para viajeros , es necesario pedir cita con una antelación mínima de 10 días a la fecha de salida.
En caso de que el paciente se encuentre enfermo, la vacunación se deberá posponer, por ello es importante la antelación a la hora de solicitar la cita.
Cómo es la recuperación de la vacuna de la fiebre amarilla
Aplicar frío local o tomar antiinflamatorios ante el dolor en la zona de la inyección o dolores de cabeza.
Si la sintomatología se agrava debe acudir al médico, ya que en algunos casos puede provocar efectos secundarios en el sistema nervioso o algunos órganos.
Resultados
Con la vacunación contra la fiebre amarilla, el paciente está protegido de infectarse, minimizando el riesgo de contagio y protegiendo su salud.
Preguntas frecuentes
¿Cuál es el tiempo de validez de la vacuna de la fiebre amarilla?
La protección que ofrece la vacuna de la fiebre amarilla se considera que es indefinida, de por vida, pero se recomienda una vacuna de recuerdo cada 10 años.
¿Cuál es la causa de la fiebre amarilla?
La fiebre amarilla se produce por la infección de un virus del género Flavivirus que se transmite por la picadura de mosquitos.
¿Cómo se transmite la fiebre amarilla?
La fiebre amarilla solo se puede transmitir mediante la picadura de mosquitos infectados por el virus, no de persona a persona.
Las personas que se contagian de la fiebre amarilla solo pueden transmitir el virus los 5 días después de aparecer los primeros síntomas y mediante el mosquito.
Los mosquitos de la familia de los Aedes y Haemagogus, son quienes transmiten la enfermedad, la cual se considera que tiene su origen en los primates.
¿Cómo se puede prevenir la fiebre amarilla?
La fiebre amarilla es una enfermedad vírica que puede prevenirse mediante la vacunación.
La vacuna, de tipo vivo atenuado, consta de una dosis, que se debe aplicar mínimo 10 días antes de exponerse a la fiebre amarilla, y actualmente la única aprobada recibe el nombre de Stamaril®.
Una vacuna de tipo vivo atenuado es aquella que introduce en el organismo del paciente el germen que causa la enfermedad de forma debilitada (o atenuada).
¿Cuál es la diferencia entre malaria y fiebre amarilla?
La malaria y la fiebre amarilla, tienen en común que se transmiten sólo por la picadura de mosquitos.
Pero, se diferencia en:
La fiebre amarilla tiene una vacuna preventiva y la malaria no.
La malaria es causada por parásitos y la fiebre amarilla por un virus.
Los síntomas de la fiebre amarilla incluyen vómitos y hemorragias, mientras los de la malaria son fiebre y sudoración.
Contenido de salud
PAAF
Definición
PAAF, son las siglas de Punción Aspiración con Aguja Fina, que dan nombre a una prueba médica por la cual se obtienen muestras celulares de órganos y nódulos mediante la punción, para analizarlas y determinar si son benignos o malignos, y evitando tener que realizar una biopsia tradicional.
Estudios de examen PAAF
La PAAF, es una punción que se realiza mediante una aguja fina, en aquellos lugares del cuerpo donde se considere necesario analizar las células para determinar su origen. En cada examen PAAF se realizan diferentes estudios:
Estudios Moleculares : se busca la identificación de proteínas determinadas para clasificar el tipo de células.
Estudios de Inmunofluorescencia : se administran sustancias fluorescentes a determinadas células para visibilizar su existencia.
Estudios Citológicos : mediante el cual se analizan las células una por una en conjuntos pequeños.
También se llevan acabo otras pruebas como:
Cultivos microbiológicos : si se presentan dudas ante la posible infección por el desarrollo de microorganismos.
Tintes celulares : se suministran tintes a las células para facilitar su observación por el microscopio.
Preparación
Es una prueba poco invasiva, por lo que se realiza de manera ambulatoria sin necesidad de ingreso. Tiene una duración aproximada de media hora, pero la punción como tal dura apenas unos minutos.
Es necesario que el paciente acuda sin haber comido ni bebido nada en las 8 horas previas. Debe evitar tomar antiinflamatorios o ibuprofenos una semana antes, y comunicar al médico los fármacos que toma habitualmente, ya que en algunos casos deberán suspenderse, así como las alergias a medicamentos.
En algunos casos, el paciente deberá tomar un antibiótico antes de la punción para evitar posibles infecciones locales en la zona inyectada.
Generalmente, el examen PAAF requiere cita previa y una analítica antes de realizarlo.
Cómo se realiza un examen PAAF
Antes de iniciar la punción, el paciente deberá ponerse una bata hospitalaria. Si el médico lo considera necesario puede aplicar alguna sedación al paciente.
Dependiendo de la zona a examinar, deberá recostaste en una camilla o permanecer sentado, de forma que se facilite la punción al médico.
Primero se desinfecta la zona con alcohol o yodo, si se aplica anestesia local, se suministrará en la piel superficial notando un pequeño pinchazo y escozor según se vaya administrando.
Después, se procederá a introducir una aguja larga y hueca, dentro de la cual de introduce la aguja fina de la PAAF, que realiza un aspirado de las células de la zona que se quiere analizar.
Una vez finalizado el examen se retirarán las agujas y se pondrá un vendaje compresivo en la zona para evitar que sangre.
En caso de que la zona donde se quiere realizar la PAAF, no se pueda palpar o tenga dificultades para acceder, se recurrirá a una PAAF guiada, en la que se emplea un ecógrafo para conducir la aguja al lugar deseado.
Complicaciones de un examen PAAF
Al tratarse de una técnica invasiva, aunque sea de levedad, pueden surgir ciertas complicaciones durante la realización de la prueba o después. Las más frecuentes son:
Dolor local en la zona e hinchazón.
Sangrado en la zona de la punción.
Infección local.
Desmayo o lipotimia durante la prueba.
En casos aislados y muy poco frecuentes se puede producir una perforación de otros órganos, propagar el tumor o un neumotórax, si se realiza en la zona del torax.
Resultados
Sobre la muestra de células extraídas se realizan diferentes estudios y análisis, por lo que los resultados tardan entre una semana y un mes.
Los resultados son procesados por un médico especialista que redacta un informe, en el que se recogen la sintomatología del paciente, la analítica y la PAAF.
Mediante dicho informe se determinará el diagnóstico del paciente, o en su defecto se mandarán más pruebas en caso de que fuesen necesarias.
Preguntas frecuentes
¿Qué es una punción en la tiroides?
La punción en la tiroides se realiza para analizar un nódulo tiroideo ante el desconocimiento de su origen .
Se suele realizar mediante una punción guiada, con el uso de un ecógrafo, y el paciente deberá permanecer sentado durante el examen PAAF, para facilitar al médico el acceso a la zona.
¿Qué es un BAAF de mamas?
Un BAAF de mamas, biopsia-aspiración con aguja fina, se realiza para extraer tejido mamario y analizarlo.
La biopsia requiere de una incisión o corte en la piel para extraer la muestra, mientras un BAAF o PAAF mamario se realiza con una aguja fina y hueca que aspira las células del pecho que se quieren analizar.
¿Qué es una biopsia por aspiración?
Una biopsia por aspiración se conoce bajo las siglas BAAF o PAAF, y a que consiste en extraer mediante una punción las células o parte de los órganos o nódulos de la zona que se quiere analizar, con el empleo de una aguja muy fina , que aspira el tejido y/o líquido necesario extrayéndolo.
¿Qué es un nódulo tiroideo?
Un nódulo tiroideo es un crecimiento anómalo del tejido del tiroides que se manifiesta en forma abultada .
Suelen ser frecuentemente analizados, para descartar que sean malignos o en caso de serlo iniciar cuanto antes el tratamiento.

Contenido de salud
Prótesis de Hombro
Definición
La artroplastia de sustitución del hombro es una técnica de cirugía mayor que consiste en la sustitución de la articulación del hombro que está enferma o fracturada, reemplazandola por una articulación artificial llamada prótesis. Esta sustitución puede ser necesaria de forma completa (prótesis total) o de sólo una parte (prótesis parcial). También se puede realizar un reemplazo de la superficie de la articulación en la parte superior del húmero, a modo de capuchón, preservando más parte del hueso. Son las llamadas prótesis de reemplazo de superficie. Por último, en las situaciones en las que hay afectación del manguito de los rotadores (grupo de tendones de músculos que están fijos en la articulación del hombro y que le proporcionan estabilidad), se puede implantar la llamada prótesis invertida del hombro, en la que las estructuras protésicas de reemplazo de la articulación se colocan en posición contraria u opuesta a la posición normal anatómica de la articulación.
¿Cómo es la prótesis de hombro?
La cirugía se realiza en el quirófano. Primeramente se coloca al paciente en la camilla en una posición de semisentado. Se administra la anestesia (habitualmente general) por parte del médico anestesista quien controlará su efecto durante toda la cirugía y la situación del paciente. Se realizan todos los preparativos de colocación de material quirúrgico estéril. Se limpia y desinfecta la zona quirúrgica con aplicación de antiséptico (sustancia que destruye los gérmenes). Se realiza un sondaje vesical (colocación de un tubito en la vejiga para el control de la eliminación de la orina). La operación dura de una hora y media a dos horas.
La intervención consiste en practicar una incisión (corte) en la región anterior del hombro de unos 10 a 15 centímetros, hasta acceder a visualizar todos los elementos de la articulación. Se extraen entonces las piezas dañadas y se da forma al hueso para poder colocar la prótesis. Luego se procede a mejorar la fijación de las piezas para lo que puede ser necesaria la utilización de cemento (sustancia especial para fijación), para unir el o los componentes de la prótesis al hueso. También se pueden unir al tener los componentes protésicos una superficie porosa que se adhiere de forma natural al hueso. Es muy posible que se tenga que realizar un reajuste de los ligamentos (elementos a modo de “cordones” de unión entre las partes de la articulación) que hay alrededor de la articulación.
Una vez colocada y fijada la prótesis los demás elementos de la articulación, se procede a cerrar la herida quirúrgica y así termina la cirugía. El paciente pasa entonce a la sala de reanimación donde despertará de la anestesia.
¿Para quién está indicada?
La indicación fundamental es calmar el dolor y secundariamente, dependiendo de cada caso, mejorar la movilidad del hombro. Varias patologías pueden afectar a la articulación del hombro causando dolor y discapacidad, lo que puede llevar a la indicación final de su sustitución por una prótesis:
La fractura compleja de la parte superior del húmero a veces impide su reconstrucción a través de una fijación de los segmentos fracturados (osteosíntesis) y colocación de los fragmentos en su lugar. Esto es motivo para que el traumatólogo tenga que indicar la utilización de una prótesis de hombro para asegurar la función adecuada del hombro y con ello del brazo.
Las enfermedades que conllevan una degeneración de la articulación importante y que agotan todas las vías de tratamiento, son otra de las indicaciones. Dentro de estas enfermedades se encuentran: Artrosis severa (enfermedad en la que se produce un desgaste progresivo del cartílago o tejido que amortigua los huesos del hombro lo que produce que lentamente la articulación del hombro se vuelva rígida y dolorosa). Artritis Reumatoide (enfermedad en la que se produce una i nflamación crónica de la articulación que puede dañar progresivamente el cartílago y eventualmente causar su desaparición lo que provoca dolor y rigidez). Artritis postraumática (afectación que se puede producir después de una grave lesión en el hombro, como fracturas de los huesos que componen el hombro o roturas de los tendones o ligamentos del hombro, que pueden dañar el cartílago de la articulación con el tiempo, lo que a largo plazo causa dolor en el hombro y limita su función)
La necrosis avascular ( enfermedad que ocurre cuando el suministro de sangre al hueso (parte superior del húmero) se interrumpe. Debido a ésto las células óseas mueren por no tener suministro de sangre (osteonecrosis), lo que puede finalmente causar la destrucción del hombro.
La prótesis de hombro también está indicada en la artropatía del manguito de los rotadores ( cambios en la articulación del hombro debidos al desgarro del manguito rotador, que es el desprendimiento del hueso de un grupo de tendones de músculos que movilizan el hombro y hacen que la articulación permanezca estable, y que puede conducir a la artritis con la destrucción del cartílago articular).
A veces las prótesis del hombro fracasan, generalmente debido a su aflojamiento, desgaste, infección y dislocación del implante. Cuando esto ocurre, puede ser necesaria la realización de una segunda cirugía de reemplazo de la prótesis, llamada cirugía de revisión de prótesis de hombro.
¿Por qué se realiza?
El propósito principal de la intervención es aliviar el dolor e intentar mejorar la función articular cuando los tratamientos no quirúrgicos como los fármacos y los cambios de actividad ya no son útiles para aliviar el dolor que la enfermedad produce en el hombro.
Riesgos de la prótesis de hombro
Complicaciones derivadas de la propia técnica quirúrgica y de la situación vital de cada paciente según el padecimiento de enfermedades crónicas como la diabetes, la hipertensión, enfermedades del corazón, obesidad, etc. que pueden ser potencialmente serias y afectar a todos los órganos y sistemas, pudiendo llegar hasta un riesgo vital, y requerir tratamientos complementarios, tanto médicos como quirúrgicos.
Fracturas del hueso húmero, durante la intervención o más tardíamente.
Infección de la herida quirúrgica, superficial o profunda (infección del implante, que puede obligar a la extracción de la prótesis si el tratamiento antibiótico fracasa).
Lesión de los vasos sanguíneos (los que llevan la sangre por el cuerpo) adyacentes. Si se afecta un gran vaso puede producirse una hemorragia masiva y puede requerir la administración de una transfusión de sangre.
Lesión o afectación de los nervios adyacentes, lo que podría ocasionar trastornos de la sensibilidad o del movimiento (parálisis) que pueden ser irreversibles.
Producción de trombos (obstrucción) en vasos sanguíneos (venas): trombosis en el brazo o en los pulmones.
Complicaciones cutáneas: necrosis o muerte del tejido, cicatrices anómalas (queloides), etc.
Luxación de la prótesis (cuando la prótesis se sale de su lugar), o inestabilidad de los componentes de la prótesis que puede exigir su reducción e incluso recambio.
Disminución de la movilidad del hombro por posibles variaciones de la longitud del hueso, desequilibrio o los tejidos blandos que forma parte de la articulación o mal posicionamiento de los componentes protésicos.
Aflojamiento de la prótesis o desgaste de la misma, que puede implicar la necesidad de un recambio protésico prácticamente siempre, con un peor resultado clínico previsto respecto a la colocación de la prótesis inicial.
Calcificaciones de los tejidos que rodean a la prótesis que pueden causar dolor y/o limitar la movilidad de la misma.
Rigidez articular post-operatoria.
Rotura del Manguito rotador (grupo de tendones del hombro).
Hematomas.
Dolor, que en general es de menor cuantía que el pre-operatorio.
Preparación
Antes de la decisión de la implantación de la prótesis de hombro, el traumatólogo le indicará la realización de una radiografía de hombro o, si fuera necesario, la realización de una resonancia magnética del hombro, para poder evaluar mejor la situación de la enfermedad y tomar la mejor decisión en cuanto al tipo de prótesis a utilizar.
El paciente se deberá realizar un estudio preanestésico con analítica de sangre, radiografía de tórax y electrocardiograma.
En la consulta de anestesiología, el anestesista le indicará al paciente el tipo de anestesia que se va a utilizar en su intervención.
Debe permanecer en ayunas 8 horas antes de la realización de la cirugía.
El paciente debe advertir de sus posibles alergias medicamentosas, padecimiento de enfermedades como alteraciones de la coagulación, enfermedades cardiopulmonares, existencia de prótesis, marcapasos. También debe informar al médico de los fármacos que toma o cualquier otra circunstancia.
No se deben portar objetos metálicos como anillos, pendientes, etc.
Cómo es la recuperación de la prótesis de hombro
El alta hospitalaria dependerá del estado general de salud del paciente, de la aparición de complicaciones y del protocolo del centro hospitalario donde se realiza la intervención. Si la evolución es buena, el tiempo de ingreso es aproximadamente de cuatro o cinco días.
En los primeros días el brazo se pone en un cabestrillo. Tras los primeras 24 a 48 horas de la intervención, se iniciará el movimiento progresivo de la articulación en periodos cortos, manteniendo el uso habitual del cabestrillo. Después de unos 10 días se inicia el tratamiento rehabilitador, realizando fisioterapia para que progresivamente, durante todo el tiempo de recuperación, el paciente vaya adquiriendo movilidad en la articulación, mejore el estado de la musculatura que existe alrededor de la articulación y aumente la estabilidad de la articulación.
El tiempo medio de recuperación completa es de unos 6 meses, aunque este tiempo puede aumentar según el estado previo de la articulación y la enfermedad que la afecta, el tipo de prótesis y las características del paciente.
Resultados
Si la indicación es correcta para la patología del paciente y es realizada por un equipo especializado, la tasa de éxito es muy alta. La reducción del dolor y el aumento de la movilidad es un objetivo conseguido en la mayoría de las intervenciones.
El paciente seguirá las revisiones pautadas por el traumatólogo para ver la evolución de la prótesis y valorar la posible existencia de complicaciones posteriores a la cirugía. Los primeros 2 o 3 años son críticos para valorar el éxito de la cirugía, si no hay complicaciones en ese periodo, normalmente el paciente puede disfrutar de la prótesis unos 15 años después de su instauración, dependiendo del tipo de prótesis, la fijación empleada y la actividad que el paciente realice. De forma progresiva con el tiempo, el paciente puede notar algo de empeoramiento porque pueda mover menos la articulación, tenga menos fuerza o le duela un poco más. En las revisiones el traumatólogo puede detectar a largo plazo un desgaste del hueso provocado por la propia prótesis que por lo general, no va a afectar a su función ni a provocar dolor intenso.
Preguntas frecuentes
¿Cuánto dura la recuperación de la prótesis de hombro?
Tras la intervención el paciente puede iniciar una movilidad relativa en torno al mes posterior a la intervención, durante la que en la mayoría de ese tiempo tendrá que utilizar un cabestrillo y podrá presentar dolor y limitación importante de los movimientos. La recuperación es progresiva y se puede tardar en alcanzar de forma completa en término medio unos 6 meses, aunque puede aumentar ese tiempo dependiendo del tipo de prótesis utilizada, las características propias del paciente, la existencia o no de alguna complicación posterior a la cirugía, y de la enfermedad inicial que propició la indicación de la prótesis de hombro.
¿Cuál es la artroplastia de hombro sin prótesis?
Una artroplastia sin prótesis hace referencia a la eliminación de la superficie de la articulación del hombro dañadas cuyo deterioro ocasiona dolor e incapacidad de movilización de la articulación. Una vez eliminados el extremo o extremos de los huesos recubiertos de cartílago destruido o desgastado, se pueden dejar así esas partes recreando una articulación fibrosa que no produce dolor pero es inestable y con limitación del movimiento. También se pueden realizar descompresiones en partes de la articulación que producen proliferación o inflamación de estructuras, y realizar reparaciones de tendones que puedan estar rotos en la articulación (como el manguito de los rotadores). El acceso a la articulación en estos casos se suele realizar mediante una artroscopia (introducción de una pequeña cámara por medio de pequeñas incisiones sobre la articulación).
¿Cuál es la rehabilitación de la prótesis de hombro?
Normalmente se comenzará con ejercicios pasivos de movilización al día siguiente de la intervención, pero se utiliza un cabestrillo durante unas tres semanas para permitir una buena cicatrización de los tejidos. Después de este tiempo, comenzará con la realización de actividades sencillas y movimientos activos, pautados por el médico rehabilitador y el fisioterapeuta según el estado del paciente, la patología de base de la articulación y el tipo de prótesis. Se pueden aplicar técnicas de fisioterapia para disminuir el dolor y la inflamación como la cinesiterapia activa y pasiva o la electroterapia.
Tipos de prótesis de hombro:
Prótesis tota l: en ella se sustituyen las dos partes de la articulación, la parte externa del omóplato (cavidad glenoidea) que tiene forma de media luna y la cabeza del húmero que es la otra parte de la articulación.
Prótesis parcial : en ella se sustituye sólo la parte de la cabeza humeral.
Prótesis invertida: en ella los componentes de la articulación se colocan en una posición anatómicamente invertida, es decir, la parte superior del húmero es cóncava (forma de media luna hacia arriba), como suele ser de forma natural la parte superior de la articulación que corresponde al omóplato, y ésta última en la prótesis invertida tiene una forma redondeada, como suele ser la parte superior del húmero de forma natural.
¿Qué es la prótesis de hombro invertida?
Es la prótesis de hombro en la que la colocación de las partes de la prótesis se realiza de forma inversa a la forma que habitualmente tiene la articulación del hombro de forma natural es decir, la “bola” del hombro (parte superior del húmero) pasa a estar fijada en la escápula, y la “cavidad” pasa a estar en el húmero .
Contenido de salud
Punción Lumbar
Definición
La punción lumbar es una prueba médica mediante la cual se extrae líquido cefalorraquídeo (LCR), para analizarlo y dar un diagnóstico al paciente. Para extraerlo la aguja debe atravesar las vértebras y llegar al canal raquídeo.
El LCR es un líquido que se encuentra alrededor del sistema nervioso central, de manera que lo protege del choque con los huesos frente a movimientos bruscos.
La punción lumbar, se realiza en los pacientes que tienen una sintomatología concreta y se busca asegurar el diagnóstico. Las principales enfermedades que requieren la extracción de LCR para su diagnóstico son: Esclerosis múltiple: esta enfermedad suele detectarse cuando ya hay daños neurológicos en el paciente, un análisis del LCR permitiría un diagnóstico precoz. Meningitis : las membranas que bañan al sistema nervioso central se llaman meninges, y en algunas ocasiones se inflaman debido a una infección causada por virus o bacterias, esta alteración recibe el nombre de meningitis. Neurosífilis : Una persona que padece sífilis y no responde al tratamiento o presenta daños neurológicos, requiere de una punción lumbar para ver si la bacteria ha llegado al LCR. Encefalitis/ Mielitis : Se produce una inflamación del cerebro/médula espinal, que en muchos casos es derivada de la meningitis.
Preparación
La prueba dura alrededor de 20 minutos, pero tras su realización el paciente debe estar tumbado durante una hora, después recibirá el alta. No debe realizar ningún tipo de esfuerzo físico durante ese día.
Normalmente no es necesario tomar medicamentos previos ni acudir en ayunas, pero se debe evitar tomar sustancias excitantes como el café o alcohol, el día de la punción lumbar e incluso el día anterior.
En caso de tomar una medicación habitual, deberá comunicárselo al médico por si es necesario suspender, sobre todo si son anticoagulantes o antiinflamatorios.
Cómo se realiza una punción lumbar
Una vez que el médico considere necesaria la realización de la punción lumbar, puede realizarse de manera urgente o planificando con una cita previa.
Antes de iniciar el proceso, el paciente debe vestirse con una bata hospitalaria y el equipo médico le colocará una serie de instrumentos para medir la tensión arterial, temperatura y frecuencias cardiaca y respiratoria, controlando en todo momento su salud. Además, el paciente en la mayoría de los casos será sedado para minimizar el dolor, o en caso de que este nervioso.
Después, el médico pedirá al paciente que se tumbe en la camilla, que doble las rodillas y las abrace, de forma que la espalda queda curvada y las vértebras levemente separadas, lo que facilitará la punción.
Se desinfecta la zona local con alcohol o yodo, y se administra anestesia local. Una vez haya hecho efecto se inicia la punción lumbar mediante el uso de una aguja más larga, que atraviesa las vértebras y meninges para poder extraer la muestra de LCR.
Cuando esté extraído el suficiente LCR para analizarlo, se retirará la aguja y se hará presión local para evitar el sangrado. El paciente deberá permanecer una hora tumbado.
Complicaciones de una punción lumbar
Aunque sea una prueba poco invasiva, pueden surgir ciertas complicaciones, aunque las de mayor gravedad son muy improbables. Las complicaciones de la punción lumbar pueden ser:
Que sangre la zona de la punción, y/o aparezca un hematoma alrededor.
Dolor en la zona local.
Infección local y síntomas febriles.
Reacción alérgica a la anestesia.
Cefalea por la extracción del LCR.
Que por la zona de la punción salga LCR.
Que se produzca un daño en la médula espinal por la punción.
La punción lumbar, no se debe realizar en pacientes con problemas de coagulación sanguínea o bajos niveles de plaquetas.
Resultados
Sobre la extracción del líquido cefalorraquídeo se realizan diferentes pruebas analizando las proteínas, células, el aspecto y la presión, entre otras.
En función de la urgencia con la que se mande la realización de la punción lumbar, los resultados tardarán desde una hora hasta varios días.
Los resultados de la punción los analizará el médico especialista, junto con la sintomatología y pruebas complementarias, para diagnosticar al paciente.
Preguntas frecuentes
¿Qué es el estudio del líquido cefalorraquídeo?
El estudio cefalorraquídeo se realiza mediante la punción lumbar, extrayendo el LCR del sistema nervioso central para diagnosticar la presencia de enfermedades, generalmente neurológicas.
¿Qué es la toracocentesis?
Punción quirúrgica, mediante la cual se extrae un exceso de líquido entre los pulmones y la pared interna del pecho, que provoca una efusión pleural y es necesario drenarlo.
¿Qué es aspirado de médula ósea?
La extracción de una parte del tejido adiposo que contiene la médula ósea, en estado líquido, para analizarlo.
¿Cómo es la donación de médula ósea?
Se realiza mediante una punción lumbar, en la zona posterior al hueso de la cadera.
En este proceso se aplica anestesia general o epidural para minimizar los dolores.
¿Cualquiera puede donar médula ósea?
No. Para ser donante de médula ósea la edad debe estar comprendida entre los 18 y los 55 años, además debe tener un buen estado de salud, y no padecer o haber padecido enfermedades como: hipertensión, diabetes, enfermedad tumoral, hepatitis B, C o VIH, entre otras. Por ello antes de donar se realiza una analítica.
Las mujeres embarazadas o en periodo de lactancia y las personas con tratamiento anticoagulante, no pueden donar durante ese proceso.
Contenido de salud
Sigmoidoscopia
Definición
La sigmoidoscopia es una prueba médica que consiste en introducir el sigmoidoscopio a través del ano para visualizar el recto, el colon sigmoide y el intestino grueso, para dar un diagnóstico al paciente.
Las principales causas por las que se realiza una sigmoidoscopia son ante este tipo de sintomatologías:
Sangre en las heces : esto se debe a que puede haber una hemorragia interna y se emplea esta prueba para conocer de donde proviene el sangrado.
Estreñimiento o diarrea : ante la presencia de estos síntomas de forma habitual se realiza la sigmoidoscopia, ya que pueden deberse a una inflamación intestinal.
Disminución de peso sin causa: se emplea ante la posibilidad de que el intestino realice una malabsorción por alguna enfermedad intestinal, o incluso puede deberse al desarrollado de cáncer.
Dolor abdominal : mediante esta prueba se puede observar si hay inflamación abdominal, lo que indicaría la presencia de alguna enfermedad en el intestino.
Preparación
La sigmoidoscopia requiere que el recto este vacío, de forma que antes de iniciarse la prueba el paciente recibirá un enema o laxante en el centro médico.
No debe acudir en ayunas, pero los días previos a la prueba es recomendable que evite consumir fibra y su dieta se base lo máximo posible en alimentos líquidos.
Si toma medicación habitual debe comunicárselo al médico por si es necesario suspender para la prueba.
En caso de sangrado excesivo o una diarrea aguda debe comunicarlo al médico, por si requiere suspender la prueba.
Cómo se realiza la prueba
La prueba se realiza mediante el sigmoidoscopio: instrumento médico flexible, similar al endoscopio, de unos 20 centímetros de largo y menos de 1 centímetro de diámetro, que se introduce por el ano. Lleva una cámara integrada que proyecta la imagen en una pantalla durante la prueba.
El paciente, tras haber vaciado el recto con el enema o laxante, debe ponerse una bata hospitalaria sin ropa interior, y recostarse en la camilla de forma lateral, apoyado sobre el lado izquierdo en postura fetal, con las rodillas flexionadas y agarradas por los brazos.
Lo primero será realizar un tacto rectal lubricado, para comprobar que no existe nada que pueda impedir el paso del sigmoidoscopio. Después se procederá a introducirlo, notando el paciente una sensación de presión en la zona baja del abdomen.
Se irá introduciendo el instrumento médico lentamente para observar toda la zona a analizar. Si durante la exploración se observa alguna anomalía que el médico determinase que es necesario analizar, tomaría una biopsia mediante unas pequeñas pinzas que tiene en el extremo el sigmoidoscopio. Si esto sucede el paciente sentirá un leve pinchazo que durará unos segundos.
Cuando se haya recorrido toda la zona, el sigmoidoscopio será retirado lentamente.
Complicaciones de una sigmoidoscopia
Las complicaciones durante la realización de una sigmoidoscopia son poco habituales, no obstante se puede producir una perforación en el recto o sigma que requiere de una cirugía de urgencia.
Tras la realización de la prueba es importante que el paciente tenga un dieta rica en fibra y fruta para evitar que se produzca un estreñimiento.
También puede aparecer algunos síntomas:
Sangrado en las heces, que deberá desaparecer a los pocos días.
Infección en la zona, para la cual deberá acudir al médico para tomar antibiótico.
Si presenta síntomas febriles, dolor o sangrado continuo del ano debe acudir al médico.
Resultados
La sigmoidoscopia permite al médico evaluar los resultados, de manera aproximada, al finalizar la prueba, de forma que el paciente puede iniciar un tratamiento si existe una enfermedad concreta.
En caso de que se haya realizado una biopsia de alguna zona, deberá acudir a una cita posterior para ver los resultados. Si la sigmoidoscopia no ha resultado concluyente el médico le mandará otras pruebas.
Preguntas frecuentes
¿Qué es la sigmoidoscopia flexible?
Es una prueba que se realiza mediante un instrumento flexible que lleva una cámara integrada, llamado sigmoidoscopio, el cual se introduce por el ano para observar las posibles alteraciones del colon sigmoide, el recto y el intestino grueso, al estar conectado a una pantalla.
¿Qué es un enema de bario y para qué sirve?
Es un tipo de radiografía gastrointestinal para el estudio del colon, intestino grueso y recto, en el que se suministra bario mediante una sonda de enema para observar en la radiografía si hay alguna obstrucción o alteración.
¿Qué es un enema opaco y cómo se hace?
Es igual que el enema de bario. Se suministra al paciente vía rectal el bario, mediante una sonda de enema, y se aplica aire para que se expanda y circule por los intestinos.
Durante este proceso se toman varias radiografías y se pide al paciente que se coloque en distintas posturas. Tras el proceso el paciente deberá ir al baño para expulsar la mayor cantidad de bario posible y realizar otras dos radiografías.
¿Qué es el enema baritado?
Es el enema opaco o de bario, que consiste en introducir bario en el cuerpo del paciente a través del ano para la observación radiológica.
¿Qué es un enema de retención?
El enema de retención se le administra al paciente y debe de aguantar la sustancia en el interior un mínimo de 30 minutos, mientras se realiza una prueba radiológica para ver el tracto intestinal.

Contenido de salud
Test de O'Sullivan
Definición
El test de O’Sullivan es una prueba médica no invasiva que suele realizarse a todas las mujeres embarazadas a partir del segundo trimestre de embarazo, ya que es el momento en el que los cambios hormonales propios de esta etapa generan una mayor resistencia a la insulina y por tanto mayores alteraciones de glucosa.
También se realizará en el primer y tercer trimestre de embarazo cuando existen factores de riesgo asociados. Los resultados del test de O’Sullivan determinan los valores de glucosa en sangre de la madre, detectando o descartando la presencia de diabetes gestacional , enfermedad grave durante el embarazo y el parto.
El test de O’Sullivan del embarazo se realiza tras el consumo de 50 gramos de glucosa pura.
Existe una variante del test de O’Sullivan del embarazo que determina la glucosa en sangre una hora después de un desayuno rico en hidratos de carbono. Esta prueba se puede llevar a cabo en cualquier momento del día.
Posteriormente la mujer debe usar un glucómetro para leer los niveles de azúcar desde casa, tanto en ayunas como después de las comidas.
Preparación
Una hora antes de la realización del test de O’Sullivan se debe ingerir 50 gramos de glucosa para calcular los niveles de glucosa en sangre, no es necesario estar en ayunas. Si la paciente se está medicando con algún fármaco, es conveniente informar a su doctor. Aunque la medicación no suele influir en la preparación del test de O’Sullivan, nunca está de más avisar.
Cómo se realiza el test de O´Sullivan
Esta prueba se lleva a cabo entre las semanas 24 y 28 de gestación , generalmente aprovechando el análisis de sangre que se realiza en el segundo trimestre. Se supone que son necesarias de 8 a 10 horas de ayuno previo, pero esto no se especifica en todos los centros de salud. Se realiza una extracción de sangre y se mide la glucosa en la misma; posteriormente, la paciente embarazada debe ingerir un líquido que contiene 50 gr. de azúcar disueltos en agua y una hora más tarde se vuelve a extraer sangre para medir de nuevo la glucosa que contiene. Para descartar una posible diabetes gestacional la glucosa en sangre debe ser menor a 140 mg/dl en las dos extracciones.
Complicaciones del test de O´Sullivan
Esta es una prueba sencilla y no trae consigo muchas complicaciones. Puede producir molestias a la hora de realizar la venopunción (extracción de sangre de una vena), que se soporta sin ningún problema, aunque a veces puede ser bastante dolorosa o en ocasiones se pueden producir también hematomas.
En ocasiones la paciente puede vomitar el agua glucosada antes de que se cumpla la hora o muchas veces , nada más ingerirla, anulando así la efectividad de la prueba. También se puede dar el caso que en ocasiones la paciente pueda tener náuseas y mareos durante buena parte del día tras la realización de la prueba.
Resultados
Con el resultado se puede identificar si es posible que la paciente sufra de diabetes gestacional, con esto se puede buscar el tratamiento necesario para tratar este tipo de diabetes. El test es positivo cuando es superior a 140 mg/dl, pero para confirmar el diagnóstico, tras un test de O´Sullivan positivo será necesario realizar el llamado test de tolerancia oral de la glucosa (TTOG) o curva de glucemia.
Preguntas frecuentes
¿Cuál es la diabetes gestacional?
Las pacientes que han desarrollado diabetes gestacional son aquellas que no son diabéticas antes del embarazo pero que, durante este, producen unos niveles de azúcar en sangre elevados.
¿Cuál es el examen de glucemia basal?
Es el examen que se realiza en ayunas para conocer la cantidad de glucosa que circula por la sangre. La persona no debe comer ni beber nada durante las 8 horas previas al análisis.
¿Qué le pasa al bebé cuando la madre tiene diabetes gestacional?
El bebé es más propenso a tener períodos de bajo nivel de azúcar en la sangre o hipoglucemia durante los primeros días de vida. Hay un leve incremento del riesgo de muerte del bebé cuando la madre padece diabetes gestacional sin tratamiento. La diabetes gestacional aumenta el riesgo de sufrimiento fetal, macrosomía, muerte intrauterina, partos por cesárea y problemas neonatales.
¿Cuándo hay un nivel alto de glucosa en la sangre?
La insulina es una hormona que produce el páncreas y es responsable de mantener los niveles «normales» de azúcar en sangre . Si hay un problema en el páncreas, es posible que los niveles de azúcar en sangre sean altos. Los niveles normales de glucosa o azúcar en sangre son de 70 a 110 mg/dl. Niveles por encima de estos pueden indicar hiperglucemia, siendo un factor de riesgo para el posible desarrollo de una diabetes en el futuro.
¿Cuáles son los tipos de diabetes?
Los diferentes tipos de diabetes son : diabetes tipo 1, diabetes tipo 2, diabetes MODY (tipo de diabetes de la edad madura que se presentan en la edad joven), diabetes relacionada con fibrosis quística, diabetes secundaria a medicamentos y diabetes gestacional.
Haz nuestro test de embarazo y averigua todo lo que debe saber una embarazada. Descubre todos los consejos y cuidados de las mujeres embarazadas.

Contenido de salud
Lavado Gástrico
Definición
El lavado gástrico es una técnica aplicada en medicina para vaciar el contenido del estómago, de forma que las sustancias no lleguen al tubo digestivo y evitar que sean absorbidas por el organismo.
Mediante la técnica del lavado gástrico se consigue la descontaminación del estómago, ocasionada por la ingesta voluntaria o involuntaria de sustancias tóxicas en el cuerpo del paciente.
Es de fácil ejecución y a su vez de gran eficacia, por lo que es una técnica aplicada de manera general en muchos hospitales.
Este tipo de técnica médica se realiza en diferentes situaciones, siendo las más frecuentes en urgencias ante un paciente que haya ingerido voluntaria o involuntariamente:
Una sobredosis de medicación.
Ingesta de sustancias tóxicas o venenosas para el organismo.
O ante pruebas médicas para:
Descartar la presencia de sangrado en el estómago.
Analizar los jugos gástricos.
Realizar una limpieza del estómago previamente a una gastroscopia.
Ante una obstrucción intestinal, para descomprimir el estómago.
Preparación
El lavado gástrico no requiere preparación ni ingreso hospitalario .
Si se realiza ante una intoxicación o sobredosis por emergencia médica , el paciente podrá ser hospitalizado, pero no por causas que engloben a esta prueba médica.
En caso de que el lavado gástrico sea planificado previamente por su médico , es recomendable acudir acompañado, ya que la prueba puede ser molesta.
Cómo se realiza un lavado gástrico
El procedimiento es sencillo, se introduce una sonda por la boca o nariz, la cual llega hasta el estómago, pasando por la faringe y el esófago .
A través de la sonda, se procede a extraer el contenido del estómago mediante la succión, recogiendo dicho contenido en una bolsa transparente que está en el otro extremo de la sonda.
En algunas ocasiones, si el médico lo considera necesario, se inyectará suero salino a través de la sonda, propiciando la presencia de agua en él para diluir todo el contenido, limpiando su interior en caso de ingestas tóxicas .
También puede darse el caso de introducir sustancias para neutralizar los tóxicos, como el carbón activado, ya que pertenece a una familia absorbente.
Para realizar el proceso con éxito debe realizarse antes que de que pase una hora desde la ingesta . Generalmente, se realiza un análisis de sangre antes y otro después, con ciertas horas de margen para comprobar que los parámetros se han estabilizado.
La sonda se puede dejar puesta en el paciente hasta que se asegure que no es necesario aplicar de nuevo el tratamiento.
Complicaciones del lavado gástrico
Es un procedimiento seguro y empleado muy a menudo, pero al tratarse de una técnica invasiva, su aplicación puede provocar en algunos casos complicaciones como:
Si la sonda pasa a la tráquea en vez de al estómago, puede provocar una neumonía.
Pasar el contenido del estómago al intestino delgado, al hacer presión con la introducción de la sonda.
Dolor en las cuerdas vocales.
Lesionar o provocar dolencias en las paredes del esófago o el estómago, al pasar la sonda.
Sangrado, si se rasga el tubo digestivo con la sonda, o se daña la nariz.
Efectos secundarios de la sedación.
Si ha pasado más de 1 hora desde la ingesta de las sustancias, al haberse iniciado ya el proceso de digestión.
Resultados
Principalmente los resultados del lavado gástrico se reflejan directamente en el paciente con una mejoría tras su tratamiento.
Las sustancias que se extraen del estómago no suelen ser analizadas, a no ser que se desconozca el origen de la intoxicación o por que se haya realizado como prueba médica para analizar los componentes gástricos.
Preguntas frecuentes
¿Cómo hacer un lavado gástrico con carbón activado?
El carbón activado es una sustancia que neutraliza los tóxicos que el paciente ha ingerido, de forma que a veces es necesario aplicarlo en un lavado gástrico.
Se inyecta a través de la sonda que llega al estómago y tiene la capacidad de eliminar la mayoría de los medicamentos y sustancias tóxicas ingeridas.
¿Es lo mismo lavado gástrico que lavado intestinal?
No. El lavado gástrico es una técnica que evita que sustancias tóxicas sean absorbidas por el organismo, vaciando el estómago por medio de una sonda, mientras que el lavado intestinal se basa en la aplicación de un enema para reactivar el flujo intestinal y facilitar la eliminación de residuos fecales.
¿Qué es la aspiración nasogástrica?
Es el proceso de succión por el cual se consigue extraer el contenido del estómago mediante la sonda.
¿Qué es una sonda nasogástrica?
Consiste en un tubo cilíndrico alargado y flexible, generalmente de plástico, que se introduce por la nariz o la boca hasta el estómago, pasando por la faringe y el esófago.
¿Qué es una sonda de Levin?
Es la sonda nasogástrica más empleada. Se utiliza para suministrar alimentos, extraer muestras de los jugos del estómago y la realización de lavados gástricos en los pacientes.
Tiene 4 orificios laterales y uno central, líneas de medición cada 10 centímetros y dependiendo del material de fabricación, así será su flexibilidad.
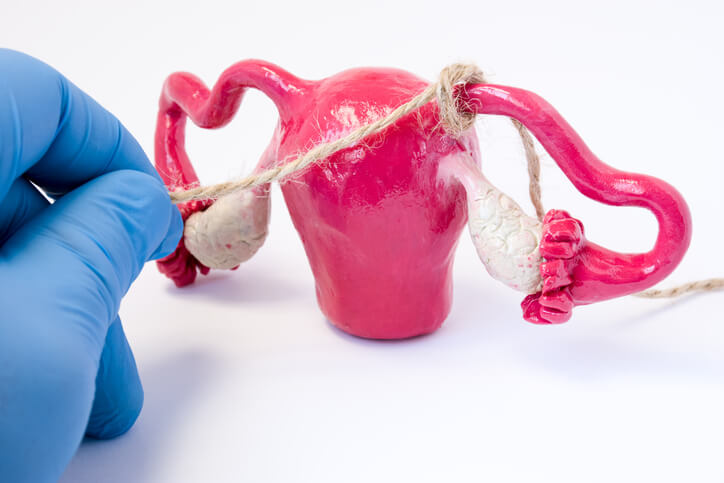
Contenido de salud
Ligadura de Trompas
Actualizado el día 30/08/2021
La ligadura de trompas es el método anticonceptivo más común en todo el mundo, situándose cerca del 20% de todos los métodos anticonceptivos utilizados por mujeres de hasta 49 años y que viven en pareja.
Se trata de un procedimiento quirúrgico que se usa como método de esterilización en la mujer y que consiste en interrumpir la conexión entre las trompas de Falopio y el útero para evitar que se produzca la fecundación. De este modo, se impide el embarazo de forma permanente.
¿Cómo se realiza la ligadura de trompas?
La intervención quirúrgica para la ligadura de trompas es rápida y eficaz y se puede realizar bajo anestesia general, anestesia local o anestesia raquídea.
Existen varias técnicas para para ligar o cerrar las trompas de Falopio , que incluyen cortar y anudar las trompas, dañar la trompa mediante el uso de corriente eléctrica, aplicar clips o anillos de silicona y bloquear las trompas con productos químicos o insertos tubáricos.
A través de las trompas de Falopio el óvulo progresa desde el ovario para ser fecundado. Si se interrumpe esta conexión se podrá evitar que la fecundación sea posible. Esto se puede lograr mediante diferentes métodos que suelen llevarse a cabo por laparoscopia. En la actualidad, los más utilizados son:
Salpingectomía parcial (o técnica Pomeroy). Se trata del procedimiento más habitual, consistente en cortar las trompas y atar sus extremos con un material de sutura. Existen diversas variaciones sobre esta técnica.
Oclusión tubárica . Consiste en la colocación de un anillo o grapa para obstruir las trompas y así impedir su funcionamiento. Este método es más fácil de revertir.
Electrocoagulación . Se utiliza una corriente eléctrica para cauterizar o quemar los extremos de las trompas de Falopio.
Se trata de técnicas muy eficaces con una tasa de fracaso (embarazo) a los 12 meses posteriores a la esterilización muy baja y una aparición de complicaciones graves muy poco frecuentes. La electrocoagulación se puede asociar con menos dolor postoperatorio que los métodos de Pomeroy o de anillo tubárico.
¿Por qué se realiza y para quién está indicada?
La ligadura de trompas es un método anticonceptivo definitivo adecuado para mujeres convencidas de no quedarse embarazadas en el futuro. De este modo, se trata de un método para evitar embarazos no deseados y un medio de planificación familiar.
En este sentido, es esencial que las mujeres que lo soliciten o a las que se les recomiende por parte de su médico dispongan de toda la información al respecto.
Entre esta información se debe exponer que los métodos anticonceptivos de acción prolongada, incluidos los dispositivos intrauterinos (DIU) y el implante anticonceptivo son al menos tan efectivos como la oclusión tubárica por laparoscopia y se asocian con menores complicaciones. Además, la esterilización tubárica no protege frente a las enfermedades de transmisión sexual, incluido el VIH.
Por otro lado, las mujeres sometidas a ligadura tubárica son menos propensas a desarrollar cáncer de ovario y enfermedad inflamatoria pélvica.
En algunos casos se produce el arrepentimiento de la paciente tras haberse sometido a la ligadura de trompas, por lo que es preciso recurrir a métodos de reproducción asistida. Cuanto más joven es la mujer, más habitualmente decidirá revertir la esterilización.
Riesgos de una ligadura de trompas
Las complicaciones laparoscópicas importantes incluyen cirugía mayor no planificada, daño de las estructuras circundantes, fiebre, infecciones y hemorragia.
Los riesgos de complicaciones aumentan con el uso de anestesia general, cirugía pélvica o abdominal previa y enfermedades como obesidad y diabetes.
También se puede producir un cierre incompleto de las trompas, lo cual podría hacer posible que se produjese un embarazo .
Recuperación de una ligadura de trompas
La recuperación en la mayoría de las pacientes es rápida, siendo normal la vuelta a casa el mismo día de la intervención.
La paciente presentará alguna sensibilidad y dolor que podrán ser aliviados mediante analgésicos. Podrá retornar a la mayoría de las actividades normales al cabo de unos cuantos días.
Resultados
La ligadura de trompas es un método anticonceptivo y de control de la natalidad eficaz. Los fallos de esterilización (embarazos) en el primer año después de la esterilización puede llegar a 5 de cada 1.000 procedimientos. Estos datos son comparables con las tasas de embarazo de las mujeres que utilizan métodos anticonceptivos de acción prolongada, como el dispositivo intrauterino (DIU) y el implante anticonceptivo. Sin embargo, la esterilización tubárica parece ser un método anticonceptivo más eficaz con el tiempo. Los fallos de esterilización pueden deberse a la concepción que se produce antes del procedimiento (el llamado embarazo en la fase lútea), la oclusión tubárica incompleta o la formación de fístulas.
Preguntas frecuentes
¿Es posible tener hijos después de una ligadura de trompas?
Sí. Existe la posibilidad de que la paciente pueda tener hijos gracias a la reversión de la ligadura de las trompas . Se trata de un procedimiento quirúrgico que se puede llevar a cabo si la paciente es menor de 50 años y no se ha extirpado la trompa o la parte distal de la misma. En esos casos sí se podría realizar una fecundación in vitro .
¿Desaparece la menstruación con la ligadura de trompas?
No. La paciente continuará con su ciclo menstrual normal, ya que los ciclos hormonales no se ven alterados. Los ovarios de la mujer siguen funcionando y, por tanto, la menstruación seguirá produciéndose cada mes.
¿Es cierto que la ligadura de trompas engorda?
No. La ligadura de trompas no determina un desequilibrio hormonal y no tiene por qué afectar al metabolismo de la mujer, ni aumentar su peso o causar una mayor retención de líquidos.
¿Existe algún beneficio para la salud derivado de la ligadura de trompas?
Uno de los beneficios de someterse a una ligadura de trompas es que disminuye el riesgo de padecer un cáncer de ovario.
¿Cuál es el precio de una ligadura de trompas?
El precio dependerá del lugar donde se realice la cirugía de ligadura de trompas y del método utilizado para realizar el procedimiento quirúrgico. Los precios pueden variar de 1.000 a 3.000 Euros, o incluso más.
¿Se puede hacer vida normal después de una ligadura de trompas?
La ligadura de trompas es un procedimiento rápido y básico que no tiene muchas complicaciones, por lo que la mayoría de las pacientes pueden continuar con su vida cotidiana después de realizarse el procedimiento.
Bibliografía
Sociedad Española de Ginecología y Obstetricia. Anticoncepción definitiva femenina mediante técnicas endoscópicas (enero de 2014). Prog Obstet Ginecol 2015; 58(1): 41-53 .
Sung S, Abramovitz A. Tubal Ligation. 2021 Jul 31. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan–. PMID: 31751063 .
Lawrie TA, Kulier R, Nardin J. Techniques for the interruption of tubal patency for female sterilisation. Cochrane Database of Systematic Reviews 2016, Issue 8. Art. No.: CD003034. DOI: 10.1002/14651858.CD003034.pub4 .

Contenido de salud
Naturopatía
Actualizado el 13/12/2021
La naturopatía surge en Alemania en el siglo XIX, si bien su mayor apogeo se produjo en Estados Unidos a principios del siglo XX. Algunos de sus tratamientos tienen siglos de antigüedad.
Además de los tratamientos tradicionales la naturopatía incorpora tratamientos innovadores.
¿Qué es la naturopatía?
La naturopatía, conocida también como medicina natural o naturista es un tipo de “medicina alternativa” que se encarga de curar al ser humano desde una perspectiva holística y natural. De este modo, se sirve de remedios naturales para ayudar al propio organismo a encontrar las vías de la curación.
Su principal aplicación se basa en recuperar la salud del paciente mediante la autorregulación, equilibrando el organismo, pero, sobre todo, desde un punto de vista preventivo.
De esta manera, no solo se centra en el tratamiento de la sintomatología, sino en averiguar las razones que llevan a desarrollar una patología y acabar con el problema desde la base.
Consta de una extensa variedad de técnicas, procedimientos y productos naturales que pueden ser útiles en el tratamiento.
Principios de la naturopatía
La naturopatía enfatiza la prevención, el tratamiento y la optimización de la salud mediante el uso de métodos terapéuticos que fomentan el proceso de autocuración inherente del organismo. La práctica de la medicina naturopática incluye métodos modernos y tradicionales.
Los siguientes principios son la base de la práctica médica naturista:
El poder curativo de la naturaleza.
Identificar y tratar las causas.
Primero, no hacer daño.
El Doctor es un profesor.
Tratar a la persona de forma global.
Prevención.
Técnicas terapéuticas de la naturopatía
Las principales técnicas contempladas por la naturopatía incluyen:
Modificación de la dieta y uso de complementos nutricionales . La nutrición clínica básica a menudo se considera una piedra angular de la medicina naturista. La ingesta nutricional saludable y el uso de suplementos son componentes importantes de la medicina naturista.
Fitoterapia . El uso de plantas medicinales en la naturopatía se basa en la tradición y también en la validación científica. Los naturópatas están capacitados en el uso apropiado de medicamentos de origen botánico.
Homeopatía . La homeopatía utiliza preparaciones que se diluyen y potencian teóricamente la curación del cuerpo. No está respaldada por evidencias científicas.
Acupuntura y Medicina China . Basado en el antiguo sistema de curación china, los naturópatas utilizan acupresión, acupuntura, hierbas chinas y recomendaciones dietéticas para restablecer el equilibrio y la armonía del cuerpo.
Hidroterapia . Los naturópatas a menudo utilizan el agua a diferentes temperaturas en diferentes tratamientos. Se trata de un enfoque terapéutico no invasivo que pretende estimular la capacidad curativa del cuerpo.
Medicina manipulativa y fisioterapia . Los naturópatas incorporan el masaje terapéutico y la manipulación articular en su enfoque terapéutico. También se pueden utilizar equipos de ultrasonidos y otras técnicas para estimular el proceso de curación.
Asesoramiento sobre estilo de vida . Los naturópatas utilizan el asesoramiento sobre el estilo de vida para educar a los pacientes en el entorno físico, emocional, dietético y ambiental que puedan estar involucrados en cualquier enfermedad. El manejo del estrés y otras intervenciones de asesoramiento a menudo se utilizan para abordar las actitudes mentales que pueden tener un impacto negativo en la salud del paciente.
¿Para quién está indicada?
Cualquier persona puede tratarse a través de la naturopatía, en función de las técnicas aplicadas. Puede ser compatible con la medicina tradicional.
Riesgos de la naturopatía
Existen riesgos cuando la práctica de la naturopatía la llevan a cabo personas no cualificadas. También existen riesgos por la elaboración errónea de los tratamientos y la posibilidad de lesionar al paciente, si se manipula el cuerpo de manera inapropiada.
Además, a pesar de que lo realice un experto, se pueden dar reacciones ante las terapias naturales por una mala combinación de plantas a la hora de elaborar los productos, así como por algún tipo de alergia.
Finalmente, sustituir tratamientos tradicionales por tratamientos naturistas puede suponer un riesgo para la salud. Por ello, todos los tratamientos naturales deben ponerse en conocimiento del médico de cabecera.
Preparación y recuperación
Antes de iniciar el tratamiento el paciente será evaluado en una consulta previa por el naturópata. La recuperación depende de cada paciente y la terapia aplicada.
Resultados
La naturopatía busca restablecer el equilibrio orgánico y psicológico del paciente, logrando reconducir los malos hábitos o aquellos que son perjudiciales para su salud. De este modo, la medicina naturista puede suponer un beneficio para la salud general del paciente. Es más discutible el efecto específico que puede ejercer sobre patologías concretas.
Preguntas frecuentes
¿Qué es un naturópata?
El naturópata es el nombre que recibe el especialista en naturopatía. Tiene conocimientos en diferentes ramas sanitarias y el cuerpo humano. A través del empleo de los recursos y técnicas naturales puede contribuir a prevenir y tratar ciertas patologías y disfunciones.
¿En qué materias es entrenado un naturópata?
El naturópata debe tener conocimientos sobre anatomía, nutrición, bioquímica, fitoterapia, además de especializarse en diferentes técnicas curativas como aromaterapia, iridología, oligoterapia o flores de Bach, entre otras. Muchas de estas técnicas no están respaldadas por la medicina convencional ni las autoridades sanitarias.
¿Cuál es la diferencia entre un médico y un naturópata?
El médico lleva a cabo el tratamiento del paciente de manera alopática, es decir, tratando los síntomas concretos que presenta en el momento que padece una enfermedad, con medicamentos o tratamientos médicos cuya efectividad ha sido demostrada.
Por su parte, el naturópata se centra en promocionar la salud del paciente, es decir, actúa de manera preventiva buscando el origen que le causa o le puede causar alguna enfermedad para que el paciente los corrija o evite, mejorando su salud. También aplica tratamientos naturales para paliar los síntomas durante la enfermedad, en ocasiones, sin rigor científico.
¿Qué herramientas emplea un naturópata?
Según el tratamiento y las necesidades del paciente el naturópata recurrirá a herramientas de diferentes ramas como la psicología, la nutrición, la acupuntura, la aromaterapia, la reflexoterapia, la medicina del color, las flores de Bach, etc.
Bibliografía
Atwood KC 4th. Naturopathy: a critical appraisal. MedGenMed 2003: 30;5(4): 39. PMID: 14745386 .
Smith MJ, Logan AC. Naturopathy. Med Clin North Am 2002; 86(1): 173-84. Doi: 10.1016/s0025-7125(03)00079-8 .
American Association of Naturopathic Physicians. Principles of Naturopathic Medicine. Consultado: 02/12/2021 .

Contenido de salud
Otoscopia
Definición
La otoscopia consiste en el examen físico del oído, desde su conducto externo situado en la oreja, hasta el conducto medio y la membrana del tímpano.
Para realizar la prueba el médico necesita un instrumento llamado otoscopio.
El otoscopio, es un instrumento médico con un grosor de unos 2 cm y cabezales huecos de diferentes diámetros, que permite observar el interior del oído, mediante el examen físico de la otoscopia.
El cabezal consta de dos partes, un lado fino que es el que se introducirá en el oído; y en la otra parte una lente transparente por la cual se ve el interior.
Para realizar la otoscopia es muy importante contar con una buena iluminación, por lo que los otoscopios cuentan con luz propia para facilitar el trabajo del médico.
Fases de la otoscopia
La otoscopia cuenta con dos fases a analizar:
Oído externo: se observan las características de la piel, la simetría con la otra oreja, la presencia de bultos o malformaciones, el lóbulo, es decir la anatomía de la oreja, y a su vez el conducto auditivo externo (CAE).
Oído medio: se observa la membrana timpánica (MT), y, en algunos casos, la cadena de huesecillos (martillo, yunque y estribo).
Oído interno: no es observable mediante una simple otoscopia, por lo que en caso necesario se derivarán pruebas para ello como una resonancia magnética.
Preparación
La otoscopia es una examen médico que se realiza de manera común en cualquier consulta médica.
El paciente no requiere una preparación para la realización de la prueba, y no está contraindicada en ningún paciente, aunque se evita realizarla en aquellos recién operados de los oídos o con una otitis muy aguda.
Cómo se realiza una otoscopia
La otoscopia se inicia con una exploración externa de la oreja y el conducto auditivo, de manera que el médico palpará esta zona.
Después, con el empleo del otoscopio y eligiendo el cabezal que más se adapte al diámetro del oído del paciente, explorará el conducto auditivo y el oído medio, introduciendo el cabezal, mientras tira suavemente de la oreja para facilitar la visibilidad.
Observará primero el conducto auditivo, el cual deberá tener un color rosado y poca cera, y después el tímpano, comprobando que no esté inflamado. También observará que las estructuras siguientes (apófisis, mando del martillo, umbo y cono luminoso) se mantengan en la posición adecuada. Por último mirará el otro oído para compararlos, limpiando previamente el cabezal.
Los principales aspectos a observar durante la otoscopia son:
Color y apariencia: debe ser translúcido, dejando pasar la luz para ver el interior, y de color blanquecino nacarado con vasos sanguíneos.
Movilidad de la membrana timpánica: aplicando presión se deberá mover por las vibraciones, primero hacia dentro y luego hacia fuera.
Posición de la membrana timpánica: debe ser cónica, siendo la parte más alejada el llamado umbo. La membrana timpánica puede estar normal, retraída o abombada.
Triángulo luminoso: brillo producido por la reflexión de la luz del otoscopio.
Complicaciones de una otoscopia
Al tratarse de una exploración sencilla, no suelen presentarse graves complicaciones, pero bien es cierto que pueden darse algunas como:
Traspasar la infección de un oído al otro si no se limpia el cabezal.
Dolor e irritación tras la exploración con el otoscopio, sobretodo si hay infección.
Posible perforación del tímpano, muy poco frecuente, ya que los cabezales son de pequeña longitud.
Resultados
La observación del oído externo y medio mediante la otoscopia, permite la evaluación en el momento de las posibles alteraciones que presente el paciente.
Tras la otoscopia el médico redacta un informe con las alteraciones que haya observado durante la exploración, obteniendo el diagnóstico de manera inmediata y por consiguiente el tratamiento en caso necesario.
Preguntas frecuentes
¿Qué se ve en una otoscopia?
Mediante la otoscopia se puede observar el oído desde la oreja hasta la membrana timpánica (MT), incluyendo el conducto auditivo externo (CAE).
De esta forma se pueden diagnosticar infecciones locales u alteraciones en el oído, de una forma sencilla.
¿Qué es una otoscopia normal?
Si tras la otoscopia el médico determina que es normal, significa que no hay alteraciones en el conducto auditivo ni la membrana timpánica.
De forma que el conducto auditivo externo (CAE), tendrá un color rosado y el cerumen no será excesivo, y por su parte, la membrana timpánica (MT) no estará inflamada ni enrojecida.
¿Qué es una otoscopia bilateral?
La otoscopia bilateral es la que se realiza en ambos oídos para comparar el estado de uno con el otro. Casi todas las otoscopias son bilaterales para tener una comparativa acorde al paciente.
El médico deberá tener cuidado, y limpiar el cabezal del otoscopio cuando pase de un oído a otro, ya que si no puede transferir la infección al el oído sano.
¿Qué es una otoscopia neumática?
La otoscopia neumática se utiliza para comprobar la movilidad de la membrana timpánica (MT).
Se usa un otoscopio neumático, el cual se caracteriza por tener conectado un tubo de caucho que termina en una pera de goma, la cual permite variar las presiones en el oído al bombear aire, y así se pueden observar las vibraciones del tímpano y el oído medio.

Contenido de salud
Vacuna Neumococo
Definición
Se entiende por vacuna, cualquier preparación destinada a generar inmunidad (defensas de recuerdo) contra una enfermedad estimulando la producción de anticuerpos (que son proteínas del sistema inmune que reconocen el microorganismo que produce la enfermedad, activando al sistema inmune para que lo destruya).
La vacuna del neumococo va destinada a provocar una reacción inmunológica controlada contra esa bacteria. El neumococo ( Streptococcus pneumoniae) , de la que existen 90 subtipos diferentes con distinta agresividad, es responsable de posibles infecciones graves en los pulmones (neumonía), en la sangre (sepsis) y en las membranas que cubren el cerebro (meningitis). Así, el cuerpo puede tener memoria de cómo es esa bacteria y si vuelve a tomar contacto con ella, está más preparado para poderla eliminar. Las vacunas existentes tienen el inconveniente de no cubrir la mayoría de los subtipos de neumococo.
En la actualidad, existen dos tipos de vacunas del neumococo: polisacáridas o conjugadas:
Vacuna antineumocócica polisacárida 23-valente: esta vacuna protege frente a 23 subtipos de neumococo, entre los que se encuentran el 90% de los que producen infecciones graves. Es efectiva en la mayoría de los adultos sanos de 2 a 3 semanas después de su administración. Tiene el inconveniente de que algunos grupos de población como menores de 2 años, personas muy ancianas o pacientes con enfermedades crónicas de larga evolución, pueden no responder adecuadamente a la vacuna. Su protección cubre hasta alrededor de los 5 años tras su administración en adultos sanos.
Vacuna antineumocócica conjugada 13-valente: esta vacuna protege frente a 13 subtipos de neumococo. También existe la 10-valente: ésta protege frente a 10 subtipos de neumococo. Se ha demostrado efectiva en la prevención de las enfermedades producidas por esta bacteria en las primeras etapas de la vida ya que consigue una respuesta inmunológica muy buena en los niños menores de dos años. Su cobertura de protección inmunológica es a largo plazo. Ha demostrado eficacia en la prevención de enfermedades graves (como meningitis o sepsis), en parte de las neumonías que puede producir el neumococo y protección moderada frente a otitis media-aguda causada por esta bacteria.
Administración de la vacuna del neumococo
Vacuna antineumocócica polisacárida 23-valente: se recomienda la vacuna en personas de 2 años o mayores que presenten un mayor riesgo de padecer enfermedades graves producidas por el neumococo, y muerte por la enfermedad. Esta vacunación se añadiría a la administración de la vacuna antineumocócica conjugada 13-valente. Se administra una dosis.
Vacuna antineumocócica conjugada 13-valente: Esta vacuna está incluida en los calendarios de vacunación sistemática infantil de todas las comunidades autónomas en España. La pauta de vacunación es a los 2 meses de edad, a los 4 meses y una tercera dosis de refuerzo que se puede administrar entre los 11 y los 15 meses de edad. Los niños que no son vacunados en estas edades pueden recibir igualmente la vacuna. La cantidad de dosis y el intervalo entre ellas dependen de la edad del niño.
La vía de administración de la vacuna es por medio de una inyección intramuscular, en los lactantes en la zona anterolateral del muslo y en los niños mayores o adultos, en la región superior del brazo.
¿Para quién está indicada?
La vacuna conjugada 13-valente está indicada en todos los calendarios de vacunación infantil de todas las comunidades autónomas de España.
También se recomienda, está financiada por la Seguridad Social en todas las comunidades autónomas, la vacuna polisacárida 23-valente para adultos. Además, algunas comunidades autónomas financian una pauta mixta con la vacuna conjugada (una dosis) y vacuna de polisacáridos (una dosis separada un año de la anterior), para los grupos con mayor probabilidad de sufrir una enfermedad neumocócica grave .
¿Por qué se realiza?
La enfermedad neumocócica es la principal causa de mortalidad potencialmente prevenible mediante vacunación en el mundo .
Riesgos de la vacuna del neumococo
Aunque la vacuna se considera muy segura, en ocasiones pueden aparecer algunas reacciones adversas como: enrojecimiento leve y dolor en el lugar de la inyección (son raras las reacciones locales más pronunciadas), fiebre o dolores musculares. Es muy infrecuente las reacciones alérgicas fuertes.
Como ocurre con todos los medicamentos, existe un riesgo muy pequeño de que ocurra algún problema grave o incluso la muerte después de la vacunación , pero este riesgo es siempre mucho menor que el derivado de contraer la enfermedad .
Preparación
No hay una preparación específica, aunque siempre hay que informar a los profesionales sanitarios de las enfermedades que se padecen ya que las vacunas no se deben administrar o se debe hacer con mucha precaución en pacientes que tienen algún trastorno de la coagulación de la sangre o pacientes con plaquetas bajas . Además, no se debe realizar la vacunación cuando se tienen enfermedades infecciosas agudas o fiebre alta.
¿Cómo es la recuperación de la vacuna del neumococo
Habitualmente el lactante o adulto puede tener un pequeño enrojecimiento en la piel en la zona donde se ha administrado la vacuna. Puede aparecer dolor y leve endurecimiento en la zona y, en ocasiones, los pacientes pueden tener febrícula (fiebre prolongada) o fiebre durante algún día después de la vacunación para lo que podrá tomar un antitérmico .
Resultados
Está científicamente demostrado que la vacunación frente al neumococo sirve para la prevención de las enfermedades potencialmente graves producidas por el neumococo y la disminución de la mortalidad por este motivo.
Preguntas frecuentes
¿ Cuántas son las dosis de la vacuna neumococo?
De la vacuna polisacárida 23-valente se administra, cuando es preciso ponerla, una dosis. De la vacuna conjugada 13-valente se administran una dosis a los 2 meses, otra a los 4 meses, y posteriormente una tercera dosis de recuerdo entre los 11 y los 15 meses .
¿Qué es la vacuna neumocócica conjugada?
Se trata de un tipo de vacuna existente frente a la bacteria neumocócica ( Streptococcus pneumoniae). Hay dos tipos: la conjugada 10-valente, y la conjugada 13-valente que es la que se administra en el calendario de vacunación infantil. Es válida frente a 13 subtipos de neumococo, y se utiliza para la prevención de enfermedades producidas por esa bacteria como neumonía, otitis media aguda, infección invasora neumocócica, en niños desde los 2 meses hasta los 17 años. También está indicada para la prevención de neumonía y de la enfermedad invasiva en adultos de 50 años con patologías de base de alto riesgo .
¿Cómo se transmite el virus del neumococo?
El contagio se produce de una persona a otra por contacto cercano a través de las secreciones respiratorias cuando se tose o se estornuda .
¿Qué es el meningococo C?
El meningococo C es una bacteria del grupo Neisseria Meningitidis . Puede causar una enfermedad grave neurológica llamada meningitis .
¿Cuál es la vacuna para la meningitis?
Hay varios gérmenes que pueden causar meningitis. Las vacunas que se utilizan para su prevención son la vacuna frente al meningococo (para varios subtipos), la vacuna frente al neumococo y la vacuna frente a Haemophilus Influenzae tipo B . Hay otras bacterias que pueden producir la meningitis, pero no existen vacunas para ellas.
 Savia
Savia