Ginecología y Obstetricia
La especialidadArtículos especializados
Enfermedades
Síntomas
Otros contenidos
Artículo especializado
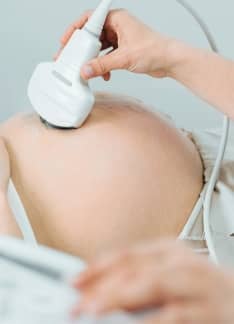
Histerosonografía: ¿Qué es y cómo se realiza?
La histerosonografía forma parte integral de la ecografía ginecológica y de las técnicas utilizadas para el estudio de la cavidad endometrial.
¿Qué es la histerosonografía?
La histerosonografía (también denominada sonohisterografía o ecografía de infusión salina) es un procedimiento para la evaluación de la cavidad uterina mediante la introducción de suero salino fisiológico a través del cérvix con ayuda de una cánula. Sirve así para mejorar la visualización del endometrio durante la realización de una ecografía transvaginal.
Se trata de una técnica utilizada para la detección más eficiente de patologías endometriales, incluyendo pólipos, hiperplasias, leiomiomas y cáncer, entre otras. Además, es un procedimiento mínimamente invasivo, de menor duración que una histeroscopia, y que es bien tolerado por la mayoría de las pacientes.
Por otro lado, existen técnicas como la histerosalpingografía, más compleja que la histerosonografía, basadas en la utilización de contraste ecográfico, empleando radiación ionizante, que suele indicarse para evaluar la permeabilidad tubárica de las trompas de Falopio (vital para el correcto desplazamiento del óvulo hasta su implantación en el endometrio) en pacientes con infertilidad.
¿Para qué sirve la prueba de histerosonografía?
Su objetivo principal es visualizar la cavidad endometrial con detalle y sin el uso de radiación ionizante o agentes de contraste radiológico como sucede en otras técnicas.
La prueba está indicada en los siguientes casos:
Sangrado uterino anormal.
Evaluación de la cavidad uterina, especialmente en la sospecha de miomas uterinos, pólipos endometriales y sinequias.
Anomalías endometriales detectadas en la ecografía endovaginal.
Patología uterina benigna.
Infertilidad, especialmente en mujeres con fallo de implantación recurrente en ciclos de fertilización in vitro.
Pérdida recurrente de la gestación.
Visualización dificultosa del endometrio en la ecografía endovaginal convencional.
Qué detecta la histerosonografía
Entre los hallazgos específicos que permite la técnica, los cuales no se podrían encontrar mediante otras técnicas más simples, se encuentran los siguientes:
Pólipos endometriales
Se trata del hallazgo uterino anormal más frecuente. Se asocian con sangrado intermenstrual y reducción en las tasas de implantación en casos de fecundación in vitro, aunque también pueden permanecer asintomáticos.
Hiperplasia endometrial
La hiperplasia endometrial se sospecha cuando existe un endometrio irregular. Se trata de un diagnóstico que debe ser confirmado por el estudio histológico de una muestra de tejido endometrial.
Adherencias/sinequias uterinas
Las adherencias intrauterinas son una causa de amenorrea e infertilidad y podrían ser el resultado de una endometritis o infección pélvica. La histerosonografía es una prueba adecuada para el diagnóstico de adherencias intrauterinas.
Anomalías uterinas congénitas
Las anomalías congénitas uterinas pueden ser causa de abortos recurrentes o infertilidad. La histerosonografía puede proporcionar información precisa sobre anormalidades uterinas y contribuir a su clasificación.
Leiomiomas (fibromas)
Los leiomiomas son tumores de naturaleza benigna que se producen en el miometrio. En función de su ubicación, tamaño y número las repercusiones clínicas variarán, incluyendo los abortos recurrentes, la infertilidad y las complicaciones obstétricas como el parto prematuro.
Factor tubárico
Los factores tubáricos son responsables de aproximadamente un tercio de la infertilidad femenina. El estudio de la permeabilidad tubárica es parte de la investigación que se lleva a cabo cuando existen problemas de fertilidad mediante técnicas basadas en la histerosonografía que incorporan otros medios de contraste.
¿En qué consiste la prueba de histerosonografía?
La prueba se lleva a cabo en el momento de la consulta y con un transductor endovaginal de alta frecuencia.
Tras el estudio ecográfico preliminar, se procede a la colocación de un espéculo que permite la visualización del cuello uterino. Luego se realiza una desinfección del orificio cervical externo y la vagina.
A continuación, se lleva a cabo la colocación de un catéter intracervical por el que se introduce, bajo control ecográfico, el líquido estéril (solución fisiológica) que distiende la cavidad uterina.
Con la técnica de visualización en 2D se evalúa la cavidad uterina durante la introducción del líquido. Por otro lado, la ecografía 3D permite además la captura del volumen del útero en pocos segundos, pudiendo almacenar el conjunto de datos para analizarlo una vez finalizado el procedimiento.
La técnica de histerosonografía es especialmente útil para la visualización de patologías intrauterinas. Además, el empleo de medios de contraste (gel-espuma) basados en soluciones de burbujas de aire y suero fisiológico pueden aumentar la precisión del método diagnóstico. Sin embargo, no es eficaz en la determinación y evaluación de la permeabilidad de las trompas de Falopio.
Efectos adversos y complicaciones de la histerosonografía
Existen situaciones en las que no se puede llevar a cabo la técnica. Entre ellas se incluyen:
Incompetencia cervical.
Estenosis cervical.
Miomas
Sinequias o síntomas que obligan a la finalización la prueba.
En cuanto a los efectos adversos, los más frecuentes suelen ser el dolor pélvico y los síntomas que incluyen sudoración, náuseas, lipotimias y bajadas de tensión. Estos suelen aparecer en menos del 10% de las pacientes y de forma severa en aproximadamente el 1%.
Los efectos adversos suelen ser más frecuentes en mujeres que todavía no han dado a luz y mujeres que ya han pasado la menopausia.
Otras complicaciones poco frecuentes que dificultan la técnica son la salpingitis o inflamación de las trompas de Falopio, la enfermedad inflamatoria pélvica y la peritonitis.
Contraindicaciones
En cuanto a las contraindicaciones que recomiendan no realizar la prueba se encuentran:
El embarazo.
Cáncer en el tracto reproductor.
Historial con infección pélvica documentada.
Infecciones vaginales recurrentes.
Pacientes con patología tubárica.
Pacientes con factores de riesgo, como enfermedades cardiovasculares, hipertensión arterial o ictus, entre otras.
Sangrado vaginal abundante.
Artículo especializado
Saco vitelino: ¿Qué es?
Para el desarrollo del embrión y del feto, que dará lugar al nacimiento de una nueva vida a los 9 meses, se crean una serie de estructuras capaces de proteger y nutrir al feto durante su desarrollo y que se van modificando conforme avanza la gestación. Una de estas estructuras es el saco vitelino.
¿Qué es el saco vitelino?
El saco vitelino (también denominado vesícula vitelina) se trata de una estructura embrionaria con forma de saco o bolsa adjunta al embrión que aparece en las primeras semanas de gestación y que es visible durante las primeras ecografías. Su evolución puede servir como marcador del progreso del embarazo en sus primeras etapas.
Esta estructura tiene el objetivo de transferir nutrientes y oxígeno. Su presencia es fundamental para el desarrollo de la placenta y para establecer una circulación normalizada entre esta y el embrión.
El saco vitelino se encuentra conectado a la abertura umbilical del embrión. Se forma en torno a la cuarta semana de embarazo y está rodeado de una membrana delgada que contiene líquido en su interior y presenta una pared interna rica en vasos sanguíneos.
¿Cuál es la función del saco vitelino?
La principal función del saco vitelino es proporcionar los nutrientes y el oxígeno necesarios para que el embrión se desarrolle. También se encarga de producir las células sanguíneas para la formación de la placenta y las células sexuales que migrarán hacia las gónadas primitivas del embrión para dar lugar al desarrollo de sus órganos sexuales. Además, se encarga de eliminar los desechos metabólicos y el CO 2 , tratándose de una estructura visible en la ecografía dentro del saco gestacional.
Saco vitelino en la ecografía
En el seguimiento médico del embarazo, la vesícula vitelina puede servir, junto a otros elementos e indicadores, como marcador de la correcta evolución del embarazo durante los primeros tres meses.
La ecografía transvaginal muestra el saco gestacional que puede identificarse ya con 2-3 mm de diámetro a las 2-3 semanas de embarazo (4-5 semanas desde la fecha de la última menstruación). El saco vitelino es la primera estructura que puede identificarse en el interior del saco gestacional. Se identifica como una estructura quística redondeada, de pared fina, dentro del saco cuando este alcanza los 6-8 mm, a partir de las 3,5 semanas de embarazo.
El saco vitelino crece a un ritmo de 1 mm por semana hasta alcanzar 6 mm en la semana 10 y disminuye a partir de entonces, no siendo visible ya a las 12-13 semanas. Con 5 semanas de gestación, es posible observar por ecografía la vesícula vitelina dentro del saco gestacional, confirmando de esta manera que hay embrión y que la gestación es evolutiva (de lo contrario, podría suceder que el embrión no se desarrolle, dejando un saco gestacional vacío). El embrión se observa como una estructura de unos 2-3 mm, junto al saco vitelino. La forma y el tamaño desarrollado del saco vitelino son importantes, ya que pueden indicar que existe algún problema en el desarrollo del embarazo.
Después de cumplir con su función de nutrir, oxigenar y recoger los deshechos del embrión, el saco vitelino suele desaparecer hacia la semana 12 de embarazo. Tras ello, la placenta debe haberse desarrollado adecuadamente para asumir esas funciones.
¿Qué pasa si no desaparece el saco vitelino?
En torno a la semana 12 de embarazo el saco vitelino desaparece, pasando a desempeñar sus funciones la placenta, que hasta ese momento estaba en desarrollo.
Efectivamente, el tamaño puede indicar un problema, especialmente cuando el diámetro del saco es superior a 9 mm o inferior a 3 mm después de la quinta semana. De igual modo, si el saco vitelino no desaparece y sigue estando presente después del primer trimestre de embarazo puede ser indicativo de problemas que suelen desencadenar un aborto natural, habitualmente porque el embrión no se ha podido llegar a desarrollar.
Artículo especializado
Asfixia perinatal: ¿Qué la causa?
El aporte de oxígeno y nutrientes durante el embarazo es esencial para el correcto desarrollo del feto y para que el nacimiento tenga lugar de manera óptima. Las interrupciones o la disminución del aporte de oxígeno en momentos próximos al parto pueden dar lugar a complicaciones como la asfixia perinatal.
¿Qué es la asfixia perinatal?
La asfixia perinatal se produce cuando el feto experimenta una falta de oxígeno alrededor del momento del nacimiento. Esta condición puede provocar una hipoxemia o disminución de la cantidad de oxígeno en la sangre fetal, paralelamente a una hipercapnia o aumento del CO 2 con acidosis metabólica significativa.
Además de los daños cerebrales, que pueden conducir a una parálisis cerebral , la asfixia perinatal, para ser diagnosticada como tal, debe provocar una afectación hipóxico-isquémica de al menos otro órgano o sistema.
De este modo, los mecanismos que pueden provocar problemas en el feto son la hipoxemia y la isquemia o disminución de la perfusión de sangre necesaria para mantener la integridad funcional de los tejidos.
¿Qué causa la asfixia perinatal?
La insuficiencia placentaria suele ser la causa más habitual de la asfixia perinatal. Esta situación determina la dificultad para aportar el oxígeno y eliminar el dióxido de carbono de la sangre fetal. También se puede dar un problema en el feto a nivel respiratorio o cardiovascular.
Por otro lado, entre las patologías de la madre que pueden provocar la asfixia perinatal por medio de un aporte insuficiente de sangre y oxígeno a la placenta, se pueden incluir entre otras:
Hipertensión o diabetes pregestacional mal controladas.
Enfermedades pulmonares o cardíacas.
Hipertensión pulmonar.
Anemia.
Infecciones.
La asfixia perinatal también puede acontecer por causas de naturaleza exclusivamente fetal, incluyendo:
Anemia fetal.
Infecciones.
Hídrops.
Malformaciones y problemas cardíacos.
Finalmente, los eventos que pueden provocar una disminución de oxígeno en el feto alrededor del parto capaces de dañar a un feto neurológicamente intacto incluyen:
El desprendimiento prematuro de la placenta.
La ruptura uterina.
El prolapso de cordón umbilical.
El embolismo de líquido amniótico.
La exanguinación fetal por la existencia de vasa previa con vasos fetales desprotegidos.
La hemorragia feto-materna.
Síntomas de la asfixia perinatal
La manifestación de la asfixia perinatal se produce por medio de hipoxemia, hipercapnia y acidosis láctica por una perfusión tisular disminuida. Sin embargo, la identificación de la asfixia perinatal en ocasiones es complicada. Cuando tiene lugar, permitiendo actuar de manera precoz, existe la posibilidad de revertir la situación sin repercusiones para el feto y continuar con el parto de manera segura.
Los síntomas y signos que pueden aparecer dependerán del grado de asfixia que se haya dado en el feto:
En la asfixia perinatal leve el recién nacido puede presentar unos reflejos afectados, junto con anormalidades de comportamiento. Normalmente estos síntomas suelen desaparecer en 24 horas.
En la asfixia perinatal moderada pueden darse reflejos disminuidos, apnea y convulsiones. Se trata de síntomas que suelen remitir en las primeras dos semanas.
En la asfixia perinatal severa la encefalopatía hipóxico-isquémica grave puede determinar síntomas como respiración irregular, perturbación del movimiento ocular y estado de coma, entre otros.
Prevención y tratamiento de la asfixia perinatal
La prevención de la asfixia perinatal incluye todas las medidas de un buen cuidado prenatal y de atención del parto. Los antecedentes perinatales permiten identificar a gran parte de los niños que pueden nacer con asfixia. Algunas pruebas que pueden contribuir a identificar al feto con riesgo de asfixia incluyen la medición de la altura uterina, el análisis de líquido amniótico, los movimientos fetales disminuidos y la frecuencia cardíaca.
En caso de que la frecuencia cardíaca fetal se encuentre alterada intraparto se puede realizar una toma de sangre procedente del cuero cabelludo fetal y medir el pH, cantidad de oxígeno y C0 2 . De esta forma se puede tener una prueba directa de que está teniendo lugar sufrimiento e hipoxia fetal para poder proceder de forma inmediata a la extracción del recién nacido por la vía más rápida (cesárea o vía vaginal en función de la situación fetal en la pelvis materna).
Esto permite estar preparados para llevar a cabo una buena reanimación y a un eventual traslado del recién nacido a la Unidad de Cuidados Intensivos.
La asistencia en las primeras 6 horas de vida del recién nacido con asfixia perinatal es fundamental. Tras la estabilización inicial, se debe proceder a la monitorización de diversas funciones fisiológicas, incluyendo la frecuencia cardiaca, la tensión arterial, la función respiratoria y la temperatura.
Este último aspecto es de especial relevancia ya que, por cada incremento de 1°C en la temperatura del recién nacido, el riesgo de muerte o discapacidad neurológica aumenta de forma significativa. De este modo, el traslado del recién nacido a la unidad neonatal debe producirse con la cuna de transporte apagada, monitorizando durante las primeras horas la temperatura rectal con el objetivo de evitar la hipertermia. Por este motivo, una de las terapias que se emplean para los recién nacidos con hipoxemia severa es la hipotermia.
Por otro lado, cuando se ha producido una agresión hipóxico-isquémica, el cerebro es particularmente vulnerable a otros factores que pueden contribuir al daño del sistema nervioso central. Entre estos factores se encuentran la hipoglucemia, la hipocapnia y la hiper/hipoxia.
Finalmente, junto con la monitorización de las constantes vitales y de los factores comórbidos a través de la analítica, el aspecto clave consiste en establecer si el recién nacido con asfixia perinatal presenta o no encefalopatía aguda.

Artículo especializado
Distocia: tipos y diagnóstico
La distocia o parto distócico forma parte de las complicaciones que se pueden producir durante el alumbramiento. En este caso, relacionadas con la disposición del bebé y el canal y el trabajo de parto.
¿Qué es la distocia?
La distocia o distocias son anomalías en la progresión del trabajo de parto.
Estas anomalías en la progresión del parto suelen afectar a cerca del 20% de los nacimientos. El principal factor de riesgo para que se produzcan es que la mujer sea primípara.
La distocia fetal puede deberse a un tamaño anormalmente grande o una disposición o colocación especial dificultosa para el parto.
Cuando un parto se prolonga o queda detenido por causas como la distocia, una de las posibles soluciones es la práctica de una cesárea de urgencia.
Tipos de distocia
La distocia fetal tiene lugar cuando el feto es demasiado grande para el estrecho superior de la pelvis o su posición es anormal. De este modo, los tipos de distocia que se pueden presentar incluyen:
Desproporción feto-pelviana . Si el trabajo de parto presenta un progreso normal y el peso fetal es inferior a 5 kg, el parto puede continuar con seguridad. Si el progreso es más lento que el esperado en la segunda etapa del trabajo de parto, se debe determinar si se requiere un parto vaginal operatorio instrumental (con fórceps o extractor por vacío).
Presentación del feto con occipucio posterior . Se trata de la presentación anormal más común. El cuello fetal se presenta levemente flexionado, por lo que es mayor el diámetro de la cabeza que debe pasar por el canal de la pelvis. La mayoría de las presentaciones de occipucio posterior requieren un parto vaginal operatorio (instrumental) o una cesárea.
Presentación del feto de frente o de rostro . La cabeza aparece hiperextendida y la posición es designada por el mentón. Cuando el feto no flexiona el cuello y en lugar de presentar la parte posterior de la cabeza presenta la cara, el diámetro de la cabeza es mayor, por lo que el paso a través de la pelvis materna es más difícil. La mayor parte de los partos en presentación de cara pueden transcurrir por vía vaginal. Cuando la barbilla fetal se encuentra en disposición lateral o hacia abajo, la cabeza suele rotar hasta que la barbilla se coloca mirando hacia arriba. La barbilla se apoya en el pubis materno y flexiona, si esto no ocurre, la vía de parto sería una cesárea.
Presentación podálica o de nalgas . Se trata de la segunda presentación anormal más común. Dentro de esta se puede dar la presentación pelviana franca, con las caderas del feto flexionadas y las rodillas extendidas. En la presentación pelviana completa el feto parece estar sentado con las caderas y las rodillas flexionadas. Finalmente, se puede dar la presentación de uno o ambos pies. La presentación podálica puede ser problemática porque la parte de presentación es una mala cuña de dilatación y puede hacer que la cabeza quede atrapada durante el parto y comprima el cordón umbilical, causando hipoxemia fetal.
Distocia de hombros
Se trata de una condición infrecuente en la que el hombro fetal anterior queda atascado detrás de la sínfisis pubiana después de la salida de la cabeza, requiriendo maniobras obstétricas adicionales para producir la expulsión fetal tras la salida de la cabeza.
Los riesgos de lesiones del plexo braquial o fracturas óseas, así como la mortalidad neonatal aumentan. Para la madre, puede determinar la aparición de hemorragia posparto, lesiones perineales y del esfínter, separación de la sínfisis del pubis y neuropatía cutánea femoral lateral asociada con la hiperflexión de las piernas.
Los factores de riesgo para que se produzca la distocia de hombros incluyen:
Tamaño grande del feto.
Obesidad o diabetes materna.
Distocia de hombro en embarazos anteriores.
Trabajo de parto rápido o prolongado.
Una vez identificada la distocia de hombro deben ponerse en práctica varias maniobras para desencajar el hombro, incluyendo la hiperflexión de los muslos de la mujer, la compresión suprapúbica para rotar y desencajar el hombro y la introducción de una mano en la cara posterior de la vagina para flexionar el hombro fetal para rotar al feto en la dirección que resulte más sencilla. La última maniobra sería colocar a la madre en posición de cuadripedia (siempre y cuando las extremidades inferiores no se encuentren bajo los efectos de la anestesia epidural).
Cuando las maniobras resultan ineficaces, se revierten los movimientos del trabajo de parto, recolocando la cabeza en la vagina o el útero para proceder a una cesárea.
Causas de la distocia
Las principales causas de la aparición de distocia incluyen:
Disminución de la contractilidad del útero . Se trata de la causa principal de la prolongación o la detención del parto en la fase de dilatación.
Desproporción céfalo-pelviana . En este caso, existen dificultades para que la cabeza fetal atraviese la pelvis materna. Habitualmente, se asocian a una mala presentación de la cabeza fetal. También puede producirse por deformaciones en la pelvis materna.
Anillo de Bandl . Se produce una obstrucción debida a la formación de un anillo muscular grueso entre las partes superior e inferior del útero.
Obesidad materna . La obesidad de la madre se relaciona con duraciones más largas del periodo de dilatación.
Diagnóstico de la distocia
El diagnóstico de una distocia se lleva a cabo mediante el examen y la respuesta al trabajo de parto.
Para ello, la monitorización del parto se lleva a cabo mediante el registro cardiotocográfico, técnicas ecográficas y tacto vaginal.
La desproporción feto-pelviana se puede anticipar a partir de las estimaciones clínicas prenatales de las dimensiones pélvicas y la presencia de un trabajo de parto prolongado.
En cualquier caso, determinadas presentaciones anómalas del feto durante el parto son difíciles de diagnosticar hasta que la dilación no se ha completado.
Finalmente, el tratamiento o resolución de las distocias tiene como finalidad que el parto tenga lugar con el menor perjuicio posible tanto para el feto como para la madre. Principalmente, se utilizan maniobras físicas de reposicionamiento del feto, la elección de un parto vaginal operatorio instrumental o el parto por cesárea.
Artículo especializado
Tensión baja en el embarazo: síntomas y recomendaciones
Aunque son más comunes los casos de hipertensión, un síntoma también habitual que puede afectar a muchas mujeres durante el embarazo son las bajadas de tensión arterial. La hipotensión en el embarazo suele ser más común durante las primeras semanas, aunque los episodios pueden aparecer a lo largo de toda la gestación.
¿Por qué se producen bajadas de tensión en el embarazo?
La hipotensión se puede producir por diferentes causas. Cuando tiene lugar una bajada de tensión durante el embarazo, normalmente responde a la nueva condición fisiológica determinada por la gestación.
Debido a que la sangre debe abarcar un mayor recorrido −ahora circula también hacia el feto− el sistema circulatorio de la mujer se ve obligado a funcionar más deprisa para cubrir las necesidades del bebé. Y esto hace que la presión sanguínea baje. En cuanto esta situación se estabilice y se produzcan las adaptaciones necesarias, como la formación de una mayor cantidad de sangre, la hipotensión irá remitiendo.
Otra de las causas de la hipotensión durante el embarazo es la presión que ejerce el útero sobre la aorta y vena cava. En este sentido, las recomendaciones señalan que las mujeres embarazadas no deben dormir tumbadas boca arriba, sino recostadas sobre el lado izquierdo.
¿Qué provoca la hipotensión en el embarazo?
Es bastante habitual que las mujeres sufran bajadas de tensión en el embarazo. Especialmente durante las primeras semanas de gestación, la tensión baja puede producirse de forma puntual o prolongarse hasta el final del embarazo.
Son diversos los factores que favorecen la hipotensión en el embarazo. Como ya se ha dicho, el sistema circulatorio se amplía según se va desarrollando el feto, con lo que disminuye la presión que ejerce la sangre sobre las paredes de arterias y vasos sanguíneos.
Por otro lado, durante el embarazo se producen en el organismo de las mujeres el aumento de los niveles de determinadas hormonas con efectos vasodilatadores que también contribuyen a que la tensión arterial disminuya. La progesterona es una de ellas, especialmente, durante el primer trimestre del embarazo.
También pueden confluir ciertos factores ajenos al embarazo. Entre ellos destacan la tendencia de la mujer a padecer hipotensión o bajadas de tensión arterial (previas al embarazo). También la tendencia a padecer anemia.
De entrada, la tensión baja durante el embarazo no supone un riesgo relevante para el progreso del embarazo. Sin embargo, debe ser el médico el que determine el alcance de esta situación y el posible tratamiento para su resolución.
Síntomas de tensión baja en el embarazo
Los síntomas de tensión baja durante el embarazo no son muy específicos y pueden confundirse con síntomas debidos al propio embarazo o a otras patologías. Entre ellos, se incluyen:
Mareos y desmayos.
Sensación de cansancio y debilidad.
Somnolencia y dificultad de concentración.
Visión borrosa ocasional.
Tensión baja y pulsaciones altas en el embarazo
Cuando la tensión es baja, el corazón se activa para compensar esa situación y late a una mayor velocidad, por lo aumentan las pulsaciones.
Por otro lado, conforme avanza el embarazo, el organismo de la madre se va adaptando a la nueva situación. Entre estas adaptaciones se incluye la producción de más sangre. Este incremento del volumen sanguíneo contribuye a la aparición de ciertos síntomas habituales durante el embarazo, entre los que destacan el dolor de cabeza, la aparición de hemorroides, la retención de líquidos y la hinchazón de pies y manos, entre otros. También se puede producir un aumento de la frecuencia cardíaca de la madre, lo que se puede traducir en la aparición de palpitaciones y taquicardias.
Recomendaciones en caso de tensión baja
Cuando se dan situaciones de hipotensión durante el embarazo se pueden llevar a cabo algunas acciones sencillas para intentar contrarrestar sus efectos. Algunas de ellas incluyen:
Levantarse con precaución y de forma lenta, evitando la hipotensión ortostática que se puede producir al ponerse de pie o al incorporarse de la cama.
Mantener una alimentación saludable rica en alimentos vegetales, frutas y verduras, junto con una correcta hidratación. Esta última aumenta el volumen de la sangre disminuyendo el riesgo de hipotensión.
Realizar comidas de forma frecuente que no sean muy abundantes.
La práctica de ejercicio físico acorde a las circunstancias individuales y al momento del embarazo favorece la circulación y al correcto funcionamiento del sistema cardiovascular.
Prestar especial atención a los posibles desmayos para que no se produzcan problemas por los golpes y caídas.
No tomar ningún medicamento, excepto si ha sido prescrito por el médico.
Otras recomendaciones incluyen el empleo de medias de compresión y la aplicación de agua fría en las extremidades inferiores.
Para valorar los problemas de tensión arterial Savia pone a tu disposición a los mejores especialistas en cardiología .

Artículo especializado
Estreñimiento en el embarazo: cómo solucionarlo
Una de cada tres mujeres sufre estreñimiento −o constipación− durante el embarazo. Se trata de una situación “normal”, con unas bases fisiológicas que lo justifican.
Sólo en el 10% de los casos se dan determinadas circunstancias que adquieren una relevancia suficiente que requiere de un tratamiento más consistente. Se incluyen aquí los casos en los que están presentes hemorroides, fístulas o desgarros, o cuando los días sin defecar son muy numerosos.
Causas del estreñimiento en el embarazo
Durante el proceso del embarazo se dan una serie de factores que promueven la aparición del estreñimiento.
Puede estar relacionado con una disminución en la velocidad de tránsito a lo largo del tracto gastrointestinal, debido a una reducción de la motilidad, lo que puede determinar una mayor absorción de líquidos y electrolitos.
Estas modificaciones vienen dadas, principalmente, por los cambios hormonales que tienen lugar durante el embarazo. En este sentido, el aumento de los niveles de progesterona podría causar alteraciones en la motilidad intestinal provocando la debilidad de la fuerza propulsora de las heces. Por otro lado, la disminución en los niveles de otra hormona, la motilina, hace disminuir el movimiento del estómago y del intestino.
Otros factores que pueden contribuir a la aparición de constipación durante el embarazo incluyen:
La disminución de la ingesta de fibra en la dieta.
La utilización de suplementos de hierro.
Una disminución en la ingesta de líquidos.
El aumento del estrés típico del embarazo.
La aparición de hemorroides.
El aumento de tamaño del útero.
Síntomas de estreñimiento en el embarazo
Los síntomas de estreñimiento aparecen en 1/3 de las embarazadas. Suele ser más común en mujeres que ya han dado a luz alguna vez más que en primíparas.
Dentro de los síntomas que definen el diagnóstico del estreñimiento (presencia de 2 o más síntomas, en los últimos 6 meses) se encuentran:
Menos de 3 defecaciones por semana.
Esfuerzo en más del 25% de las defecaciones.
Utilización de maniobras manuales (digitación) en más del 25% de las defecaciones.
Sensación de evacuación incompleta en más del 25% de las defecaciones.
Sensación de obstrucción o bloqueo ano‐rectal en más del 25% de las defecaciones.
No presentar deposiciones blandas o líquidas.
No cumplir con criterios de síndrome de intestino irritable.
Cómo solucionar o aliviar el estreñimiento en embarazadas
El estreñimiento se suele considerar una situación normal e inherente al embarazo. De este modo, no se trata de una patología, sino de una consecuencia de los cambios fisiológicos que conlleva el embarazo. En ocasiones se trata, simplemente, de unos hábitos higiénico‐dietéticos inadecuados.
En cualquier caso, el tratamiento debe ser lo más natural posible, utilizando los fármacos para los casos en los que realmente sean necesarios.
Muchas veces suele ser suficiente con una alimentación correcta con un aporte adecuado de fibra y una ingesta de líquidos suficiente. La ingesta de líquidos debe realizarse mayoritariamente durante las comidas, fuera de ellas no tiene tanto efecto.
Además, también es importante mantener unos hábitos saludables, incluyendo el desempeño de actividad física regular, como caminar.
Tratamiento farmacológico
Dentro de los tratamientos farmacológicos para el estreñimiento durante el embarazo se incluyen:
Laxantes incrementadores de volumen.
Laxantes osmóticos.
Laxantes emolientes o surfactantes.
Laxantes estimulantes.
Enemas y lavados retrógados.
Siempre debe ser el especialista en ginecología el encargado en indicar el tratamiento más adecuado en cada caso.
Hábitos importantes para el estreñimiento en el embarazo
Durante el embarazo son habituales las situaciones tanto de diarrea como de estreñimiento. Para solucionarlas, se deben poner en marcha medidas generales como los cambios dietéticos.
Recomendaciones generales para evitar el estreñimiento durante el embarazo
La mayoría de las recomendaciones para evitar el estreñimiento en mujeres embarazadas son las mismas que para la población general, incluyendo:
Una ingesta de agua y líquidos suficiente (8 vasos al día, principalmente agua).
Un consumo fibra de 20‐35 g/día, a través de una dieta rica en alimentos de origen vegetal (verduras, frutas, legumbres, frutos secos, etc.).
Actividad física regular (caminar, natación, bicicleta fija, yoga, etc.).
Unos correctos hábitos intestinales. Destinar el tiempo necesario para defecar, intentando evacuar al levantarse o después de las comidas (aprovechando el reflejo gastro‐cólico). Defecar en cuanto aparece la necesidad y no posponerlo. Una maniobra que puede ayudar a la defecación es la elevación de los pies sobre un altillo o escalón mientras se está sentado en el inodoro. Dicha maniobra corrige el ángulo rectal y favorece el paso del bolo fecal.
Artículo especializado
Triple screening: ¿En qué consiste?
A lo largo del embarazo son muchas las pruebas médicas que se deben llevar a cabo para controlar que el desarrollo del feto y el estado de salud de la madre y el bebé sean óptimos. Entre ellas, las pruebas de screening o cribado sirven para valorar el riesgo de que exista un trastorno o patología en todas las mujeres embarazadas. Un ejemplo es la prueba del triple screening.
¿Qué es el triple screening?
El triple screening o cribado combinado del primer trimestre forma parte de las pruebas médicas que se llevan a cabo durante el embarazo y consiste en la estimación del riesgo de padecer tres síndromes causados por anomalías cromosómicas (síndrome de Down, Edwards y Patau). Para ello se llevan a cabo dos técnicas no invasivas: una extracción de sangre materna y una ecografía.
La estimación del riesgo se calcula a partir de la combinación de diferentes parámetros obtenidos con las pruebas anteriores: los niveles sanguíneos de determinadas hormonas, junto con determinados marcadores ecográficos, además de la edad de la madre.
Cuando el resultado de las pruebas determina un riesgo elevado, se debe proceder con otro tipo de pruebas. De este modo, para poder establecer un diagnóstico prenatal inequívoco de la presencia de anomalías genéticas, se requiere la obtención de material biológico del feto mediante técnicas invasivas como la amniocentesis o la biopsia corial . Al contrario que las pruebas de screening no invasivas, las pruebas diagnósticas conllevan cierto riesgo de pérdida gestacional.
Por otro lado, cuando el riesgo del triple screening es intermedio, se puede realizar una prueba no invasiva para el feto que consiste en el análisis de su ADN en sangre materna . Con esta técnica, se analizan los cromosomas responsables de los síndromes de Down, de Edwards y de Patau, además de los cromosomas sexuales.
¿Qué detecta el triple screening?
La prueba del triple screening del primer trimestre permite hacer una estimación del riesgo de que el feto esté afectado por 3 síndromes cromosómicos o trisomías:
Síndrome de Down (trisomía 21).
Síndrome de Edwards (trisomía 18).
Síndrome de Patau (trisomía 13).
Este riesgo se calcula en función de la edad materna, los marcadores ecográficos y los niveles bioquímicos en sangre materna en el primer trimestre.
¿En qué consiste el triple screening?
Además de la edad de la madre, el triple screening incluye diversas pruebas:
Análisis de sangre . La extracción de sangre se realiza en el tercer mes de embarazo, generalmente entre las semanas 9 y 11. Principalmente, se utiliza para valorar dos marcadores bioquímicos presentes en la sangre materna: una fracción de la hormona del embarazo (beta-hCG libre) y los valores de la proteína placentaria asociada al embarazo (PAPP-A).
Ecografía fetal . La ecografía se debe realizar entre las semanas 11 y 14 de gestación. En ella se lleva a cabo un estudio anatómico del feto y se procede a datar con exactitud la gestación midiendo la longitud céfalo-nalga fetal. En cuanto al marcador ecográfico por excelencia relacionado con las trisomías 21, 18 y 13, se trata de la traslucencia nucal . Éste es un espacio situado en la parte posterior de la cabeza del feto, en proximidad al cuello. En caso de síndrome de Down suele haber una mayor cantidad de fluido en ese espacio. Además, las malformaciones cardíacas también pueden dar aumento de acúmulo de líquido en la región nucal del feto.
Cómo interpretar los resultados del triple screening
La estimación del riesgo de los síndromes cromosómicos en el feto (trisomias 21, 18 y 13) se lleva a cabo gracias a un software de cálculo de riesgo que tiene en cuenta, en primer lugar, el riesgo inherente de la edad materna, junto con el resto de parámetros. De este modo, se incluyen en el programa informático los diferentes valores:
Longitud céfalo-nalga del feto.
Traslucencia nucal.
La analítica materna. Se lleva a cabo una ponderación de los valores bioquímicos en función del peso materno, la etnia o la concurrencia de patologías como la diabetes mellitus.
Cuando se trata de una gestación gemelar bicorial (cada feto tiene su placenta) las estimaciones de riesgo son independientes para cada feto. En caso de gestación gemelar monocorial, se lleva a cabo una única estimación de riesgo calculado a partir de la media de la traslucencia nucal de cada feto.
El resultado final de la prueba se interpreta como de alto riesgo o como gestación de alto riesgo cuando este es superior a 1/250 para los tres síndromes analizados (trisomía 21, 18 o 13).
Cuando el resultado de la prueba es de alto riesgo, se ofrecerá la opción a los padres de llevar a cabo una prueba diagnóstica.
En cualquier caso, una prueba diagnóstica que permita la confirmación o exclusión con certeza de una anomalía genética pasa ineludiblemente por llevar a cabo una técnica invasiva que permita la obtención de material biológico sobre el que realizar el estudio genético. Las técnicas invasivas más empleadas son la biopsia corial y la amniocentesis .
La elección del procedimiento técnico a realizar debe hacerse en función de las características de cada caso y dependerá, especialmente, de la edad gestacional en la que se realice la prueba invasiva.
Artículo especializado
Incompatibilidad de Rh: ¿Qué es?
La isoinmunización tiene lugar cuando los glóbulos rojos fetales heredan algún antígeno del padre diferente a los de la madre. De este modo, cuando acceden a la circulación materna, se forman anticuerpos específicos contra ellos.
El caso más habitual de isoinmunización es el antígeno D del factor Rh .
¿Qué es la incompatibilidad Rh y qué la causa?
La incompatibilidad Rh es una de las posibles complicaciones que tienen lugar durante el embarazo . Se trata de un problema que tiene lugar cuando una mujer embarazada tiene glóbulos rojos con Rh negativo y el feto −heredado del padre− Rh positivo.
Debido a que, en el transcurso del embarazo, los glóbulos rojos del feto pueden pasar a la sangre materna a través de la placenta, el sistema inmunitario de esta reaccionará frente a las células fetales Rh positivas.
Los anticuerpos creados por la madre podrán atravesar la placenta hacia el feto, destruyendo los glóbulos rojos del bebé.
La mayoría de las isoinmunizaciones se producen por la circulación de sangre fetal en la madre, las cuales pueden producirse antes o durante el parto. Sin embargo, también se producen durante un aborto y embarazo ectópico, entre otros. También puede suceder durante algunos procedimientos obstétricos como la biopsia corial , amniocentesis, funiculocentesis, o la extracción manual de placenta. Solo en casos excepcionales se produce la inmunización por recibir sangre incompatible.
Con un simple análisis de sangre puedes averiguar tu grupo sanguíneo y el factor Rh.
Reserva ya
¿Qué problemas puede causar la incompatibilidad Rh?
La incompatibilidad Rh puede causar trastornos que pueden ir de leves a mortales. La principal consecuencia es la destrucción de glóbulos rojos que puede determinar una anemia en el bebé. Dependiendo del grado de destrucción de hematíes la anemia variará desde una forma leve que cursa con ictericia (piel y esclerótica de los ojos amarillas), hasta una forma grave.
Otros problemas que pueden aparecer en el feto incluyen:
La disminución de la síntesis de albumina en el hígado, que puede dar lugar al desarrollo de hydrops y anasarca.
La disminución de glóbulos rojos provoca una reducción en el transporte de oxígeno con un aumento de la frecuencia cardiaca. Si no se compensa puede desencadenar una insuficiencia cardiaca congestiva.
La acumulación de bilirrubina en sangre puede determinar su acúmulo en los tejidos nerviosos causando kernícterus y signos de disfunción cerebral que van acompañados de letargo e hipotonía.
Acumulación de líquido o hidropesía fetal.
Síntomas de la incompatibilidad del factor Rh
Cuando los anticuerpos de la madre atacan a los glóbulos rojos del feto estos se descomponen, produciendo bilirrubina. Esto hace que aparezca la ictericia y el bebé se ponga amarillo.
Por el contrario, en la madre no suele aparecer ningún síntoma.
En el bebé los síntomas pueden variar en cada embarazo y niño. Los síntomas y signos más habituales incluyen:
Ictericia.
Palidez debida a la anemia.
Taquicardia y taquipnea.
Hepatomegalia (hígado de gran tamaño), esplenomegalia (bazo aumentado) y cardiomegalia (corazón grande).
Puede aparecer líquido acumulado en el estómago, los pulmones o el cuero cabelludo. Se trata de signos de eritroblastosis fetal que cursa con edema grave.
¿Cómo se trata la incompatibilidad del Rh?
La prevención de la incompatibilidad del Rh es sencilla gracias a la administración de la “vacuna anti Rh” con inmunoglobulina anti-D. En mujeres que tienen sangre Rh negativa se les administra una inyección de anticuerpos Rh en diversas situaciones:
A las 28 semanas de embarazo.
Dentro de las 72 horas posteriores al parto de un bebé que tiene sangre Rh positiva. También después de un aborto (espontáneo o voluntario).
Tras cualquier tipo de sangrado vaginal durante el embarazo.
Después de una amniocentesis o de una biopsia corial.
En ocasiones, se necesitan inyecciones adicionales cuando entran grandes cantidades de sangre del feto en el torrente sanguíneo de la madre.
En cuanto al tratamiento una vez que la incompatibilidad se ha materializado, dependerá del embarazo y de la gravedad de la afección. En el caso de anemia fetal leve puede no ser necesario ningún tratamiento.
Por otro lado, el tratamiento antenatal tiene como objetivo disminuir la cantidad de anticuerpos maternos y mejorar la anemia fetal, evitando las complicaciones:
Transfusión intrauterina de sangre. Este procedimiento tiene como objetivo aumentar los glóbulos rojos en el feto, por medio de la inyección en la vena umbilical de sangre del grupo 0, Rh negativo.
Utilización de corticoides, plasmaféresis materna y la administración de inmunoglobulina inyectada para reducir la cantidad de anticuerpos en la madre.
El tratamiento posnatal consiste en la administración de una transfusión al recién nacido si la anemia fuera importante y la prevención del daño derivado del aumento de la bilirrubina en sangre, mediante fototerapia o, si fuera necesario, mediante el recambio de toda su sangre.
En los casos en los que sea necesario, se puede proceder a provocar el parto de forma prematura.

Artículo especializado
Desprendimiento de la placenta: síntomas y causas
El desprendimiento de la placenta en el curso de un embarazo es una afección grave que se suele producir en el último trimestre y que afecta a cerca del 1% de las gestaciones.
¿Qué es el desprendimiento de placenta?
El desprendimiento de placenta −también conocida como “abruptio placentae” o desprendimiento prematuro de placenta normoinserta− se define como la separación prematura parcial o completa de la placenta normalmente insertada antes del inicio del parto, lo que da lugar a un síndrome hemorrágico. Normalmente aparece de manera repentina.
El desprendimiento de placenta forma parte de las posibles complicaciones del embarazo . En este caso, se trata de una complicación grave, ya que la placenta es la vía de alimentación y suministro de oxígeno para el feto.
El desprendimiento de placenta puede poner en peligro a la madre y al bebé.
¿Por qué se produce el desprendimiento de placenta?
No se conoce con exactitud la causa del desprendimiento de la placenta. Sin embargo, es conocido que la causa inmediata del desprendimiento tiene lugar cuando se produce la rotura en la zona donde de los vasos sanguíneos de la madre se unen a los del feto. De este modo, la hemorragia producida provoca que se despegue el útero de la placenta.
Por otro lado, son numerosos los factores que se pueden relacionar con la aparición de la enfermedad:
Traumatismo abdominal . La incidencia del desprendimiento placentario tras un trauma o accidente es variable y depende, principalmente, de las características del trauma y su severidad.
Exceso de volumen de líquido amniótico . Se relaciona con eventos adversos que incluyen el nacimiento pretérmino, anomalías fetales y mayor riesgo de desprendimiento.
Hipertensión crónica . Las mujeres con hipertensión tienen un riesgo 5 veces mayor de desprendimiento de placenta grave.
Cuando aparece con características graves, como daño en los órganos, el riesgo de desprendimiento de placenta puede aumentar significativamente.
Gestación múltiple . Cuando va unida a un exceso de líquido amniótico puede llevar a un mayor riesgo de desprendimiento placentario.
Rotura prematura de membranas . Cuando se produce y la latencia con el parto supera las 24 horas, existe un mayor riesgo de desarrollar desprendimiento placentario.
Infecciones intrauterinas . Las infecciones, principalmente la corioamnionitis, incrementan el riesgo de desprendimiento.
Malformación uterina . El útero no permite una implantación estable de la placenta. Es el caso del útero bicorne, sinequias uterinas o leiomiomas, entre otras.
Antecedentes de desprendimiento en embarazos anteriores.
Síntomas de un posible desprendimiento de placenta
Los síntomas más significativos asociados al desprendimiento placentario incluyen:
Hemorragia vaginal . En algunos casos el desprendimiento se puede producir sin sangrado visible. En los casos en los que el desprendimiento placentario se desarrolla lentamente (desprendimiento crónico), el sangrado es ligero e intermitente. La hemorragia se puede ver agravada por la coagulación intravascular diseminada . Se trata de un proceso en el que los factores sanguíneos responsables de la coagulación y de restablecer el equilibrio en caso de pérdida hemática son empleados y agotados de forma indiscriminada en pequeños vasos sanguíneos, impidiendo de esta forma que se pongan en marcha los mecanismos de taponamiento en los grandes vasos uterinos.
Dolor abdominal y de espalda de comienzo repentino.
Rigidez y contracciones uterinas . Existe un signo clínico muy característico del desprendimiento de placenta que es la hipertonicidad uterina, también llamada “útero de Couvelaire”.
Factores de riesgo a evitar
Los factores evitables que pueden aumentar el riesgo de sufrir un desprendimiento prematuro de placenta son:
Hipertensión arterial . Tanto si se trata de una hipertensión crónica como inducida por el embarazo (preeclampsia o hipertensión gestacional).
Edad de la madre . El riesgo aumenta si la madre es mayor de 35 años o menor de 20.
Tabaquismo . Se trata de un factor de riesgo modificable cuya asociación ha podido ser bien documentada.
Déficit de ácido fólico . Este promueve la disfunción endotelial, incluyendo la de los vasos placentarios, constituyendo un mayor riesgo de desprendimiento.
Consumo de cocaína y otras drogas . La cocaína puede atravesar fácilmente la placenta y la barrera hematoencefálica fetal, produciendo vasoconstricción, que es el principal mecanismo causante del daño fetal y placentario.
¿Cómo se diagnostica el desprendimiento de placenta?
El diagnóstico del desprendimiento de placenta está basado en las manifestaciones clínicas.
En cualquier caso, existen ciertas pruebas que pueden ayudar al diagnóstico:
Cardiotocografía . Permite evaluar la situación del feto y verificar si hay contracciones en el útero.
Ecografía . Su utilidad es limitada por su baja sensibilidad: puede detectar aproximadamente la mitad de las abrupciones placentarias. El hallazgo más frecuente durante la ecografía es la bradicardia fetal como consecuencia de la hipoxia sufrida.
Análisis de sangre . Una analítica permitirá comprobar la presencia de anemia, situación habitual frente a pérdidas importantes de sangre.
Ante la sospecha de un desprendimiento prematuro de placenta el médico puede recomendar la hospitalizada para valorar su alcance.
Tratamiento
El tratamiento estará condicionado por el estado materno y fetal, el grado de desprendimiento placentario y la edad gestacional en el momento del diagnóstico.
En el caso de desprendimiento prematuro de placenta no grave en embarazos de menos de 34 semanas se esperará hasta la semana 37-38 para inducir el parto (si la situación de la madre y del feto así lo aconsejan).

Artículo especializado
Sangrado de implantación
La implantación es el proceso por el cual el óvulo fecundado −el embrión− inicia el camino para su desarrollo, para lo cual anida en las paredes del útero, donde puede recibir los nutrientes esenciales para su desarrollo. En algunos casos, durante esta fase el embrión rompe pequeños vasos sanguíneos que irrigan el endometrio y se produce una pequeña hemorragia. Se trata del sangrado de implantación.
¿Qué es el sangrado de implantación?
Uno de los signos más universales que indican que una mujer está embarazada es la interrupción de la menstruación. Sin embargo, algunas veces tiene lugar entre los 7 y los 14 días posteriores a la fecundación, un sangrado similar a la regla. Se trata del sangrado de implantación. De hecho, en ocasiones es confundido con la menstruación, demorando de esta forma el diagnóstico de embarazo.
Suele ser un acontecimiento que pasa inadvertido, ya que la mujer desconoce que se haya producido la fecundación y en ningún caso relaciona la pequeña hemorragia con un embarazo. Por el contrario, en pacientes sometidas a tratamientos de fertilidad , esta situación se suele percibir con mayor alarma ya que sí son conscientes de cuándo ha tenido lugar la fecundación.
La pequeña pérdida de sangre que se produce tiene lugar cuando el embrión se adhiere a la pared del útero para su desarrollo. Esta no debe suponer ningún problema, ni para el propio embrión ni para la mujer.
Sangrados durante la gestación
Además del sangrado de implantación, durante la gestación se puede producir otro tipo de sangrados, en algunos casos provocados por situaciones que pueden ser graves. Es el caso de situaciones que pueden provocar el aborto o el desarrollo de un embarazo ectópico . En los casos leves el origen de la hemorragia puede ser una infección, los cambios hormonales que sufre la gestante o un pequeño sangrado posterior a las relaciones sexuales.
Sea por una causa o por otra, ante cualquier tipo de hemorragia o sangrado vaginal que se produzca durante el primer trimestre o en el resto del embarazo, es recomendable acudir de inmediato a urgencias. En los casos en los que una hemorragia durante el primer trimestre es una amenaza de aborto, se suele producir de forma abundante y se acompaña de dolor abdominal.
¿Cuándo se produce y cuánto dura el sangrado de implantación?
La hemorragia que se produce durante la implantación del embrión puede aparecer entre siete y catorce días después de la fecundación. La pérdida de sangre que se produce puede alargarse entre tres y seis días.
De este modo, cuando tiene lugar un sangrado vaginal con anterioridad a la fecha estimada de la siguiente regla, esto es, un sangrado entre periodos menstruales naturales, podría tratarse de un sangrado de implantación.
¿Qué se siente cuando se produce la implantación?
En la mayoría de los casos, la implantación del embrión en el útero pasa totalmente desapercibida sin provocar ningún síntoma ni signo. En los casos en los que tiene lugar el sangrado de implantación, se trata de una consecuencia normal relacionada con el proceso de inicio de un embarazo. Aparece, aproximadamente, en una de cada tres mujeres gestantes y no se trata de ninguna situación anormal o patológica, por lo que no añade ningún riesgo al embarazo. En algunos casos puede ir acompañado de dolores leves de tipo menstrual.
Su presentación no es homogénea y puede haber variaciones entre unas mujeres y otras. De igual modo, que haya aparecido sangrado de implantación en un embarazo anterior no garantiza que se vuelva a repetir en gestaciones posteriores.
Diferencias entre el sangrado de implantación y la regla
El sangrado de implantación tiene lugar en los primeros días transcurridos desde la fecundación, cuando la mujer todavía desconoce que pueda estar embarazada. De este modo, es frecuente confundir el sangrado de implantación con una menstruación adelantada, si bien este dura menos tiempo y suele ser menos abundante. También suele ser un tipo de sangrado con una coloración más oscura.
¿Qué hacer ante un sangrado por implantación?
En el caso de que aparezca un sangrado de las características descritas que no sea incompatible con haberse quedado embarazada, lo recomendable es que se realice un test de embarazo. En el caso de dar positivo, se debería consultar con el ginecólogo para iniciar el control de la gestación.
De igual modo, si el sangrado tiene lugar en una mujer en tratamiento para inducir la ovulación, tras haberse sometido a una inseminación artificial o una fecundación in vitro, es recomendable que se ponga en contacto con su médico.
Artículo especializado
Diafragma anticonceptivo
Dentro de la variedad de métodos anticonceptivos disponibles para evitar o prevenir el embarazo existen varios grupos que incluyen los método quirúrgicos, intrauterinos, hormonales y los métodos de barrera. Dentro de estos últimos se encuentra el diafragma anticonceptivo, de utilización femenina.
¿Qué es el diafragma anticonceptivo?
El diafragma es un método anticonceptivo de barrera de uso femenino. Al contrario de lo que ocurre con el método de barrera utilizado por el hombre, el preservativo, el diafragma no confiere protección contra las enfermedades de transmisión sexual.
El diafragma consiste en un capuchón flexible de látex o silicona, que debe colocarse en la vagina, tapando el cuello del útero para impedir la entrada del semen dentro del útero y reducir la posibilidad de que se produzca el embarazo tras el coito.
Debe colocarse antes de cualquier contacto sexual. Es de uso individual y para potenciar su efectividad, se debe utilizar junto a una crema espermicida.
El diafragma es reutilizable, aunque se recomienda examinarlo con regularidad para identificar posibles roturas y renovarlo al menos cada año.
No se trata de un método anticonceptivo infalible, ya que su efectividad se cifra en el 92-96% de los casos, según la Organización Mundial de la Salud. De este modo, de 4 a 8 mujeres de cada 100 que lo utilizaran durante un año se quedarían embarazadas. Esta efectividad podría ser todavía menor si se producen errores en su utilización.
¿Quién puede utilizar el diafragma?
El diafragma puede ser utilizado por todas las mujeres, con algunas excepciones como:
Mujeres con prolapso uterino o con pérdida del tono muscular en la vagina.
Mujeres que acaban de dar a luz.
Cuando existe una infección vaginal.
Mujeres que han padecido un síndrome de shock tóxico.
En el caso de mujeres alérgicas al látex se pueden utilizar diafragmas de silicona.
Beneficios y desventajas del diafragma anticonceptivo
La utilización del diafragma ofrece beneficios y desventajas que deben ser sopesados en cada caso. Entre sus principales ventajas destacan:
La ausencia de efectos adversos.
Su colocación se produce antes de la relación sexual y no la interrumpe.
No se nota durante las relaciones sexuales.
En cuanto a sus desventajas, hay que destacar:
Uno de sus principales inconvenientes es su relativa baja efectividad.
Para asegurar el tamaño adecuado puede ser necesaria la evaluación médica.
Su utilización correcta precisa de cierto adiestramiento.
No se puede utilizar en el transcurso de la menstruación.
No protege frente a las enfermedades de transmisión sexual.
Existe un riesgo de infecciones si se deja colocado mucho tiempo.
Se debe acompañar su uso de cremas espermicidas.
Resta espontaneidad a las relaciones sexuales, puesto que el diafragma debe ser colocado con cierta antelación. Especialmente, cuando se está comenzando a utilizar y requiere de mayor tiempo para una correcta colocación.
¿Cuánto tiempo se puede usar el diafragma?
El diafragma anticonceptivo debe colocarse con anterioridad al acto sexual. La antelación máxima recomendable se sitúa en 4 horas.
Una vez concluido el acto sexual, no se debe retirar hasta pasadas un mínimo de 6 horas. En cualquier caso, no se deben superar las 24 horas sin retirarlo, ya que se incrementa el riesgo de infección.
Cuando se tienen varias relaciones sexuales seguidas no es preciso extraer el diafragma. Simplemente hay que aplicar la crema espermicida en la vagina antes de cada relación sexual vaginal.
¿Cómo se coloca el diafragma?
Antes de empezar a utilizar el diafragma, es recomendable acudir al ginecólogo para que realice una exploración ginecológica con el fin de identificar la talla de diafragma más adecuada. En esta visita el ginecólogo ofrecerá las indicaciones oportunas para su correcta colocación y uso.
Una breve descripción de cómo colocar el diafragma anticonceptivo incluiría:
Antes de la colocación del diafragma es necesaria una adecuada higiene de manos.
Una vez lavadas las manos, se aplicará la crema espermicida, extendiéndola por todo el diafragma, incluyendo las dos caras y los bordes.
A continuación, la mujer debe situarse en una posición cómoda, por ejemplo, tumbada en la cama y con las piernas separadas.
Seguidamente, deberá separarse con la mano los labios de la vulva, apretando sobre el aro del diafragma con la otra mano, doblándolo e introduciéndolo dentro de la vagina hasta donde pueda llegar.
Finalmente, debe comprobar con los dedos que la colocación es correcta y que el cuello uterino ha quedado cubierto por el diafragma.
Para proceder a la extracción del diafragma, se debe introducir el dedo dentro de la vagina para engancharlo por encima del aro y, de este modo, tirar hacia abajo y extraerlo hacia afuera.
Cuando se haya extraído se debe proceder a su lavado con jabón neutro y agua. Una vez secado al aire, se debe guardar en una caja protectora.
Es recomendable no utilizar desinfectantes, ni agentes químicos agresivos. Tampoco se recomiendan aplicar métodos de calor como el hervido.
Artículo especializado
Cordocentesis o funiculocentesis: ¿Qué es y qué detecta?
Cuando durante un embarazo existe el riesgo de que el feto desarrolle determinados problemas, puede estar indicada la realización de una cordocentesis, especialmente si otras pruebas llevadas a cabo no han aportado una información concluyente.
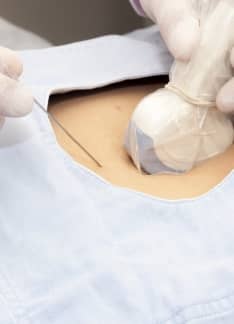
¿Qué es la cordocentesis?
La cordocentesis, funiculocentesis o muestra sanguínea percutánea del cordón umbilical es un procedimiento invasivo por medio del cual se extrae sangre del cordón umbilical del feto. Se trata de una prueba de diagnóstico prenatal indicada en casos específicos, como en la sospecha de anemia fetal o en determinadas situaciones graves en las que pueden estar presentes alteraciones en los cromosomas fetales.
La sangre obtenida a través de la cordocentesis también puede usarse potencialmente para otro tipo de estudios genéticos, para administrar al feto determinados tratamientos si se consideran necesarios o recibir una transfusión de sangre.
¿Para qué sirve la cordocentesis?
La utilidad de la cordocentesis viene dada por todas las pruebas que se pueden llevar a cabo a partir de la sangre y el material genético del feto. De este modo, puede servir para confirmar afecciones sanguíneas como anemia y trombocitopenia, anomalías genéticas como el síndrome de Down o enfermedades infecciosas como la rubeola, toxoplasmosis o citomegalovirus, entre otras.
Por otro lado, también sirve como vía de acceso para realizar algunos tratamientos dentro del útero.
La prueba suele realizarse a partir de las 20 semanas de gestación, cuando el cordón umbilical ya se ha desarrollado.
En definitiva, las indicaciones de la cordocentesis incluyen:
Estudios genéticos.
Cuando se ha llevado a cabo una amniocentesis, puede servir para confirmar los resultados si la muestra de líquido amniótico es insuficiente o la amniocentesis ha indicado la presencia de alteraciones genéticas como el mosaicismo.
La presencia de anomalías fetales observadas por medio de una ecografía.
Hidrops fetal o presencia de acúmulo de líquido en el cuerpo del feto.
Crecimiento anómalo del feto y disminución de la cantidad de líquido amniótico.
¿Cuándo se tiene que hacer la cordocentesis?
La cordocentesis generalmente se realiza tras descartar otras pruebas. De este modo, no se trata de la prueba de primera elección debido a que conlleva un mayor riesgo de complicaciones para el bebé que otros procedimientos.
Debe ser el ginecólogo el que determine si es necesario realizar la prueba en el caso de que no sea posible realizar otras opciones o estas no han aportado suficiente información. De este modo, suele realizarse cuando la información de diagnóstico no puede obtenerse a través de ecografía o amniocentesis , o si los resultados de estas pruebas no fueron concluyentes.
En cualquier caso, debe realizarse después de las 20 semanas de embarazo.
Procedimiento y riesgos de la cordocentesis
La cordocentesis es un tipo de procedimiento invasivo realizado de forma ambulatoria que consiste en la punción en el cordón umbilical para la obtención de una muestra directa de sangre del feto para su posterior análisis.
La punción del cordón umbilical fetal es dirigida por ecografía y se lleva a cabo por medio de la punción en el abdomen de la embarazada con una aguja delgada hasta llegar a través de la pared abdominal al interior del útero y de la bolsa de líquido amniótico donde está el feto. Se accede al cordón umbilical cerca de la inserción con la placenta para evitar el riesgo de movimientos del feto. Se punciona la vena del cordón con la aguja para la obtención de la sangre. Se suelen extraer unos 3-5 mililitros de sangre fetal.
Al igual que otros procedimientos, esta prueba conlleva riesgos tanto para la madre como para el feto.
El aborto espontáneo es el principal riesgo de la cordocentesis, con uno o dos abortos espontáneos por cada 100 procedimientos.
Otros posibles riesgos de cordocentesis que se pueden dar incluyen:
Sangrado y hematoma de cordón.
Bradicardia fetal.
Infecciones.
Hemorragia.
Rotura prematura de membranas.
Riesgo de parto prematuro.
Punción accidental de partes fetales. Este riesgo se minimiza realizando la punción cerca de la inserción placentaria.
Otro riesgo importante es el de la inmunización de las madres con grupo sanguíneo Rh negativo cuyos fetos sean Rh positivo. Por ello es imperativo administrar vacunación frente al Rh −conocida como gammaglobulina anti-D− en todas las madres negativas a las que se les realice una prueba invasiva en el plazo de las 48-72 horas siguientes. La inmunización puede dar lugar a cuadros de anemia fetal en gestaciones posteriores.
Funiculocentesis, amniocentesis y biopsia corial
Las tres principales pruebas invasivas para el diagnóstico fetal son la amniocentesis, la biopsia corial y la cordocentesis o funiculocentesis. Todas ellas permiten la obtención de material fetal para llevar a cabo el estudio de los cromosomas del feto o cariotipo.
La amniocentesis consiste en la obtención de una pequeña cantidad de líquido amniótico a partir de la introducción de una aguja a través de la pared abdominal de la madre. Permite la realización del cariotipo fetal.
La biopsia corial consiste en la obtención de una pequeña muestra de tejido placentario. Se puede realizar por vía transabdominal o transvaginal.
La funiculocentesis permite la obtención de sangre fetal cuando existen dudas sobre los resultados genéticos obtenidos mediante amniocentesis o biopsia corial.

Artículo especializado
Embarazo críptico: ¿Qué es?
¿Qué es el embarazo críptico?
El embarazo críptico o embarazo silencioso o negado responde a la situación en la que una mujer está embarazada, pero ella lo desconoce hasta que el mismo está muy avanzado o el parto es ya inminente.
Evidentemente, se trata de casos excepcionales que se suelen dar en mujeres con distintos problemas, incluyendo las menstruaciones irregulares, el sobrepeso y la obesidad y otros problemas de salud.
Cuando un embarazo críptico se produce la mujer no llega a experimentar o no reconoce los síntomas y signos típicos comunes durante la gestación, incluyendo la amenorrea, náuseas y vómitos o el incremento del volumen abdominal. En muchos casos tampoco el médico ni los familiares son capaces de detectarlos.
Las causas no son del todo conocidas y en él pueden intervenir condicionantes psicológicos de negación por parte de la madre a la hora de aceptar el embarazo. Esto puede condicionar la aparición e identificación por parte de la madre de los síntomas del embarazo.
En Savia ponemos a tu disposición los mejores especialistas en Psicología .
Riesgos del embarazo críptico
Los riesgos del embarazo críptico son evidentes, tanto para la madre como para el bebé. Cuando la mujer no es consciente de que está embarazada no existe ninguna precaución ni control sobre la evolución del embarazo ni recibe la atención médica prenatal necesaria .
De este modo, la situación de la madre en el momento del embarazo, así como la evolución del feto no pueden ser evaluadas y no se dispone de información por parte de los médicos sobre posibles estados carenciales, complicaciones o anomalías.
En consecuencia, los bebés que nacen de un embarazo críptico tienen más riesgo de presentar problemas de salud, incluyendo el nacimiento prematuro y un peso bajo al nacer.
De igual modo, las complicaciones prenatales para la madre como la diabetes gestacional, la hipertensión o la preeclampsia pueden pasar desapercibidas y pueden poner en riesgo la salud de la madre.
Finalmente, cuando la madre no es consciente de que está embarazada, es posible que tenga comportamientos de riesgo como fumar, beber alcohol u otros tóxicos lo que puede afectar de forma negativa a la salud y el desarrollo del bebé.
Cómo detectar y evitar un embarazo críptico
Los embarazos crípticos son casos excepcionales que no suelen darse de forma habitual. En el momento en el que aparezcan molestias o cambios en la menstruación o en otros aspectos de la salud de la mujer en edad reproductiva y con relaciones sexuales activas se debería someter a una revisión por parte del ginecólogo .
En cualquier caso, a medida que el embarazo críptico avanza existen más posibilidades de que sea detectado.
Síntomas del embarazo críptico
Los síntomas y signos que tienen lugar durante el embarazo −incluso durante las fases más tempranas− son muy evidentes y característicos, por lo que cuesta creer que una mujer no sea capaz de identificarlos. Por todo ello, en el embarazo críptico la parte psicológica juega un papel muy relevante.
Pruebas de embarazo negativas
Finalmente, las pruebas de embarazo se basan en la detección de la hormona gonadotropina coriónica humana en la orina. Esta hormona aumenta su concentración en el momento de la concepción. A partir de las 12 semanas de embarazo disminuye sus niveles, llegando incluso a negativizarse.
Además de que suelen ser escasas las madres con embarazos crípticos que se realizan un test de embarazo, en ocasiones estos dan negativo debido a que este está ya avanzado y los niveles de gonadotropina coriónica han disminuido.

Artículo especializado
Estrés en el embarazo: cómo evitarlo
Las circunstancias que rodean a la vida fetal y perinatal pueden tener consecuencias sobre la salud del feto y de la madre. En este sentido, los altos niveles de estrés durante el embarazo pueden ser uno de los elementos con repercusión sobre la salud maternoinfantil.
¿Por qué se produce estrés durante el embarazo?
El embarazo es un proceso fisiológico para el que la mujer está perfectamente preparada. Sin embargo, este puede suponer una sobrecarga y una importante fuente de estrés y ansiedad para la madre.
El estrés específico del embarazo está relacionado con las circunstancias que envuelven a todo el proceso, incluyendo los potenciales problemas médicos, la salud del recién nacido, los cambios que el embarazo suponen en las relaciones sociales de la madre y en su aspecto físico y el miedo al parto, entre otras.
Además, en ocasiones existe un estrés psicológico derivado de las presiones sociales, problemas económicos, discriminación o violencia a los que está sujeta la madre y que pueden producir un aumento en la probabilidad de resultados adversos en el embarazo.
Finalmente, el conocimiento existente sobre los efectos nocivos que tiene el estrés de la madre sobre la salud del feto lleva a muchas mujeres a sentirse obligadas a permanecer felices y serenas durante todo el embarazo. Cuando esto no sucede, se sienten culpables y estresadas.
En cualquier caso, no todo el estrés materno parece ser perjudicial, sino que depende de su intensidad y duración. De este modo, el estrés intermitente leve o moderado, podría favorecer el desarrollo saludable del feto, mientras que estados de estrés más graves y prolongados se asociarían con resultados adversos.
En definitiva, la aparición del estrés durante el embarazo es muy variable y puede verse influido y fomentando por multitud de circunstancias. Algunas de ellas pueden incluir:
Las circunstancias socioculturales y familiares de la madre.
La edad de la madre. En la actualidad es frecuente que existan embarazos después de los 35 años e incluso de los 40.
Una mayor frecuencia de embarazos por técnicas de reproducción asistida. Estas pueden ocasionar labilidad emocional grave por la gran carga hormonal que contienen los fármacos empleados para lograr la estimulación ovárica.
Las propias pruebas y controles de diagnóstico prenatal (bioquímicas, ecográficas, etc.) pueden constituir un generador de estrés.
Aumento de los niveles de cortisol
La exposición a elevados niveles de estrés psicológico durante el embarazo se traduce en el organismo en cambios neuroendocrinos debidos a la activación del eje hipotalámico-pituitario-adrenal. Esta tiene como principal consecuencia el aumento de los niveles de cortisol −la hormona del estrés− que en origen tiene como objetivo que el organismo pueda hacer frente a los estímulos estresantes.
Efectos del estrés en el embarazo
El estrés del embarazo ha sido relacionado con una mayor prevalencia de ansiedad en la madre durante el embarazo, un mayor aumento de peso corporal durante y después del embarazo, mayores tasas de cesáreas no planificadas, bajo peso del feto al nacer y mayor incidencia de embarazos de riesgo y partos prematuros.
Efectos del estrés sobre la madre
Entre las alteraciones maternas con las que se relaciona la exposición a elevados niveles de estrés durante el embarazo destacan:
Un mayor riesgo de depresión posparto, que puede afectar al 10-15% de las mujeres después de dar a luz.
Preeclampsia.
Diabetes gestacional.
Retraso en la producción de leche materna.
Efectos del estrés sobre el bebé
En cuanto a la salud infantil, unos niveles elevados de estrés prenatal se relacionan con un mayor riesgo de:
Bajo peso al nacer.
Parto prematuro.
Alteración del desarrollo neonatal.
Afectación del neurodesarrollo infantil.
De este modo, los estudios muestran un posible vínculo deficiente en la relación madre-hijo, así como un menor neurodesarrollo infantil. De igual modo, existe una relación negativa entre el estrés del embarazo y los niveles de neurodesarrollo cognitivos y motores en los primeros meses de vida. Estas disfunciones neuromotoras en edades tempranas se asocian con problemas posteriores en el comportamiento y con un menor rendimiento académico.
Síntomas de estrés en el embarazo
La evaluación del estrés específico del embarazo se puede llevar a cabo por medio de cuestionarios en los cuales las mujeres embarazadas responden a una serie de preguntas relacionadas con las preocupaciones específicas del embarazo. Los cuestionarios son evaluados e interpretados posteriormente por un profesional de la Psicología.
El estrés durante el embarazo puede dar lugar a la aparición de síntomas como episodios de ansiedad, modificaciones notables en el estado de ánimo de la madre y aumento de peso.
Control del estrés en el embarazo
Es importante que los casos de estrés en el embarazo puedan ser identificados por los profesionales de la salud encargados del seguimiento médico, incluyendo el especialista en Ginecología y Obstetricia o la matrona.
Cuando se identifica un caso, se puede contar con la intervención de un psicólogo. Los profesionales de la Psicología tienen las herramientas para, mediante la aplicación de terapias psicológicas, reducir los niveles de estrés específico del embarazo.
Una de las intervenciones basadas en la evidencia que ha mostrado una alta eficacia en el control del estrés durante el embarazo es la terapia cognitivo conductual . La psicoterapia aplicada al control del estrés incluye diversas etapas, entre las que destacan las de afrontamiento, relajación muscular profunda, técnicas de desactivación y técnicas de asertividad.
Dentro del manejo del estrés en el embarazo ocupan un papel relevante el mantenimiento de unos hábitos dietéticos adecuados, la realización de ejercicio moderado de forma regular y las técnicas de meditación entre las que cabe destacar el “Mindfulness”.
En el caso de que el médico lo considere oportuno, se puede optar por un tratamiento farmacológico para reducir los niveles de estrés y ansiedad que sea compatible con el embarazo.
Para el tratamiento del estrés y la ansiedad Savia pone a tu disposición los mejores psicólogos .

Artículo especializado
Útero miomatoso
Se estima que una de cada cuatro mujeres desarrollará algún mioma a lo largo de su vida, siendo máxima su incidencia en las edades cercanas a la menopausia. Aunque se trata de acontecimientos asintomáticos, pueden causar síntomas en el 30% de las mujeres diagnosticadas de miomas uterinos.
Su prevalencia ha aumentado en los últimos tiempos por la tendencia a retrasar el embarazo, lo que expone a muchas mujeres a presentar miomas uterinos en el momento de la concepción. También influye en el aumento de casos la mayor capacidad de diagnóstico gracias a la utilización sistemática de la ecografía transvaginal.
¿Qué es el útero miomatoso?
El útero miomatoso es un útero afectado por la aparición de miomas . El mioma o fibroma uterino, es un tipo de tumoración benigna que se forma en las paredes del útero por fibras musculares lisas. Derivan del miometrio o capa muscular del útero y presentan una abundante matriz extracelular rodeados de tejido conectivo y fibras musculares comprimidas.
Se trata de los tumores sólidos más frecuentes de la pelvis de la mujer. Mayoritariamente aparecen de forma múltiple, aunque también pueden ser únicos.
Los miomas se pueden clasificar según su localización en el miometrio en subserosos (localizados en la superficie uterina, deformando la serosa), intramurales (situados en el espesor de la pared muscular, sin relación con la serosa ni la mucosa), transmurales (son miomas en el espesor de la pared muscular que deforman la serosa y la mucosa endometrial) y submucosos (se desarrollan bajo el endometrio desplazándolo en su crecimiento). Más de la mitad son subserosos, un 40% intramurales y un 5% submucosos.
Causas del útero miomatoso
Las causas del útero miomatoso y la aparición de miomas no son del todo conocidas. Sin embargo, se ha detectado una relación directa con las hormonas femeninas, condicionando el desarrollo y crecimiento de los miomas, por eso se suelen dar en mujeres en edad fértil. Cuando aparece la menopausia el tamaño disminuye debido a que los niveles hormonales también disminuyen.
Además de los estrógenos y la progesterona, ciertas citocinas y factores de crecimiento relacionados con la fibrosis y la formación de vasos sanguíneos parecen estar implicados en el desarrollo de los miomas.
Por último, parece existir cierta predisposición genética a desarrollar miomas.
En cuanto a los factores que pueden influir en la aparición y evolución de los miomas se pueden incluir:
La raza . Las mujeres afroamericanas tienen una mayor prevalencia de miomas uterinos en comparación con las asiáticas y las caucásicas.
Agregación familiar . La miomatosis uterina familiar es factor de riesgo para la aparición de miomas, cuyo comportamiento es diferente a los no familiares.
Características reproductivas . La menarquia precoz (por debajo de los 10 años) se ha relacionado con la aparición de miomas. Por otro lado, la frecuencia de miomas es menor en las mujeres que ya han sido gestantes (a mayor número de gestaciones mayor es el efecto protector), mujeres que han tenido una maternidad temprana y cuando existe un corto intervalo desde la última gestación. No obstante, las pacientes con miomatosis uterina previa que quedan gestantes suelen experimentar un crecimiento significativo de los miomas preexistentes debido al estatus hormonal propio del embarazo.
Tratamientos hormonales . La respuesta de los miomas al estímulo hormonal varía en función de dosis, vía de administración, sustancia y tiempo de administración.
Otros factores . El tabaco parece reducir la aparición de miomas. Por el contrario, la hipertensión, la obesidad y la diabetes mellitus se asocian con un aumento del riesgo en el desarrollo de miomas. En cuanto a factores nutricionales, las dietas ricas en vitamina A y un consumo elevado de carnes rojas parecen aumentar el riesgo de miomas.
Síntomas del útero miomatoso
La mayoría de los miomas del útero no ocasionan síntomas. La aparición de estos se relaciona con el tamaño de los miomas, su número y emplazamiento, siendo los más sintomáticos los que se localizan en la cavidad interna del útero.
Cuando las pacientes con miomas presentan manifestaciones clínicas, las más frecuentes son las alteraciones de la menstruación, especialmente el sangrado menstrual abundante o hipermenorrea.
Otros síntomas del útero miomatoso son:
Cambios menstruales en su duración, frecuencia y cantidad de sangrado.
Presión pélvica y dolor, especialmente con miomas de gran tamaño de localización intramural o subserosa.
Anemia ferropénica debido al exceso de sangrado.
Aumento del perímetro del abdomen en caso de miomas grandes.
Aumento de peso.
Complicaciones en embarazo y parto.
Compresión de vejiga y recto en el caso de miomas de gran tamaño.
Ganas de orinar con mayor frecuencia.
Lumbalgia y dolor de pelvis.
Aumento de probabilidades de aborto o parto prematuro.
Molestias en las relaciones sexuales.
Además, pueden contribuir a un problema de infertilidad, si bien es excepcional que se trate de su única causa.
El tratamiento de los miomas que producen síntomas inicialmente está enfocado a la reducción de los mismos (tratamientos con bloqueantes hormonales, analgésicos para el dolor, etc.). En el caso de que no sean suficientes, se podría optar al tratamiento quirúrgico. Este variará en función de si la paciente desea tener hijos o no. En el primer caso, se procederá a la extirpación de los miomas, mientras que en el segundo se podría optar por la extirpación uterina (histerectomía). Existe la posibilidad de que vuelvan a aparecer los miomas tras su extirpación.
En el caso de miomas de tipo asintomático no se requiere seguimiento ni tratamiento específico, especialmente en pacientes próximas a la menopausia.
La detección de los miomas se puede dar con un examen pélvico manual del ginecólogo o una ecografía pélvica.
Miomas malignos
Los leiomiosarcomas uterinos son tumores malignos del útero compuestos completamente por músculo liso. Aproximadamente, una de cada 10.000 mujeres con miomas presentará un tumor maligno.
Su crecimiento suele ser rápido, por lo que habrá de tenerse en cuenta en pacientes posmenopáusicas, ya que la edad media de las mujeres con leiomiosarcoma es de 50-55 años.
Útero miomatoso en la menopausia
Aunque es frecuente que los miomas se desarrollen en la edad fértil, pueden persistir durante y después de la menopausia.
La mayoría de las mujeres, debido a la disminución de estrógenos que acompaña a la menopausia, experimentan la disminución del tamaño de los miomas.
En pacientes con terapia sustitutoria hormonal es necesario un seguimiento periódico para determinar si sus miomas están aumentando de tamaño. De ser así, podría estar indicada la suspensión del tratamiento.
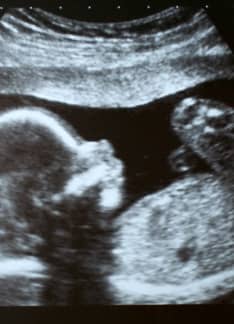
Artículo especializado
Gastrosquisis fetal: diagnóstico prenatal
¿Qué es la gastrosquisis?
La palabra gastrosquisis deriva del prefijo griego “gaster”: estómago y “schisis”: fisura. Actualmente, se define como una malformación congénita caracterizada por una herniación visceral a través de un defecto de la pared abdominal. La presencia de la fisura por lo general es pequeña (menos de 4 cm) y está localizada en la mayoría de los casos a la derecha del cordón umbilical.
Esta lesión da lugar a la herniación de las asas intestinales, el estómago, el hígado y en ocasiones la vejiga, que no se encuentran cubiertas por una membrana protectora. Las vísceras expuestas al líquido amniótico responden desarrollando un proceso inflamatorio de la capa seromuscular, la que además de serositis causa la destrucción de las células de Cajal; este daño seromuscular es el que da lugar a la hipomotilidad del intestino en el neonato.
Hay varias teorías que explican el origen de la gastrosquisis. La más aceptada considera como causa principal la involución precoz de los vasos que irrigan la pared abdominal que son la vena umbilical y la arteria onfalomesentérica derecha.
Los factores de riesgo más importantes asociados a esta patología incluyen:
El consumo de tabaco, alcohol y drogas como marihuana, cocaína, metanfetaminas.
Medicamentos como aspirina, efedrina e ibuprofeno.
Ser madre joven (menor de 20 años).
Primer parto.
Malnutrición y ausencia de fortificación con ácido fólico previo al inicio de la gestación.
Infecciones de transmisión sexual y del tracto urinario en el primer trimestre del embarazo.
La gastrosquisis presenta un porcentaje bajo de asociación con anomalías cromosómicas u otras malformaciones.
El pronóstico de la gastrosquisis está dado por las complicaciones intestinales asociadas, producidas por la inflamación ante la exposición a sustancias irritativas del líquido amniótico y la constricción, con la consiguiente isquemia a nivel del defecto de pared.
Se ha propuesto clasificar a la gastrosquisis en simple (sin lesiones intestinales) y gastrosquisis compleja (con anomalías intestinales asociadas como atresia, necrosis, vólvulo, perforación, etc.). El factor pronóstico más importante es la presencia de lesión en las asas intestinales, asociada a gran morbilidad debido a estancias hospitalarias prolongadas y complicaciones neonatales, aunque con un porcentaje elevado de supervivencia.
¿Cuándo y cómo se diagnóstica la gastrosquisis?
El diagnóstico prenatal de gastrosquisis se realiza cada vez más frecuentemente. Puede realizarse tan precozmente como a las 12 semanas de edad gestacional, ya que es en esta etapa cuando se produce el cierre definitivo parietal.
Sin embargo, lo más frecuente es que el diagnóstico prenatal se realice en el segundo trimestre de embarazo mediante ecografía morfológica .
La alfafetoproteína es la principal glicoproteína del suero fetal y está elevada en los pacientes con esta patología, por lo que puede servir para apoyar el diagnóstico, si bien no es específico de la gastrosquisis, ya que también se eleva en otras patologías.
La ecografía es el método de elección para la detección y la confirmación diagnóstica de la gastrosquisis en la etapa prenatal. El diagnóstico se realiza al detectar las asas intestinales flotando libremente en el líquido amniótico.
La mayor fortaleza del diagnóstico prenatal de gastrosquisis es la posibilidad de realizar consulta prenatal con cirujano, neonatólogo, ginecólogo y obstetra. El objetivo de la consulta prenatal será el de la evaluación conjunta por parte de un equipo interdisciplinario que estudiará el caso clínico. En base a ello brindarán asesoramiento y consejo a los padres, pudiendo además explicar las características de la patología, posible evolución y pronóstico.
El objetivo principal en el manejo perinatal de estos fetos es detectar aquellos casos con riesgo de presentar una gastrosquisis compleja, para esto se han descrito múltiples marcadores ecográficos para predecir la lesión intestinal, tales como dilatación de las asas extra o intra abdominales y la dilatación gástrica.
Savia pone a tu disposición los mejores especialistas en Ginecología y Obstetricia .
Tratamiento de la gastrosquisis
El tratamiento de la gastrosquisis es quirúrgico y consiste en devolver el intestino y los órganos herniados a la cavidad abdominal. Existen diferentes técnicas para lograr la reintroducción del contenido eviscerado al abdomen y el cierre parietal. En el mayor porcentaje de los casos es posible la realización de un cierre primario, borde a borde o utilizando el cordón umbilical para permitir el cierre con menor tensión parietal. En un porcentaje más bajo no es posible realizar un cierre primario, por lo que es necesario realizar un silo quirúrgico (bolsa de silicona que cubre el defecto y produce la reducción progresiva por gravedad de las vísceras) para protección del contenido eviscerado y una reintroducción progresiva del contenido abdominal. Posteriormente se realizará el cierre definitivo en una segunda intervención.
Actualmente el símil-EXlT ( Exit-Like procedure ), técnica de reducción de las vísceras intra abdominales, manteniendo el soporte placentario para evitar la deglución de aire por el recién nacido, se vislumbra como un procedimiento prometedor, encontrando mayor supervivencia, menor uso de ventilación y menor índice de infección.
En cualquier caso, se hace necesario un protocolo institucional que abarque el control prenatal, la planificación del parto, el soporte al recién nacido, el tipo y tiempo de cirugía, con seguimiento de las complicaciones postoperatorias, en aras de reducir la alta mortalidad postoperatoria.
¿Cómo prevenir la gastrosquisis?
Desde el punto de vista de la prevención, dado que se trata de una patología cuya incidencia está íntimamente relacionada con la edad de la madre, habría que hacer especial énfasis en la prevención de embarazos no deseados, especialmente cuando la madre es muy joven.
De igual modo, es muy importante en todas las mujeres embarazadas llevar a cabo las pertinentes pruebas durante el embarazo para la detección prematura y control de patologías en el feto y en la madre.

Artículo especializado
Diarrea en el embarazo: causas y soluciones
La diarrea es un problema habitual en las mujeres embarazadas. Suele ser común durante el primer trimestre de embarazo, aunque también tiende a aparecer conforme se acerca la fecha del parto.
La diarrea durante el embarazo no suele ser consecuencia de una afección grave, aunque siempre es recomendable consultar con el médico, especialmente si es persistente.
Diarrea en el embarazo: causas y síntomas
Es importante cuidar de la salud de la mujer en todas las etapas, también durante el embarazo. De este modo, además de las pruebas periódicas a las que debe someterse desde que sabe que va a ser madre hasta el momento del nacimiento , también es importante estar atentos ante la aparición de cualquier síntoma como la diarrea.
La diarrea se define por la evacuación de 3 o más deposiciones diarias de características líquidas o pastosas. La diarrea aguda es normalmente leve y autolimitada; en la mayoría de las ocasiones no persiste más de 1 semana. Si el trastorno dura más de 4 semanas se considera diarrea crónica. La diarrea puede acompañarse de fiebre, especialmente si es de causa infecciosas, dolor y distensión abdominal, náuseas y vómitos.
La diarrea durante el embarazo puede aparecer por diferentes motivos. Entre ellos, cabe destacar:
Cambios hormonales . Durante el embarazo se producen modificaciones en los niveles hormonales que tienen multitud de implicaciones. Una de ellas es que se puede ver afectado el funcionamiento del sistema gastrointestinal, pudiendo llevar a la aparición de náuseas, vómitos y también diarrea.
Problemas en la digestión . Las alteraciones en la digestión pueden provocar que los alimentos no se digieran adecuadamente, lo que puede llevar a la aparición de diarrea.
Cambios en la alimentación . En el embarazo se recomienda modificar algunos aspectos de la dieta. Por ejemplo, una recomendación habitual es aumentar el consumo de alimentos ricos en fibra para evitar el estreñimiento. El aumento excesivo en la ingesta de alimentos vegetales puede ocasionar la aparición de gases, flatulencia y diarrea. Por otro lado, también se suele aumentar el consumo de lácteos por su alto contenido en calcio, por lo que el exceso de lactosa de la leche puede propiciar la aparición de diarrea.
Intoxicaciones alimentarias . Como en el resto de las personas, las mujeres embarazadas no están exentas de poder padecer toxiinfecciones alimentarias. De este modo, es importante prestar atención a la higiene de los alimentos. Se deben limitar los riesgos, evitando el consumo de alimentos crudos o poco cocinados de origen animal, o alimentos vegetales con una higiene defectuosa o de procedencia desconocida. También se debe evitar el consumo de lácteos no pasteurizados y el empleo de utensilios de cocina de madera (es un material poroso que dificulta una desinfección adecuada).
Una vez que la diarrea se ha producido, la presencia de sangre en las heces puede alertar de un posible origen bacteriano de la diarrea.
Otra causa de diarrea en el embarazo son las causadas por infecciones sin relación con la ingesta alimentaria, tales como virus respiratorios que ocasionalmente pueden afectar al intestino, como los adenovirus.
Presión en el aparato digestivo . Conforme el feto crece, aumenta la presión en la cavidad abdominal sobre las estructuras internas, incluyendo el estómago y el resto del aparato digestivo. Esto puede provocar dificultades en la digestión y absorción de los nutrientes de los alimentos, aumentando el riesgo de padecer algún episodio diarreico.
Medicamentos y suplementos . El tratamiento con determinados medicamentos o suplementos de vitaminas y minerales durante la gestación podrían ocasionar cambios en los hábitos en las deposiciones, incluyendo la aparición de diarrea. En esos casos habría que ponerlo en conocimiento del médico para que sustituya el tratamiento.
Nerviosismo . El nerviosismo por el propio embarazo puede ser causa de la aparición de trastornos gastrointestinales y diarrea.
Proximidad del parto . Es habitual que aparezcan síntomas como náuseas, indigestión o diarrea en los días próximos al parto.
Retortijones en el embarazo
Los retortijones y diarrea en el embarazo se pueden producir de forma común. De este modo, las molestias gastrointestinales y la diarrea pueden formar parte de los síntomas asociados al embarazo, si bien son las náuseas y los vómitos los más habituales.
Los retortijones son accesos de dolor abdominal intermitente y agudo que acompaña a los cólicos intestinales causados por la contracción de la musculatura lisa del intestino.
¿Cómo tratar la diarrea en embarazadas?
El tratamiento en la mayoría de los casos de diarrea en embarazadas permite una actitud expectante, ya que se suele tratar de procesos autolimitados que solo requieren de rehidratación y reposo intestinal. Por ello, cuando aparece la diarrea y esta persiste la pauta a seguir incluye:
Dieta sin alimentos sólidos en las primeras 24 horas, con suero o limonada alcalina. Posteriormente pasar a dieta astringente (arroz hervido con zanahorias y pollo, manzana, preferiblemente asada, y plátano). Las comidas deben ser poco abundantes y frecuentes. Evitar los alimentos grasos, las verduras, legumbres, bebidas con gas, alcohol, excitantes y los lácteos.
En general no se deben utilizar fármacos astringentes, a no ser que los haya prescrito el médico.
Cuando existe sospecha de diarrea de causa bacteriana el médico puede establecer un tratamiento antibiótico a la espera del resultado del análisis de las heces.
En casos extremos se puede considerar el ingreso hospitalario cuando se precisen rehidratación endovenosa o endoscopia por duda diagnóstica entre enfermedad inflamatoria intestinal y diarrea infecciosa.
Si tienes cualquier duda ponemos a tu disposición las mejores consultas de ginecología y obstetricia .
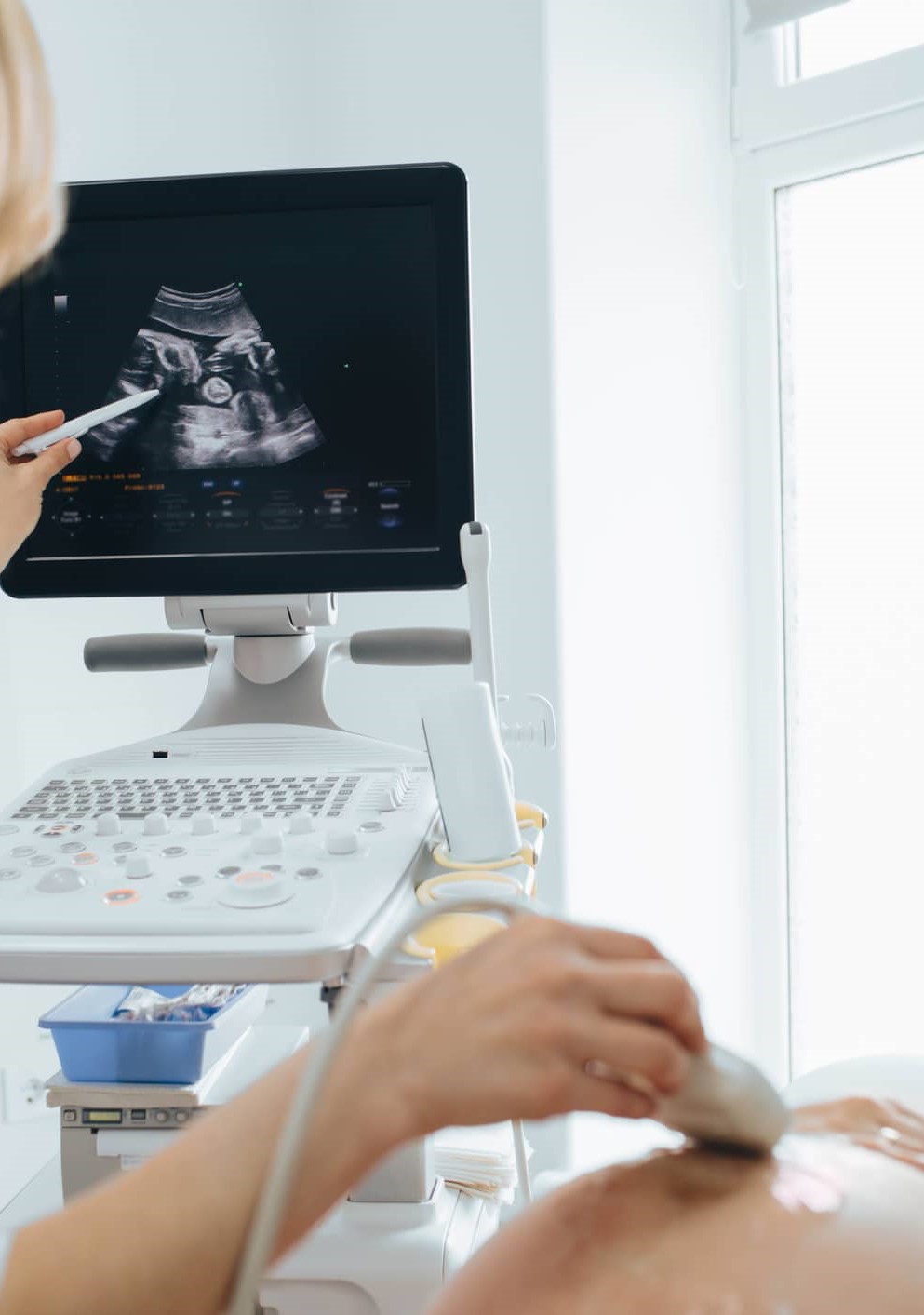
Artículo especializado
¿Cómo se calcula la fecha probable de parto?
Una de las fechas clave que se establecen cuando se produce el conocimiento del embarazo es la fecha probable de parto. A partir de aquí, se establece el resto de fechas importantes que determinarán el momento de realizar los controles y pruebas necesarias para seguir la evolución del desarrollo fetal y su estado de salud, junto con el de la madre.
Para calcular la fecha probable de parto se puede utilizar la fecha de la última regla. A partir de esta fecha, normalmente, el parto tendrá lugar entre la semana 37 y la 42. También se puede estimar la fecha de parto a partir del volumen uterino, o a lo largo de la gestación, según los parámetros de desarrollo fetal que se pueden observar por medio de ecografía.
Calcular la fecha probable de parto
El principal síntoma de que se ha producido el embarazo es la falta de menstruación.
Para saber la fecha probable de parto, se puede calcular en un 90% de los casos a partir de la fecha en la que se produce esa primera ausencia de menstruación (amenorrea).
Sin embargo, en el 10% restante de las gestantes esto no es posible, debido a posibles trastornos menstruales. En estos casos, se puede utilizar la ecografía realizada en el primer trimestre. Con la medida exacta del embrión en la ecografía de las 12 semanas, se puede estimar con gran exactitud el tiempo de gestación.
Cálculo mediante la regla
Cuando la mujer presenta una menstruación regular (el tiempo entre un ciclo y otro es de 28 días, aproximadamente), se considera que la ovulación tiene lugar con un margen de ±5 días tras llegar a la mitad del ciclo.
Existen diferentes fórmulas utilizadas para calcular la fecha de alumbramiento probable:
La fórmula de Pinard consiste en sumar 10 días desde que terminó la última menstruación, además de sumarle 9 meses.
La regla de Wahl determina que hay que sumar 10 días al primer día de la última menstruación, además de sumarle 9 meses.
La regla de Naegele −la más común− señala que se deben añadir 7 días al primer día de la última regla y sumarle 9 meses.
Etapas de desarrollo embrionario y fetal
La fecha de gestación −que determina la fecha probable de nacimiento− es clave para seguir la evolución del embarazo y del feto en la fase embrionaria y fetal.
Período embrionario
Se trata de una etapa delicada en la cual pueden ocurrir alteraciones en la formación y desarrollo del embrión.
Período fetal
El período comprende desde la semana 9 hasta el nacimiento. Se caracteriza por el desarrollo del organismo y la diferenciación de los tejidos y órganos formados en el período embrionario.
Al final de la semana 12 se diferencian los genitales externos. En el primer embarazo se pueden empezar a notar los movimientos del feto a partir de la semana 20. En los siguientes embarazos se pueden empezar a percibir a partir de la semana 16.
El feto sigue creciendo y ganando peso hasta el momento del nacimiento.
¿Cómo saber la fecha exacta de la concepción siendo irregular?
Se considera como regular o normal un ciclo menstrual que tiene lugar cada 21-35 días, con una hemorragia de entre 20 y 60 mililitros, con una duración aproximada de 2-5 días.
Sin embargo, las alteraciones en la menstruación son frecuentes, tratándose de uno de los motivos más habituales de consulta al ginecólogo.
Los trastornos menstruales más habituales incluyen:
Ciclos irregulares . Estos tienen lugar cuando la duración de la menstruación difiere mucho de un ciclo a otro.
Ciclos cortos o largos . También se considera fuera de la normalidad las menstruaciones regulares que duran poco (21 días o menos) o demasiado (más de 35 días).
Hemorragias anormales . Algunas mujeres pueden tener menstruaciones con hemorragias excesivas, con una duración mayor a cinco días (menorragia) o, por el contrario, una menstruación con un sangrado muy débil (hipomenorrea). Otras con ciclos y sangrados normales pueden sufrir también una hemorragia intermenstrual o spotting intermenstrual, un pequeño sangrado entre los ciclos normales.
Amenorrea . Ausencia de menstruación en un periodo superior a tres meses sin causa justificada (lactancia o embarazo).
En el caso de ciclos irregulares, la manera de calcular con exactitud el momento de la fecundación y la fecha de parto más probable es a partir de una ecografía, utilizando como parámetro para ello la longitud cráneo-caudal (CRL).
¿Qué es un gestograma?
Un gestograma es una calculadora que incluye información sobre el embarazo, sus etapas y la posible fecha de parto. También se conoce como rueda de embarazo o disco gestacional por su forma circular.
Además, el gestograma permite seguir los progresos del embarazo, conociendo el estado del desarrollo del bebé.
El gestograma es muy sencillo de utilizar. Conociendo la fecha de la última menstruación, permite calcular información de interés, incluyendo:
La fecha probable del parto.
La semana de gestación actual.
El peso fetal estimado en esa semana.
El tamaño fetal estimado para esa semana.
Otros parámetros fetales como el diámetro de la cabeza, la longitud del fémur, etc.
Savia pone a tu disposición los mejores especialistas en ginecología y obstetricia .

Artículo especializado
Test estreptococo en el embarazo: qué es y cuándo es necesario
Los Streptococcus agalactiae o estreptococos del grupo B (EGB), son bacterias que están presentes de forma habitual en el tracto digestivo, urinario y en la vagina de una alta proporción de adultos. La colonización puede ser transitoria, intermitente o persistente y raramente causan síntomas o problemas en los adultos sanos, pero pueden causar problemas graves en recién nacidos si se infectan durante el parto. Aproximadamente el 50% de los recién nacidos de madres portadoras son colonizados por EGB.
De este modo, es importante identificar a las embarazadas portadoras de la bacteria para evitar una infección del bebé mediante un sencillo test.
Qué es el test del estreptococo en el embarazo
Se trata de una prueba sencilla e indolora que consiste en recoger una muestra por medio de una torunda de algodón en la vagina y el ano. A partir de aquí, se puede realizar un cultivo a partir de la muestra con el exudado vaginorrectal en el laboratorio para la identificación de la presencia de EGB. Por otro lado, se han hecho importantes progresos en el desarrollo de pruebas rápidas de detección de EGB basadas en la amplificación de ácidos nucleicos y detección de antígenos de la bacteria.
La presencia de la bacteria en adultos es muy variable. En Europa se han señalado tasas próximas al 20%. En España se han estimado una tasa de colonización en embarazadas entre el 12 y el 20%, aunque puede ser mayor.
Para qué sirve la prueba
Identificar la presencia de la EGB en la madre es el primer paso para prevenir la infección del recién nacido. La prueba sencilla e indolora debe realizarse al final del embarazo y sirve para disminuir el riesgo de una infección del bebé cuando se rompe la bolsa amniótica o a través del canal del parto.
La infección por EGB es una las causas más frecuentes de sepsis neonatal de etiología bacteriana. En ausencia de medidas de prevención, un 1-2% de los recién nacidos colonizados durante el parto desarrollan una infección en los primeros 7 días de vida.
La infección cursa con sepsis, neumonía o meningitis y en la gran mayoría de casos se presenta en el primer día de vida. La mortalidad por esta causa se ha reducido notablemente como resultado de los avances en la asistencia neonatal. Sin embargo, como consecuencia de la infección, el 25-30% de los recién nacidos afectados pueden padecer importantes secuelas neurológicas.
La infección por EGB es también causa importante de infección durante el embarazo (corioamnionitis) y en el posparto (endometritis).
En madres portadoras de la bacteria, la administración de un tratamiento antibiótico en el parto determina que el riesgo de que el neonato sufra una infección debida al Estreptococo B disminuye considerablemente.
Cuándo se recomienda hacer la prueba
Habitualmente, se sugiere ofrecer un cribado universal para la colonización por estreptococo B entre la semana 35 y 37 de gestación para disminuir el riesgo de sepsis neonatal. Si se realiza con mucha antelación al momento del parto, se podría producir la infección a posteriori y dejar la prueba sin utilidad.
En caso de que exista riesgo de parto prematuro, el ginecólogo podría indicar la realización de la prueba con anterioridad.
Cómo se realiza y qué resultados puede dar
La realización de la prueba y la toma de muestras es muy sencilla. Aunque lo habitual es que sea un profesional de la salud quien la realice, se puede llevar a cabo por el propio paciente sin que se vea distorsionado en resultado.
En el caso del test rápido de detección del estreptococo B, se recoge la muestra y se introduce el hisopo en el cubilete y se mezcla la solución, dejando reposar durante 1 minuto. Finalmente, se vierte el contenido en el pocillo del kit rápido. Se podrá leer el resultado en cuestión de minutos. Los test rápidos presentan una precisión diagnóstica muy próxima a la prueba de cultivo tradicional. El ginecólogo puede determinar la necesidad de confirmar el resultado con otro tipo de prueba.
En caso de resultado positivo se deberá administrar la profilaxis antibiótica en el momento del parto.
De este modo, la profilaxis antibiótica intraparto está indicada en los siguientes casos:
Todas las mujeres portadoras vaginales o rectales de EGB al final del embarazo. El momento óptimo para la toma del cultivo es en la semana 35-37 de gestación.
Todas las mujeres en que se detecta EGB en orina durante la gestación, independientemente del resultado del cultivo vaginorrectal.
Todas las gestantes que previamente han tenido un hijo con infección neonatal por EGB, con independencia del resultado del cultivo vaginorrectal.
Todos los partos con menos de 37 semanas de gestación en que no se disponga del resultado del cultivo.
Todos los partos en que exista rotura de membranas superior a 18h cuando no se disponga del resultado del cultivo.
Todos los partos en que exista fiebre intraparto (38 °C o más) cuando no se disponga del resultado del cultivo.
Mujeres a las que se les ha realizado una prueba molecular (PCR) intraparto de detección de colonización por EGB y el resultado es positivo.
Por el contrario, la profilaxis antibiótica intraparto no está indicada si:
El cultivo vaginorrectal es negativo en la presente gestación, aunque hayan sido positivas en un embarazo anterior.
El parto se lleva a cabo por cesárea programada sin comienzo del parto y membranas íntegras, aunque el cultivo a EGB haya sido positivo.
Partos en embarazo de más de 37 semanas de duración con estado de colonización por EGB desconocido y sin factores de riesgo.
En Savia disponemos de test rápido para la identificación del estreptococo .
Bibliografía
Ministerio de Sanidad. Guía de práctica clínica de atención en el embarazo y puerperio. 2014 .
Alós JI et al. Prevención de la infección perinatal por estreptococo del grupo B. Recomendaciones españolas. Actualización 2012. Documento de consenso SEIMC/SEGO/SEN/SEQ/SEMFYC. Enfermedades Infecciosas y Microbiología Clínica 2013; 31(3): 159-172. DOI: 10.1016/j.eimc.2012.03.013 .
Verani JR, McGee L, Schrag SJ; Division of Bacterial Diseases, National Center for Immunization and Respiratory Diseases, Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease–revised guidelines from CDC, 2010. MMWR Recomm Rep 2010; 59(RR-10): 1-36. PMID: 21088663 .
Carrillo-Ávila JA et al. Comparison of qPCR and culture methods for group B Streptococcus colonization detection in pregnant women: evaluation of a new qPCR assay. BMC Infect Dis 2018; 18(1): 305. doi: 10.1186/s12879-018-3208-4 .
Artículo especializado
Análisis de sangre recomendados durante el embarazo
A lo largo del embarazo se recomienda la realización de diferentes pruebas para seguir la evolución de la gestación y descartar cualquier problema de salud tanto en el feto como en la madre. Entre esas pruebas se incluyen varios análisis de sangre, cuyos parámetros analíticos variarán en función del momento del embarazo y de las circunstancias específicas de la madre y el feto.
Análisis de sangre antes del embarazo
Es recomendable que las mujeres que deseen quedarse embarazadas se hagan un análisis de sangre preconcepcional para valorar su estado de salud, detectar posibles alteraciones y poder abordarlas y corregirlas con anterioridad a que se produzca el embarazo.
Análisis de sangre del primer trimestre de embarazo
Las pruebas que se realizan durante el embarazo incluyen diferentes análisis de sangre.
Primer análisis de sangre en el embarazo
Suele ser habitual una analítica completa para comprobar el estado de salud general de la madre en cuanto sabe que está embarazada.
Para ello, en la primera analítica del embarazo se suele incluir:
Hemograma completo. En él se realiza el recuento de glóbulos rojos, leucocitos y plaquetas. También los niveles de hemoglobina y el hematocrito.
Bioquímica (glucemia, perfil lipídico, electrolitos, etc.).
Hormona tiroestimulante (TSH).
Determinación del grupo sanguíneo y Rh. Cribado de anticuerpos irregulares o test de Coombs indirecto.
Serología para la detección de anticuerpos contra microorganismos causantes de enfermedades infecciosas (rubeola, toxoplasmosis, VIH, sífilis, hepatitis, etc.).
Dentro del primer trimestre de embarazo también se puede realizar el test de O’Sullivan para el cribado de la diabetes gestacional si se trata de mujeres mayores de 35 años, o con obesidad, o diabetes gestacional previa o antecedentes de diabetes familiar. Consiste en suministrar una bebida que contiene 50 g de glucosa y analizar la glucosa en sangre antes y después. Si es positiva (más de 140 mg/dl) se realizará la confirmación diagnóstica con la prueba de sobrecarga oral con 100 g de glucosa.
En Savia disponemos de todos los análisis clínicos que necesites desde 25 €.
Análisis de sangre para el cribado combinado del primer trimestre
El objetivo de esta prueba es la identificación de gestantes con riesgo de anomalía cromosómica fetal (la más común es la trisomía 21 o síndrome de Down ).
Dentro de la prueba se incluye un análisis de sangre para cuantificar diferentes marcadores bioquímicos presentes en la sangre materna, como la proteína plasmática A asociada al embarazo (PAPP-A) y la fracción libre de la gonadotropina coriónica humana (fb-hCG). Esta información, combinada con la edad materna, los marcadores ecográficos (como la translucencia nucal del feto, esto es, el engrosamiento del pliegue nucal) permite estimar el riesgo de anomalías cromosómicas.
Análisis de sangre para el test de la preeclamsia
El test para la preeclamsia consiste en calcular el riesgo de preeclamsia en función de los niveles hormonales en sangre (análisis de sangre), los valores de tensión arterial y determinados datos recogidos en la primera ecografía fetal.
La preeclamsia es un cuadro asociado al embarazo que puede llegar a ser grave y que se suele desarrollar en el tercer trimestre. Afecta a distintos órganos maternos siendo sus síntomas más frecuentes la elevación de la tensión arterial y la retención de líquidos.
El test se puede realizar en todos los trimestres.
Puedes acceder al test de preeclamsia del primer trimestre y al test de preeclamsia del segundo/tercer trimestre .
Análisis de sangre del segundo trimestre
Análisis de sangre rutinario del segundo trimestre
En el segundo trimestre se recomienda realizar una nueva analítica rutinaria del embarazo. En ella se incluye:
Test de O’Sullivan para el cribado de la diabetes gestacional. En mujeres sin factores de riesgo se lleva a cabo entre las semanas 24 y 28 de embarazo. Se suministra una bebida que contiene 50 g de glucosa y se analiza la glucosa en sangre antes y después.
Anticuerpos contra Rh si este salió
Test de diagnóstico prenatal no invasivo en sangre materna
Se trata de una prueba que a partir de una muestra de sangre de la mujer embarazada permite estimar el riesgo de alteraciones genéticas o cromosómicas del feto sin someterlo a ningún riesgo. Se puede realizar a partir de la semana 10 de embarazo, momento en el que existe suficiente material fetal circulante en la sangre materna.
En Savia puedes acceder a un test prenatal no invasivo en sangre materna .
Análisis de sangre del tercer trimestre
Analítica rutinaria del tercer trimestre
En la analítica sanguínea rutinaria del tercer trimestre se incluye:
Bioquímica.
Serología de hepatitis y toxoplasmosis.
Algún otro parámetro que el especialista estime oportuno.
¿Los análisis de sangre en mujeres embarazadas deben ser en ayunas?
Los análisis de sangre en mujeres embarazadas, al igual que los del resto de la población, se deben llevar a cabo en ayunas para evitar que la ingesta de alimentos interfiera en los resultados analíticos. Se recomienda realizarlos siempre a primera hora de la mañana para no alargar el ayuno excesivamente.
En Savia disponemos de todos los análisis clínicos que necesites desde 25 €.
Bibliografía
Organización Mundial de la Salud. Recomendaciones de la OMS sobre atención prenatal para una experiencia positiva del embarazo. 2018. Consultado: 13/10/2021 .
Ministerio de Sanidad. Guía Práctica Clínica sobre la Atención al Parto Normal. 2010. Consultado: 23/07/2021 .
Sociedad Española de Ginecología y Obstetricia. Embarazo. Consultado: 13/10/2021 .
Sociedad Española de Ginecología y Obstetricia. Control prenatal del embarazo normal. Progresos de Obstetricia y Ginecología 2018; 61(5): 510-527.
Contenidos sobre enfermedades
Somos conscientes de que los conceptos médicos pueden resultar confusos si no te los explican con claridad. Para evitar esto, le hemos pedido a nuestros profesionales que preparen estas fichas en donde podrás acceder a información relevante sobre enfermedades que te ayudará a entender de una manera sencilla por qué se producen y por qué es necesario su tratamiento.
Ver todas las enfemedades 
Enfermedad
Ovarios Poliquísticos
Actualizado el día 15/09/2021
El síndrome del ovario poliquístico es la patología endocrina más frecuente en mujeres en edad fértil, aunque permanece infradiagnosticado. Se trata de un síndrome complejo y heterogéneo en cuanto a su presentación, evolución y consecuencias a corto y largo plazo.
¿Qué es el síndrome de ovarios poliquísticos?
El síndrome de ovarios poliquísticos determina la aparición de quistes (pequeñas cavidades llenas de líquido) en los ovarios, debido a una producción excesiva de hormonas masculinas.
El síndrome de ovarios poliquísticos agrupa una colección de signos y síntomas que incluye, además de la producción de hormonas masculinas por encima de lo normal, disfunción ovulatoria con prolongación, disminución de la frecuencia o ausencia de los períodos menstruales con escasa liberación de óvulos y aparición de quistes en los ovarios .
El signo clínico más característico determinado por el hiperandrogenismo es el hirsutismo o exceso de vello siguiendo un patrón masculino. También puede aparecer acné y alopecia.
Esta alteración endocrina afecta aproximadamente a 1 de cada 10 mujeres en edad reproductiva y está relacionado directamente con la disminución de la fertilidad.
Causas del síndrome de ovarios poliquísticos
Como en la mayoría de los síndromes, no existe una única causa para los ovarios poliquísticos. Sí existe una disfunción neuroendocrina con un exceso de hormona luteinizante, que es la encargada de regular la secreción de testosterona, impidiendo a los óvulos madurar lo suficiente y que, en lugar de ser expulsados de los ovarios durante la ovulación, permanezcan en el interior formando los quistes.
También existe un trastorno metabólico con resistencia a la insulina e hiperinsulinemia, lo que también estimula la producción de andrógenos.
Otros factores que se relacionan con la enfermedad y que pueden influir en el desarreglo hormonal son la obesidad , una alimentación deficiente y una vida sedentaria, entre otros.
Finalmente, el síndrome de ovario poliquístico puede tener causas genéticas, por alteración o mutación de genes, lo que determina que sea una patología altamente hereditaria.
Síntomas
Los síntomas del síndrome de ovarios poliquísticos pueden incluir:
Menstruaciones irregulares . Es común la oligomenorrea (disminución hasta 6-8 reglas anuales) o amenorrea (ausencia de regla durante varios periodos menstruales seguidos). Estos ciclos menstruales irregulares se asocian con una disminución en la ovulación y mayores tasas de infertilidad.
Hirsutismo y síntomas virilizantes . El exceso de hormonas masculinas (hiperandrogenismo) determina la aparición de síntomas virilizantes, como el aumento de vello en diferentes zonas como la cara, muslos, abdomen, espalda y antebrazos. Otros síntomas incluyen clitoromegalia, alopecia, voz grave, hipotrofia mamaria y aumento de la masa muscular.
Acné y piel grasa.
La resistencia a la insulina puede conducir a la aparición de diabetes, hipertensión arterial, aumento del colesterol y obesidad, entre otros.
Aumento de peso .
Dolor pélvico .
Manchas de color marrón oscuro en la piel.
Pruebas y exámenes para el diagnóstico del síndrome de ovarios poliquísticos
En un tercio de las mujeres pasan más de 2 años hasta que se les diagnostica la enfermedad. De ahí que se deba poner el foco en dos cuestiones específicas para identificar a los pacientes con mayor riesgo: mujeres con exceso de vello corporal o facial con un patrón masculino y mujeres con un historial de irregularidad menstrual u oligoamenorrea.
Las pruebas complementarias y exámenes para el diagnóstico del síndrome de ovarios poliquísticos deben incluir:
Examen físico.
Examen pélvico.
Análisis de sangre completo que incluya determinaciones hormonales, en especial, las hormonas masculinas.
Ecografía ginecológica de alta resolución.
Tratamiento del síndrome de ovario poliquístico
El síndrome de ovario poliquístico no tiene cura, pero sí se pueden establecer metas terapéuticas para diferentes aspectos de la enfermedad.
Tratamiento no farmacológico
Los cambios en el estilo de vida pueden suponer una mejora considerable de los diferentes parámetros alterados por la enfermedad. La pérdida de peso, una alimentación sana y realizar ejercicio físico de manera regular puede favorecer la regulación hormonal, mejorar la sensibilidad a la insulina, aumentar la fertilidad y hacer que mejoren todos los síntomas.
Tratamiento farmacológico
Los anticonceptivos hormonales pueden ser adecuados para regular la producción de hormonas y de esta manera normalizar el ciclo menstrual. También pueden incidir positivamente sobre el acné y el crecimiento del vello corporal.
El tratamiento hormonal como los antiandrógenos que regulan el nivel de las hormonas masculinas mejoran el acné y el vello corporal.
Por otro lado, el uso de antidiabéticos orales como la metformina puede ayudar a regular los niveles de insulina y, por tanto, a regular los ciclos menstruales.
Por último, se pueden utilizar inductores de la ovulación en el caso de pacientes que deseen quedarse embarazadas.
Factores desencadenantes del síndrome del ovario poliquístico
Como en la mayoría de síndromes, no existe un único desencadenante del síndrome del ovario poliquístico.
Por el contrario, existen diversos factores que pueden determinar un mayor riesgo de que aparezca la patología.
Factores de riesgo de los ovarios poliquísticos
Los factores de riesgo del síndrome de ovarios poliquísticos pueden incluir una alimentación deficiente, el exceso de peso y la obesidad y una vida sedentaria. También puede haber factores genéticos que hacen que la enfermedad sea hereditaria en base a determinados cambios o mutaciones genéticas.
Complicaciones
Las mujeres que padecen el síndrome de ovario poliquístico pueden presentar una serie de complicaciones asociadas, entre ellas:
Síndrome metabólico.
Diabetes tipo 2 y obesidad.
Hipertensión arterial.
Enfermedades cardiovasculares.
Trastornos menstruales, infertilidad y abortos.
Crecimiento excesivo de vello.
Apnea obstructiva del sueño.
Cáncer de endometrio.
Depresión y ansiedad.
Prevención
Existe una serie de recomendaciones que pueden ayudar a reducir el riesgo de padecer la enfermedad y, en todo caso, atenuar los síntomas y regular los ciclos menstruales. Además del tratamiento médico, es importante conseguir una buena calidad de vida eliminando el estrés, realizar ejercicio físico de manera regular, mantener una dieta saludable y evitar el exceso de peso y la obesidad.
Especialidades para el síndrome del ovario poliquístico
El síndrome de ovarios poliquísticos es tratado por los médicos especialistas en Endocrinología y en Ginecología.
¿Necesitas atención presencial con un especialista en ginecología? En Savia reserva una consulta con los mejores profesionales sin esperas.
Preguntas frecuentes
¿Cuáles son los síntomas de quistes en los ovarios?
Los síntomas de quistes en los ovarios son dolor en la parte baja del abdomen, hinchazón y sensación de plenitud abdominal, dolor durante las relaciones sexuales o dolor durante la defecación, entre otros.
¿Qué riesgos implica el ovario poliquístico?
El síndrome de ovario poliquístico aumenta el riesgo de infertilidad, cáncer de endometrio, metabolismo anormal de la glucosa y dislipidemia.
¿Qué produce quistes en los ovarios?
Los quistes de ovarios suelen tener un componente genético, pero también se producen por una alteración hormonal, endometriosis, embarazo, infecciones pélvicas o el síndrome de ovarios poliquísticos.
¿Cuál es el tamaño normal de un quiste de ovario?
Un quiste de ovario suele medir menos de 5 cm. En el síndrome de ovarios poliquísticos suelen aparecer al menos 12 folículos que suelen medir de 2 a 10 mm.
¿Qué son los folículos de los ovarios?
Los folículos son estructuras anatómico-funcionales que forman parte del ovario y que albergan en sus paredes internas al ovocito y a otras células productoras de estrógenos.
¿Qué es un quiste funcional?
En los ovarios se producen folículos que son estructuras funcionales que producen hormonas y liberan el óvulo durante la ovulación. Cuando un folículo normal continúa creciendo, se denomina quiste funcional. No suelen causar síntomas y desaparecen por sí solos.
¿Cuánto tiempo tarda en quitarse un quiste de ovario?
Por norma general, un quiste de ovario se rompe en el momento de la ovulación, pero algunos resisten y pueden tardar hasta 3 meses en desaparecer.
Bibliografía
Sociedad Española de Ginecología y Obstetricia. Estudio y tratamiento de la anovulación en el síndrome de ovarios poliquísticos. Prog Obstet Ginecol 2017; 60(5): 505-516 .
Azziz R. Polycystic Ovary Syndrome. Obstet Gynecol 2018; 132(2): 321-336. doi: 10.1097/AOG.0000000000002698 .
McCartney CR, Marshall JC. Polycystic Ovary Syndrome. N Engl J Med. 2016 Jul 7;375(1):54-64. doi: 10.1056/NEJMcp1514916 .

Enfermedad
Síndrome premenstrual
¿Qué es el síndrome premenstrual?
El síndrome premenstrual (SPM) es un conjunto de síntomas y cambios físicos y psíquicos, bien definidos, que experimentan las mujeres días antes de la menstruación (entre el día 14 y 28). Esto sucede mes tras mes y puede afectar al 90 % de las mujeres, y con mayor frecuencia entre los 20 y 30 años de edad.
La intensidad de los síntomas puede variar de unas mujeres a otras y pueden ser simples molestias o ser tan agudos que el malestar que ocasionan pueden interferir e incluso incapacitar en las actividades diarias o laborales.
El síndrome premenstrual termina cuando empieza la regla .
Tipos de síndrome premenstrual
No existen tipos de síndrome premenstrual.
Causas de un síndrome premenstrual
No se sabe con exactitud cuales son las causas del síndrome premenstrual , pero podría estar relacionado con un desequilibrio hormonal de estrógenos y progesterona. Esto produce una retención de líquidos y sodio que provocaría un aumento de peso y edema generalizado dando lugar a los síntomas premenstruales.
También se desconocen las causas por las que unas mujeres son más sensibles que otras a estos cambios hormonales.
Síntomas de un síndrome premenstrual
Los síntomas del síndrome premenstrual pueden ser:
Síntomas físicos:
Hinchazón de abdomen
Edemas generalizados por retención de líquidos
Tensión e inflamación de las mamas
Diarrea o estreñimiento
Calambres
Dolor de cabeza y espalda
Intolerancia a la luz y al ruido
Acné
Síntomas psicológicos o emocionales:
Cambios repentinos del estado de ánimo
Irritabilidad
Cansancio
Ansiedad
Tristeza o depresión
Cambios de apetito como la necesidad de comer dulce
Trastornos del sueño
Pérdida de interés en el sexo
Pérdida de concentración
Tratamiento de un síndrome premenstrual
El tratamiento del síndrome premenstrual puede ser:
Tratamiento médico: para aliviar los síntomas como los antiinflamatorios, analgésicos, diuréticos, antidepresivos o anticonceptivos hormonales, entre otros.
Remedios caseros: ayudan a paliar los síntomas como la actividad física diaria, evitar la sal, cafeína, alcohol y azúcar los días previos al ciclo, no fumar, controlar el estrés, descansar y dormir más horas, o llevar una dieta saludable con más vitaminas y minerales durante esos días previos.
Pruebas complementarias de un síndrome premenstrual
No hay pruebas específicas para diagnosticar el síndrome premenstrual , basta con la descripción de los síntomas, en qué momento aparecen y si se repiten durante al menos tres ciclos menstruales para poder diagnosticar el síndrome premenstrual.
Factores desencadenantes de un síndrome premenstrual
El factor desencadenante se debe a la disminución de los niveles de estrógeno y progesterona después de la ovulación. Cuando comienza la menstruación, los niveles de estas hormonas comienzan a subir de nuevo. S e desconoce porqué unas mujeres son más sensibles que a otras .
Factores de riesgo de un síndrome premenstrual
No hay factores de riesgo.
Complicaciones de un síndrome premenstrual
Las posibles complicaciones de un síndrome premenstrual pueden ser la incapacidad del desarrollo de las actividades diarias y laborales, pensamientos suicidas e incluso suicidio en las mujeres con depresión, por eso es importante ajustar el tratamiento esos días puntuales .
Prevención de un síndrome premenstrual
No existe prevención para evitar el síndrome premenstrual.
Especialidades a las que pertenece
El síndrome premenstrual es tratado por el médico de Atención Primaria , que trata los síntomas y recomienda pautas para aliviarlos, pero cuando el síndrome premenstrual afecta de manera más intensa o incapacita el ritmo de vida diario es el Ginecólogo (médico del aparato reproductor femenino) quien hace un seguimiento y tratamiento del síndrome premenstrual.
Preguntas frecuentes
¿Cuándo aparecen los primeros síntomas del embarazo?
Los primeros síntomas de embarazo es la ausencia de regla, senos hinchados, cansancio y somnolencia, orinar más a menudo, náuseas y vómitos, hinchazón abdominal y dolor pélvico, entre otros.
¿Cuándo se presenta el síndrome premenstrual?
El síndrome premenstrual se presenta cuando aparecen una serie de síntomas concretos días antes de la regla, durante al menos 3 meses.
¿Cuánto es lo máximo que dura el periodo menstrual?
El periodo menstrual puede durar entre 25 y 30 días, incluso alargarse a 35 días.
¿Cuáles son los trastornos menstruales?
Los trastornos menstruales pueden ser náuseas, vómitos, dolor abdominal tipo retortijón, dismenorrea (dolor menstrual), dolor de espalda, diarrea o dolor de cabeza, entre otros.
¿Cuánto tiempo pueden durar los síntomas premenstruales?
Los síntomas pre menstruales duran unos días antes de la aparición de la regla. Suelen estar presentes en los años entre la adolescencia y la vida adulta, es decir, entre los 20 y 30 años.

Enfermedad
Mioma Uterino
¿Qué es el mioma uterino?
El mioma o fibroma uterino, es un tipo de tumoración benigna en las paredes del útero y está formado por un incremento en forma de nódulo de las fibras musculares del útero .
Los miomas varían en número, tamaño y localización. Afecta a mujeres en edad fértil y su origen es desconocido , pero su crecimiento está muy influenciado por las hormonas femeninas.
Tipos de mioma uterino
Los miomas uterinos pueden ser:
Mioma subseroso: tiene una afectación en mujeres del 40% de miomas. No produce síntomas, pero si alcanza un tamaño grande puede producir molestias y dolor por compresión en órganos próximos.
Miomas intramusculares: debido a que pueden alcanzar gran tamaño, puede aumentar, también, el tamaño del útero. Constituye el 55% de los miomas y se suelen localizar en la porción central del miometrio (capa muscular intermedia).
Mioma submucoso: son menos frecuentes, dan más sintomatología al producir mucho sangrado menstrual provocando, en muchos casos, que la mujer padezca anemia ferropénica (falta de hierro). Tiene una elevada probabilidad de malignizar.
Causas de un mioma uterino
No se conocen las causas del mioma de útero, pero se ha detectado una relación directa con las hormonas femeninas , condicionando el desarrollo y crecimiento de los miomas, por eso se da en mujeres en edad fértil (desde la pubertad hasta la menopausia). Transcurrido este tiempo, el tamaño disminuye debido a que los niveles de hormonas en sangre son menores.
Síntomas de un mioma uterino
Aproximadamente el 30% de las mujeres no tienen ningún síntoma y solo se descubre su presencia de un mioma uterino en las revisiones rutinarias con el ginecólogo .
La aparición de los síntomas depende de su tamaño, número de miomas y localización, siendo los más sintomáticos los que se localizan en la cavidad interna del útero.
Los síntomas pueden ser:
Cambios menstruales en su duración, frecuencia y cantidad de sangrado.
Dolor.
Anemia ferropénica debido al exceso de sangrado.
Aumento del perímetro del abdomen en caso de miomas grandes.
Aumento de peso.
Complicaciones en embarazo y parto.
Compresión de vejiga y recto en el caso de miomas de gran tamaño.
Necesidad de orinar con mayor frecuencia.
Lumbalgia y dolor en pelvis.
Infertilidad.
Aumento de probabilidades de aborto o parto prematuro.
Molestias en las relaciones sexuales.
Tratamiento de un mioma uterino
La mayoría de los miomas no requieren tratamiento por ser asintomáticos, y se tiende a tener una actitud conservadora.
En caso de presentar sintomatología, el tratamiento puede ser:
Tratamiento médico:
Fármacos (agonistas de la GnRH) que disminuyen el nivel de estrógenos en sangre y, con ello, el tamaño de los miomas, pero tiene efectos secundarios con sintomatología similar a una menopausia (sofocos, sudoración, sequedad vaginal, etc.) y, además, cuando se termina el tratamiento, el mioma vuelve a crecer.
Analgésicos para paliar el dolor.
Anticonceptivos, progestágenos y dispositivos uterinos para disminuir la hemorragia.
Hierro para tratar la anemia.
Tratamiento quirúrgico:
Se emplea dependiendo de tamaño y localización del mioma.
Se puede realizar por vía vaginal o laparoscópica (tubo flexible con una cámara e instrumentos quirúrgicos, que se introduce por unas incisiones realizadas en el abdomen). Pueden ser:
Miomectomía, en la que se extirpa sólo el mioma, se conserva el útero y se preserva la fertilidad.
Histerectomía, en la que se extirpa una parte o la totalidad del útero, dependiendo de la localización y tamaño del mioma. Se preserva la función hormonal por conservar los ovarios, pero no hay posibilidad de embarazo.
Radiología intervencionista: técnica guiada por rayos usada para embolizar los miomas, es decir, suspender el riego sanguíneo del mioma.
Pruebas complementarias de un mioma uterino
Algunas pruebas complementarias para el diagnóstico de un mioma uterino son:
Exploración física: para detectar el tamaño del útero, presencia de miomas y dolor a la palpación.
Ecografía: para localizar, medir y determinar cuántos miomas hay. Es la prueba diagnóstica más efectiva y fiable.
Histeroscopia: se introduce un tubo por la vagina para ver el interior del útero.
TAC pélvico: para observar la repercusión de los órganos vecinos.
Resonancia magnética: para visualizar posibles tumores.
Factores desencadenantes de un mioma uterino
Los factores desencadenantes de los miomas uterinos están causados por el aumento de estrógenos en sangre .
Factores de riesgo de un mioma uterino
Los factores de riesgo de un mioma pueden ser:
Mujeres de entre 35 y 45 años.
Mayor incidencia en la raza afroamericana.
Obesidad, hipertensión o diabetes.
Mujeres nulíparas (no han dado a luz).
Desarreglo hormonal (aumento de estrógenos).
Factor hereditario.
Complicaciones de un mioma uterino
Las complicaciones del mioma uterino pueden ser:
Compresión de vejiga y retención urinaria.
Edemas, varices y trombosis en las piernas, por compresión de venas pélvicas dificultando la circulación de retorno de las piernas.
Hemorragias abundantes.
Malignización del mioma, suele ocurrir en un 0,5 % de los miomas.
Prevención de los miomas
Los miomas no se pueden prevenir debido a que no se sabe con exactitud la causa .
Se pueden hacer unas recomendaciones como son las revisiones ordinarias con el ginecólogo, controlar el peso y llevar una dieta saludable junto con la práctica regular de ejercicio físico.
Especialidades a las que pertenece
La especialidad médica que trata los miomas es Ginecología y Obstetricia.
Preguntas frecuentes
¿Cuál es el tamaño de un mioma uterino?
Los miomas varían en tamaño, siendo los más pequeños de hasta 2 cm. y los grandes a partir de 6 cm .
¿Cuál es la diferencia entre un mioma y un fibroma?
Es lo mismo un mioma que un fibroma. También se pueden llamar leiomiomas .
¿Qué son miomas tipo 4?
Los miomas tipo 4 son miomas que ocupan un 50% del volumen del interior del útero .
¿Qué es un mioma en el endometrio?
Un mioma en el endometrio es aquel que crece hacia la cavidad uterina, es decir, hacia la mucosa que recubre la pared del útero .
¿Cuándo una mujer tiene miomas puede quedar embarazada?
Los miomas son compatibles con el embarazo, pero, en ocasiones, pueden aparecer complicaciones durante la gestación (abortos, partos prematuros o alteración en el desarrollo fetal), en el parto (hemorragias, mala presentación del feto o dificultad en las contracciones), y en el postparto (hemorragias).

Enfermedad
Vaginosis Bacteriana
¿Qué es la vaginosis bacteriana?
La vaginosis bacteriana es una infección vaginal por una bacteria , se produce por el desequilibrio entre la diferente flora bacteriana de la vagina, en la cual se produce un descenso de los lactobacilos y un aumento de la gardnerella (bacilo de la región genital). Es la infección bacteriana más frecuente entre los 14 y 40 años, y es una enfermedad leve.
Tipos de vaginosis
Los tipos de vaginosis serán diferentes según el germen que lo produce, así tenemos:
Vaginosis bacteriana : se produce por el germen conocido como Gardnerella vaginalis.
Vaginitis candidiasica o candidiasis vaginal : se debe a la infección por hongo Candida albicans , produce un flujo blanco y espeso.
Vaginitis tricomoniasis : se produce por el protozoo Trichomona vaginalis.
Vaginitis por clamidia : producida por la Chlamydia trachomatis
Causas de la vaginosis bacteriana
La causa de la vaginosis bacteriana es la infección por parte de la Gardnerella vaginalis.
Síntomas de vaginosis bacteriana
La vaginosis bacteriana en la mayoría de los casos es asintomática , o presenta síntomas muy leves. Cuando aparecen síntomas, estos son, la presencia de flujo delgado y abundante con olor a pescado , de un color que puede ser blancuzco, gris apagado o incluso verdoso, las pacientes también pueden presentar ciertas molestias como ardor al orinar o ligero picor, en algunos casos poco frecuentes puede dar dolor suprapúbico.
Tratamiento para la vaginosis bacteriana
El tratamiento de la vaginosis bacteriana va a ser tratamiento antibiótico , que puede ser de uso oral, en forma de óvulos vaginales, o geles. Los antibióticos que se suelen usar son el Metronidazol o Clindamicina .
Pruebas complementarias del tratamiento de vaginosis bacteriana
La prueba complementaria será un exudado vaginal , aunque también se puede encontrar mediante citología en aquellas personas que no presentan sintomatología y por tanto no consultan por este problema.
Factores desencadenantes de la vaginosis bacteriana
No se conocen las causas que desencadenan las vaginosis bacterianas, si bien se conoce que las personas con relaciones sexuales con múltiples parejas pueden sufrir esta infección. No se encuentran casos de vaginosis bacteriana en personas que no tienen relaciones sexuales.
Factores de riesgo de la vaginosis bacteriana
Son factores de riesgo las duchas vaginales, el uso de productos de higiene femenina muy perfumados o que puedan ser irritantes, y el uso de ropa ajustada y que no transpire.
Complicaciones de la vaginosis bacteriana
La vaginosis bacteriana es una infección local que no presenta complicaciones.
Prevención de la vaginosis bacteriana
Evitar las duchas vaginales.
Evitar el uso de jabones abrasivos.
Usar preservativo para evitar contagios.
Ropa interior de algodón.
Especialidades a las que pertenece la vaginosis bacteriana
La vaginosis bacteriana será tratada en primer lugar por el médico de familia, solo en casos que sean recidivantes puede ser necesario el tratamiento por parte del ginecólogo.
Preguntas frecuentes
¿Qué es la candidiasis bacteriana?
No existe la candidiasis bacteriana. La candidiasis es un infección producida por un hongo conocido como Cándida albicans , que, al reproducirse por alteraciones locales en mayor cuantía de lo normal, da lugar a una infección que se caracteriza por picor intenso , asociado a producción de flujo blanquecino y espeso. Las bacterias son un tipo de células diferentes que producen otras infecciones como la vaginosis bacteriana.
¿Qué es la vulvovaginitis?
La vulvovaginitis es la inflamación tanto de la vulva como de la vagina, la paciente presenta síntomas internos de molestias vaginales, asociados a picor externo y, en muchos casos, ardor al orinar, ya que el paso de la orina da lugar a un irritación local de la vulva. Precisará tratamiento interno de la vagina y externo de la vulva para mejorar los síntomas. Puede ser producida por bacterias y hongos.
¿Hay algún remedio casero para aligerar los síntomas de la vaginosis bacteriana?
Para tratar la vaginosis bacteriana son necesarias medidas que cambien el PH vaginal, haciéndolo más ácido. Así, al añadir vinagre de manzana al agua de lavarse puede ser eficaz, el consumo y aplicación de yogur natural puede ser otro tratamiento, añadir al agua de lavarse el aceite del árbol de té puede ser también cambiar el PH vaginal, impidiendo las infecciones de repetición. Evitar el uso exagerado de productos de higiene femenina que pueden ser irritantes y cambiar el PH por sí mismo.
¿Qué es la enfermedad Gardnerella?
La Gardnerella es una bacteria conocida como Gardnerella vaginalis , que produce una infección en la vagina conocida como vaginosis bacteriana, que se debe a una alteración de la flora vaginal donde disminuyen los Lactobacillus y prolifera la Gardnerella , es la principal causa de alteración vaginal aunque hasta el 50 de las personas que la presentan no tiene síntomas.
¿Qué es una célula clave?
La célula clave es una célula pavimentosa de la vagina, que se encuentra rodeada de bacterias, en general Gardenella vaginaleis , las baterias se hayan pegadas a la pared celular y son típicas de la infección por esta bacteria.
Artículos por especialidad
CertificadosAlergologíaAnatomía PatológicaAnestesiología y ReanimaciónAngiología y Cirugía VascularAnálisis ClínicosAparato DigestivoCardiologíaChequeosCirugía General y del Aparato DigestivoCirugía General y del Aparato Digestivo PediátricaCirugía Oral y MaxilofacialCirugía Ortopédica y TraumatologíaCirugía Ortopédica y Traumatología PediátricaCirugía PediátricaCirugía Plástica y ReparadoraCirugía TorácicaClínica u HospitalDermatología Médico-Quirúrgica y VenereologíaEndocrinología y NutriciónEnfermeríaFisioterapiaGenética HumanaGinecología y ObstetriciaInmunologíaLogopedia y FoniatríaMedicina Estética y Unidad LaserMedicina Física y RehabilitaciónMedicina GeneralMedicina InternaMedicina NuclearMedicina del DeporteNefrologíaNeumologíaNeurocirugíaNeurofisiología ClínicaNeurologíaNutrición y DietéticaOdontología y EstomatologíaOftalmologíaOncología MédicaOncología RadioterápicaOsteopatíaOtorrinolaringologíaPediatríaPodologíaPoliclínicasPreparación al PartoPsicologíaPsiquiatríaRadiodiagnóstico-Diagnóstico Por ImagenReumatologíaTricologíaUnidad del DolorUrgencias HospitalariasUrología
Todas las especialidades  Savia
Savia