Medicina Interna
La especialidadArtículos especializados
Enfermedades
Síntomas
Otros contenidos
Artículo especializado
Adenoma Hepático y sus Características
En el hígado pueden producirse una gran variedad de tumores, algunos de ellos benignos. Uno de estos últimos es el adenoma hepático.
¿Qué es el adenoma hepático?
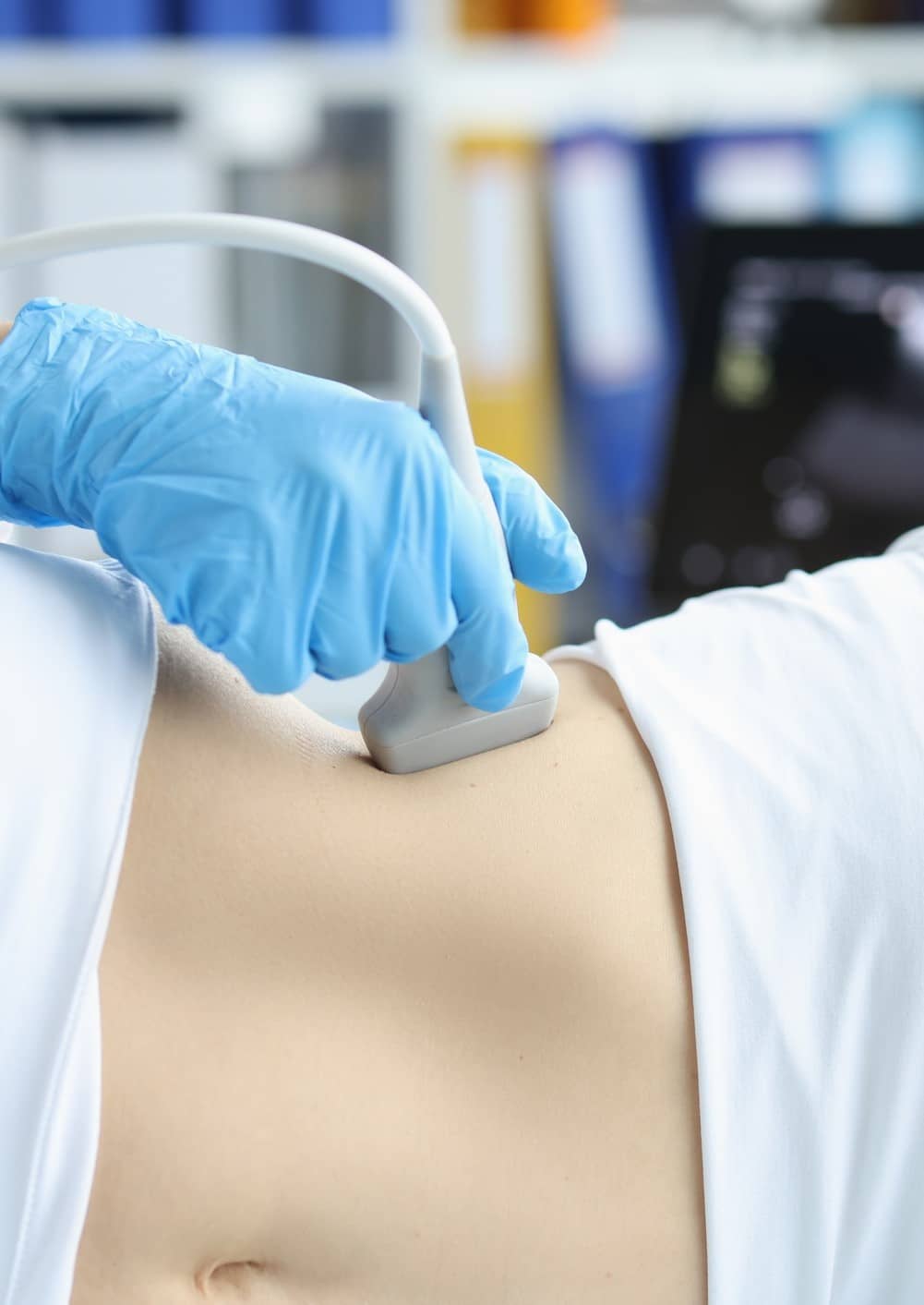
El adenoma hepático o adenoma hepatocelular (AHC) es un tumor hepático benigno y poco frecuente. Se manifiesta como un nódulo hepático que suele identificarse inicialmente en una ecografía abdominal, como hallazgo incidental.
Se trata de proliferaciones benignas de las células del hígado, los hepatocitos. Los datos de incidencia y prevalencia del adenoma hepático no están bien establecidos, si bien existe una prevalencia descrita de entre el 0,001 y el 0,004% y se diagnostica más comúnmente en mujeres de 35-40años (la proporción de mujeres respecto a los varones es de 10:1).
Causas y factores de riesgo
Varios estudios han respaldado el posible papel de las hormonas sexuales en la aparición del adenoma hepatocelular. Se ha supuesto que, en las mujeres que toman anticonceptivos orales a largo plazo se produce un aumento de 30-40 veces en la incidencia de AHC. Se estima que el riesgo de desarrollo de este tipo de tumor aumenta 25 veces tras 10 años de tratamiento.
Cerca del 4% de los casos tiene lugar en varones. La incidencia del AHC ha aumentado por el aumento del uso de sustancias anabolizantes en relación con el deporte o tras el empleo de esteroides androgénicos anabolizantes en los culturistas.
El reciente aumento de la prevalencia del AHC también se asocia de manera apreciable con la elevación de la prevalencia de la obesidad y del síndrome metabólico.
Existen asociaciones menos frecuentes como la enfermedad de almacenamiento de glucógeno de tipo I, III y IV, con un riesgo aumentado de adenomas inflamatorios (AHC-I), también el Adenoma hepatocelular familiar asociado a la diabetes de inicio en la madurez de tipo 3 (MODY3), la sobrecarga de hierro relacionada con la beta-talasemia y la hemocromatosis.
El alcoholismo y el tabaquismo también se han asociado a la aparición de adenoma hepático en varones.
Características y evolución de los adenomas hepáticos.
Los adenomas hepáticos suelen ser lesiones solitarias, a veces pedunculadas o exofíticas, y de tamaño diverso. El tamaño oscila entre unos milímetros y 30 cm.
Histológicamente, el adenoma hepático consiste en una proliferación de células hepáticas benignas dispuestas con un patrón trabecular con vasos sanguíneos finos por todo el tumor. Contienen varios subgrupos moleculares que están asociados a características morfológicas específicas y riesgos significativos de complicaciones, como lo son:
La rotura del adenoma.
La producción de hemorragias.
La posterior malignización del adenoma.
En casi todos los casos de ruptura espontánea o de hemorragia, la lesión tiene más de 5 cm, aunque los adenomas exofíticos (incluso los de menor tamaño) se asocian a un riesgo superior.
La transformación maligna es relativamente infrecuente (menos del 1%), pero es más común en los adenomas hepáticos con mutaciones activadoras de la ß-catenina, mientras que los adenomas con mutación de HNF-1a rara vez sufren una transformación maligna.
Desde un punto de vista práctico, el curso clínico de los adenomas hepáticos diagnosticados en las mujeres es con frecuencia más benigno, mientras que los diagnosticados en los varones tienen una incidencia significativamente superior de transformación maligna.
Clasificación molecular de los adenomas hepatocelulares
Mediante el análisis genómico, hasta el momento se han identificado claramente tres subtipos moleculares principales de AHC, y hay una cuarta clase no caracterizada en la actualidad.
Adenomas hepáticos inactivados para HNF-1 a (AHC-H), que constituyen un 30-40% de los casos. Los AHC-H se definen por la inactivación del HNF-1a, un factor de transcripción que interviene en el control de la diferenciación y el metabolismo de los hepatocitos.
Adenomas inflamatorios (AHC-I), que suponen un 40-55% de los casos. Los AHC-I constituyen un subgrupo heterogéneo por lo que respecta a la diversidad de mutaciones génicas, aunque todas las mutaciones descritas dan lugar a la activación de la vía de JAK/STAT.
AHC con activación de ß -catenina (AHC- b ), que constituyen un 10-20% de los casos. Los AHC-b se definen por la activación de la ß-catenina en el interior de los tumores.
AHC no clasificados, que suponen un 5-10% de los AHC.
Un pequeño subgrupo no muestra características morfológicas específicas ni tiene ninguna de las mutaciones génicas descritas.
Aunque a partir de 5cm aumenta el riesgo de complicaciones (tanto de sangrado como de aparición de un carcinoma hepatocelular), la determinación del subtipo molecular del adenoma muestra una intensa asociación con el riesgo de transformación maligna a cáncer hepático. De entre los diferentes subgrupos, los AHC-b son los que muestran el mayor riesgo de transformación maligna, incluidos los que tienen un fenotipo doble de ß-catenina e inflamatorio.
Clásicamente se eliminaban quirúrgicamente casi todos los que habían sido diagnosticados. Sin embargo, los adenomas inferiores de 5cm y que no expresan ciertos marcadores (ß-catenina) solo se complican excepcionalmente, por lo que en la actualidad se mantiene un tratamiento conservador en algunos casos.
Síntomas del adenoma hepático
Uno de los principales síntomas del adenoma hepático es el dolor en la parte superior derecha del abdomen donde está situado el hígado. El dolor aparece en tumores muy grandes o cuando hay complicaciones como roturas y hemorragias, por lo que el diagnóstico se produce casualmente con la realización de una ecografía u otra prueba de imagen debido a otra causa.
Diagnóstico del adenoma hepático
El diagnóstico radiológico del adenoma hepático no es sencillo. En cualquier caso, los métodos diagnósticos más empleados incluyen:
La ecografía abdominal. Es útil tanto para diagnóstico como seguimiento.
La eco-doppler y la ecografía con contraste.
El TAC multifase.
La RM con contrastes hepatoespecíficos. Es superior a todas las demás modalidades de diagnóstico por imagen y brinda la oportunidad de determinar el subtipo de AHC hasta en el 90% de los casos.
Tratamiento y Seguimiento
La estrategia terapéutica ha cambiado en los últimos años. Clásicamente, casi todos los adenomas eran extirpados o resecados por las posibles complicaciones. Sin embargo, actualmente se acepta una estrategia más conservadora.
Ante un presunto adenoma hepatocelular, se recomienda repetir la evaluación con RM con contraste al cabo de 6 meses.
Los tratamientos habituales incluyen:
En un adenoma hepático con un tamaño persistentemente superior a 5 cm, o con un aumento del tamaño superior al 20% del diámetro, el tratamiento de primera línea recomendado es extirpar la totalidad del tumor y eliminar todo riesgo de transformación maligna. Las modalidades de tratamiento no quirúrgicas, como la embolización de las lesiones de mayor tamaño o la ablación de las más pequeñas, pueden utilizarse como alternativa a la resección.
Se recomienda una resección o un tratamiento curativo para todos los adenomas hepáticos diagnosticados en los varones, dada la incidencia significativamente superior de transformación maligna que se da en ellos.
Se recomienda una intervención curativa en el caso de los adenomas hepáticos con mutación de ß -catenina activada, sea cual sea su tamaño cuando se ha determinado la histología por biopsia.
En las mujeres, los adenomas hepáticos de menos de 5cm en el examen inicial rara vez sufren una ruptura y la transformación maligna es menos frecuente. Se recomienda un cambio de estilo de vida, dejar de tomar anticonceptivos orales y un control del peso corporal. Las lesiones de menos de 5 cm deben ser evaluadas de nuevo al cabo de 1 año, y luego deben realizarse nuevas exploraciones de imagen a intervalos anuales.
Un adenoma hepatocelular con un sangrado que comporte inestabilidad hemodinámica debe ser objeto de embolización. Además, la presencia de una lesión viable residual en un examen de imagen de seguimiento constituye una indicación para la resección.
Artículo especializado
Hepatitis infantil: cómo detectarla
Se conoce cómo hepatitis al proceso inflamatorio del hígado, producido por respuesta inmunológica de causa multifactorial. Este órgano es esencial porque desempeña múltiples funciones que ayudan al adecuado funcionamiento del metabolismo, entre ellas se encuentran:
Producción de bilis, colesterol, proteínas transportadoras de grasas y factores
Almacenamiento y liberación de glucosa. Depuración de fármacos y sustancias nocivas.
Regulación de la coagulación sanguínea.
Compensación de la bilirrubina en sangre.
La hepatitis determina que muchas de las funciones de este órgano vital se vean afectadas. Las manifestaciones clínicas que aparecen pueden variar desde una forma asintomática con detección por analítica rutinaria , sintomatología inespecífica, hasta forma fulminante con fallo hepático.
Causas de hepatitis
La principal causa de hepatitis en niños es viral, siendo los virus hepatotropos (VHA, VHB, VHC, VHD, VHE) los más frecuentes. En menor medida están los virus que causan enfermedad sistémica con afectación hepática que suele resolverse en varias semanas sin evolución a la cronicidad. Entre ellos se encuentran los citomegalovirus, Epstein Bar , varicela, herpes simple, enterovirus, parvovirus B19, adenovirus y rubéola.
Otras causas menos frecuentes son las toxicológicas por sustancias de empleo común por adolescentes como ácido retinoico para el acné, contraceptivos orales, alcohol y anfetaminas, o fármacos hepatotóxicos como analgésicos, antibióticos, antifúngicos y antiepilépticos, entre otros. La hepatitis también puede estar causada por enfermedades autoinmunitarias que dañan el hígado.
¿Cómo detectar la hepatitis en niños?
Tras el contagio o período de incubación asintomática, se distinguen tres fases clínicas denominadas, pre Ictérica, ictérica y post ictérica, en función de la coloración amarillenta que toma la piel y que distingue cada una de las fases. Los síntomas generales que se pueden desarrollar en cada una de ellas son los siguientes:
Fiebre.
Dolor de cabeza.
Dolor
Vómitos.
Diarrea o estreñimiento
Pérdida de apetito.
Fatiga.
Orina oscura.
Heces blanquecinas.
Ictericia muy leve casi imperceptible.
Hepatomegalia (aumento del tamaño del hígado) y esplenomegalia (aumento del tamaño del bazo).
Astenia.
Dolor muscular.
Lesiones en piel (sobre todo en hepatitis B).
La complicación más temida de la hepatitis aguda viral es la hepatitis fulminante, que cursa con necrosis hepatocelular masiva y disfunción grave. Aparece como una enfermedad hepática de pocas semanas de evolución, en la que podría estar indicado el trasplante hepático.
El diagnóstico de la enfermedad se lleva a cabo con un detallado examen físico. La confirmación se realiza con la determinación de transaminasas séricas que, en el caso de infección por virus hepatotropos, suelen estar muy elevadas. De forma transitoria, se observan neutropenia, linfopenia y, posteriormente, linfocitosis relativa. No es infrecuente la hipergammaglobulinemia y, en formas graves, puede haber prolongación del tiempo de protrombina e incluso hipoglucemia.
En Savia ponemos a tu disposición los mejores especialistas en Pediatría .
Principales tipos de hepatitis virales
Hepatitis A
La hepatitis A es la más frecuente en la infancia, casi siempre benigna y autolimitada. En los últimos años ha disminuido significativamente debido a las mejoras sanitarias generales.
La transmisión es por vía fecal-oral, de persona a persona, por la ingestión de alimentos y agua contaminada. Se ve favorecida por la mala higiene y con frecuencia se relaciona con un bajo nivel socio-económico.
Hepatitis B
Se trata, principalmente, de una enfermedad de transmisión sexual. Sin embargo, la hepatitis b infantil puede haberse transmitido de madre a hijo durante el embarazo y el parto o por contacto sangre-sangre.
La mayor parte de los casos de infección son asintomáticos y otras veces cursa con un cuadro poco específico de fiebre (ocasional), malestar general, cansancio, anorexia, vómitos, dolor abdominal e ictericia que en niños es aún menos frecuente. En un porcentaje muy bajo están los casos que pueden tener un curso fulminante con fallo hepático agudo, que de no recurrir al trasplante conduce a la muerte en muchas ocasiones.
La mejor manera de controlar la infección es mediante la vacunación, implantada de manera universal en nuestro país.
Hepatitis C
La enfermedad infantil es infrecuente, sin embargo, desde la vacunación universal de la hepatitis B, la hepatitis C es la principal causa de hepatitis crónica en la infancia. En la actualidad la transmisión principal es la que se produce durante el parto en madres infectadas (suele ser asintomática) y en segundo lugar, la transmisión en inmudeprimidos, grandes cirugías, hemodiálisis y uso de drogas por vía parenteral.
El método de diagnóstico definitivo de la infección es la detección del virus en el suero. No existe vacuna para este virus, pero sí tratamiento farmacológico con antivirales.
Otras hepatitis
Otras menos habituales, especialmente en los niños, son la hepatitis D (o delta), de transmisión sanguínea y que sólo afecta a los que ya sufren una hepatitis por virus B, agravando su evolución, y la hepatitis E, que se contagia como la provocada por el virus A y que no suele hacerse crónica.
¿Qué debe comer un niño con hepatitis?
La hepatitis puede afectar la absorción de nutrientes e influir sobre el apetito, provocando pérdida de peso, reducción de las reservas de energía y dificultando la recuperación del paciente. La alimentación no sufre grandes modificaciones hasta que la hepatitis no se encuentra en un estado avanzado. Antes de esto no hay necesidad de hacer modificación alimentaria. Una dieta saludable es fundamental para el bienestar físico y mental del paciente con hepatitis ya que influye directamente en su calidad de vida. Unos hábitos alimentarios saludables ayudan a mantener el balance de líquidos y electrolitos en el organismo y a disminuir la sobrecarga de trabajo del hígado.
La dieta hepatoprotectora se caracteriza por ser una alimentación de fácil digestión en la cual se deberían evitar los siguientes alimentos:
Aguacate, frutos secos, galletas, chocolate,
Pescados como salmón, atún, trucha, sardinas y
Carnes rojas ricas en grasa, tocino, embutidos (salchicha, chorizos, mortadela, jamón, etc.).
Mantequilla, margarina, manteca y crema de leche.
Alimentos industrializados, precocinados y confeccionados con azúcar
Refrescos, zumos, leche entera, quesos grasos y yogures con azúcar.
Salsas como ketchup, mayonesa, mostaza, salsa inglesa, de soja, y
Finalmente, deben evitarse sustancias que podrían dañar al hígado, incluyendo las bebidas alcohólicas y medicamentos como el paracetamol.
Artículo especializado
Lupus, ¿Qué Debes Saber?
Ante todo, debemos saber que el nombre completo de esta enfermedad es lupus eritematoso sistémico (LES). En España, nueve de cada 10.000 la sufren, siendo mucho más frecuente en mujeres (90%), y la edad de inicio alrededor de los 30-35 años . Sus síntomas son más leves en los pacientes de mayor edad.
Sus principales características son:
Es una enfermedad sistémica (puede afectar a cualquier órgano del cuerpo).
Es crónica (cursa con períodos de exacerbaciones y remisiones).
Tiene una base autoinmune (el sistema inmunitario ataca las células sanas del cuerpo por error). Esta alteración puede darse en otras enfermedades relativamente frecuentes como la enfermedad celíaca, la diabetes tipo 1, la artritis reumatoide y la esclerosis múltiple.
¿Cuál es la causa del LES?
Se trata de una enfermedad multifactorial en la que influyen los factores genéticos y hormonales, las alteraciones inmunológicas y los agentes ambientales (infecciones, radiación ultravioleta y exposición a ciertos fármacos).
¿Qué síntomas ocasiona?
Su presentación es muy variable y dará síntomas diferentes dependiendo del órgano afectado. Principalmente, se afectan los riñones, la piel y las mucosas, el sistema músculo esquelético, el sistema cardiopulmonar y el sistema nervioso . Las manifestaciones más frecuentes son las lesiones cutáneo-mucosas, las articulares y las hematológicas.
En fase inicial de la enfermedad (cuando aún no ha dado síntomas) es posible detectar los autoanticuerpos circulantes en sangre.
Estos son los síntomas más frecuentes y sus principales características:
Lesiones cutáneas lúpicas: según las características de las lesiones cutáneas encontraremos el lupus discoide, el lupus subagudo cutáneo, etc.
El exantema malar o en alas de mariposa: es la lesión cutánea por excelencia. Se trata de un enrojecimiento típico que afecta a las mejillas y nariz.
Otras lesiones cutáneas no específicas son : fotosensibilidad (enrojecimiento tras exposición al sol), alopecia, úlceras orales, urticaria, fenómeno de Raynaud y vasculitis.
Manifestaciones músculo-esqueléticas : artralgias (dolores articulares), artritis (inflamación de las articulaciones) y mialgias (dolores musculares) son las más comunes, sobre todo en manos.
Manifestaciones sistémicas : malestar general, astenia (cansancio extremo), la fiebre o la pérdida de peso, pleuritis, pericarditis, endocarditis.
Manifestaciones renales : en uno de cada tres pacientes en forma de nefritis lúpica.
Manifestaciones neuropsiquiátricas: cefalea, crisis comiciales/convulsivas, alteraciones cognitivas, psicosis, neuropatías periféricas…
Manifestaciones hematológicas : las principales son la disminución de las series hemáticas como anemia.
¿Necesitamos realizar una analítica específica para detectar el LES?
Existen algunos parámetros que se encuentran típicamente elevados en el LES. Sin embargo, no son específicos de esta enfermedad y se pueden encontrar en otras enfermedades. Es el caso de los anticuerpos antinucleares (llamados ANA), presentes en otras enfermedades autoinmunes como la esclerosis sistémica, la dermatomiositis, la polimiositis, la artritis reumatoide, las tiroiditis, etc. Una curiosidad, unos ANA positivos no son específicos de LES, pero un LES sin ANA es poco probable.
Existen otros anticuerpos, los anti DNA , que son muy específicos de LES. Su título se correlaciona con su severidad y con la progresión de la enfermedad renal. Es decir, la presencia de anti DNA sugiere LES, además, cuanto mayor es el número o título de estos anti DNA más severa y rápidamente progresiva será la enfermedad. Por ello decimos que tienen un valor predictivo, orientándonos de la evolución que tendrá.
Los Anticuerpos anti-Sm: son patognomónicos de la enfermedad, sólo se encuentran en el LES.
¿Cómo llegamos al diagnóstico de LES?
El diagnóstico de LES no es sencillo dada la variabilidad de síntomas posibles, en función del órgano afectado. Ante la sospecha, es cuando debe solicitarse una analítica específica como estudio complementario dirigido.
En la actualidad para llegar al diagnóstico de LES nos basamos en unas tablas que contemplan las principales manifestaciones clínicas, datos analíticos y marcadores serológicos. La presencia de al menos cuatro de los criterios descritos en esa tabla confirma el diagnóstico de LES.
No debemos olvidar que, al confirmar el diagnóstico, hemos de conseguir que el paciente entienda y acepte su enfermedad, de forma que siga el tratamiento fielmente para evitar la progresión de la misma.
¿Cuál sería el tratamiento del LES?
El LES cursa con síntomas clínicos muy diferentes. El tratamiento, por tanto, varía a lo largo de la evolución y según el síntoma u órgano a tratar. También influye el grado de severidad. En el tratamiento del LES se ve implicado el reumatólogo (como principal médico responsable), pero trabaja en colaboración con otros especialistas que controlan el resto de afectaciones sistémicas, como el dermatólogo para tratar las lesiones cutáneas, o el nefrólogo para el control renal. Es fundamental advertir al paciente que debe evitar la exposición solar pues las lesiones cutáneas empeoran sustancialmente al ser expuestas (son fotosensibles).
El objetivo principal sería mantener la enfermedad inactiva o con la menor actividad posible y evitar la progresión del daño orgánico. Para mejorar la supervivencia, debemos emplear el mínimo de tratamientos posibles para minimizar los efectos secundarios. La presencia de manifestaciones graves en órganos importantes (renales, neurológicas, cardiopulmonares o hematológicas) requiere del uso de dosis altas de corticoides asociadas a inmunosupresores (cuya finalidad es atenuar la respuesta autoinmune del cuerpo frente a nuestros propios tejidos).
¿Qué evolución tiene el LES?
También va a depender del órgano afectado y del grado de severidad. Los pacientes afectados de LES tienen una morbimortalidad mayor que la población general (el riesgo de muerte en los pacientes con LES es de dos a tres veces mayor que en la población general).
¿Hay factores que marcan un mal pronóstico?
Entre los factores asociados a una mayor mortalidad podríamos citar la presencia de enfermedad renal, la hipertensión arterial y unos anticuerpos llamados antifosfolípido . Vamos a añadir, sin embargo, que la remisión de la enfermedad se consigue en algunos pacientes, permitiendo incluso llegar a retirar el tratamiento que se había instaurado con intención crónica. Por ello es fundamental contar con la implicación del paciente.

Artículo especializado
Gonorrea, ¿Qué Debes Saber?
Seguro que sabes que la gonorrea es una enfermedad de transmisión sexual , pero poco más. Para empezar, te diremos que afecta sobre todo a personas jóvenes, entre los 15 y los 25 años, y que está provocada por la bacteria Neisseria Gonorrhoeae , un germen que existe en todos los países del mundo. El principal problema para su tratamiento está siendo el desarrollo de resistencias a los antibióticos.
¿Cómo se contrae?
En contagio se produce por relaciones homo o heterosexuales, genitales, orales o anales. Puede afectar a los genitales masculinos y femeninos, y también al ano o la cavidad oral. Una mujer embarazada que la padezca puede transmitírsela a su bebé durante el parto. La única manera de evitar la transmisión es limitar la promiscuidad sexual, y tener sexo protegido con preservativo. Además, para evitar la diseminación de la infección, cada vez que se diagnostica un caso hay que localizar a las parejas sexuales previas (teóricamente, a las personas con las que se han tenido relaciones durante los 60 días previos), explorarlas y tratarlas.
¿Qué síntomas produce?
En el hombre, el síntoma fundamental es el dolor o picor al orinar , que es la traducción de la inflamación de la uretra. Además, es frecuente observar una gota de pus blanco, verde o amarillo al final de la micción. Puede haber otros síntomas más raros, como el dolor en los testículos.
En la mujer, la gonorrea puede pasar inadvertida, o puede simular los síntomas de una irritación vulvar, una vaginitis o una infección de orina . Puede notarse ardor al orinar, aumento del flujo vaginal, o sangrado
Independientemente del sexo, la infección en el ano o el recto puede no causar síntomas, o manifestarse como flujo, picor en el ano o dolor al ir de vientre.
En el caso de afectar la cavidad oral, la enfermedad provoca una faringitis que se manifiesta por dolor de garganta, secreciones, fiebre , aumento de los ganglios linfáticos, o dolor de cabeza.
Se ha de tener en cuenta que existen otras uretritis y vaginitis no gonocócicas, que no están causadas por la bacteria de la gonorrea, sino por otros microbios, fundamentalmente la clamidia. Su diagnóstico se basa en pruebas microbiológicas, de la muestra tomada. Como son difíciles de distinguir de la gonorrea, muchas pautas de tratamiento incluyen antibióticos que sean efectivos para los dos gérmenes.
¿Cómo se diagnostica?
Se puede utilizar una muestra de orina para detectar la gonorrea. Sin embargo, si ha habido relaciones sexuales orales o anales, hay que usar un hisopo (bastoncillo) para obtener muestras de la garganta o del recto. Lo mismo se puede emplear para tomar muestras de la uretra del hombre o la vagina de la mujer.
¿Qué pasa si no se trata?
No tratada, esta infección puede curar por sí sola u ocasionar problemas muy graves. En la mujer puede ser responsable de una enfermedad inflamatoria pélvica , una infección interna de la pelvis que puede causar fiebre, dolor abdominal crónico, o infertilidad. En el hombre, puede ser responsable de infección de los testículos o la próstata , y causar también infertilidad . En casos graves, la infección puede pasar a la sangre y afectar a las articulaciones u otros órganos, y puede ser incluso mortal.
¿Cómo se trata?
Es una infección que se trata con antibióticos como los macrólidos y las cefalosporinas. Las resistencias del germen han ido aumentando a muchos antibióticos, por lo que no puede tratarse con penicilina u otros antibióticos más antiguos. En algunos casos, es necesario practicar una prueba llamada antibiograma para conocer la sensibilidad del germen a los distintos antibióticos y administrar el más adecuado.
¿Y la prevención?
Es evidente que el sexo seguro es la mejor prevención, con la utilización del preservativo para cualquier relación genital, oral o anal. También es importantísimo detectar y tratar a posibles parejas que puedan seguir transmitiendo la enfermedad a otras personas.

Artículo especializado
Cirrosis Hepática
La cirrosis es una enfermedad crónica e irreversible del hígado caracterizada por la formación de unas zonas inflamadas y nódulos que sustituyen y alteran la anatomía normal del órgano y con ello su función. Hay múltiples causas de cirrosis: todas aquellas que provoquen daño e inflamación de los hepatocitos, las células que lo conforman.
¿Qué sabes del hígado?
El hígado es el mayor órgano del cuerpo humano (pesa alrededor de 1500 g), forma parte del sistema digestivo y realiza una serie de funciones fundamentales y vitales para el organismo.
Está constituido por unas células llamadas hepatocitos. Las funciones del hígado incluyen:
Función vascular, recibe el 30-40% del gasto cardíaco (sangre que proviene del corazón), actuando como reservorio cuando se produce una disminución de las reservas de sangre.
Función inmunitaria: filtra y depurar la sangre procedente del territorio portal con la colaboración de células especializadas (macrófagos).
Función metabólica del hígado:
Carbohidratos: Regula la concentración de glucosa que hay presente en la sangre circulante, mediante almacenamiento de glucosa. Por otra parte, cuando se necesita glucosa en sangre, la libera. Lípidos: Formación de lipoproteínas para transportar los ácidos grasos y formación de colesterol y fosfolípidos. Proteínas: Formación del 90% de proteínas plasmáticas (como albúmina, fibrinógeno, transferrina…).
Función secretora y excretora : metabolización y excreción de fármacos y hormonas (T4, esteroides, aldosterona. Producción de bilis necesaria para la digestión de los alimentos. Elimina tóxicos como el alcohol.
Otras: síntesis de factores de coagulación y almacenamiento vitaminas (A, B12 y D) y hierro en forma de ferritina.
¿Qué es y qué causa la cirrosis?
La causa principal de cirrosis hepática es el alcoholismo y las hepatitis víricas (sobre todo la hepatitis por virus C). El listado de las enfermedades que producen cirrosis incluye:
Alcohol
Hepatitis víricas. Se conocen cinco diferentes virus de la hepatitis VHA, VHB, VHC, VHD y VHE.
Hepatitis autoinmune
Enfermedades metabólicas: hemocromatosis, enfermedad de Wilson, fibrosis quística, glucogenosis, esteatosis hepática no alcohólica,..
Enfermedades infecciosas (además de las víricas): sífilis.
Sarcoidosis
Obstrucción de la vía biliar: cirrosis biliar primaria y cirrosis biliar secundaria (colangitis esclerosante primaria)
Causa vasculares
Drogas/fármacos/hipervitaminosis A
Idiopática o de causa desconocida
¿Cuáles son los síntomas?
Inicialmente la cirrosis tiene una fase asintomática , es decir, el hígado ya ha empezado a perder hepatocitos y generar fibrosis pero no da ninguna manifestación clínica. La fase asintomática puede durar años. Se sigue de una fase sintomática y posteriormente puede progresar rápidamente y el paciente sufrir las complicaciones derivadas del mal funcionamiento hepático . Esta última fase se conoce como cirrosis hepática descompensada.
Una de las consecuencias más graves asociada a la cirrosis es la aparición de un tumor hepático maligno (hepatocarcinoma), que empeora mucho el pronóstico de la enfermedad.
Síntomas generales : cansancio, malestar, pérdida de peso, náuseas y vómitos.
Síntomas y signos de la cirrosis hepática , muchos de ellos cutáneos: arañas vasculares (pequeñas venitas rojas a modo de tela de araña ) sobre todo en cuello y cara, picor generalizado, piel delgada y frágil, hematomas, coloración amarillenta de la piel y la esclerótica (ictericia).
Según avanza la enfermedad puede aparecer:
Aumento del perímetro abdominal por retención de líquido (ascitis) e hígado agrandado con molestia en la zona.
Fiebre/infecciones : la ascitis puede provocar una peritonitis bacteriana grave, al infectarse el líquido acumulado en el abdomen. El mal funcionamiento del sistema inmunitario favorece la aparición de infecciones.
Los trastornos en la coagulación por la falta de producción del hígado de las proteínas necesarias y que pueden dar lugar a hemorragias o aparición de hematomas.
Varices esofágicas y bazo agrandado . Aparición de vasos sanguíneos dilatados y agrandados en el esófago (varices) y del volumen del bazo debido al aumento de la presión arterial en la circulación hepática (llamada hipertensión portal). Presentan gran riesgo de hemorragia.
Encefalopatía hepática , que ocurre cuando el hígado no puede realizar adecuadamente su función de desintoxicación y éstas se acumulan en el cerebro. Se manifiesta como cuadros de confusión que pueden llegar al coma
Ictericia. La ictericia se presenta cuando el hígado no elimina suficiente bilirrubina de la sangre, lo que provoca una coloración amarillenta de la piel y en el blanco de los ojos, y oscurecimiento de la orina.
Resistencia a la insulina y la diabetes tipo 2. La cirrosis provoca resistencia a la insulina, una hormona producida por el páncreas que le permite al cuerpo usar la glucosa.
Mal funcionamiento del riñón y del pulmón , conocidos como síndrome hepatorrenal y síndrome hepatopulmonar.
¿Cómo se realiza el diagnóstico?
El diagnóstico de la enfermedad puede ser casual (en fases asintomáticas), tras la realización de una analítica o una ecografía abdominal por otro motivo.
El diagnóstico se basa en:
Historia médica y antecedentes del paciente , exploración física, que varían según el estadio de la enfermedad. Cuanto más avanzada los signos físicos como ascitis son más evidentes.
Pruebas de laboratorio :
Alteración de las pruebas de función hepática (transaminasas, fosfatasa alcalina, GGT, bilirrubina). Hemograma con cifras bajas de glóbulos rojos, glóbulos blancos y plaquetas y alteraciones de la coagulación.
Pruebas de imagen : ecografía, TAC con hígado agrandado y/ con alteraciones en su estructura.
El diagnóstico de confirmación se realiza mediante la biopsia hepática (obtención de una pequeña muestra de tejido hepático). Esta técnica tiene una alta sensibilidad ya que permite estudiar directamente el tejido hepático y el grado de fibrosis, sin embargo, no se realiza de rutina en la práctica habitual, al ser una técnica invasiva y no exenta de riesgo.
Elastografía hepática o fibroscan . Es una técnica sencilla, no invasiva y rápida que utiliza ondas de vibración y pulsaciones miden la dureza del tejido, así indirectamente dan una idea del grado de fibrosis.
Generalmente, el diagnóstico se establece por los criterios clínicos , las alteraciones de la analítica, pruebas de imagen y los antecedentes del paciente (por ejemplo, historia de alcoholismo crónico). La biopsia se suele reservar a casos de dudoso diagnóstico y/o en los que la causa de la enfermedad no está clara.
Tratamiento
El tratamiento depende de la causa y de la situación de la enfermedad (asintomática o descompensada).
Algunas de las causas requieren tratamientos específicos, por ejemplo, en la cirrosis de origen autoimune se indican corticoides e inmunosupresores. La asociada a hepatitis víricas requiere tratamiento antiviral. La secundaria a hemocromatosis puede beneficiarse de flebotomías.
Como recomendaciones generales encontramos:
Dieta: prohibición absoluta del alcohol y de tóxicos hepáticos (drogas, algunos fármacos o remedios herbarios). Dieta variada y equilibrada con fruta y verduras frescas. Es importante asegurar un buen estado nutricional, la malnutrición es una situación habitual en este tipo de pacientes. Restricción de sal. Aporte multivitamínico en los pacientes que lo precisen (por ejemplo, alcohólicos).
Evitar fármacos que aumenten el riesgo de hemorragia como los AINEs.
Vacunación anual de gripe, neumococo y virus influenza.
Realizar ejercicio físico moderado.
Prevención y tratamiento de las complicaciones
La descompensación hepática requiere el ingreso del paciente y su manejo intrahospitalario.
Hemorragia por varices esofágicas : si el paciente ha desarrollado varices puede precisar tratamiento farmacológico (betabloqueantes) que disminuye la presión arterial de la zona o ligaduras de las venas varicosas mediante endoscopia para evitar episodios de sangrado. También se han desarrollado nuevos métodos no quirúrgicos en pacientes con alto riesgo y que no responde al tratamiento habitual: derivación de la corriente sanguínea desde el territorio portal hasta la circulación general (sistémica) lo que se denomina shunt portosistémico.
Ascitis/edema : se recomiendan diuréticos para eliminar el exceso del líquido. También puede ser preciso la evacuación de la ascitis mediante punciones abdominales (paracentesis evacuadora).
Síndrome hepatorrenal : requiere la realización de hemodiálisis.
Encefalopatía hepática : se utilizan laxantes o enemas para limpiar el intestino y así disminuir la concentración de sustancias tóxicas. Puede ser necesario disminuir las proteínas de la dieta.
Peritonitis bacteriana espontánea/profilaxis de infecciones : antibióticos, generalmente por vía venosa.
Tratamientos para tratar otros síntomas como el picor (antipruriginosos) y la fiebre o el dolor.
No existe ningún tratamiento farmacológico curativo , la única opción para curar la cirrosis es el trasplante hepático . Los criterios de trasplante hepático quedan restringidos a pacientes con descompensaciones e insuficiencia hepática aguda que puedan cumplir criterios de trasplante. Se deben remitir a un centro de referencia de trasplante hepático.

Artículo especializado
Tratamiento y Dieta para la Diverticulitis
La dieta tiene un papel fundamental en el tratamiento de la diverticulitis , y consumir abundantes alimentos ricos en fibra es la mejor prevención para evitar su aparición.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
¿De qué hablamos?
Cuando hablamos de enfermedad diverticular o diverticulosis nos referimos a la presencia de divertículos en el tracto gastrointestinal , generalmente en el intestino grueso. Estos divertículos son protuberancias con forma de saco que se producen por un aumento en la presión interna de la pared del colon , provocando que las capas internas se hernien. Se sabe que cuantos menos alimentos ricos en fibra se consumen, existe más probabilidad de tener estreñimiento y ello conlleva que para realizar las deposiciones se haga más esfuerzo, aumentando así la presión en el colon y, como consecuencia, la formación de estas protuberancias . Seguir una dieta baja en fibra, compuesta en su mayoría de alimentos procesados, es su principal causa de aparición.
Los divertículos, en la mayoría de los casos, no suelen dar molestias o son asintomáticos, pero si se inflaman o infectan se produce una diverticulitis y requiere de atención médica urgente. La diverticulitis se caracteriza por síntomas como dolor abdominal intenso, fiebre y náuseas y, si es diagnosticada como leve sólo suele precisar reposo, cambios en la dieta y tratamiento con antibiótico. Sin embargo, puede complicarse y ser grave o aguda y, en estos casos, requerirá de cirugía.
¿Qué papel juega la dieta?
La dieta tiene un papel fundamental en la prevención y tratamiento de la diverticulitis. En una fase inicial, si es aguda o grave, se debe seguir una dieta absoluta para evitar el riesgo de perforación. Una vez se inicia la mejoría clínica, se puede iniciar con precaución una dieta pobre en residuo para disminuir al máximo el volumen fecal que pasa por la zona inflamada y así disminuir el dolor. Posteriormente se puede ir introduciendo la fibra según tolerancia personal, llegando a una alimentación lo más variada posible.
A continuación, encontrarás unas recomendaciones para seguir en las fases de brote e inflamación (diverticulitis):
Fraccionar la ingesta en comidas frecuentes y poco copiosas , entre cinco o seis tomas al día, para disminuir en lo posible el estímulo sobre el movimiento intestinal (peristaltismo).
Evitar aquellos alimentos que irritan la mucosa digestiva y producen aumento del peristaltismo: café, zumo de naranja, especies, picantes.
Evitar las temperaturas extremas ya que aumentan el movimiento intestinal.
Restringir alimentos ricos en fibra : verduras, frutas, legumbres, frutos y frutas secas y productos integrales (muesli, cereales integrales, pan integral, arroz integral…)
No ingerir alimentos con semillas o que contengan pepitas como pueden ser el higo, las uvas y el kiwi, ya que pueden ubicarse en el divertículo e inflamarlo.
Preferir la fruta cocida o al horno sin piel, en almíbar sin el jugo o bien en forma de zumos colados no ácidos y sin azúcar. Probar alimentos que contienen pectina (fibra soluble con efecto astringente): manzana rallada y oscurecida (ligeramente oxidada), pera cocida, patata hervida «chafada» o en forma de puré, membrillo, plátano maduro, albaricoque.
Consumir las carnes y aves sin piel ni grasa visible. Preferir los cortes magros.
Preferir el pescado blanco al azul, ya que tiene menos grasa.
Evitar la bollería y la repostería.
Evitar alimentos grasos como aguacate, aceituna y frutos secos.
Evitar técnicas grasas como rebozados, empanados, guisos y fritos.
Restringir los condimentos irritativos de la mucosa intestinal como: vinagre, café, chocolate, pimienta, pimentón y guindilla.
Evitar el consumo de alcohol.
Moderar el uso de sal y azúcar.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
En la siguiente tabla se especifica qué alimentos son los más aconsejados y cuáles se deben evitar para la elaboración de una dieta pobre en residuo.
ALIMENTOS
PERMITIDOS
A EVITAR
Lácteos
y derivados
Yogur desnatado, queso fresco bajo en grasa, leche desnatada (excepto si hay déficit de lactasa).
Leche y resto de lácteos cremosos o enteros.
Cereales
y tubérculos
Pan blanco, cereales dextrinados, sémola, arroz, pasta, tapioca y patata sin piel.
Pan integral y cereales integrales, arroz integral, salvado (galletas integrales, pasta integral, etc.)
Legumbres
y frutos secos
Ninguno.
Legumbres en general.
Frutos secos en general.
Verduras
y hortalizas
Caldos vegetales colados.
Cuando se inicia la introducción, según tolerancia. Empezar por: zanahoria pelada, calabacín sin piel y puntas de espárrago. Siempre cocidas.
Todas las verduras y hortalizas:
Las últimas a introducir una vez acaba el episodio:
Verduras fibrosas (col, rábanos, lechuga, apio, brécol, escarola nabos)
Fruta
Zumos de fruta licuados.
Cuando se inicia la introducición, según tolerancia. Empezar por: fruta cocida y sin piel como: manzana, pera, membrillo, o plátano maduro.
Todas las frutas:
las últimas a introducir una vez acaba el episodio: Frutas fibrosas (frambuesa, mora, ciruelas, higos), ácidas y todas las pieles de las frutas.
Carne, pescado
y huevos
Carne magra no fibrosa, picada o bien cocinada (ternera, lomo de cerdo, pollo, pavo, conejo).
Pescado blanco.
Huevos.
Carne dura y fibrosa (con cartílagos) (ternera, cordero, cerdo) pescado azul. Embutidos y paté.
Grasas
y aceites
En cantidades limitadas aceites vegetales, preferiblemente aceite de oliva, margarina y mantequilla.
En cantidades importantes.
Mayonesa y derivados.
Postres
y dulces
Gelatinas sin azúcar y galletas tipo “María” no integrales.
Aquellos que están hechos con harina integral o cereales integrales o frutos secos.
Bebidas
Agua e infusiones.
Café, té, bebidas carbonatadas y
alcohólicas.
Otros
Sal, azúcar.
Hierbas aromáticas.
Platos precocinados, salsas
comerciales y especias.
Nota: con respecto a la introducción de alguna verdura o fruta en la dieta, priorizar las indicaciones del médico. En una dieta pobre en residuo estricta sólo se podrían tomar caldos vegetales colados y zumos de fruta licuados.
En la diverticulosis o fase asintomática la ingestión de fibra dietética se contempla como una medida coadyuvante al tratamiento. No obstante, como medida de prevención se deben desaconsejar alimentos que contengan semillas que no puedan ser digeridas completamente en la parte superior del tracto gastrointestinal, puesto que el residuo podría alojarse dentro de un divertículo favoreciendo la aparición de diverticulitis aguda. Así pues, se desaconseja la ingesta de semillas no trituradas o alimentos que contengan pepitas o semillas, excepto que estas se eliminen antes de la ingesta (por ejemplo, pimientos, tomates, kiwis, uvas…).
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.

Artículo especializado
La Vida Después de un Infarto de Miocardio
En el día después de haber padecido un ataque al corazón es inevitable experimentar sensaciones de incertidumbre, temor e inquietud, sin saber muy bien cómo actuar en el día a día a partir de ese momento. Te explicamos qué secuelas pueden quedar y otras informaciones relacionadas con el infarto o ataque al corazón.
¿Qué es un infarto?
El infarto de miocardio (familiarmente denominado ataque al corazón) es la destrucción o muerte de parte de la capa muscular del corazón debido a la falta de oxígeno . Afortunadamente, la parte de músculo cardíaco que permanece sano después del infarto, realiza el trabajo de bombeo de sangre necesario, de tal forma que el paciente puede llevar con posterioridad una vida perfectamente normal.
SABÍAS QUE…
Las enfermedades cardiovasculares son una constante de preocupación en nuestra sociedad occidental, ya que siguen siendo una de las enfermedades más frecuentes y con mayor índice de mortalidad.
Los hombres tienen el triple de posibilidades de tener un infarto que las mujeres.
Causas del infarto
Los infartos de corazón son bastante probables cuando existe un estrechamiento de las arterias coronarias (las arterias que suministran sangre con oxígeno propiamente al corazón). Con frecuencia el estrechamiento sucede a causa de los depósitos grasos que se forman en las paredes de las arterias (fenómeno denominado arteriosclerosis) y, sobre estas placas, las plaquetas (pequeñas partículas de la sangre que participan en la coagulación) se pegan, dando lugar a un coágulo , que obstruye el paso de flujo sanguíneo.
A veces el bloqueo de paso de sangre se produce por un espasmo (estrechamiento repentino) de una de las arterias coronarias.
Factores de riesgo
Los factores que aumentan el riesgo de padecer un infarto son los siguientes:
El tabaco.
La hipertensión arterial (tensión alta).
Altos niveles de colesterol en sangre (hipercolesterolemia).
Altos niveles de azúcar en sangre (diabetes).
La edad (hombres con mayores de 45 años y mujeres de más de 55 años).
El sobrepeso y el sedentarismo (falta de ejercicio físico regular).
Antecedentes familiares de infartos de miocardio.
Signos y síntomas
Los síntomas comunes son:
Dolor aplastante en el medio del pecho , que puede irradiarse (hacerse extensivo) a cuello, mandíbula, brazos, espalda o epigastrio (zona de abdomen donde se halla el estómago, típico de los infartos de corazón que afectan al ápex o parte más inferior del músculo cardiaco). El dolor puede durar de cinco minutos a varias horas, ser constante o intermitente y el hecho de cambiar de postura o descansar no calmará el dolor.
Sensación de ahogo.
Sudoración profusa o náuseas (ganas de vomitar), vómitos.
Mareos.
Malestar general, con sensación de gravedad (“mala cara”).
A veces, se puede confundir el infarto de miocardio, propiamente dicho, con la denominada angina de pecho , porque los síntomas son parecidos. Sin embargo, a diferencia del infarto, la angina suele desaparecer a los 15-20 minutos de descansar o tomarse el medicamento.
Diagnóstico
Si hay sospecha de padecer un infarto, normalmente te llevarán al hospital y te realizarán una serie de pruebas diagnósticas.
Con un electrocardiograma (ECG ) se puede trazar la actividad eléctrica del corazón. La prueba es indolora y dura unos 5min.
Con una analítica de sangre se puede determinar si contiene “enzimas del corazón” (cuando el corazón ha sufrido daño se empiezan a filtrar a la sangre unas proteínas – enzimas- que contribuyen a regular las reacciones químicas en el organismo).
Con una Rx de tórax se puede comprobar si ha habido agrandamiento (hinchazón) del corazón.
Tratamiento
Se realizarán las siguientes intervenciones, entre otras actuaciones médicas importantes:
Generalmente se administrará al paciente una dosis de AAS (ácido acetil salicílico o aspirina).
Asimismo, los fármacos trombolíticos sirven para disolver el coágulo de sangre que obstruye la arteria coronaria, lo que permite que la sangre vuelva a fluir a la parte del corazón que sufre asfixia. Lo ideal es que se administren en el plazo de una hora desde que comenzaron los síntomas.
Si el corazón se ha detenido (paro cardiaco) el equipo médico aplicará las maniobras de reanimación cardiopulmonar (RCP), usando, entre otros elementos, un aparato denominado desfibrilador, con el que se envía un electrochoque al pecho para que el corazón vuelva a latir.
Pronóstico
Cuanto antes se aplique el tratamiento, más eficaz será, y, por tanto, mayor será la probabilidad de sobrevivir y menores las consecuencias.
Las complicaciones-secuelas derivadas de un infarto de miocardio incluyen:
Arritmias cardiacas (pulsaciones del corazón demasiado lentas o demasiado rápidas).
Hipotensión arterial peligrosa (bajada de tensión que comprometa la llegada de sangre al cerebro).
Edema pulmonar (acúmulo de líquido en los pulmones por debilidad de bombeo del corazón).
Insuficiencia cardiaca congestiva (corazón débil).
Pericarditis (inflamación del saco que envuelve el corazón).
Trombosis venosa profunda (formación de trombos en otras partes del organismo -piernas o pelvis-).
Formación de aneurismas (dilataciones de la pared del corazón sobre la cicatriz del infarto).
Rotura cardiaca .
La depresión, la pérdida de deseo sexual y el miedo a las relaciones sexuales son comunes después de un infarto.
La repetición del infarto.
Prevención
Para prevenir nuevos futuros infartos es posible que debas tomar diversos medicamentos de forma crónica: los antiplaquetarios reducen la posible “pegajosidad” de las plaquetas, los betabloqueantes disminuyen la frecuencia cardiaca del corazón y, por tanto, reducen su esfuerzo, los vasodilatadores (IECA) abren los vasos sanguíneos y, con ello, bajan la tensión arterial, lo que repercute en alivio de carga para el corazón, y las estatinas contribuyen a reducir el colesterol en sangre…
Otras medidas, no de menor importancia, son: dejar de fumar, practicar ejercicio físico regularmente adecuado a tus circunstancias, llevar a cabo una alimentación sana y equilibrada, así como reducir el consumo de alcohol, controlar las emociones y aprender técnicas de relajación, etc…
Si acudes a las revisiones médicas regulares y sigues el programa de rehabilitación reducirás considerablemente el riesgo de tener complicaciones.
RECUERDA QUE…
Has de llamar inmediatamente al 112 si sospechas que tú mismo o que otra persona está padeciendo un infarto de miocardio. No es buena idea esperar a ver cómo evolucionan los síntomas. La mayoría de los casos pueden tratarse con éxito si reciben atención médica inmediata.

Artículo especializado
Dieta Aconsejada Para el Hígado Graso
La enfermedad hepática por hígado graso no alcohólico (EHGNA) o lo que comúnmente se denomina “ hígado graso ” es una patología multifactorial que debuta con acumulación excesiva de grasa en el hígado (esteatosis) en ausencia de causas secundarias como el consumo excesivo de alcohol, en cuyo caso se denominaría esteatosis hepática alcohólica.
¿Cómo se manifiesta?
Esta enfermedad se puede manifestar de dos formas:
Hígado graso no alcohólico (HGNA) o esteatosis hepática simple (cuando hay grasa en el hígado, pero ausencia de infamación).
Esteatohepatitis no alcohólica (EHNA) (cuando además de grasa en el hígado existe inflamación que puede causar fibrosis, cirrosis o cáncer de hígado).
La prevalencia de EHGNA a nivel mundial es del 20-30 % de la población y afecta al 95% de personas con obesidad , al 70% de diabéticos tipo 2 y al 50% de pacientes con dislipemia , enfermedades que, a su vez, se relacionan con la resistencia a la insulina y el síndrome metabólico. Por ello, es muy importante diagnosticar de forma precoz este trastorno y modificar sus factores de riesgo (dieta y estilos de vida) para evitar la progresión de la enfermedad, cuya consecuencia más grave es la cirrosis que puede requerir un trasplante de hígado.
¿Qué signos hacen sospechar de una enfermedad de hígado graso?
Hay ciertas personas y situaciones clínicas que pueden presentar mayor susceptibilidad para desarrollar una EHGNA. Entre los signos más destacados que nos alertan sobre una posible enfermedad de hígado graso, encontramos:
Sobrepeso u obesidad.
Resistencia a la insulina.
Aumento de las transaminasas ALT (alanina aminotransferasa) a valores entre 50-150 U/l con cifras de AST (aspartato aminotransferasa) menores que las de ALT.
Bajos valores de colesterol HDL.
Elevados valores de colesterol LDL.
Aumento de la hemoglobina glucosilada (HbA1c).
Personas con antecedentes familiares de diabetes tipo 2.
Alteraciones hepáticas en ausencia de una ingesta excesiva de alcohol (consumo diario menor de 30 g en hombres y menor de 20 g en mujeres).
¿Cómo se diagnostica la HGNA?
Debido a que muchas veces la enfermedad de hígado graso es asintomática o dichos síntomas son muy difusos (fatiga, malestar general, cansancio, pesadez, dolor e hinchazón en el lado superior derecho abdominal), es importante hacer un diagnóstico precoz a aquellas personas que puedan ser más susceptibles de desarrollarla. Los métodos diagnósticos más utilizados en estudios clínicos son:
Ecografía abdominal : es el método más empleado por ser no invasivo, ampliamente disponible y de bajo coste.
Resonancia magnética , aunque es de mayor sensibilidad que la ecografía, se utiliza en menor medida debido a su elevado coste.
Medición de la alaninoaminotransferasa (ALT) mediante analítica de sangre: se trata de una enzima hepática cuyo examen permite determinar si estamos ante una lesión hepática alcohólica o ante una HGNA.
Biopsia hepática: a través de esta prueba podemos diferenciar la esteatosis simple (HGNA) de la esteatohepatitis (EHNA) aunque sólo se recomienda realizarla en aquellos pacientes que tienen alto riesgo de tener EHGNA con fibrosis avanzada.
Tratamiento y prevención del hígado graso
La aparición de la EHGNA está muy relacionada con la resistencia insulínica , por ello, el mejor tratamiento parar tratar y prevenir esta patología consiste principalmente en medidas no farmacológicas basadas en dieta (para la disminución de peso) y ejercicio físico . Sin embargo, una vez se haya desarrollado cirrosis debido a la esteatosis hepática no alcohólica, el trasplante de hígado es una opción terapéutica, con buenos resultados.
Además, como prevención, debemos tener en cuenta que:
Ciertos fármacos pueden predisponer el desarrollo de la enfermedad: amiodarona, diltiazem, esteroides, estrógenos sintéticos, tamoxifeno y tratamiento antirretroviral.
Se debe controlar la diabetes tipo 2 con modificaciones del estilo de vida y tratamiento farmacológico si fuera necesario.
Se deben reducir los niveles de colesterol y triglicéridos . De hecho, el colesterol libre hepático tiene una mayor participación que los triglicéridos en el desarrollo de la esteatohepatitis no alcohólica (HGNA).
La cirugía bariátrica podría ser una alternativa cuando las modificaciones de estilo de vida (dieta y ejercicio) y el tratamiento farmacológico no hayan sido efectivas en personas con obesidad mórbida (IMC mayor a 40) y en ausencia de cirrosis hepática. Esta intervención podría reducir la inflamación, la esteatosis y podría incluso regresar la fibrosis hepática.
¿Cómo debe ser la alimentación para controlar el hígado graso?
Una dieta adaptada a la EHGNA no debe diferir mucho de una dieta equilibrada , aunque sí hay una serie de alimentos prohibidos o restringidos como las grasas saturadas y los azúcares simples que interfieren mucho en la regulación de la insulina. Sin embargo, también se debe priorizar el consumo de fibra y antioxidantes, componentes que tienen un efecto directo en el manejo nutricional de esta enfermedad. A continuación, nombramos las principales características alimentarias a tener en cuenta:
Si existe sobrepeso u obesidad, se debe llevar a cabo una reducción de 600-800 calorías o una restricción calórica de 25-30 kcal/kg de peso corporal ideal para lograr una pérdida de peso del 5-10% del peso inicial siempre y cuando esta reducción sea gradual (entre 0,5 y 1 Kg/semana)
La fracción de carbohidratos (arroz, pasta, patata, pan) debe ser reducida a un máximo de 45% del total de calorías, evitando el consumo de azúcares simples, presentes en el azúcar blanco o moreno, en aditivos edulcorantes (como jarabe de maíz o fructosa) y en alimentos procesados azucarados como bollería, dulces, refrescos o zumos envasados.
Cuando se consuman cereales, se debe priorizar su versión integral (pan, arroz, pasta, etc.). Además, si tomamos cereales de desayuno, debemos optar por aquellos sin azucarar (copos de avena, trigo o muesli).
Se deben consumir al menos dos raciones de vegetales al día: una ración en la comida y otra en la cena.
Se deben consumir dos o tres piezas de fruta al día. No obstante, se debe evitar la toma de zumos de fruta, aunque sean caseros, ya que en estas presentaciones se excluye la fibra, componente básico en la regulación de la resistencia a la insulina.
Se deben consumir legumbres (garbanzos, lentejas, alubias, soja) entre dos y tres veces por semana y alternar su consumo con otras proteínas magras como las carnes blancas, pescados blancos, pescado azul y huevos.
Se debe evitar el consumo de grasas saturadas (leche entera, nata, quesos grasos, embutidos) y más concretamente, evitar el consumo de grasas “trans” presentes margarinas, galletas y otros dulces ultraprocesados que contengan aceite de coco o de palma.
Se debe aumentar el consumo de ácidos grasos omega-3 presentes en pescado azul y frutos secos y utilizar el aceite de oliva virgen para aliños y cocciones.
Se deben ingerir alimentos ricos en vitamina A, C, E y selenio como, por ejemplo, pescados azules, tomate, espinacas, brócoli, pimientos, nueces y aguacate
Suprimir cualquier tipo de bebida alcohólica . El agua debe ser la bebida de prioridad.
Existen algunos estudios que sugieren que las dietas vegetarianas mejoran la resistencia a la insulina y favorecen la pérdida de peso. Por ello, se ha demostrado cierta mejora de la enfermedad de hígado graso con la sustitución de carnes y pescados por legumbres como la soja.
Y, por último. y no menos importante… la práctica de ejercicio físico mejora la insulino-resistencia y la esteatosis hepática. Por ello, se recomienda realizar una actividad cardiovascular (caminar, correr, bicicleta, nadar, etc.) durante un mínimo de 30 minutos con una frecuencia de tres a cinco veces por semana.
Artículo especializado
Hábitos Saludables Para Aliviar la Enfermedad de Crohn
De momento, no existe una cura médica para la enfermedad de Crohn . La meta es suprimir la respuesta inflamatoria. Esto permite que el tejido intestinal sane y se alivian los síntomas. Una vez se controlan los síntomas, la terapia médica y dietética se utiliza para disminuir la frecuencia de los brotes de enfermedad y mantener los períodos de remisión.
¿Qué es?
La enfermedad de Crohn es una de las principales del grupo de Enfermedades Inflamatorias Intestinales (EII). Es un proceso inflamatorio crónico del tracto intestinal que, aunque puede afectar a cualquier parte del tracto digestivo desde la boca hasta el ano, afecta de forma más común a la porción más baja del intestino delgado (íleon) o el intestino grueso (colon y recto).
Una de las complicaciones que se pueden dar es la desnutrición (existe una alta prevalencia), debido a la mala absorción de los nutrientes a nivel intestinal cuando la enfermedad está activa; y también puede haber déficit vitamínico y/o mineral, por lo que se debe tener muy presente seguir una correcta alimentación y suministrar suplementos si fuese necesario.
¿Qué síntomas da?
Debido a que la enfermedad de Crohn puede afectar a cualquier parte del intestino, los síntomas pueden ser muy distintos entre un paciente y otro.
Dolor abdominal.
Retortijones frecuentes.
Diarrea (puede empezar lentamente o de repente).
Necesidad de ir al baño con frecuencia.
Sangrado rectal.
Anemia (que puede causar mareos o cansancio).
Pérdida de apetito.
Pérdida de peso.
Fiebre.
Durante los períodos de síntomas activos, los pacientes también pueden experimentar fatiga (cansancio extremo), lesiones en la piel, en los ojos, o dolores en las articulaciones. En niños y adolescentes puede haber retraso en el crecimiento.
¿Cuáles son las causas de la enfermedad de Crohn?
Se desconoce la causa exacta, los estudios actuales se concentran en una reacción autoinmunitaria (el propio sistema inmunitario ataca las células sanas del cuerpo) donde las bacterias en el tubo digestivo pueden desencadenar de manera equivocada una reacción del sistema inmunitario. Esta respuesta del sistema inmunitario causa inflamación, lo que genera los síntomas de la enfermedad.
A veces puede ser hereditaria . Las investigaciones han demostrado que, si padres o hermanos tiene la enfermedad de Crohn, se podría tener mayor probabilidad de llegar a padecer la enfermedad.
¿Cuál es el tratamiento de la enfermedad?
La enfermedad de Crohn con medicinas (que no curan la enfermedad, pero sí disminuyen los síntomas), reposo intestinal y cirugía.
No hay un único tratamiento que funcione para todos los casos de la enfermedad. El tratamiento intenta disminuir la inflamación intestinal, evitar brotes de los síntomas y mantenerlo en remisión.
Como parte del tratamiento también debe tenerse en cuenta la alimentación, hacer cambios puede ayudar a reducir los síntomas. A pesar de esto, no hay una dieta especial y estándar para la enfermedad . Cada persona es diferente, por lo que la tolerancia dependerá del momento de la enfermedad en que se encuentre y de la zona afectada.
¿Qué pautas de alimentación se pueden seguir?
La alimentación será distinta cuando una persona se encuentre en una fase activa de la enfermedad, diferenciando un brote severo, moderado o leve; y cuando se encuentre en una fase de remisión.
Durante la fase activa se recomienda:
Distribuir la comida en varias tomas de menos cantidad y evitar las comidas copiosas . Una adecuada distribución de los alimentos a lo largo del día ayudará a controlar los síntomas de la enfermedad.
En los períodos de brote, se aconseja controlar el c ontenido de lactosa, grasas y fibra dietética.
Identificar los alimentos a los que asocian los síntomas.
Identificar los alimentos que causan menor sintomatología.
Evitar el alcohol , la cafeína, la fructosa, el azúcar y los edulcorantes artificiales si hacen sentir peor.
En muchas ocasiones, en fase de brote severo o cuando existe hospitalización por complicaciones debidos a la propia enfermedad, se prescribe una dieta enteral (NE) por vía oral (sin fibra y sin lactosa).
Consejos específicos sobre los lácteos
Dentro de los alimentos de consumo diario en una alimentación saludable, se aconseja tomar lácteos y alimentos con fibra (verduras, frutas y cereales integrales), pero estos pueden ocasionar problemas de digestión al consumirlos o incluso aumentar los síntomas en las fases de actividad de la enfermedad. La intolerancia a la lactosa es una situación muy frecuente en nuestro medio, y su prevalencia es más elevada aún en las personas afectadas por enfermedad de Crohn. Sin embargo, dado que las personas con intolerancia a la lactosa tienen una menor densidad ósea, la tendencia actual es mantener el consumo de lácteos, en la medida en que su tolerancia lo permita. Es recomendable consultar con el médico especialista para saber si se puede consumir fibra y lactosa.
En caso de no tolerar bien los lácteos: se puede tomar leche sin lactosa o bebidas vegetales como la de soja o avena, pero enriquecido en calcio. Los quesos y yogures contienen menos lactosa por lo que su tolerancia puede ser mayor. Los quesos suelen contener mayor fracción grasa, y eso los convierte en más calóricos. En caso de estar con bajo peso, puede ser una buena opción rica en calcio y además ayudará a aumentar las calorías de la dieta.
En caso de no tolerar ningún lácteo: se puede aumentar el consumo de otros alimentos ricos en calcio, siempre que estos sean bien tolerados. Un ejemplo son los pescaditos pequeños con espina o sardinas en lata (consumir con las espinas), los frutos secos (almendras, nueces, avellanas), y las semillas de sésamo. Otras alternativas pueden ser: bebidas de soja o de arroz enriquecidas con vitamina D y calcio.
Consejos específicos sobre la fibra
Si los alimentos muy ricos en fibra provocan molestias se pueden tomar medidas para mejorar su digestibilidad:
Preparar las legumbres en cocciones sencillas , evitando los guisos grasos. Si igualmente enteras no se toleran bien, se pueden tomar trituradas, y si aún así dan molestias se puede pasar el puré por el chino.
Tomar las frutas masticándolas bien, o bien hornearlas para mejorar su tolerancia.
Probar la tolerancia a los diferentes tipos de verduras y mediante diferentes formas de cocción, ir probando una por una y en pequeñas cantidades.
Las verduras y frutas que generalmente dan más problemas son las coles, coliflor, brócoli , etc. y los cítricos, aunque eso no significa que en todos los casos vayan a ser mal tolerados.
Durante la fase de remisión se recomienda:
Los consejos dietéticos son los mismos que para la población sana, es decir, seguir una dieta variada y equilibrada, suficiente para cubrir las necesidades de macro y micronutrientes. Sólo se deben excluir aquellos alimentos que por propia experiencia no se toleran bien.
En caso de brote moderado-severo
En caso de brote leve
Consejos generales
Dieta sin fibra
Bajo contenido en grasas transformadas
Dieta sin lactosa (en personas intolerantes) o con muy escasa cantidad
Dieta de fácil digestión
Restricción de fibra insoluble y residuos
Dieta controlada en grasas transformadas (bollería, pastelería, precocinados comerciales)
Moderar el contenido en lactosa
Alimentos que suelen tolerarse bien
En caso de brote moderado-severo
En caso de brote leve
Lácteos
Leche sin lactosa o vegetal diluida (eliminación total de la leche solo si hay diarreas, flatulencia, dolor abdominal)
Bebidas vegetales, prioridad en el consumo de queso y yogur.
Exclusión completa en intolerantes a la lactosa
Carne y pescado
Carne de ternera picada, pollo sin piel, pavo, conejo
Pescado blanco magro
Todo tipo de carne
Pescado blanco magro
Gambas y langostinos
Huevos
Tortilla de claras (probar tolerancia a la yema)
Tortilla, huevo duro (muy cocido)
Pan, cereales
Tostadas no integrales, biscotes, sémola de arroz, sopa de tapioca, arroz hervido, maicena, pasta de sopa pequeña muy cocida
Pan tostado no integral, biscotes, pan de molde, arroz hervido, pasta muy cocida, maicena, sémola de arroz, cereales sencillos sin azúcar ni fibra
Patata
Puré de patata
Puré de patata
Embutido
Jamón dulce sin grasa, pechuga de pavo cocido
Jamón dulce o curado sin grasa, pechuga de pavo cocida
Fruta
Manzana o pera al horno o hervida, pera o melocotón en almíbar sin líquido, membrillo
Zumo de uva o manzana caseros, manzana al horno o hervida, plátano maduro, membrillo
Verdura
Verduras en puré, verduras tiernas hervidas.
Bebida
Agua, agua de arroz o zanahoria, caldo vegetal
Agua, agua de arroz o zanahoria, caldo vegetal
Cocciones
Cocido y papillote
Cocido, papillote, plancha, horno, grill, parrilla, guiso suave
Alimentos que NO suelen tolerarse bien
Verduras
Cebolla, coles, coliflor, pimientos, puerros, rábanos
Legumbres
Guisantes, lentejas, habas, garbanzos, habichuelas, judías, patatas fritas
Pan
y cereales
Centeno, pan muy fresco
Fibra insoluble procedente de cereales integrales
Frutas
Albaricoque, melocotón, ciruelas, cerezas, higos, melón
Huevo
Huevos duro y frito
Lácteos
Leche entera, queso graso
Pescado
Pescado azul frito o en aceite
Carne
Tocino, carnes grasas (cerdo, cordero, pato) y fritas. Embutidos, sesos, callos, pollo frito
Bebidas
Bebidas con gas, bebidas con cacao
Tomar suficiente cantidad de líquidos, se aconseja tomar pequeñas cantidades de agua de forma frecuente a lo largo de todo el día, para asegurar una correcta hidratación.
Grasas
Alimentos grasos como mantequilla, nata, manteca, embutidos grasos, etc.
Preparaciones grasas como frituras, salsas, etc.
Otros
Evitar los picantes y los edulcorantes, pueden ocasionar diarreas (caramelos, chicles, bebidas Light o Zero… ). Evitar bollería

Artículo especializado
Síndrome de Fibromialgia
Dolor, cansancio, alteraciones en el estado de ánimo… son síntomas que refieren las personas con fibromialgia , un síndrome que no fue reconocido como enfermedad hasta 1992 y que afecta, y mucho, a la calidad de vida de quienes lo sufren. Te explicamos cómo se llega al diagnóstico y en qué consiste el tratamiento.
¿Por qué se le llama síndrome?
Por tratarse de un conjunto de síntomas entre los que destacan el dolor crónico musculoesquelético generalizado junto con fatiga, insomnio o mala calidad de sueño, y alteraciones en el estado de ánimo. El síndrome de fibromialgia (SFM) es más frecuente en mujeres (les afecta 10 veces más que a hombres) y en el rango de edad entre los 30 y los 50 años. En su inicio costó catalogarlo por la diversidad e inespecificidad de sus síntomas, y fue reconocida como enfermedad por la Organización Mundial de la Salud (OMS) en el año 1992.
El dolor
Su causa es desconocida, aunque su principal síntoma, el dolor, se asocia a la llamada sensibilización central. Existe una fuerte relación entre la fibromialgia y una alteración en la modulación del dolor, que explica la respuesta dolorosa aumentada que aparece ante estímulos de baja intensidad. Dicho de otra manera, estas personas sufren más dolor que el resto de la población con el mismo estímulo. Y este bajo umbral de tolerancia al dolor ocasiona una hiperestesia o hipersensibilidad ante mínimos estímulos. [
Por otro lado, se aboga por una predisposición genética y ambiental , siendo más frecuente en hijos de progenitores con fibromialgia y en aquellas personas con mala calidad de sueño, obesidad, inactividad física e insatisfacción laboral y personal.
¿Cómo se confirma el diagnóstico?
El diagnóstico del SFM es absolutamente clínico. No existe ninguna prueba que lo confirme. Para etiquetar de fibromiálgica a una persona debemos basarnos en los síntomas, junto con una exhaustiva exploración física y una analítica (básicamente para descartar otras causas como enfermedades reumáticas).
Entonces, ¿los dolores generalizados sin causa aparente equivalen a fibromialgia?
La respuesta es: no. Existen unos criterios diagnósticos que deben tenerse en cuenta. Hasta hace pocos años el dolor se valoraba mediante la exploración sistemática de los llamados “ puntos gatillo ”, que son un total de 18, y son unos lugares anatómicos específicos cuya palpación provoca un dolor local o irradiado. Si una persona tenía dolor al palpar un mínimo de 11 de los 18 puntos se consideraba una exploración positiva y sugestiva de fibromialgia.
En 2010 se definieron unos criterios diagnósticos que debían estar presentes durante al menos tres meses con una intensidad similar y sin otra causa que los justificara. Se valoraba un índice de dolor generalizado y una escala de gravedad de síntomas . Posteriormente, fueron modificados con la introducción de unos cuestionarios en forma de autoencuesta que debía cumplimentar el paciente.
¿QUÉ MÉDICO ME LLEVA?
Normalmente es controlado por el reumatólogo, aunque durante el seguimiento pueden intervenir el traumatólogo, el rehabilitador, la clínica del dolor e incluso el psiquiatra (por asociarse a oscilaciones en el estado de ánimo).
¿Cuándo sospecharemos el diagnóstico de SFM?
Dolor: es generalizado, de inicio insidioso e intermitente (pero progresivo). Debe tener una duración de tres meses y sin otra causa aparente. Es de predominio muscular, aunque puede ser articular. Son frecuentes la cefalea y la dismenorrea (dolor menstrual).
Fatiga: presente en el 90% de los pacientes, es el síntoma más comúnmente asociado. Puede ser más incapacitante que el propio dolor.
Alteraciones del sueño: insomnio de primera o segunda fase (cuesta coger el sueño o se despiertan durante la noche) o sueño no reparador (se despiertan con sensación de “no descanso”).
Distimia: alteraciones en el estado de ánimo como depresión y/o ansiedad son frecuentes (tres de cada cuatro pacientes).
Otros síntomas: disfunción sexual (hasta en un 97% de los pacientes), síndrome del intestino irritable, sequedad ocular, palpitaciones, bruxismo, acufenos (pitidos), sobrepeso u obesidad, etc.
¿Qué pruebas podemos solicitar antes estos síntomas?
Ante un posible SFM podemos encontrarnos con una exploración física normal. No obstante, solicitamos una analítica completa para descartar otras enfermedades. Diversas entidades pueden cursar con un dolor similar, por ejemplo, enfermedades musculo esqueléticas (artritis reumatoide, espondilo artritis, lupus eritematoso sistémico o poli mialgia reumática) o neurológicas (esclerosis múltiple o neuropatías periféricas). Algunos fármacos pueden causar dolor generalizado como esta tinas, inhibidores de la bomba de protones y bifosfonatos.
¿Cómo abordamos el tratamiento del SFM?
El tratamiento debemos enfocarlo en la reducción de síntomas para mejorar el entorno médico del paciente. Disponemos de un tratamiento farmacológico y de un tratamiento no farmacológico, pero no existe un tratamiento estándar ni específico. Centrándonos en los síntomas predominantes de cada paciente individualizaremos su tratamiento.
En cuanto a las medidas no farmacológicas podríamos mencionar:
Concienciación del paciente y comprensión de su enfermedad: debemos fomentar una actitud positiva por su parte, pues influye fuertemente en la respuesta al tratamiento.
Ejercicio físico: mejorando el bienestar físico y psicológico conseguiremos disminuir el dolor y mejorar la calidad de sueño. Es preferible el ejercicio aeróbico de baja potencia (caminar, trotar, nadar, aquagym, pilates, bailar, pedalear, etc). Tres sesiones a la semana de 30 minutos de duración son suficientes. Otras actividades aconsejadas serían: yoga, taichi, meditación o masaje corporal.
Psicoterapia: el estado de ánimo influye en la evolución de la enfermedad.
El tratamiento farmacológico debe abordar aquellos síntomas invalidantes, pero empleando la mínima dosis eficaz y durante periodos de tiempo controlados. No hay ningún fármaco aprobado con indicación específica para la fibromialgia. Por ello, el tratamiento será sintomático:
Analgésicos y antiinflamatorios para el dolor.
Relajantes musculares o antidepresivos para mejorar el descanso y el estado de ánimo.
Otros: los fármacos anticonvulsivantes (gabapentina y pregabalina) han demostrado eficacia en el control de algunos síntomas.
A pesar de que los síntomas suelen persistir y fluctuar a lo largo del tiempo debemos fomentar que el paciente tenga una vida activa y recurra al tratamiento médico sólo cuando sus síntomas se intensifiquen. La convivencia con el SFM es más fácil si el paciente es conocedor de su patología y de su abordaje. Asimismo, el optimismo y una buena calidad de sueño van a influir positivamente en el control de la enfermedad.

Artículo especializado
Espondilitis Anquilosante
Cualquier patología que afecta a una articulación limitará su movilidad y, por tanto, la calidad de vida de quien la sufre, que será mayor o menor en función de la gravedad de dicha afectación. Es lo que ocurre en la espondilitis anquilosante , una enfermedad crónica de carácter inflamatorio que afecta básicamente a la columna vertebral y a la articulación sacroilíaca y produce un anquilosamiento entre vértebras que se sueldan entre sí, además de posibles cuadros de sacroiliitis, espondilitis, espondiolodiscitis, entesitis y artritis.
¿Por qué se produce?
Las causas son, a día de hoy, poco específicas. Algunos expertos hablan de una posible relación entre ciertos gérmenes intestinales y la enfermedad , pero este es un tema que aún ha de seguir estudiándose. Hay indicios, eso sí, que indican que esta relación puede existir. Por otro lado, parece que hay un componente genético , como el que se conoce como HLAB27. Es un presente en un pequeño porcentaje de la población general (8% de los caucásicos), aunque no significa que todas las personas que presentan este gen desarrollarán la enfermedad, ya que sólo el 10% de los portadores llegarán a sufrirla. De hecho, se aconseja hacer un estudio genético únicamente a las personas que presentan sintomatología de espondilitis anquilopoiética (síntomas inflamatorios de articulaciones).
Afecta de manera más habitual a gente joven entre 20-30 años y es raro su inicio pasados los 45 años. Su prevalencia es mayor en hombres que en mujeres.
¿Cuáles son sus síntomas?
La espondilitis puede cursar con brotes y se caracteriza por un dolor especialmente localizado en la zona lumbar o en la parte central de la columna vertebral, de aparición nocturna, que despierta al paciente y le obliga a levantarse en muchas ocasiones.
El hecho de no ser un dolor mecánico sirve para realizar el diagnóstico diferencial con otras patologías relacionadas con problemas de la columna como las artrosis o discopatías. Acompañando a este dolor, el paciente refiere una rigidez matutina que puede durar entre 30 minutos y horas y, por tanto, limita en gran medida sus posibilidades de realizar una vida en condiciones normales.
Otra zona típica de afectación son las articulaciones sacrolíacas, y en este caso se caracteriza por un dolor en la zona de los glúteos que puede confundirse con un dolor parecido a la ciática ya que se irradia a la parte posterior de las extremidades inferiores.
Afectación más allá de las articulaciones
Además de las articulaciones propiamente dichas, la espondilitis provoca alteraciones en otras estructuras como son los tendones ocasionando entesitis , que es la inflamación de la zona de inserción del tendón en el hueso. No es propiamente una afectación articular, pero sí que llega a limitar la movilidad, el tendón de Aquiles o el esternón son localizaciones donde pueden aparecer molestias.
Existen también manifestaciones extra articulares, enfermedades inflamatorias que no afectan a estructuras óseas, sino que se encuentran en otras localizaciones. La presencia de dolor, ojo rojo, sensibilidad a la luz (fotofobia), disminución de la visión o visión borrosa debe hacer pensar en una uveítis que requiere de un diagnostico precoz porque puede conducir a ceguera. La Enfermedad de Crohn y la colitis ulcerosa , que afectan al intestino, son posibles patologías también asociadas a la espondilitis que causan diarreas o pérdidas de peso sin motivo justificado. Por último, pero no menos importante, lesiones cutáneas de extensión variable que afectan a zonas articulares (rodillas y codos) de manera más importante, pero que pueden afectar también a la cabeza son signos de psoriasis una enfermedad autoinmune que ocasiona descamación.
¿Cómo se diagnostica?
La sintomatología típica de esta enfermedad, los dolores nocturnos localizados en la zona central-lumbar son bastante indicativos de dicha patología, pero serán las pruebas complementarias las que ayuden al diagnóstico. El diagnóstico por la imagen es determinante ya que se observa en las radiografías, la existencia de lesiones típicas en las vértebras y articulaciones sacroilíacas, aunque hay casos en que se necesiten otras pruebas como una resonancia magnética.
¿Cómo se trata?
En cuanto al abordaje terapéutico, éste debe ser combinado e incluir tanto terapia farmacológica como actividad física.
La batería de fármacos actuales son tres: los corticoides, los antiinflamatorios, los fármacos modificadores de la enfermedad (FAME) y las terapias biológicas . Los dos primeros actúan reduciendo la sintomatología, básicamente el dolor y la inflamación, pero no tienen efecto sobre el curso de la patología, mientras que los FAME sí pueden ser útiles en los casos en que existen manifestaciones extraarticulares. Siempre será el especialista quien decida la opción terapéutica más adecuada a cada caso.
Además del tratamiento farmacológico es esencial mantenerse activo, hay que evitar al máximo el sedentarismo siempre adaptándose a las características individuales, sobre todo al ser una enfermedad que cursa a brotes. Es recomendable conseguir realizar sesiones de ejercicios en los que se combinen ejercicios de tipo aeróbico con ejercicios cuyo objetivo es el trabajo muscular para tonificar y fortalecer la musculatura. Antes de empezar siempre hay que realizar unos minutos de calentamiento para que el cuerpo se vaya adaptando de manera progresiva. En cuanto a los ejercicios de tipo aeróbico, andar, bicicleta o nadar se pueden incluir en la rutina y además todos ellos pueden ayudar a expandir la caja torácica. Respecto al trabajo muscular, conviene centrarse en grupos musculares grandes y en movilizar aquellas zonas más afectadas por la propia espondilitis. Es importante buscar el consejo de un profesional.
Complementario a esta terapia, es importante no olvidar que una dieta adecuada es otra recomendación conveniente, sobre todo para evitar el sobrepeso y la obesidad que empeorarían la sintomatología articular. En aquellas personas en las que la enfermedad se presenta también en el intestino es necesario consultar con un especialista.

Artículo especializado
Hábitos Saludables para Evitar la Epilepsia
Un 1% de los niños menores de 14 años están diagnosticados de epilepsia. Es una enfermedad crónica neurológica que puede afectar a niños y adultos. Según la Organización Mundial de la Salud (OMS), en todo el mundo hay 50 millones de personas que padecen epilepsia: es uno de los trastornos neurológicos más comunes.
¿Qué es la epilepsia?
Actualmente sabemos que la epilepsia se caracteriza por crisis producidas por descargas de impulsos desordenados y generalizados de las neuronas . Son provocadas por alteraciones en el equilibrio de los neurotransmisores (sustancias que transmiten señales entre neuronas).
Los griegos ya describían la epilepsia como una enfermedad divina o sagrada ( morbus divinus o morbo sacro ) ya que pensaban que sólo un dios podía ser capaz de tirar a las personas al suelo y producirles convulsiones. Según la mitología griega, Hércules padecía epilepsia y se la llamó, también, la “enfermedad de Hércules”. Hipócrates no compartía esa visión mágica y la llamó Gran Enfermedad ( morbus maior ). Los romanos pensaron que era una enfermedad contagiosa y la llamaron morbus comiciales , por el hecho de que, si una persona presentaba una crisis en un comicio, éste se suspendía y se purificaba para evitar el contagio. En la Edad Media, los epilépticos corrían con peor suerte, ya que se pensaba que estaban poseídos por espíritus o demonios.
¿La epilepsia se hereda?
Hay tipos de epilepsia con una carga hereditaria muy clara . Hay muchos genes implicados. En otros tipos, la herencia no es tan evidente y la aparición de epilepsia puede ser debida a múltiples factores. Es importante tener en cuenta los antecedentes familiares en la evaluación del niño.
Tipos de epilepsia
Existen dos grandes tipos de epilepsia según el tipo de crisis que produzcan. A su vez, estas se pueden subdividir en idiopáticas (no sabemos la causa de la epilepsia) o criptogenéticas o sintomáticas (dónde existe una causa orgánica o lesión que justifica la epilepsia).
Crisis focales o parciales: se inicia en una parte localizada del cerebro, donde las neuronas empiezan a tener una actividad desordenada. En función de la región cerebral afectada (foco epiléptico) tendrán diferentes manifestaciones clínicas o tipos de crisis. Pueden acompañarse, o no, de pérdida de conocimiento. Pueden ser de varios tipos:
Crisis epiléptica focal simple : el niño presenta síntomas motores que producen sacudidas rítmicas de una parte del cuerpo durante segundos o minutos.
Crisis epiléptica focal compleja : el niño presenta movimientos rítmicos de una parte del cuerpo y pierde el conocimiento, pero sin perder el tono muscular, es decir, se puede quedar inmóvil sin responder varios segundos o unos pocos minutos y se acompaña de movimientos automáticos con la boca, con las manos. El conocimiento se recupera poco a poco y queda con un estado de confusión mental que dura varios minutos.
Crisis focal con generalización secundaria : sucede cuando una crisis epiléptica parcial simple o compleja se extiende desde el foco epiléptico a toda la superficie cerebral.
Espasmos epilépticos: Aparecen en lactantes. Consisten en una flexión o extensión brusca del cuerpo y de la cabeza durante 1 a 5 segundos. Son muy graves y de difícil control.
Crisis generalizadas: empiezan a la vez en todas las áreas del cerebro, por lo tanto, todas las neuronas realizan descargas de impulsos desordenados. Esto conlleva, irremediablemente, a una pérdida de conocimiento. Pueden ser de varios tipos:
Crisis de ausencias: el niño permanece absorto e inmóvil con el conocimiento perdido y con la mirada fija durante 10 a 15 segundos. Pueden producirse movimientos oculares y parpadeo de otras partes del cuerpo. La recuperación es muy rápida y muchas veces pasan desapercibidas por su brevedad. Se repiten con mucha frecuencia, a veces varias en el día, por lo que pueden ser una causa de bajo rendimiento escolar.
Crisis mioclónica: el niño presenta una sacudida brusca de todo el cuerpo o bien de una parte, sobre todo de los miembros superiores, que provocan una caída al suelo.
Crisis atónica: el niño cae de forma brusca por pérdida del tono muscular y de la conciencia durante muy pocos segundos y se recupera de forma instantánea.
Crisis tónico-clónica: el niño presenta una pérdida brusca de conocimiento y cae al suelo si se está de pie. Al inicio provoca rigidez de todo el cuerpo (fase tónica) y después movimientos rítmicos de todo el cuerpo (fase clónica).
En las crisis generalizadas con caída al suelo el mayor peligro es que la persona (niño o adulto) se lesione durante la caída.
¿Se conocen las causas?
La mayor parte de las epilepsias (siete de cada 10 casos) tienen una causa no conocida , sobre todo en los niños, y podrían ser atribuidas a:
Problemas del desarrollo cerebral durante la gestación.
Hipoxia (falta de oxígeno) durante o después del parto.
Traumatismos craneoencefálicos.
Tumores cerebrales.
Encefalitis o meningitis (infecciones del sistema nervioso central).
Antecedentes de epilepsia en la familia.
Además de los tipos de crisis, hay síndromes ya descritos con patrones muy definidos que son típicos en la infancia, como el síndrome de West o el de Lennox-Gastaut .
¿Cómo se diagnostica la epilepsia?
Tras la primera crisis convulsiva el pediatra y el neurólogo pediátrico ponen en marcha una serie de pruebas que son claves para la confirmación del diagnóstico:
Historia clínica: es fundamental saber cómo fue la crisis, la edad de niño, en qué circunstancias, el tipo de movimientos y si perdió la conciencia. Los antecedentes familiares son fundamentales también.
Análisis de sangre: es un estudio general importante para pautar los fármacos antiepilépticos.
Electrocardiograma: es fundamental para descartar enfermedades del corazón relacionadas con la pérdida de conciencia.
Electroencefalograma: es un registro de la actividad eléctrica del cerebro y que nos permite observar, objetivamente, las descargas de las neuronas. Se puede diagnosticar el síndrome epiléptico y localizar el foco.
Pruebas de imagen (TAC o Resonancia magnética): en los casos que se sospeche alguna lesión cerebral, como un tumor o una malformación vascular.
Estudios genéticos: en los casos que se sospeche un componente hereditario.
Medidas generales para evitar las crisis y mejorar el control de la epilepsia
Las medidas más importantes para evitar las crisis son las siguientes:
Cumplir rigurosamente con el tratamiento pautado por el neuropediatra.
Acudir a los controles regularmente y realizarse las analíticas pertinentes para evaluar si los niveles de fármacos anticomiciales son adecuados.
Es importante que la familia o el adolescente anote en un calendario las crisis que va teniendo, describiendo el contexto en el que se dieron.
Evitar factores desencadenantes como:
Alcohol y drogas (en adolescentes).
Dormir poco. Es importante seguir un horario regular de sueño.
No llegar al agotamiento en cualquier actividad física.
Evitar deportes bruscos o de riesgo.
Evitar la hipoglucemia.
En las adolescentes, la menstruación puede incrementar el número de crisis.
Mirar la televisión a una distancia mínima de tres metros.
Si el joven acude a discotecas, es aconsejable que se coloque de espaldas de los focos de luz.
Informar al centro escolar de la enfermedad del niño.
Comentar siempre al pediatra que el niño toma anticomiciales , ya que algunos fármacos, si se dan a la vez, pueden disminuir su eficacia.
Artículo especializado
Últimos Tratamientos y Avances de la Esclerosis Múltiple
¿Sabías que es la principal causa de discapacidad neurológica de causa no traumática en pacientes jóvenes? En España la prevalencia es de 40-80 casos por cada 100.000 habitantes. Estoy segura de que has oído hablar de esta enfermedad crónica neurológica. Vamos a hacer una breve introducción sobre la esclerosis múltiple para profundizar después sobre las novedades terapéuticas de los últimos años.
¿Qué es?
Se trata de una enfermedad neurológica de causa desconocida. Es mucho más frecuente en personas con antecedentes familiares de esta enfermedad, pero no es una enfermedad hereditaria. Como curiosidad científica se asocia al antígeno HLA-DRB1*1501.
Se caracteriza por la presencia de unas lesiones focales con pérdida de mielina en la sustancia blanca del sistema nervisoso central, denominadas placas. Esta pérdida de mielina en el axón es la responsable de la discapacidad irreversible de los pacientes.
¿Qué es la mielina?
Es la sustancia que envuelve los axones de las neuronas y actúa como aislante permitiendo una conducción más rápida de los impulsos nerviosos. La pérdida de mielina en esas áreas provoca un enlentecimiento en la conducción nerviosa axonal y, por tanto, retrasos o bloqueos en la conducción de la información . Ello provoca la aparición de los síntomas (a nivel del cerebro provoca atrofia cerebral y en el resto discapacidad progresiva). Los síntomas están sometidos a una gran variabilidad que va a depender de la localización de las placas desmielinizantes .
SUSTANCIA GRIS Y SUSTANCIA BLANCA
Recordemos la diferencia entre la sustancia gris y la blanca. La sustancia gris es la encargada de las funciones intelectuales superiores (lenguaje y razonamiento). La sustancia blanca lo es del equilibrio, la marcha, la coordinación y la función vesical (control esfínteres).
¿Qué síntomas ocasiona la esclerosis múltiple?
Suele debutar entre los 20 y los 40 años, siendo su edad media de presentación los 30 años. Y es más frecuente en mujeres.
Puede ocasionar alteraciones de la sensibilidad y alteraciones motoras.
El síntoma inicial más frecuente es la alteración de la sensibilidad en forma de hormigueo o acorchamiento de uno o más miembros o del tronco.
La alteración motora se caracteriza por torpeza o debilidad y se acompaña de hipertonía (tono muscular aumentado).
Otros síntomas asociados pueden ser: disartria (dificultad en el habla), disfagia (dificultad al tragar), vértigo, alteraciones visuales (diplopia o visión doble, alteración de la visión de los colores, pérdida de la agudeza visual…), inestabilidad en la marcha, temblor, alteración en el control de esfínteres (estreñimiento, incontinencia)…
Vamos a mencionar también el signo de Lhermitte por ser característico. Se trata de una sensación eléctrica que recorre la espalda de cabeza a pies cuando el paciente flexiona el cuello.
Otras alteraciones que pueden manifestarse durante la evolución de la enfermedad pueden ser: dolor, fatiga, deterioro cognitivo (memoria reciente, razonamiento), trastornos afectivos como depresión, movimientos anormales…
¿Cómo evoluciona esta enfermedad?
Existen diferentes formas clínicas de evolución de pronóstico diferente:
Síndrome clínicamente aislado ; el paciente tiene un brote inicial aislado.
Remitente recidivante : cursa con recurrencias clínicas tras la cuál puede haber recuperación parcial o completa. Supone el 80% de los casos.
Secundariamente progresiva: cursa con recurrencias y la enfermedad progresa entre ellas.
Primariamente progresiva : la enfermedad es progresiva desde el inicio, sin brotes.
¿A QUÉ LLAMAMOS BROTE?
A la aparición de síntomas neurológicos de duración superior a 24 horas. Como curiosidad, en el embarazo hay menos tasas de brotes, pero en el puerperio se aumenta el riesgo.
¿Cómo se confirma el diagnóstico?
Existen diferentes pruebas diagnósticas, aunque la resonancia magnética es la prueba que permite detectar las lesiones desmielinizantes, así como monitorizar la evolución de la enfermedad y descartar otras causas.
¿Qué pronóstico tiene esta enfermedad?
La esclerosis múltiple es una enfermedad con gran variabilidad entre los individuos por lo que es difícil predecir el pronóstico.
La expectativa de vida tras el diagnóstico es de 25-35 años , siendo el tiempo medio entre el inicio de la enfermedad y la discapacidad muy variable en función de la forma de presentación de la misma.
Aquí debemos mencionar la llamada Esclerosis Múltiple Benigna , caracterizada por una mínima progresión o una mínima discapacidad durante décadas. Ocurre en un tercio de pacientes. Por el contrario, existen formas muy agresivas, pero son las menos frecuentes.
¿Cuál es el tratamiento más adecuado para esta enfermedad?
Al hablar del tratamiento debemos tener presente tres abordajes diferentes:
El tratamiento durante los brotes o recaídas : se emplean glucocorticoides, aunque existen pacientes que no responden.
El tratamiento para modificar la evolución de la enfermedad : hasta hace pocos años estos fármacos se administraban por vía intravenosa o subcutánea. Por su importancia, vamos a hacer hincapie en estos tratamientos.
Los tratamientos empleados en primera línea són:
Interferón beta : interfieren inhibiendo la desmielinización. Se administra en forma de inyección.
Acetato de glatirámero (comercializado como Copaxone): eficaz en la reducción de exacerbaciones. Indicado en pacientes que han tenido un primer episodio y tienen alto riesgo de evolución. Se administra en forma de inyección subcutánea (abdomen, brazos, caderas y muslos). Muy bien tolerado. Debe guardarse en la nevera.
Teriflunomida: de reciente incorporación. Novedoso por ser vía oral.
Dimetil fumarato (vía oral).
En segunda línea tendríamos:
Natalizumab: demostró que reducía la tasa de recurrencias y la progresión de la enfermedad. Efectos secundarios mayores. Se administra vía endovenosa cada 28 días.
Fingolimod (vía oral).
En tercera línea:
Mitoxantrona: frena el proceso destructivo de la mielina a nivel celular. Efectos adversos frecuentes.
Alemtuzumab (administración endovenosa).
Existen otros posibles tratamientos: azatioprina, ciclofosfamida, metotrexato, inmunoglubulinas…
El tratamiento de los síntomas de la enfermedad va encaminado a aliviar las molestias que influyen negativamente en la calidad de vida de estos pacientes.
Podríamos contemplar estas posibilidades terapéuticas:
Fármacos: diazepam, baclofeno, clinidina, tizanidina. Se prescribirá el fármaco más adecuado según el síntoma que presente el paciente (dolor, fatiga, depresión, alteración de esfínteres, disfunción sexual, temblor…)
Tratamiento no farmacológico : ejercicios para potenciar el movimiento, ejercicios de estiramiento muscular, estimulación electromagnética…
¿Existen terapias alternativas para esta enfermedad?
Existen muchas terapias propuestas como tratamiento alternativo: ácidos grasos, acupuntura, aromaterapia, naturopatía, homeopatía, iridología , hipnosis, yoga, oxígeno hiperbárico… Pero la mayoría de estos tratamientos carece de base científica.
La búsqueda de nuevos recursos terapéuticos para esta enfermedad es incesante. El objetivo es convertir la esclerosis múltiple en una enfermedad estable y bien tolerada. Las líneas de investigación están orientadas hacia nuevos fármacos orales y otras alternativas terapéuticas como anticuerpos monoclonales y trasplantes o terapia celular. La investigación es muy optimista al respecto.

Artículo especializado
Disnea: Aguda o Crónica
¿Cómo podemos definir la disnea? Es una sensación subjetiva de malestar respiratorio en la que uno nota que su respiración es cualitativa y cuantitativamente insuficiente. Hacemos referencia a disnea aguda si se instaura en minutos, horas o unos pocos días. Puede deberse a patologías de nueva aparición o a patologías crónicas reagudizadas como puede ser una crisis asmática o una descompensación en un paciente crónico respiratorio.
¿Qué sospecharemos ante una disnea de inicio brusco? Debemos descartar entidades relevantes como neumotórax espontáneo, neumonía, embolismo pulmonar, angioedema, arritmia cardiaca, infarto agudo de miocardio, insuficiencia cardíaca, crisis de pánico…. Una apreciación respecto a la disnea psicógena (de causa no orgánica), que será diagnosticada como tal sólo tras descartar todas las otras posibles causas. Como curiosidad, las principales causas de disnea en la infancia serían la bronquiolitis, la epiglotitis, la laringitis, la aspiración de un cuerpo extraño , etc.
¿Cómo se clasifica?
Existen diferentes clasificaciones que se manejan en función de la patología de base que tenga el paciente. Las dos clasificaciones más empleadas son:
Clasificación de la New York Heart Association (NYHA ): recomienda su escala para medir la disnea y definir la capacidad funcional en pacientes con insuficiencia cardiaca de base. Cuantifica cuatro clases:
Clase I: ausencia de síntomas que impidan su actividad ordinaria.
Clase I I: presencia de síntomas con su actividad ordinaria.
Clase III : presencia de síntomas que le impiden su actividad ordinaria.
Clase IV: síntomas ante mínimos esfuerzos o en reposo. Es la más grave.
La escala de disnea del Medical Research Council es la recomendada por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) cuando hay una enfermedad pulmonar obstructiva de base. Hablaríamos de:
Clase 0: no sensación de falta de aire al correr en llano o subir cuestas.
Clase 1 : sensación de falta de aire al correr en llano o subir cuestas.
Clase2 : anda más despacio que las personas de su edad en llano por falta de aire o tiene que parar para respirar cuando anda a su propio paso en llano.
Clase 3 : para para respirar después de andar unos 100 metros o tras pocos minutos en llano.
Clase 4 : la falta de aire le impide salir de casa o se presenta al vestirse o desnudarse.
¿Cómo actuar en la disnea aguda?
Centrándonos en la disnea aguda de cualquier causa debemos remarcar que es siempre una situación potencialmente grave que requiere una actuación médica urgente. El manejo es complicado, siendo necesario administrar, de forma inmediata, fármacos vía parenteral (endovenosa o intramuscular) así como otras medidas de apoyo como oxígeno en forma de mascarilla a alto flujo con medicación broncodilatadora. No podemos dudar. Debemos acudir inmediatamente a urgencias donde, si es factible, se hará un interrogatorio dirigido (en ocasiones el estado del paciente no nos lo permite y debemos interrogar a los acompañantes o, actuar directamente), una exploración (fundamental es la auscultación y la monitorización de la saturación de oxígeno o pulsioximetría) y administraremos medicación parenteral y, muy probablemente, una nebulización. Por supuesto, si se trata de un paciente con antecedentes respiratorios y dispone de un aerosol broncodilatador en casa puede administrárselo hasta ser visitado médicamente.
Cuando la causa es una anafilaxia
Sin duda, la causa de disnea que más angustia a cualquier edad es la debida a una anafilaxia que suele instaurarse en pocos minutos y acompañarse de s ensación de ausencia de entrada de aire y de muerte inminente. Es debida a una reacción de hipersensibilidad sistémica. Es grave y puede ser mortal. Se trata de una reacción aguda , con presentaciones clínicas variadas. Puede progresar rápidamente hacia la obstrucción de la vía aérea o una situación de shock. Por ello, en urgencias, ante un caso de disnea aguda grave por anafilaxia actuaremos de forma muy dirigida y sospechando las principales causas : farmacológica (sobre todo por alergia a antibióticos y contrastes radiológicos), alimentaria (alergia a frutas, frutos secos, marisco, pescado, huevo o leche, fundamentalmente) o picaduras de insecto.
¿Cuáles son los principales síntomas de gravedad?
Especial alarma nos creará el paciente que esté obnubilado o adormecido , con mucosas azuladas o cianosis (indicativas de poca o insuficiente oxigenación tisular), una frecuencia cardíaca o respiratoria elevadas (sugieren esfuerzo compensatorio), h ipotensión , tiraje intercostal (o sobrecarga de musculatura respiratoria), ruido al inspirar o saturación de oxígeno baja. Cuando el paciente está estabilizado, en caso de disnea leve-moderada (estando el paciente bien ventilado) realizamos una batería de pruebas (radiografía de tórax, electrocardiograma, analítica, gasometría…)
¿Qué sospecharemos ante una disnea subaguda?
Cuando la disnea es progresiva en su evolución sospecharemos una afectación cardiaca, una enfermedad pulmonar o una anemia . Es este caso la instauración será lenta y a su vez progresiva.
En cuanto al tiempo de duración, hablaremos de disnea crónica para referirnos a aquella de más de un mes de evolución.
Asimismo, es importante hacer mención de determinadas situaciones que pueden agravar la disnea y le confieren un nombre específico. Para tu conocimiento te nombraré las más comúnmente empleadas entre el colectivo médico:
Trepopnea es la disnea que se produce en decúbito lateral (con el paciente estirado y de lado). Es característica del derrame pleural y de algunas cardiopatías.
Ortopnea es la que se produce en decúbito supino (con el paciente estirado y mirando hacia arriba): Es característica de la insuficiencia cardiaca y de enfermedades respiratorias.
Disnea paroxística nocturna es aquella que despierta al paciente por la noche obligándole a permanecer sentado y se asocia a tos y en ocasiones a sibilancias o pitidos al respirar. Característica de la insuficiencia cardiaca, obesidad y enfermedades crónicas respiratorias.
Disnea de esfuerzo es aquella que aparece ante un aumento de solicitud, normalmente al realizar una actividad física. Debe descartarse una patología isquémica como la angina de pecho.
¿Cómo se diagnostica?
La mayoría de los pacientes con disnea crónica tiene uno de estos diagnósticos de base: asma, enfermedad pulmonar obstructiva crónica (EPOC), enfermedad intersticial pulmonar, disfunción miocárdica u obesidad/sedentarismo.
Todo paciente con disnea debe ser valorado de forma integral. Asimismo, es importante la valoración de otros posibles síntomas que describa como dolor torácico, palpitaciones, tos, dolor al tragar, fiebre, etc.
En el momento del estudio es muy importante descartar las dos principales causas: respiratoria y cardíaca. La secuencia óptima de las pruebas diagnósticas a utilizar en la disnea crónica no está establecida. Se solicitan pruebas diagnósticas de forma secuencial, en función de las características clínicas del paciente, por ejemplo, en un paciente con sospecha de patología respiratoria la primera prueba sería una espirometría para evidenciar su capacidad pulmonar mientras que ante la sospecha de insuficiencia cardiaca empezaríamos con un electrocardiograma y una radiografía de tórax .
Existe una prueba específica que empleamos en urgencias cuando una persona sufre una crisis de disnea y sospechamos una insuficiencia cardíaca. Se trata del llamado Péptido natriurético y nos permite saber con rapidez si se trata de una insuficiencia cardíaca o no. Valores elevados sugieren cierto grado de insuficiencia cardíaca y se asocia a peor pronóstico. Sus concentraciones en sangre están relacionadas con la gravedad de la insuficiencia cardíaca. Si los resultados son normales debe pensarse en otra posible causa de los síntomas, distinta de la insuficiencia cardíaca. Esta determinación sanguínea la utilizamos con frecuencia.
El estudio posterior del paciente dependerá de la orientación diagnóstica (respiratoria, cardíaca, ansiedad…). El tratamiento dependerá, obviamente, de la causa que los ha llevado a la disnea. En ocasiones, existe más de una causa que contribuye a la presencia de disnea, y ello debe ser tenido en cuenta a la hora de prescribir el tratamiento. No obstante, no podemos dudar en la conducta a seguir ante un caso de disnea aguda o crónica descompensada: ¡debemos acudir a urgencias!

Artículo especializado
¿Qué es el Herpes Zoster?
Conocido comúnmente como “culebrilla”, el herpes zóster es una infección de la piel causada por el virus varicela-zóster , un virus de la familia de los herpesvirus, similar por lo tanto al herpes simple que produce las “calenturas” en el labio. Son infecciones muy frecuentes y, aunque en la mayoría de los casos se resuelven sin secuelas, pueden comportar complicaciones en algunos pacientes. En el caso del zóster, la más importante es un dolor intenso y prolongado.
¿Cómo se produce?
El virus varicela-zóster se manifiesta en dos fases.
La primera es la varicela , una infección típica de niños, que hasta hace pocos años se debía pasar de forma natural, como otras enfermedades víricas muy conocidas (la rubeola, el sarampión, etc), hasta que se ha instaurado la vacuna en el calendario vacunal.
Tanto si se pasa de forma natural como con la vacuna (la vacuna consiste en realidad en administrar el virus más débil o atenuado), el virus queda latente o escondido en el organismo, y puede dar lugar al zóste r en una segunda fase en algún momento de la vida. Es decir, la enfermedad o la vacuna crean anticuerpos, pero estos no son capaces de neutralizar el virus completamente. Esta segunda fase, el zóster, consiste en una reactivación del mismo virus, sólo en un territorio de la piel, de forma unilateral Es, por lo tanto, como pasar una “ segunda varicela ” en una zona de la piel, con la diferencia de que en esta fase la enfermedad puede provocar como complicación un intenso dolor, y no sólo picor, como la varicela.
¿A quién afecta?
Puede aparecer a cualquier edad sobre cualquier persona que haya pasado la varicela o haya sido vacunada para esta enfermedad, ya que tiene el virus latente, y éste puede volver a crecer y viajar a la piel para producir los síntomas. En general, el zóster aparece a edades más avanzadas, a partir de los 60 años . También es típico que aparezca en situaciones de estrés o enfermedades que comportan “bajadas de defensas”, como una pulmonía o un tratamiento con quimioterapia para un cáncer.
Síntomas
La zona más frecuentemente afectada es la región torácica o lumbar, apareciendo las lesiones típicas sobre una franja en forma de cinturón que abarca desde la línea media del abdomen a la línea media de la espalda, es decir, sólo media circunferencia del cuerpo. Por ello, se le conoce comúnmente como “culebrilla”.
En la piel primero hay un intenso dolor o escozor , que puede parecer un esguince o un “tirón” de una costilla, o incluso puede simular el dolor de una angina de pecho, un fuerte golpe, o un infarto de miocardio.
En 24 o 48 horas aparece enrojecimiento , y granitos con líquido en su interior, agrupados sobre la zona, que duran una o dos semanas hasta que se van secando y formando costras.
Puede dejar cicatrices si ha sido muy intenso.
El zóster puede afectar a cualquier zona del cuerpo, incluso la cara, con una posible afectación del ojo que puede comportar gravedad y necesitar de la colaboración de un oftalmólogo para su correcto diagnóstico y tratamiento.
El síntoma más temido: la neuralgia postherpética
El virus provoca inflamación en los nervios de la piel , y una vez eliminado correctamente con tratamiento, ese dolor puede persistir semanas o meses, y necesita ser tratado para no interferir con la calidad de vida. La neuralgia postherpética aparece más cuanto más avanzada es la edad (en general por encima de los 70 años), cuanto más extenso es el zóster, o cuanto más debilitado este el paciente.
Puede ser un dolor muy intenso, continuo, que impide el sueño , como “un puñal clavado” o como “latigazos”. En otros casos, el dolor se describe más como quemazón o escozor . Como en el momento de presentarse la neuralgia, lo único que hay es inflamación en los nervios, deben administrarse tratamientos dirigidos a controlarla, y en general no está recomendado seguir administrando más antibióticos contra el virus (antivíricos). En muchos casos, el tratamiento de la neuralgia puede necesitar de la colaboración de un neurólogo (especialista en las enfermedades del sistema nervioso).
Diagnóstico
Cualquier médico entrenado, y por supuesto un dermatólogo, somos capaces de reconocer la clínica de un herpes zóster. En casos de duda, puede obtenerse líquido por raspado de los “granitos” de la piel, y realizarse una citología , que es una prueba rápida que puede confirmar la infección de las células por el virus. Si existen dudas sobre si el paciente ha pasado o no la varicela o ha sido vacunado, el médico puede pedir una prueba en sangre llamada “serología” para saber si el cuerpo ha producido anticuerpos para el virus, y si la infección es pasada o reciente.
En las primeras 24 o 48 horas, cuando sólo hay dolor y no se observa nada en la piel, puede ser difícil asegurar que se trata de un zóster. Cuando existe esa posibilidad, el médico puede dar tratamientos para el dolor, y dar una cita al paciente para el día siguiente para volver a explorar la piel. Esto es muy importante, porque el tratamiento para frenar al virus (con antivíricos) será más eficaz cuanto antes se inicie, en los primeros dos o tres días del comienzo del zóster.
Tratamiento
El tratamiento es sencillo si se diagnostica a tiempo, y se basa en el empleo de los antivíricos en pastillas. Estos son aciclovir, famciclovir o brivudina entre otros. Los antivíricos en pomada , como los que se dan para los herpes simples del labio, no son eficaces para el herpes zóster. El tratamiento suele durar una semana, y las dosis son diferentes para cada medicamento. El médico puede necesitar ajustar la dosis si el paciente es mayor, o diabético o tiene alguna enfermedad que haga que el riñón funcione mal.
El paciente debe aplicar en la piel alguna solución secante , como povidona o alcohol, para ayudar a secar las lesiones y que hagan costras lo más rápido posible.
En el caso de presentarse neuralgia, puede ser necesario dar analgésicos como paracetamol, metamizol o codeína, y en casos en los que no se controle, hay que recurrir a medicamentos más potentes como gabapentina o pregabalina. En casos muy invalidantes, con dolor que no responde a medicamentos, el paciente puede ser remitido por el dermatólogo o el neurólogo a una clínica del dolor, una consulta realizada habitualmente por anestesistas, para la administración de otros tratamientos.
Medidas preventivas
Si un paciente con herpes zóster está en contacto con personas que no hayan pasado la varicela, como niños muy pequeños, o mujeres embarazadas que pueden pasarle la infección al bebé, debe evitar tocarlas o compartir toallas u objetos que la puedan transmitir.
Por lo demás, no existe una manera de evitar el herpes zóster. La vacuna para la varicela, que se lleva administrando más de 10 años, no ha demostrado reducir de momento la incidencia del zóster.
Artículo especializado
Inmunoterapia Contra el Cáncer
¿Existe luz al final del túnel? La inmunoterapia puede ser la clave que nos ayude a ganar definitivamente la batalla en la lucha contra el cáncer.
La inmunoterapia es un tratamiento que ha aparecido en los últimos años como herramienta fundamental en el tratamiento de determinados tipos de cáncer . En pocos años, este tipo de tratamiento ha pasado a ser uno de los avances más importantes en la lucha contra el cáncer. Prueba de ello es que en el año 2013, la prestigiosa revisa Science designó a la inmunoterapia contra el cáncer “Revelación del año”.
¿Qué papel tiene el sistema inmune en el cáncer?
El tratamiento con inmunoterapia contra el cáncer se basa en la estimulación del sistema inmune para frenar o erradicar las células tumorales . Antes de proseguir, es muy importante conocer el papel que desempeña el sistema inmune frente al cáncer.
El sistema inmune (las defensas) es un sistema que tiene nuestro organismo para identificar y eliminar células que nuestro cuerpo identifica como extrañas (ajenas). Así pues, cuando sufre una infección por un virus o una bacteria, por ejemplo, el sistema inmunitario es capaz de identificar que esas células no son células propias y actúa contra ellas, destruyéndolas. Esta identificación la realiza mediante la identificación de las proteínas que presentan las células en sus membranas (sus paredes).
Como hemos comentado, las células tumorales son células de nuestro organismo que sufren una mutación que provoca que crezcan sin control. En muchas ocasiones, esa mutación provoca que aparezcan nuevas proteínas en la superficie celular y gracias a ello, el sistema inmune puede actuar contra ellas y eliminar el tumor o frenar su crecimiento. De hecho, el sistema inmune elimina muchas células que sufren mutaciones incluso antes de que lleguen a provocar tumores.
Gran parte de los cánceres están provocados por defectos en el sistema inmune , que deja de identificar a las células tumorales como células ajenas y deja de actuar sobre ellas.
¿Y cómo actúa la inmunoterapia?
La inmunoterapia es un tipo de tratamiento que intenta estimular al sistema inmune del organismo para que éste sea el encargado de luchar contra las enfermedades.
Tipos de inmunoterapia
Anticuerpos monoclonales : los anticuerpos son proteínas que produce el organismo para identificar y eliminar células nocivas (generalmente infecciones). Hoy en día, los avances científicos nos han permitido crear anticuerpos en un laboratorio. Esos anticuerpos pueden tener principalmente dos objetivos: unirse a las células tumorales como agentes extraños y facilitar que el sistema inmune del paciente identifique más fácilmente esas células o, por el contrario, unirse a las células tumorales bloqueando su funcionamiento y frenando de esa manera su reproducción y crecimiento.
Inmunoterapias no específicas (citoquinas): son tratamientos que mejoran el funcionamiento del sistema inmune del paciente. Ejemplos de ellos son las interleuquinas, que aumentan el crecimiento y la actividad de las células inmunitarias, o los interferones, que mejoran la respuesta inmunitaria contra el cáncer.
Vacunas: las vacunas clásicas ya eran un tipo de inmunoterapia. Cuando nos vacunamos frente a una infección, no estamos haciendo otra cosa que estimular al sistema inmune para que detecte y actúe rápidamente en caso de que se identifique un determinado virus o bacteria. Este tipo de estimulación también se puede utilizar en el tratamiento contra el cáncer. El objetivo de las vacunas contra el cáncer es que el organismo reconozca las células tumorales y las destruya antes de que estas lleguen a provocar una enfermedad.
Transferencia celular adoptiva: es un tipo de terapia en la que se extraen células del sistema inmune del paciente (glóbulos blancos -células T) que se modifican en un laboratorio para hacer que sean más efectivas en la detección y eliminación de un tipo de células cancerosas. Esas células se cultivan y multiplican en el laboratorio y se vuelven a introducir en el paciente de forma que puedan actuar contra su cáncer.
¿Cuándo se utiliza?
El tratamiento con inmunoterapia ha evolucionado mucho en los últimos años. Cada vez son más los estudios que buscan demostrar su eficacia para nuevos tipos de tumores. Aunque su uso no es tan extendido como el de las quimioterapias tradicionales, cada vez son más los tipos de tumores que pueden tratarse ya con este tipo de fármacos. Cánceres como el de pulmón, el melanoma, el cáncer de vejiga o el cáncer de cérvix son ejemplos en los que la eficacia de la inmunoterapia ya está totalmente comprobada.
¿Qué efectos secundarios puede presentar?
Tal y como el resto de tratamientos contra el cáncer, la inmunoterapia también puede ocasionar efectos secundarios no deseados. Estos efectos dependerán del tipo específico de inmunoterapia, pero los más frecuentes son síntomas similares a los de una gripe, debilidad, mareos, fatiga o problemas digestivos. Algunos tipos de inmunoterapias pueden favorecer la aparición de infecciones e incluso de otros tumores. En ocasiones, pueden producirse reacciones alérgicas al tratamiento (como a cualquier otro tratamiento), que pueden ser incluso graves.
Aunque pueda parecer que existen muchos efectos adversos, es importante valorarlos con su médico especialista, puesto que en general, el beneficio potencial de utilizar este tipo de fármacos es infinitamente superior.

Artículo especializado
Cómo Combatir la Candidiasis Oral en Bebés y Niños
La candidiasis oral o muguet está provocada por la levadura Candida albicans . Es un hongo que suele provocar síntomas por sobrecrecimiento, ya que forma parte de la flora normal de la boca y la zona genital. En bebés, se considera habitual que tengan muguet en algún momento de las primeras semanas de vida. Lo mismo ocurre en personas ancianas, diabéticas o debilitadas por la edad o los tratamientos que alteran las defensas.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
¿Cuándo es más frecuente?
Se observa muguet con mayor frecuencia entre el nacimiento y los seis meses de edad, es decir, en lactantes. Es más frecuente en los niños prematuros o en aquellos debilitados por alguna enfermedad. En condiciones normales la levadura Candida está en la boca del bebé formando parte de su flora, y su crecimiento se controla con un equilibrio con el resto de la flora . En situaciones de desequilibrio de la flora (disbiosis) es cuando la Candida crece y prolifera en exceso provocando las manifestaciones clínicas. Es frecuente que este desequilibrio aparezca de forma fisiológica, debido a la inmadurez del sistema inmunológico del bebé. También es frecuente tras tratamientos con antibióticos o corticoides, que acarrean una alteración del sistema inmunitario local. Puede ocurrir en la madre que está dando el pecho, afectando el pezón y la areola mamaria , y contagiando al niño durante la lactancia.
¿Qué aspecto tiene?
El muguet se manifiesta por placas blancas en la lengua, el paladar o la mucosa de las mejillas, con un aspecto que recuerda a la leche, el requesón o el yogur sin deglutir. Al intentar limpiarlas vemos que no se desprenden con facilidad, o que lo hacen dejando un fondo sangrante . Es frecuente que haya afectación también en las comisuras de los labios, o grietas y enrojecimiento alrededor de la boca. Si el bebé tiene una capa blanca en la lengua que se aclara y desprende fácilmente, lo más habitual es que sean en realidad restos de leche.
No es raro que el muguet oral se acompañe de candidiasis en la zona del pañal, otra zona donde típicamente puede producirse sobrecrecimiento de Candida.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
¿Cómo se trata?
En muchas ocasiones la infección es pasajera y cura sin tratamiento. A criterio del pediatra o el dermatólogo, se recetarán al niño soluciones o geles antifúngicos (generalmente miconazol o nistatina) que se aplicarán con suavidad en el interior de la boca afectada. Algunos pediatras añaden también suplementos de probióticos para mejorar la disbiosis, como los yogures que contienen lactobacilos.
¿Y cómo se previene?
Sólo en algunos casos es posible la prevención . Se trataría de candidiasis provocadas o empeoradas por contagio con el pezón infectado de la madre, o con objetos contaminados, como biberones, muñecos o chupetes, que deben siempre estar limpios y desinfectados . En el caso de una madre con los pezones afectados por candidiasis, debería interrumpir la lactancia materna hasta la curación, y aplicar una crema antifúngica .
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.

Artículo especializado
Qué Obtenemos con la Punción Lumbar
La punción lumbar es un procedimiento utilizado para obtener una muestra de líquido cefalorraquídeo (en adelante LCR) o barrera física que rodea al encéfalo y a la médula espinal. Entre las funciones del LCR está proteger al encéfalo y la médula de lesiones frente a los movimientos bruscos, transportar nutrientes, eliminar sustancias de desecho y ayudar a mantener la presión a un nivel constante dentro del cráneo.
Para realizar una punción lumbar es necesario tener firmado el consentimiento informado por parte del paciente en el que se le informa de forma detallada de la técnica a realizar y de sus posibles complicaciones. Es muy importante que el paciente sea conocedor, en todo momento, de lo que se le va a realizar, así como su finalidad. No olvidemos que una punción es una técnica invasiva que puede ocasionar no sólo incomodidad sino también pánico en aquellos pacientes con belonefobia (fobia a las agujas).
¿En qué casos indicamos una punción lumbar?
La indicación prínceps de una punción lumbar es la confirmación diagnóstica de una infección del sistema nervioso central , aunque también es útil en casos de hemorragia subaracnoidea, cáncer, enfermedades desmielinizantes y en la enfermedad de Guillen-Barré.
¿Cuándo realizamos una punción lumbar urgente?
Cuando sospechamos una infección grave del sistema nervioso central (meningitis o encefalitis). Los síntomas que nos harán sospechar son: fiebre, cefalea, vómitos y signos meníngeos (como rigidez de nunca). En el resto de casos se opta por la realización de un TAC craneal en primer lugar. Posteriormente, podemos realizar una punción lumbar para completar el estudio cuando ya disponemos de un diagnóstico por imagen, por ejemplo, en caso de una hidrocefalia o de una esclerosis múltiple.
Otra indicación de la punción lumbar sería la administración de determinados fármacos que deban actuar directamente en el sistema nervioso central (por ejemplo, antineoplásicos).
A pesar de que no existen contraindicaciones absolutas para la realización de una punción lumbar debemos tener especial precaución en algunos casos como pueden ser la existencia de signos inflamatorios o infecciosos en el lugar donde está prevista la inyección (podría suponer un foco de infección del LCR) o en caso de un paciente muy inestable o con alteración de la coagulación (podríamos provocarle un sangrado).
¿Cómo se realiza una punción lumbar?
Se debe realizar en condiciones de máxima asepsia, con material estéril, así como mascarilla y guantes . Normalmente, el paciente es colocado en posición fetal (de lado). Se infiltra un poco de anestesia en el lugar donde vamos a realizar la punción para minimizar las molestias en el paciente. Las agujas de punción lumbar pueden tener diferente calibre dependiendo de si son para adultos o para niños. Al obtener la muestra de LCR se colocará en un tubo estéril que será analizado en el laboratorio. Podemos extraer hasta 40 ml sin riesgo de complicaciones. Tras la punción retiramos la aguja y colocaremos un apósito estéril en la zona de la punción. El paciente deberá permanecer en posición supina (estirado boca arriba) durante unas y beber mucho líquido para facilitar su recuperación. Es muy importante advertir de la posible cefalea post-punción dado que aparece con relativa frecuencia.
¿Tienes curiosidad por saber en qué lugar realizamos la punción?
El lugar específico de punción es entre las vértebras lumbares L3 y L4 en adultos o entre L4 y L5 en niños [. . ¿Por qué a este nivel? Para minimizar el riesgo de lesión medular (en adultos la médula termina entre L1 y L2 y en niños entre L2 y L3).
Una vez que la muestra está en el tubo y antes de enviarla al laboratorio examinamos su aspecto macroscópico. En condiciones normales el LCR normal es claro como el agua y se vuelve turbio en las infecciones.
¿Quieres saber qué analizamos del LCR en el laboratorio?
Miramos el contenido celular, el nivel de glucosa (la concentración de glucosa en el LCR oscila entre 45-80 mg/dl, aproximadamente el 60-70% de la glucemia plasmática) y la concentración de proteínas , entre otras cosas.
Como dato curioso, decirte que en caso de meningitis el valor de glucosa en el LCR está disminuido y las proteínas aumentadas, aunque pueden existir otras posibles causas.
¿Tiene alguna complicación?
Como hemos adelantado, a pesar de que la PL es un procedimiento relativamente seguro, no está exento de complicaciones, aunque se extremen las precauciones . De entre las posibles complicaciones destaca, por su mayor frecuencia, la cefalea post-punción. Aparece entre el 10% y el 30% de los casos. Cursa con cefalea frontal y occipital que suele aparecer entre las 12 y las 24 horas de la punción. Su duración media es de unos cinco días. El dolor empeora de pie y mejora al estirarnos. Puede acompañarse de náuseas, vómitos y mareo. Su tratamiento es el reposo y los analgésicos por vía oral. Debe consultarse con el médico si no evoluciona favorablemente. Otras posibles complicaciones pueden ser una meningitis (poco frecuente), un sangrado o un dolor de tipo ciático.
A pesar de tratarse de un procedimiento mínimamente cruento, aporta una información médica relevante en pacientes con sospecha de patología del sistema nervioso central. Así, si no está contraindicada por algún motivo especial, es una prueba diagnóstica solicitada frecuentemente en el estudio de enfermedades neurológicas.

Artículo especializado
Cómo Saber si Tengo Sepsis
La sepsis o septicemia es una situación médica grave en la cual se produce una respuesta inmunitaria severa y fulminante ante una infección, independientemente de su origen. Puede aparecer de manera imprevisible y su evolución suele ser rápida, de ahí que suponga una emergencia médica. La gran mayoría de infecciones no van a acabar en una sepsis , pero antes los síntomas de mala evolución que describiremos es importante acudir cuanto antes a los servicios de emergencias más cercanos.
Cómo reacciona el cuerpo ante una infección
Ante la presencia de una infección, ya sea de origen bacteriano, vírico o fúngico (hongos), el organismo libera a la sangre una serie de sustancias químicas que forman parte del sistema inmunitario y cuya misión es ayudar a combatir la infección. Estas sustancias desencadenan una reacción inflamatoria generalizada en todo el organismo . Dicha reacción facilita que se formen coágulos en los vasos sanguíneos y que se puedan producir hemorragias a diferentes niveles. Estos sucesos hacen que la circulación sanguínea se vea alterada y los órganos se vean afectados, dado que se compromete el aporte de nutrientes y oxígeno a las células, lo cual puede causar daños severos e irreparables.
En los casos más graves de sepsis, se produce una insuficiencia de uno o más órganos . Suele ser una concatenación de lesiones que van haciendo que los órganos fallen y, en el peor de los casos, se da una disminución de la presión sanguínea y un descenso de la frecuencia cardíaca el paciente puede entrar en un estado de shock séptico. Rápidamente se ven afectados los riñones, los pulmones y/o el hígado y la situación puede llegar a ser mortal.
Causas de una sepsis
Existen diversos tipos de microorganismos que pueden causar sepsis, bacterias, hongos y virus ; con todo, las bacterias suelen ser los principales agentes infecciosos que pueden desencadenar un cuadro de sepsis. Es frecuente que sea difícil establecer cuál es el agente causante de la infección y, consiguientemente, de la sepsis.
Los casos más graves de sepsis suelen ser el resultado de una infección generalizada, de todo el organismo, que se disemina a través del torrente sanguíneo. Los principales focos de origen de una sepsis son:
Infección pulmonar.
Infección de las vías urinarias.
Infección cutánea.
Infección de la cavidad abdominal (apendicitis, peritonitis).
Manipulación de vasos sanguíneos (vías venosas periféricas o centrales, cateterismos).
Quiénes son más vulnerables
Afortunadamente, no todas las infecciones van a derivar en una sepsis (de hecho, la gran mayoría de infecciones se resuelven sin problema) ni todos los pacientes van a tener el mismo riesgo de padecer una sepsis. Aquellas p ersonas con mayor riesgo de sufrir una sepsis son :
Neonatos y niños.
Ancianos.
Diabéticos.
Inmunodeprimidos (pacientes con SIDA, pacientes oncológicos).
Insuficiencia hepática.
Insuficiencia renal.
Incidencia
En España se diagnostican unos 50.000 casos de sepsis cada año , es decir, unos 104 casos por cada 100.000 habitantes. De estos casos, 17.000 personas fallecen anualmente por culpa de una sepsis, más muertes que las debidas al cáncer de mama, de colon o de páncreas, así como 13 veces más que por accidentes de tráfico. La pronta instauración de un tratamiento es fundamental, dado que, tras cuatro horas de haberse instaurado un choque séptico, las probabilidades de supervivencia caen por debajo de un 50%. Asimismo, el coste económico aproximado por el tratamiento y la hospitalización de un paciente con sepsis es de unos 17.000 euros por persona.
A nivel mundial, cada año mueren ocho millones de personas por un cuadro de sepsis , y se diagnostican entre 20 y 30 millones de caso anualmente. En la última década el número de pacientes se ha duplicado y los estudios estiman que la tendencia será que el aumento prosiga. En los países en vías de desarrollo la sepsis es la causante de la muerte de 6 millones de recién nacidos.
El aumento de las cifras globales de casos de sepsis puede ser debido a un mayor y mejor registro de los casos, a la existencia de una población más longeva y con mayor prevalencia de patologías crónicas, a la mayor resistencia de las bacterias a antibióticos, así como un uso más habitual de tratamientos inmunosupresores, como en pacientes oncológicos o trasplantados.
Qué síntomas nos alertan
Los síntomas más habituales de una sepsis pueden ser:
Fiebre.
Escalofríos.
Respiración acelerada.
Taquicardia.
Palidez y sudoración.
Malestar general intenso o sensación de muerte.
Confusión, somnolencia, incoherencia.
Estos síntomas son frecuentes en otro tipo de afecciones, por lo cual la sepsis es difícil de diagnosticar , especialmente en sus etapas iniciales, y pese a existir un contexto de infección.
Al acudir a un centro de urgencias se realizarán diversas pruebas para valorar si existe una sepsis, entre ellas una analítica de sangre, alguna prueba de imagen (radiografía, escáner), cultivos de sangre y un estricto control de las constantes del paciente para monitorizar la frecuencia cardíaca, la tensión arterial, la frecuencia respiratoria y la saturación de oxígeno en sangre.
Tratamiento
En caso de establecer un diagnóstico de sepsis los pacientes, debido a su estado grave, suelen ser tratados en las unidades de cuidados intensivos (UCI), para poder tener al paciente más controlado y tomar medidas para mantener estables las constantes del paciente . El objetivo del tratamiento es acabar con la infección, preservar los órganos vitales y evitar una caída de la presión arterial que pueda precipitar el daño en otros órganos. El tratamiento suele ser con una cobertura antibiótica amplia y un correcto aporte de líquidos por vena. En casos graves puede ser preciso intubar al paciente, realizar diálisis o bien someter al paciente a una intervención quirúrgica.
Muchos pacientes que logran superar una sepsis se recuperan por completo , pero siempre dependerá del estado basal del paciente. Si son personas más añosas o con enfermedades crónicas, algunos órganos pueden presentar daños permanentes, como los riñones, el corazón o los pulmones. Los estudios también indican que el padecer una sepsis grave puede causar una alteración en el sistema inmunitario que haga que estas personas sean más proclives a padecer futuras infecciones.
Artículo especializado
Cómo Actuar ante un Shock Anafiláctico
Si has escuchado en algún momento que un shock anafiláctico es un cuadro clínico muy grave y quieres saber más acerca de lo que es y qué sucede a quienes lo sufre n, continúa leyendo…
En un Servicio de Urgencias podemos ver tres tipos de reacciones alérgicas agudas: la urticaria, el angioedema, y la más grave de ellas, la anafilaxia, que a su vez se subdivide en shock anafiláctico y reacciones anafilactoides. Aunque estas últimas (reacciones anafilactoides) se producen por mecanismos inmunitarios diferentes (no mediadas por IgE), pueden generar unos síntomas difíciles de distinguir respecto a los que aparecen en el curso de un shock anafiláctico.
¿Qué es?
Se define anafilaxia como “una reacción adversa de causa inmunológica desencadenada por el contacto del paciente, previamente sensibilizado, con diferentes agentes externos (medicamentos, alimentos, picaduras de insecto…). Es decir, debe existir una primera exposición previa al agente, donde se produzca la sensibilización del sujeto a la sustancia, y, en un segundo tiempo, en una segunda exposición, se puede producir la anafilaxia. Es un cuadro clínico posible en los adultos y también en pediatría.
¿SABÍAS QUE…?
La palabra anafilaxia fue introducida en la literatura médica por dos autores, Paul Portier y Charles Richet, en 1902. Ambos realizaron un crucero por el Mediterráneo, invitados por el Príncipe Alberto I, oceanógrafo y científico aficionado, que les animó a llevar a cabo un estudio de toxicidad del veneno de la anémona marina, por tener conocimiento de lo dolorosa que era su picadura. Al volver, inyectaron a perros toxina de anémona y observaron que uno de ellos, a los 22 días de la primera inyección y después de recibir la segunda dosis, presentó de inmediato un cuadro de shock, mortal en pocos minutos.
Cuáles son sus causas
Fármacos (antibióticos betalactámicos, tetracicilinas, vancomicina, sulfamidas, etc.).
Alimentos (huevo, leche, almejas, chocolate, frutos secos…)
Venenos de himenópteros (abejas, avispas, hormigas)
Látex.
Anafilaxia de causa física (inducida por el ejercicio físico, la exposición masiva al frío…)
Idiopática (sin causa aparente).
Otros.
Signos y síntomas
El comienzo de las reacciones anafilácticas es brusco , pocos minutos tras la exposición al agente, siendo la rapidez de aparición de los síntomas la indicativa de la gravedad: a menor tiempo de latencia, mayor gravedad.
La mayoría de las reacciones alérgicas suelen tener como síntoma predominante la afectación cutánea , pero lo que indica su pronóstico y puede ocasionar la muerte, en minutos, es la aparición de hipotensión o compromiso respiratorio, es decir, una reacción multisistémica aguda (generalizada).
A nivel cutáneo aparece la urticaria y/o angiodema en el lugar de exposición (boca, piel…) o angioedema en el tracto gastrointestinal después de la ingestión de ciertas comidas. Los síntomas de una reacción sistémica son :
Sensación febril y de enfermedad, mareo.
Sensación de plenitud en boca y garganta. Edema (hinchazón) de laringe o glotis y lengua. Estridor laríngeo (ruidos al respirar).
Congestión nasal y rinorrea (mucosidad líquida nasal).
Prurito (picor) generalizado.
Conjuntiva ocular congestiva (inflamada) y edema ocular (hinchazón).
Broncoespasmo, disnea (sensación subjetiva de falta de aire), tos y sibilancias (se oyen “pitos” al respirar).
Disfagia (dificultad para tragar), vómitos, dolor abdominal, diarrea (a veces sanguinolentas).
Ansiedad.
Y, ya en el nivel más grave, hipotensión arterial, taquicardia (aumento de frecuencia cardiaca), palpitaciones, arritmia o, incluso, infarto de miocardio.
El síndrome crónico de anafilaxia recurrente idiopática que, como se ha indicado, no presenta una causa aparente, se manifiesta en forma de urticaria o angioedema asociado a obstrucción grave de las vías respiratorias, disnea aguda o hipotensión que puede llegar al síncope (desmayo). Suele ocurrir en pacientes atópicos.
Se debe diferenciar la anafilaxia explicada hasta el momento del cuadro denominado angioedema hereditario, en el que hay historia de parientes fallecidos por causa no bien esclarecida. No es característico que se asocie con urticaria. La respuesta a los fármacos mencionados más abajo (adrenalina, corticoides y antihistamínicos) es pobre.
Tratamiento
El tratamiento va a depender de la severidad de la reacción , pero es una verdadera emergencia médica que requiere una atención inmediata y adecuada por parte del Médico de Urgencias, pues corre peligro la vida. Todo médico, con independencia de la especialidad a que habitualmente se dedique, debe estar preparado para hacer frente a esta situación. Es de vital importancia valorar, primero, el compromiso de la vía aérea, la respiración y la estabilidad hemodinámica (del aparato cardiovascular), obligando a realizar intubación traqueal si se sospecha edema de glotis (garganta hinchada) y canalización de vías sanguíneas para aporte de fluidos y medicamentos. Si se produce una parada cardiorespiratoria se iniciarán maniobras de RCP (reanimación cardiopulmonar).
El fármaco de elección en casos de anafilaxia es la adrenalina (tiene acción vasopresora y contrarresta farmacológicamente los efectos de los mediadores químicos que actúan sobre el músculo liso, los vasos sanguíneos y otros tejidos corporales).
El oxígeno se utilizará si hay disnea, cianosis (amoratamiento de labios) o sibilancias.
Los síntomas cutáneos de urticaria y angioedema moderado se tratarán con antihistamínicos y glucocorticoides.
Generalmente, si se utilizan corticoides por vía general (intravenosos o intramuscular) al inicio del cuadro, se debería continuar con una pauta corta y descendente de corticoides por vía oral.
Otros medicamentos que pueden ser utilizados son la dopamina endovenosa (vasopresor), broncodilatadores como el salbutamol (Ventolín®) inhalado, glucagón endovenoso (hormona)…
Prevención
Habrá que intentar identificar el agente causal mediante una historia clínica cuidadosa . Se informará de la conveniencia de evitar su contacto con el paciente. En caso de picadura de himenópteros es preciso el tratamiento desensibilizante. Otra forma de prevención es una correcta indicación de fármacos, utilizando preferentemente la vía oral, y, en caso de inyección, observando al paciente durante 30 minutos.
En caso de alergia, se recomienda llevar siempre información referente a la sensibilidad, y los pacientes predispuestos deben aprender a autoinyectarse la adrenalina subcutánea.
La corticoterapia de mantenimiento en los casos de anafilaxia idiopática maligna (con más de seis crisis al año) está indicada de forma profiláctica.
Pronóstico
Si tras los primeros cuidados médicos el paciente no mejora de su sintomatología, será trasladado a la UCI (Unidad de Cuidados Intensivos). Si mejora, se mantendrá en observación 8-12 horas y si en ese momento sigue manteniéndose estable, podrá ser dado de alta con antihistamínicos orales y corticoterapia durante tres o cuatro días.
En los niños la causa de la muerte, generalmente, es producida por el edema de glotis. En los adultos, en cambio, la causa de la muerte suele ser secundaria a la combinación de edema de laringe y arritmias cardiacas.
Dra. Gemma Cardona Médico consultor de Advance Medical
Contenidos sobre enfermedades
Somos conscientes de que los conceptos médicos pueden resultar confusos si no te los explican con claridad. Para evitar esto, le hemos pedido a nuestros profesionales que preparen estas fichas en donde podrás acceder a información relevante sobre enfermedades que te ayudará a entender de una manera sencilla por qué se producen y por qué es necesario su tratamiento.
Ver todas las enfemedades 
Enfermedad
Listeriosis
¿Qué es la listeriosis?
La listeriosis es una infección producida por la bacteria “listeria monocytogenes” presente en animales, es una zoonosis. Es una infección poco frecuente con una morbilidad de unos 30%, pero una mortalidad elevada en grupos de riesgo que puede llegar al 70%. En los casos de infección en recién nacidos la mortalidad ronda el 50%.
La listeria se puede adquirir a través de carnes, leche y monocytogenes de verduras contaminadas por animales enfermos, que no son correctamente tratadas, o también por aguas contaminadas.
¿Por qué se desarrolla la listeriosis?
La listeria se desarrolla por la contaminación de ciertos alimentos, entre ellos, la leche cruda y los quesos que con ella se fabrica, carne cruda o mal cocinada, verduras crudas, embutidos, paté.
La listeria se adquiere por vía gástrica, por la ingestión de estos productos contaminados , también por contacto con animales contaminados por esta bacteria en las granjas.
Estos productos contaminados por la “listeria monocytogenes” dan lugar al contagio en las personas . Las mujeres embarazadas que sufren la enfermedad pasan la misma a través de la placenta al feto, ya que, en la placenta, pueden aislarse listerias.
Causas de la listeriosis
La causa de la listeriosis es la infección por consumo de leche cruda o carnes mal preparadas , también se puede encontrar la listeria en ciertas verduras y en aguas contaminadas.
Las personas que ingieren la bacteria pueden desarrollar la enfermedad, siendo más sensibles a las mismas las personas mayores de 50 años , los inmunodeprimidos, las mujeres embarazadas, los fetos y los recién nacidos.
Síntomas de la listeriosis
La infección por la bacteria da lugar a una infección gastrointestinal , que puede estar acompañada de fiebre, en algunos casos, en especial en personas inmunodeprimidas, puede dar lugar a septicemia, en mujeres embarazadas la infección en el feto puede dar lugar a partos prematuros o muertes al nacer . Los bebés recién nacidos son más sensibles a la bacteria y pueden sufrir meningitis con mayor frecuencia.
En los casos de recién nacidos afectados en el momento del parto o cercano a él, pueden sufrir la muerte hasta en el 50% de los casos.
En las infecciones durante el primer trimestre de embarazo se suele producir un aborto .
En los adultos puede ocasionar gastroenteritis, neumonías, septicemia, meningitis y encefalitis.
Puede dar lugar también a letargo, pérdida de apetito, ictericia, dificultad respiratoria, vómitos, erupción cutánea y shock, son los síntomas más frecuentes en los recién nacidos afectados por esta bacteria.
Los niños que sobreviven tras una afectación fetal de la listeria pueden tener daños cerebrales y del sistema nervioso central a largo plazo asociados a retraso en el desarrollo, pudiendo dar lugar a minusvalías permanentes en estos niños.
Diagnóstico de la listeriosis
El diagnóstico de la listeria se debe hacer mediante la búsqueda de la bacteria en orina, en heces, en sangre, en el líquido cefalorraquídeo y, en mujeres embarazadas, se debe buscar en el líquido amniótico.
Prevención de la listeriosis
La prevención de la listeria pasa por el cocinado efectivo de las carnes y por un control de garantía de la zoonosis en animales, para que la bacteria no pueda contaminar los alimentos que se obtienen de estos.
Es necesario lavarse bien las manos después de manipular alimentos crudos o tocar animales de granja que puedan estar contaminados, y desinfectar los utensilios que se utilizan para manipular estos alimentos
Tratamiento de la listeriosis
El tratamiento de la listeria se realiza mediante antibióticos , entre ellos, el tratamiento más eficaz es la ampicilina y trimetopim sulfametoxazol.
¿Es contagiosa la listeriosis?
No, la listeriosis no es contagiosa persona a persona , solo se contagia por ingestión de leche cruda, carnes mal cocidas, embutidos y verduras o aguas contaminadas por la listeria.
Sin embargo , sí se produce una transmisión vertical de la madre al feto a través de la placenta.
Grupos de riesgo
Los grupos de riesgos para la listeria y su mortalidad son en primer lugar los adultos mayores de 50 años , siendo más peligrosa según aumenta la edad del paciente.
Pacientes inmunodeprimidos , como enfermos con tratamientos anticancerígenos, con tratamientos inmunosupresores y con tratamiento corticoideo y, también, pacientes con enfermedades crónicas como la diabetes.
El último grupo de riesgo son las mujeres embarazadas que, durante el primer trimestre de embarazo pueden sufrir un aborto, en casos más avanzados pueden sufrir un parto prematuro y, en la época próxima al parto, el feto puede infectarse tanto a nivel intraútero como en el momento del parto. Estos niños tienen un riesgo de mortalidad de hasta el 50% de los casos. Las madres que están embarazadas van a transmitir a través de su sangre la infección a la placenta, produciendo una corioamnionitis y, a través de esta, se va a transmitir la infección al feto.

Enfermedad
Embolia
¿Qué es la embolia?
La embolia es la obstrucción de un vaso sanguíneo por un trombo que se ha formado en otra parte del organismo , dando lugar a una falta de riesgo de la zona afectada. Las embolias pueden ser grasas, en este caso son secundarias a fracturas de huesos largos de gran tamaño, como puede ser el fémur, embolias de líquido amniótico como complicación del parto y, embolia ateromatosa, que es la más frecuente y se produce cuando una placa de ateroma se desprende dando lugar a una obstrucción en otra zona.
Tipos de embolia
Los tipos de embolia se pueden clasificar:
Según el lugar donde se produce: embolia arterial o venosa, conforme afecte a una arteria o una vena.
Según el órgano que afecte: embolia cerebral, embolia arterial cardiaca, o embolismo pulmonar.
Según la causa: embolia grasa, embolia de líquido amniótico o embolia ateromatosa.
Causas de la embolia
La causa de la embolia es la obstrucción de la vena o la arteria por un coágulo de sangre, una placa de ateroma u otros factores. Esta causa no se genera en la zona que se obstruye, sino en otra localización del cuerpo y, a través del torrente sanguíneo, se desplaza hasta obstruir una determinada zona.
Síntomas de la embolia
El síntoma de la embolia, cuando esta es arterial, son los derivados de la falta de riego sanguíneo que se produce en la zona. En las embolias cerebrales se producen los ictus con afectación diferente según la zona dañada, pero, en general, con una hemiparesia.
En el caso de embolias en una extremidad, se produce una cianosis (coloración azulada) de la zona afecta con un dolor intenso, que precisa retirar el émbolo lo antes posible para recuperar el riego sanguíneo y de esta forma recuperar la extremidad.
En los casos de embolias en arterias cardiacas, da lugar a un infarto de miocardio .
En las embolias pulmonares se produce una alteración en el riego sanguíneo pulmonar , lo que provoca una fatiga intensa y dolor en la zona torácica.
Las embolias venosas profundas producen un aumento de tamaño, enrojecimiento, dolor y presencia de un cordón venoso en la zona afectada.
Tratamiento de la embolia
El tratamiento de la embolia es la retirada o lisis del coágulo, para restituir el flujo sanguíneo necesario .
Se administran sustancias trombolíticas como la estreptoquinasa. También se puede realizar una embolectomía, extracción del coágulo por medio de una sonda que se introduce en la arteria afectada, tratando de disolver o extraer el émbolo. Además, se puede situar en la arteria un stent mediante una sonda. En algunos casos puede ser necesario realizar un by-pass, que es una técnica quirúrgica que realiza un nuevo recorrido para evitar la zona obstruida.
Como tratamiento preventivo posterior, puede ser conveniente el uso de tratamientos anticoagulantes o de fármacos que evitan la agregación plaquetaria, como es el caso del ácido acetilsalicílico a bajas dosis.
Pruebas complementarias de la embolia
Entre las pruebas complementarias a realizar se encuentran las pruebas de imagen de la zona afectada mediante TAC o angiografía , también se puede realizar eco-doppler.
Entre las pruebas analíticas está el dímero D, estudio del factor VIII y estudios de activación del plasminógeno.
Factores desencadenantes de la embolia
El factor desencadenante de la embolia es un coágulo de sangre o una embolia grasa o ateromatosa que obstruye una arteria .
Factores de riesgo de la embolia
Son factores de riesgo para una embolia la fibrilación auricular, la hipercoagulabilidad sanguínea (aumento del número de plaquetas), el parto en los casos de embolias por líquido amniótico y las fracturas de huesos largos como el fémur o húmero.
Complicaciones de la embolia
Las complicaciones de la embolia son el daño que se puede producir en la zona afectada por la falta de riego , dando lugar a una isquemia que puede concluir en la pérdida de la función del órgano o de una falta de él.
En los casos de embolias cerebrales puede quedar una hemiparesia, una afasia (alteración en el habla), en las embolias de arterias cardiacas un infarto de miocardio y, en las extremidades, puede llegar a producirse una gangrena del área afectado.
Prevención de la embolia
El control adecuado del colesterol, de la glucemia y de la hipertensión, junto con el tratamiento anticoagulante y antiagregante plaquetario, son las medidas preventivas más importantes.
Especialidades a las que pertenece
Las embolias son tratadas en la parte quirúrgica por cirugía vascular y, en la parte médica de control de factores de riesgo, por medicina de familia, donde el médico debe realizar un control exhaustivo de los mismos.
Preguntas frecuentes
¿Cuáles son los síntomas de la trombosis cerebral?
Los síntomas de la trombosis cerebral dependen de la zona afectada por la misma. Los más comunes son la hemiparesia de una zona del cuerpo, derecha o izquierda, puede asociarse o no a alteración del habla, lo que se conoce como afasia. En los casos de hemiparesia se suele asociar a desviación de la comisura bucal y dificultad en la movilidad del párpado, en otras ocasiones, si la afectación es a otro nivel, se puede producir alteración al tragar, lo que da lugar a atragantamientos frecuentes del paciente y, puede aparecer también, en forma de vértigo mantenido.
¿Qué diferencia hay entre un ictus y un derrame cerebral?
Realmente no hay diferencia entre ambas, es una forma más científica o más vulgar de denominar el daño neurológico a nivel cerebral, que se produce por una rotura de un vaso en cuyo caso se conoce como ictus o derrame hemorrágico o bien por obstrucción de un vaso conociéndose entonces como ictus por embolia .
¿Qué es lo que provoca una trombosis?
La trombosis se provoca por el cierre u obstrucción de una arteria o vena. Las causas más frecuentes son las placas de ateromas, seguida de coágulos de sangre que se producen en la mayoría de los casos como consecuencia de una fibrilación auricular.
¿Cuáles son los tipos de embolia?
Los tipos de embolia dependen de la causa del émbolo que lo produce.
Émbolos grasos cuando se forma por grasa, émbolos por coágulos sanguíneos o embolia de líquido amniótico .
¿Qué es un coma inducido y para qué sirve?
El coma inducido es la situación en la cual se procede a sedar de forma profunda al paciente , con el fin de reducir el consumo de oxígeno y otras sustancias por parte del cuerpo, permitiendo que el cerebro y el resto del organismo tengan una mejor recuperación.
Se usa en especial en los casos de traumatismos cerebrales, para que haya un menor consumo de oxígeno por parte del cerebro y este tenga una menor inflamación como respuesta al trauma, permitiendo una recuperación óptima del paciente.

Enfermedad
Trombosis
¿Qué es la trombosis?
La trombosis consiste en la coagulación y formación de un trombo de sangre en el interior de las venas o el corazón. Los trombos son depósitos intravasculares compuestos por fibrina, hematíes, plaquetas y leucocitos. La formación del trombo es la consecuencia del desequilibrio entre los diferentes mecanismos que intervienen en la trombogénesis . Al desprenderse parte del trombo, puede viajar por todo el torrente sanguíneo formando un émbolo.
Es un serio problema de salud pública en España, ya que presenta una mortalidad del 12% aproximadamente, con una alta incidencia de presentación en edades superiores a 65 años. Los esfuerzos están en la prevención, ya que es 100% prevenible .
Tipos de trombosis
Existen diferentes tipos de trombosis:
En relación al nivel de oclusión:
Ocluyente: cuando el vaso queda totalmente obstruido.
Mural: cuando la obstrucción del vaso es parcial.
En relación a la ubicación del trombo:
Trombosis de precipitación: producida principalmente en las arterias y el corazón, se basa en el desprendimiento de las plaquetas.
Trombosis por coagulación: se forma en las venas y es producida por una mezcla de fibrina y plaquetas.
Trombosis hialina: se crea en capilares, producida igualmente por fibrina y plaquetas.
Causas de la trombosis
La trombosis puede ser causada por múltiples factores:
Enlentecimiento del flujo de sangre, la causa más frecuente es la inmovilización del cuerpo.
Lesiones en la pared vascular causadas por heridas.
Aumento de la coagulación sanguínea.
Enfermedades neoplásicas que originan trombos.
Síntomas de la trombosis
Los síntomas de trombosis dependen de su localización, siendo las más frecuentes la trombosis venosa profunda, tromboflebitis y tromboembolismo pulmonar.
Trombosis venosa profunda: se caracteriza por dolor, aumento de volumen o hinchazón en el miembro afectado, acompañado de sensibilidad al tacto y enrojecimiento de la piel.
Tromboembolismo pulmonar: se presenta con dificultad para respirar, taquicardia, dolor torácico, hemoptisis (tos con sangre) e hipotensión arterial.
Tromboflebitis: es una trombosis en una vena superficial, prácticamente presenta los mismos síntomas de la trombosis venosa profunda pero además existe calor, sensibilidad y visualización del trayecto venoso inflamado.
Tratamiento de trombosis
El tratamiento es a base de anticoagulantes, que pueden ser vía oral como la warfarina o acenocumarol, por vía subcutánea, como las heparinas sódicas o heparinas de bajo peso molecular como hibor o clexane, o los nuevos anticoagulantes orales entre los cuales destacan dabigatrán (Pradaxa), rivaroxabán (xarelto), apixaban (eliquis) o edoxaban (lixiana).
La duración del tratamiento varía según la localización, profundidad de la trombosis y la historia clínica del paciente.
Existen otras modalidades terapéuticas como el tratamiento trombolítico o fibrinólisis, dirigida por un catéter hasta el sitio de la trombosis y, por último, el tratamiento quirúrgico, que consiste en la colocación de filtros o embolectomías cuando los trombos son muy grandes o aparecen en sitios complicados.
Pruebas complementarias de la trombosis
Entre las pruebas complementarias de la trombosis destacan:
Ecografía: se realiza sobre la zona en la que se sospecha trombosis, normalmente en miembros inferiores o superiores.
Análisis de sangre: se mide una sustancia denominada DÍMERO D, la cual se encuentra elevada en paciente con trombosis, sobretodo en tromboembolismo pulmonar. También, antes del inicio del tratamiento con anticoagulantes, es importante realizar pruebas de coagulación y en casos en donde se sospeche alteraciones en la coagulación por problemas hereditarios, los marcadores que el especialista considere necesario.
Tomografía computarizada o Resonancia magnética, para visualizar las venas, en ocasiones en 3D, y demostrar si tienen coágulos.
Factores desencadenantes de la trombosis
Los factores desencadenantes suelen ser los siguientes:
Enlentecimiento de la circulación sanguínea.
Daño en el endotelio (capa interna) de los vasos sanguíneos.
Hipercoagulabilidad, es la mayor tendencia a formar coágulos.
Factores de riesgo de la trombosis
Son múltiples los factores de riesgo y, en ocasiones, los pacientes presentan más de uno de ellos:
Trastornos de la coagulación hereditarios, lo que hace que la persona propensa al presentar otro factor de riesgo puede aumentar su incidencia de presentación, en ocasiones por si solas no producen trombosis.
Reposo prolongado, al no ayudar la musculatura a la circulación sanguínea.
Heridas o cirugías asociadas a procesos de cicatrización y activación de los factores de coagulación.
Medicación hormonal, las píldoras anticonceptivas y la terapia de reemplazo hormonal favorecen en el organismo una activación del sistema de la coagulación, que puede propiciar una trombosis.
Obesidad, el aumento del tejido lipídico conduce a un estado pro inflamatorio en el cuerpo con activación del sistema procoagulante, además del aumento de la presión en las venas de pelvis y piernas.
Fumar, la nicotina es una sustancia procoagulante que afecta sobretodo a pacientes que ya tienen algún otro factor de riesgo.
Neoplasias, ciertos tipos de cáncer como el de ovario o vejiga, excretan sustancias procoagulantes que pueden producir trombosis. Del mismo modo, el tratamiento con quimioterapia puede producir riesgo de trombosis.
Insuficiencia cardiaca, el estasis venoso, la función cardiaca y pulmonar limitada hacen que este tipo de pacientes sean más propensos a sufrir trombos a nivel pulmonar.
Enfermedad inflamatoria intestinal, enfermedades como la colitis ulcerosa y la enfermedad de Crohn con componente hereditario, al crear un estado inflamatorio, activan el sistema de coagulación produciendo trombosis sobre todo en el área intestinal y pulmonar.
Edad, se ha evidenciado un aumento significativo de la incidencia de trombosis a partir de los 60 años.
Complicaciones de la trombosis
La complicación con mayor mortalidad es la embolia, esta es la migración del trombo al torrente sanguíneo, pudiendo llegar a los pulmones, cerebro o corazón. Otra complicación muy severa es la sepsis (infección generalizada) que se origina cuando las bacterias colonizan el coágulo y este se transforma en un émbolo circulando por todo el torrente sanguíneo .
Prevención de la trombosis
La trombosis es una enfermedad que se puede evitar si se realizan las siguientes medidas de prevención:
Uso de medias de compresión para acelerar el flujo sanguíneo en los vasos profundos de las extremidades inferiores.
Caminar o realizar ejercicios moderados con las piernas.
No fumar.
Evitar estar sentado por tiempo prolongado, como por ejemplo durante viajes en avión o coche, realizando pequeñas paradas con recorridos para evitar el estasis sanguíneo.
Ingerir la medicación que el médico indique para evitar la hipercoagulabilidad.
Si se tiene reposo en cama, es importante mover las extremidades.
Especialidades a las que pertenece
Las especialidades a las que pertenece la trombosis son angiología y cirugía vascular, también medicina interna y, en ocasiones, hematología.
Preguntas frecuentes
¿Qué produce la trombosis?
La trombosis se produce por un aumento en la tendencia a formar coágulos y estos a su vez pueden migrar a diversas partes del cuerpo.
¿Qué es una tromboflebitis en la pierna?
La tromboflebitis en la pierna es un proceso inflamatorio en una vena superficial que hace que se formen coágulos.
¿Cuál es la vitamina k y para qué sirve?
Es una vitamina soluble que desempeña un papel importante en la coagulación, formación de huesos y prevención de una enfermedad cardiaca. En la coagulación, la vitamina K es fundamental para la síntesis de varios factores de la cascada de la coagulación. Algunos de los medicamentos que se utilizan como anticoagulantes orales, como la warfarina y el acenocumarol, son antagonistas de la vitamina K, por tanto, si se consume, puede haber variabilidad en la dosis respuesta del medicamento.
¿Qué es la tromboflebitis?
La tromboflebitis es un proceso inflamatorio de una vena superficial en la que se produce trombosis a nivel de una o más venas.
¿Qué es el signo de Homans?
Es un signo clínico para el diagnóstico de trombosis venosa profunda y consiste en la aparición de dolor en la pantorrilla cuando se hace dorsiflexión del pie en pacientes con trombosis.

Enfermedad
Pancreatitis
¿Qué es la pancreatitis?
La pancreatitis es un proceso inflamatorio de la glándula pancreática (páncreas), de gran tamaño. Se ubica detrás del estómago y se encarga de fabricar jugos digestivos o enzimas que ayudan a descomponer los alimentos en la parte superior del duodeno o intestino delgado. El páncreas también es el encargado de producir insulina y glucagón, dos hormonas que ayudan a controlar los niveles de azúcar en sangre y que constituyen la principal fuente de energía del organismo. La pancreatitis se desencadena por la activación inapropiada de las enzimas pancreáticas, resultado de una autodigestión del páncreas. La inflamación puede ser súbita (aguda) o progresiva (crónica). Es más frecuente en hombres que en mujeres y suele aparecer entre los 30 y los 60 años. Es una enfermedad grave. Los casos leves de pancreatitis pueden desaparecer sin tratamiento , pero los casos graves pueden causar complicaciones potencialmente mortales.
Tipos de pancreatitis
Existen dos tipos de pancreatitis:
Pancreatitis aguda : es un proceso inflamatorio agudo del páncreas con afectación variable de otros tejidos próximos y de órganos distantes, que se se produce generalmente por los cálculos biliares (piedras en la vesícula biliar) o a un consumo excesivo de alcohol, fenómenos que pueden provocar una autodigestión del páncreas por las enzimas que produce. Tiene pocos días de duración.
Pancreatitis crónica : es un proceso inflamatorio persistente (crónico) del parénquima y/o sistema ductal del páncreas, que tiene como consecuencia fibrosis y compromiso de sus funciones. Se debe generalmente a una repetición de la pancreatitis aguda. La ingesta prolongada y excesiva de alcohol también puede ser la causa de la pancreatitis crónica.
Causas de la pancreatitis
La pancreatitis tiene lugar cuando las enzimas digestivas se activan mientras están en el páncreas, lo que irrita las células del páncreas y provoca inflamación. Cuando el páncreas funciona normalmente, las enzimas que segrega no se vuelven activas hasta alcanzar el duodeno. Pero, cuando el páncreas está inflamado, las enzimas se activan precozmente (mientras todavía están dentro del páncreas) y empiezan a atacar sus estructuras internas. El tejido que recubre el interior del páncreas , encargado de fabricar enzimas, se lesiona debido a la actividad enzimática y, por lo tanto, deja de producir nuevas enzimas.
Las causas principales de la pancreatitis en más de un 80% de los casos están provocadas por cálculos (piedras) biliares inadvertidas y el abuso del alcohol. Otras causas menos frecuentes son la genética, los traumatismos, o el consumo de algunos medicamentos, drogas o toxinas. Otro motivo es cualquier tumor o inflamación que obstruya el conducto que drena el páncreas.
Síntomas de la pancreatitis
Los síntomas de la pancreatitis incluyen: dolor en la zona abdominal superior , dolor abdominal que se extiende a la espalda, taquicardia, dolor abdominal que empeora después de comer, náuseas, fiebre, dolor con la palpación al tocarse el abdomen, vómitos, pérdida de peso de forma involuntaria, sangrado pancreático, que se manifiesta en manchas cutáneas similares a moratones en los costados o cerca del ombligo y heces de aspecto aceitoso y mal olor.
Tratamiento para la pancreatitis
En los dos tipos de pancreatitis, no hay un tratamiento curativo . El de la pancreatitis aguda se enfoca en “dejar descansar” el páncreas mediante una dieta absoluta (no tomar nada) entre 2 y 4 días. Esto suele implicar la colocación de sonda nasogástrica y la administración de analgésicos intravenosos e hidratación por vena. En la pancreatitis crónica, el tratamiento es analgésico y se administran fármacos que ayuden a que las enzimas pancreáticas realicen adecuadamente su función. Hay que tener en cuenta que, en estos casos, con cada brote habrá más daños que irán limitando el funcionamiento del páncreas.
Pruebas complementarias del tratamiento de la pancreatitis
Para el diagnóstico y tratamiento de la pancreatitis es necesario realizar pruebas como: análisis de sangre para detectar niveles elevados de enzimas pancreáticas, tomografía computarizada para detectar cálculos biliares, ecografía abdominal para detectar cálculos biliares e inflamación del páncreas , o resonancia magnética para detectar anomalías en la vesícula, el páncreas y los conductos.
Factores desencadenantes de la pancreatitis
No se conoce un factor específico que pueda desencadenar este trastorno.
Factores de riesgo de la pancreatitis
Entre los factores que aumentan el riesgo de tener pancreatitis están: alcoholismo, cálculos biliares, ciertos medicamentos, fibrosis quística, antecedentes familiares de pancreatitis, niveles altos de calcio en la sangre, niveles altos de triglicéridos en la sangre , cáncer de páncreas, tabaquismo, sobrepeso y obesidad.
Complicaciones de la pancreatitis
Las complicaciones de la pancreatitis incluyen:
Pseudoquistes.
Insuficiencia renal .
Problemas respiratorios .
Diabetes.
Desnutrición.
Cáncer de páncreas .
Prevención de la pancreatitis
Para prevenir la pancreatitis es necesario:
Evitar el sobrepeso .
No tomar alcohol .
Evitar el consumo de tabaco .
Especialidades a las que pertenece la pancreatitis
La pancreatitis pertenece a la especialidad de gastroenterología. La gastroenterología es la parte de la medicina que se ocupa del estómago y los intestinos y sus enfermedades, así como del resto de los órganos del aparato digestivo.
Preguntas frecuentes
¿Cuál es la función del páncreas?
El páncreas es el encargado de fabricar jugos digestivos o enzimas, que ayudan a descomponer los alimentos en la parte superior del intestino delgado. El páncreas también es el encargado de producir insulina y glucagón, dos hormonas que ayudan a controlar los niveles de azúcar en sangre, la principal fuente de energía del organismo.
¿Por qué se inflama el bazo?
El bazo se puede inflamar debido a muchas enfermedades , como infecciones, enfermedad hepática y algunos tipos de cáncer que pueden causar un aumento de tamaño del bazo.
¿Cuál es la función del bazo?
El bazo forma parte del sistema linfático , que combate las infecciones y mantiene el equilibrio de los líquidos del cuerpo. Contiene los glóbulos blancos que luchan contra los gérmenes. El bazo también ayuda a controlar la cantidad de sangre del organismo y destruye las células envejecidas y dañadas.
¿Qué pasa si se rompe el bazo?
Al romperse el bazo se produce un sangrado de este órgano, con lo consiguiente se produce una hemorragia interna. En algunas ocasiones, en el momento del traumatismo puede no ocurrir una rotura completa del bazo, si no una laceración o una rotura pequeña que produzca un pequeño sangrado. Existen otras causas de rotura de bazo aparte del traumatismo; esto puede ocurrir en enfermedades que produzcan una inflamación importante del bazo, de manera que se rompa la membrana que lo rodea, y por consiguiente aparece su hemorragia.
Artículos por especialidad
CertificadosAlergologíaAnatomía PatológicaAnestesiología y ReanimaciónAngiología y Cirugía VascularAnálisis ClínicosAparato DigestivoCardiologíaChequeosCirugía General y del Aparato DigestivoCirugía General y del Aparato Digestivo PediátricaCirugía Oral y MaxilofacialCirugía Ortopédica y TraumatologíaCirugía Ortopédica y Traumatología PediátricaCirugía PediátricaCirugía Plástica y ReparadoraCirugía TorácicaClínica u HospitalDermatología Médico-Quirúrgica y VenereologíaEndocrinología y NutriciónEnfermeríaFisioterapiaGenética HumanaGinecología y ObstetriciaInmunologíaLogopedia y FoniatríaMedicina Estética y Unidad LaserMedicina Física y RehabilitaciónMedicina GeneralMedicina InternaMedicina NuclearMedicina del DeporteNefrologíaNeumologíaNeurocirugíaNeurofisiología ClínicaNeurologíaNutrición y DietéticaOdontología y EstomatologíaOftalmologíaOncología MédicaOncología RadioterápicaOsteopatíaOtorrinolaringologíaPediatríaPodologíaPoliclínicasPreparación al PartoPsicologíaPsiquiatríaRadiodiagnóstico-Diagnóstico Por ImagenReumatologíaTricologíaUnidad del DolorUrgencias HospitalariasUrología
Todas las especialidades  Savia
Savia