Oncología Médica
La especialidadArtículos especializados
Enfermedades
Síntomas
Otros contenidos

Artículo especializado
Xantelasmas: Causas y Tratamientos
Posiblemente se les conoce popularmente como «las bolsitas amarillas de colesterol que aparecen en las personas mayores alrededor de los ojos». Como veremos, no sólo son «bolsitas de colesterol» y no siempre aparecen en la gente mayor .
Qué son
Los xantelasmas son efectivamente unas pápulas o placas planas, de color amarillento y consistencia blanda, que contienen una acumulación de células llamadas histiocitos, cargadas de diversas sustancias grasas, entre ellas, colesterol. Pueden aparecer como resultado del envejecimiento o también en personas relativamente jóvenes. La zona donde más frecuentemente se ven es en el borde interno del párpado superior. Pueden llegar a abarcar áreas más grandes, casi siempre alrededor del ojo , pero también otras zonas de la cara. Son algo más frecuentes en las mujeres que en los hombres.
Las personas con xantelasmas ¿tienen el colesterol alto?
Es una pregunta frecuente. La realidad es que aproximadamente una tercera parte de las personas que tienen xantelasmas tiene un colesterol por encima del considerado sano. Otras tienen una proporción baja de «colesterol bueno» (el llamado colesterol HDL) o los triglicéridos altos. Esto puede venir causado por una dieta inadecuada, o por trastornos genéticos del metabolismo de las grasas denominados hiperlipidemias. El médico encargado de diagnosticar estos trastornos es el médico de familia o, en casos complejos, el endocrinólogo .
Entonces, ¿si tengo xantelasmas debo acudir al médico y hacerme un análisis de sangre?
Es conveniente, y en especial si se trata de una persona joven, de menos de 40 años de edad, y con antecedentes familiares de colesterol alto, o historia de muerte súbita por infarto o ictus en algún miembro de la familia. Tener el colesterol u otros lípidos altos es un factor de riesgo de enfermedad cardiovascular , y hoy día existen tratamientos muy eficaces y seguros para ello.
¿Pueden asociarse con otras enfermedades?
Además de con la hipercolesterolemia, los xantelasmas pueden asociarse con la diabetes y con la cirrosis biliar (una enfermedad que afecta a las vías biliares), pero con menor frecuencia.
¿Tener xantelasmas se asocia entonces con el infarto o el ictus?
Algunos estudios han demostrado que tener xantelasmas, sobre todo a una edad temprana (antes de los 40 años), se asocia con una mayor probabilidad de sufrir aterosclerosis, infarto de miocardio o ictus. Esta relación es independiente de tener el colesterol o los triglicéridos altos, por lo que las personas con xantelasmas deberían visitarse regularmente en el médico, seguir una dieta sana, controlar su colesterol (con dieta o con medicación) hacer ejercicio físico de forma moderada y regular, y no fumar.
Desde el punto de vista estético, ¿tienen tratamiento?
Los xantelasmas se pueden tratar con métodos ablativos como la crioterapia (congelarlos con aparatos que emplean el nitrógeno líquido), el láser, el peeling químico o incluso con cirugía, extirpándolos. Sin embargo, la norma es que vuelvan a aparecer en más de la mitad de los casos cuando pasa un tiempo. La recidiva suele ser más frecuente en las personas que tienen un mal control de su hiperlipidemia.

Artículo especializado
Chequeo Preventivo Oncológico
Hoy en día, una parte importante de nuestro trabajo asistencial como médicos es el de la medicina preventiva, fomentando hábitos de vida saludables, como la dieta y la actividad física, y realizando en ocasiones pruebas de detección precoz en casos necesarios para poder prevenir enfermedades potencialmente graves o mortales. Algunas de estas enfermedades tienen un comienzo insidioso, con un periodo de tiempo prolongado durante el cual la persona permanece completamente asintomática, pese a que en su organismo ya se hayan producido cambios a nivel celular.
Es en estas ocasiones y en casos particulares en los que vale la pena llevar a cabo algunas pruebas que permitan detectar estas enfermedades en sus primeros estadios para poder tratarlas de inmediato. En el caso de las enfermedades oncológicas, este cribado preventivo puede ser de vital importancia, no para la población general, pero si en determinados pacientes en concreto.
No para todos los tipos de cáncer
Desde un punto de vista sanitario no es factible ni eficiente realizar un cribado de todos los posibles tipos de cáncer a toda la población sana. Para que la relación coste-beneficio sea tal que haga pertinente dicho cribado, la enfermedad tiene que cumplir una serie de requisitos:
Que sea una causa habitual de morbilidad y mortalidad.
Que sea detectable y tratable en un estadio temprano, cuando el paciente permanece asintomático.
Que se disponga de pruebas diagnósticas efectivas y eficaces.
Que la aplicación de un tratamiento temprano resulte mejor que el tratamiento en la fase manifiesta de la enfermedad.
Y que el daño potencial de la intervención sea menor que el del tratamiento no precoz.
Así pues, no se puede realizar un cribado poblacional de todos los tipos de cáncer porque eso sería inviable desde un punto de vista económico y porque muchos de estos tipos de tumores, pese a su potencial gravedad para la vida de los pacientes, no cumplen los requisitos mencionados. Por ejemplo, no sería ético realizar un cribado oncológico para un tumor concreto para el que no se dispone de un tratamiento o intervención que frene o trate dicho cáncer, sometiendo a la persona sana a un estado de estrés o angustia innecesario.
Programas de detección precoz
Sin embargo, en algunos casos sí que disponemos de programas sanitario de detección precoz de ciertos tipos de cáncer que cumplen los criterios mencionados anteriormente y en los cuales intervención precoz permite disminuir la morbilidad y la mortalidad de estas enfermedades oncológicas, lo cual, a su vez, permite reducir los costes sanitarios. Algunos de estos programas son:
Cribado del cáncer de mama mediante mamografías periódicas.
Cribado del cáncer de cuello de útero mediante las citologías anuales.
Cribado de pacientes con pólipos intestinales para detectar su malignización precoz.
Cribado de cáncer de colon y recto mediante detección de sangre oculta en heces (en estudio).
Las pruebas a realizar tienen que ser altamente sensibles y específicas, cómodas, que no supongan un coste elevado y que los médicos podamos interpretarlas con facilidad. Las ventajas de la detección precoz son muchas, ya que se reduce la tasa de mortalidad de estos tumores, aumenta la posibilidad de éxito de los tratamientos oncológicos, disminuyen las complicaciones y secuelas tanto de la enfermedad per se como de los propios tratamientos, y se recorta el coste asistencial al sistema sanitario.
Herencia
En algunos casos, algunos cánceres, como ciertos tipos de cáncer de colon, de mama o de ovario pueden tener un componente hereditario familiar relevante. En pacientes con familiares directos que hayan sufrido alguno de estos tipos de cáncer puede ser necesario y útil, siempre bajo supervisión médica, hacer algunas pruebas genéticas para detectar la presencia de los genes implicados en este tipo de tumores y, en caso positivo, realizar pruebas de cribado para esos cánceres.
¿Inconvenientes del diagnóstico precoz?
Con todo, el diagnóstico precoz de las enfermedades oncológicas no está exento de ciertos inconvenientes, como son la detección de falsos positivos (resultado positivo de la prueba sin que la persona esté enferma) o falsos negativos (resultado negativo de la prueba cuando la persona está realmente enferma), con las consecuencias anímicas y de salud que esto conlleva. Estas limitaciones dependen de las pruebas empleadas para la detección precoz del cáncer. Un falso positivo implicará llevar a cabo toda una serie de pruebas para confirmar el diagnóstico, con la carga emocional, física y económica que eso conlleva, mientras que un falso negativo supondrá que se perderá la oportunidad de tratar a una persona en estadios precoces de una enfermedad, con el consiguiente riesgo de que esta enfermedad progrese y luego no pueda tratarse o suponga un coste más elevado tanto para la salud del paciente como para el sistema de salud.
Algunas voces ponen en tela de juicio la utilidad de ciertas medidas de detección precoz, como es el caso de la valoración del PSA para detectar de manera precoz el cáncer de próstata. En ocasiones se diagnostican cánceres de próstata sin que se vaya a llevar a cabo ningún tratamiento activo y cuya evolución natural no va a acortar la vida del paciente. Sí es útil, no obstante, que a partir de los 40 años los hombres nos sometamos anualmente a un tacto rectal para poder palpar anomalías en la próstata, una exploración que conlleva un coste prácticamente nulo.
En conclusión
La detección precoz es una herramienta útil para luchar contra el cáncer y mejorar la salud de las personas desde un punto de vista global, pero no se puede ni se deben realizar pruebas para detectar todos y cada uno de los cánceres que existen y en todas las personas, sino en casos determinados y bajo la valoración de los profesionales de la salud.
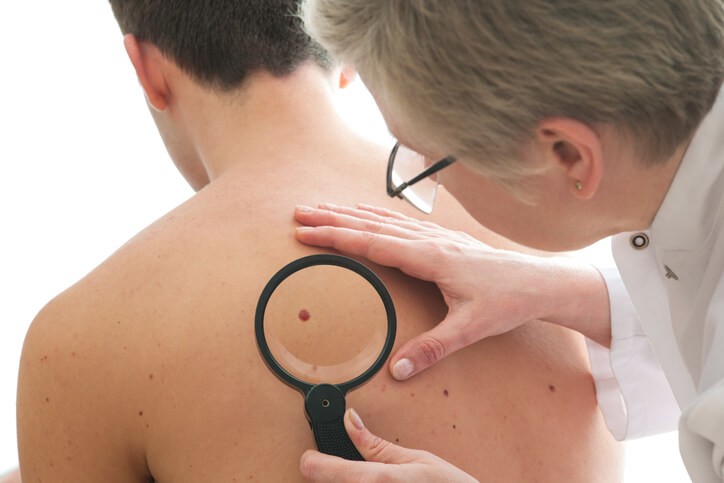
Artículo especializado
Melanoma Metastásico
El melanoma es un cáncer causado por el crecimiento incontrolado de unas células de la piel llamadas melanocitos , que son las encargadas de dar el color a la misma, produciendo la melanina. Se ha descubierto que la causa principal del melanoma es la exposición incontrolada al sol en las pieles muy claras. Se suele manifestar por una peca irregular, con diferentes colores, y de crecimiento rápido. Es un cáncer que puede afectar a gente joven, y es crítico diagnosticarlo pronto, antes de que se haya extendido, ya que provoca una alta mortalidad.
¿De qué depende que un melanoma se extienda por el cuerpo dando metástasis?
Aunque el comportamiento del melanoma es muy impredecible, en general distinguimos los melanomas “ finos ”, que no llegan a invadir en profundidad la dermis, de los “ gruesos ”, que descienden en profundidad a la dermis. Los primeros suelen tener buen pronóstico, y solamente extirpándolos con un margen de seguridad adecuado el paciente está curado. En cambio, los segundos pueden haber diseminado sus células a los ganglios linfáticos, a la sangre o a otros órganos en el momento de ser operados, con lo cual el paciente ya tiene una enfermedad a distancia que hay que detectar y tratar. En la actualidad, se considera que un melanoma es grueso y tiene peor pronóstico cuando la invasión de la dermis (el llamado “índice de Breslow”) es de más de 0,75 mm . No se puede saber la profundidad de un melanoma hasta que no es extirpado y analizado al microscopio.
Si el melanoma se extiende, ¿hacia dónde lo hace?, ¿y cómo se puede saber?
Se considera que el melanoma es un tipo de cáncer que puede extenderse tanto a través del sistema linfático como por la sangre, o por la piel próxima, por lo que puede dar metástasis en la misma piel, en los ganglios y en otros órganos, como el cerebro o el pulmón. Cuando un melanoma es extirpado y la biopsia informa de un grosor elevado, habitualmente se realiza la técnica del “ganglio centinela ”. Se inyecta una sustancia radiactiva o un tinte en la zona del tumor. Esta fluye a través de los conductos linfáticos hasta el ganglio o los ganglios linfáticos centinela (el primer ganglio o ganglios linfáticos hasta donde es probable que el cáncer se disemine). Se extraen sólo aquellos ganglios marcados con la sustancia radiactiva o tinte. Se observa al microscopio para ver si hay células cancerosas.
Además, en los melanomas metastásicos se emplean para el estudio de la extensión del tumor pruebas como la TEP (tomografía de emisión de positrones) o TC (tomografía computerizada).
De cara al abordaje del melanoma diseminado o metastásico, ¿qué lo hace diferente a otros cánceres?
El melanoma es un tumor que habitualmente es poco sensible a la radioterapia y la quimioterapia convencionales, y se hace muy rápidamente resistente a los tratamientos, por lo que hay que seguir otras estrategias, en concreto tratamientos que hoy el día están basados en la inmunoterapia y la terapia dirigida.
¿Qué es la inmunoterapia?
Consiste en modular al sistema inmunitario para que luche contra las células del tumor. En la actualidad contamos con dos tipos de medicamentos: los anti-PD1 y los anti-CTLA4 . Otros fármacos que se usan contra el melanoma metastásico de esta manera son el interferón y la interleuquina-2 . Muchos otros medicamentos que actúan mediante estas u otras vías están en estudio, así como vacunas anti-melanoma.
¿Y la terapia dirigida?
En este momento podemos saber la genética de las células del melanoma en cada paciente, mediante un análisis de ciertas mutaciones. Si el melanoma presenta una mutación de un gen llamado BRAF , podemos emplear medicamentos que inhiben las señales que este gen envía a la célula para hacerla crecer. Este tipo de tratamiento es muy ventajoso , ya que sólo frena el crecimiento de las células malignas que nos interesan, sin dañar al resto de las células del cuerpo, como la quimioterapia o la radioterapia tradicionales. Existen ensayos clínicos en marcha buscando más mutaciones y medicamentos de este tipo.
¿Qué efectos secundarios tienen estas terapias?
Los efectos secundarios existen, pero no son similares a los que produce la quimioterapia tradicional, como la caída del pelo o las infecciones. En cambio, estos tratamientos pueden provocar reacciones de tipo inmunológico, como colitis o problemas neurológicos .
¿Hay otros medios para luchar contra las metástasis
Efectivamente, hay más opciones de tratamiento. Cuando las metástasis son abordables, se pueden extirpar por cirugía convencional o tratarse con radioterapia. En algunos casos también se emplea la quimioterapia tradicional.

Artículo especializado
¿Cómo Ayudar a una Persona con Cáncer?
El cáncer es la epidemia del mundo actual. Afecta a todas las edades, niveles socio-económicos y etnias. Se estima que más de 32 millones de personas en todo el mundo tiene cáncer. No obstante, no sólo quienes lo padecen son los “afectados”. También la familia, amigos y otras personas del entorno cercano sufren el diagnóstico, por lo que la repercusión de la enfermedad es devastadora.
No es fácil, pero se puede
Los familiares y amigos quieren ayudar a la persona con cáncer, pero a veces no saben cómo. Pueden cambiar de tema porque temen meter la pata e incomodar a la persona, pueden no saber cómo enfocar la conversación quedándose en silencio, pueden sentirse fuera de lugar, etc. Se necesitan herramientas para ayudar.
A pesar de la palabra cáncer genera emociones muy negativas, es importante contrarrestarlas con esperanza . Cada vez se detecta la enfermedad en etapas más iniciales, por lo que suele ser más fácil de tratar. También cabe recordar que hoy en día, la mayoría de casos de cáncer son tratables y las investigaciones avanzan a pasos agigantados.
¿Qué significa el diagnóstico?
Cada persona es un mundo y entiende el diagnóstico de maneras muy diversas. Hay tantas formas de entender el cáncer como personas lo padecen, por lo que es fundamental que quienes estén alrededor traten de alinearse con la particular forma de entenderlo de la persona. No existen frases genéricas de consuelo que vayan bien a todas las personas.
Es normal y esperable que la persona experimente una amplia variedad de emociones y oscile de unas a otras (en cuestión de días o minutos) o incluso las sienta simultáneamente. Suele aparecer miedo, tristeza, frustración, rabia, sensación de falta de control, soledad o desconexión respecto a los demás, sentimientos de culpabilidad…
De cara a ayudar a la persona con cáncer, es importante tener en cuenta algunas variables. La primera de todas sería calibrar el grado de proximidad con la persona. No se involucra de la misma manera un compañero de trabajo o un vecino que una pareja o un progenitor. Sin embargo, todos pueden ser un punto de apoyo importante para la persona, de un modo u otro.
También es importante tener en cuenta el pronóstico. Las consecuencias emocionales serán diferentes si es un proceso resoluble o no.
Del mismo modo, ajustarse al momento en el que está la persona respecto a la enfermedad es fundamental. Algunas personas viven muchos años con cáncer, por lo que también varía su forma de entender los tratamientos y las fases de la enfermedad. No es lo mismo acabar de recibir el diagnóstico, que estar en pleno tratamiento o en fase terminal.
¿Qué hacer?
Escucha empáticamente : tenemos dos orejas y una boca para escucha el doble que hablamos. Intenta entender cómo se siente y qué necesita la persona, sin dar cosas por sentado ni intentando cambiar sus sentimientos. Recuerda que no tienes por qué tener una respuesta para todo.
Respeta también que no quiera hablar, dile que está bien igualmente y muéstrate disponible si cambia de opinión. No todas las personas tienen la misma necesidad de exteriorizar. Observa y adáptate a lo que prefiera.
Deja tus sentimientos y miedos a un lado y céntrate en los de la persona. Si te sobrepasan tus emociones, coméntaselo o apártate hasta que sea posible hablar sin que la persona tenga que consolarte.
Muéstrale tu interés y predisposición . Sé asequible cuando te necesite.
Respeta sus decisiones en el tratamiento de la enfermedad, estés o no de acuerdo.
Espera oscilaciones : habrán días mejores y peores, tanto emocional como físicamente.
Sé paciente y tolerante.
Proponle actividades o proyectos . Que sea la persona quien decida si participa o no, no tú.
Ofrécele tu ayuda en cosas concretas : gestiones, acompañarlo a visitas médicas, compras o ayuda con las comidas, cuidado de los niños…
Colabora con su entorno más inmediato: reducir el estrés de quienes le rodean también puede reducir su estrés.
¿Qué no hacer?
No juzgues . No ofrezcas consejos u opiniones a menos que te lo solicite.
No personalices . Intenta entender que la persona con cáncer puede necesitar estar sola a veces o manifestar emociones negativas, entiende que no va contra ti.
No hagas de la enfermedad un tema tabú .
No seas condescendiente . No lo trates como enfermo sino como persona.
Abandona las frases hechas , p.ej. “sé cómo te sientes” (en realidad sólo lo sabe la persona).
Compórtate en el día a día con la persona como lo hacías antes del diagnóstico. P.ej. no dejes de ponerle un límite cuando se exceda sólo porque está enfermo, o mantén el contacto físico que siempre has tenido, etc.
No presiones . A veces, con las mejores intenciones, los mejores efectos. P.ej., recordarle todo el tiempo a la persona lo valiente o fuerte que es afrontando el proceso puede hacer que no se comunique durante los momentos en que está mal y termine aislándose.
No te distancies . El cáncer puede poner en jaque tus propios temores (enfermedad, debilidades, muerte) y eso hacer que te alejes de la persona.
Artículo especializado
Glioblastoma
El glioblastoma multiforme es un tipo de cáncer cerebral muy agresivo que se forma a partir de unas células llamadas astrocitos , que son células de sostén del tejido cerebral, una tipología que da soporte a las conexiones neuronales. También llamado glioblastoma sin más o glioma de grado IV, puede resultar muy difícil de tratar, y con frecuencia no se puede curar. Los tratamientos pueden enlentecer la evolución del cáncer y reducir los signos y síntomas, pero con todo, el pronóstico es infausto, con una esperanza de vida de uno o dos años aproximadamente desde el momento del diagnóstico.
Incidencia y causas
El glioblastoma multiforme puede aparecer a cualquier edad, pero es más frecuente que lo haga en personas adultas de una edad ya avanzada. Es un tumor poco frecuente; de hecho, la mayoría de tumores cerebrales son metástasis de otros tumores primarios. En España se diagnostican unos 1.300 casos anualmente.
No existe una causa conocida responsable de la aparición de los gliomas. Menos del 5% de los pacientes con glioblastoma multiforme presentan antecedentes familiares. Algunas enfermedades degenerativas cerebrales pueden predisponer a la aparición de un glioblastoma. Por el contrario, no se ha demostrado que utilizar con frecuencia los teléfonos móviles pueda tener relación con un aumento de la incidencia de estos tumores cerebrales.
¿Cómo se manifiesta?
El glioblastoma multiforme es un tipo de cáncer que se comporta de manera diferente al resto de tumores. Es un tumor altamente agresivo , en parte debido a que muchas de sus células son parecidas a las células madre, lo cual les confiere una gran capacidad para regenerarse pese a los tratamientos y seguir invadiendo el tejido cerebral adyacente. Por el contrario, pese a su agresividad, nunca genera metástasis, es decir, no se propaga a otras partes del cuerpo.
Los glioblastomas multiformes son asintomáticos inicialmente y no es hasta que han adquirido un cierto tamaño que comienzan a dar síntomas, en general debido al aumento de la presión intracraneal que provocan. Estos síntomas, inespecíficos por desgracia, son:
Dolor de cabeza.
Náuseas o vómitos.
Convulsiones.
Pérdida de memoria.
Cambios de comportamiento.
Alteraciones del equilibrio.
Incontinencia urinaria.
Alteraciones de la movilidad o la sensibilidad.
Alteraciones del lenguaje.
Trastornos cognitivos.
Alteraciones de la visión.
¿Cómo se diagnostica?
El diagnóstico de este tipo de cáncer se basará en la exploración neurológica y en las pruebas de imagen que solicite el neurólogo para observar su presencia, como son una resonancia magnética nuclear, la resonancia magnética funcional, el escáner o la tomografía por emisión de positrones (PET). En ocasiones se pueden realizarse otras pruebas complementarias como electromiogramas, analíticas de sangre, flujometrías urinarias y una biopsia de la lesión, en función de su ubicación.
¿Cómo se trata?
La primera opción terapéutica será la cirugía , cuyo objetivo será obtener tejido tumoral para el diagnóstico, extirpar la mayor cantidad posible de tumor y reducir los síntomas provocados por el aumento de la presión intracraneal secundaria al tumor. Se intenta resecar la mayor cantidad posible de tumor. Sin embargo, en función de su localización, se pueden ver afectadas funciones como la motilidad, la sensibilidad o el habla, de manera que los tumores no se podrán extirpar en su totalidad. Asimismo, dado que las células de un glioblastoma multiforme tienen unas prolongaciones parecidas a tentáculos que se prolongan e invaden el tejido de alrededor, es difícil extirpar estos tumores cerebrales por completo.
Tras la cirugía son varias las opciones terapéuticas, como la radioterapia, la quimioterapia o la inmunoterapia mediante anticuerpos monoclonales, así como fármacos para tratar los síntomas provocados por el tumor, como corticoides o hipotensores. Con todo, el pronóstico de este tipo de cáncer tan agresivo sigue siendo poco halagüeño.
Ensayos
Se están llevando a cabo diferentes ensayos clínicos para hacer frente mejor a este tumor y mejora la esperanza de vida de los pacientes.
Uno de estos ensayos se basa en el uso de un adenovirus , un tipo de virus como el que causa el resfriado, que modificado genéticamente para que afecte solo a las células tumorales e inyectado directamente en el tumor activa al sistema inmunitario para que este ataque y destruya las células tumorales. Se está investigando el uso conjunto de este adenovirus con fármacos de inmunoterapia para aumentar la tasa de supervivencia de estos pacientes.
Otro ensayo clínico está estudiando frenar la capacidad de replicación del ADN de los tumores y por lo tanto la multiplicación de sus células. Un tercer estudio está evaluando la posibilidad de eliminar la capacidad de cambiar que tiene el glioblastoma multiforme para hacerse resistente a diferentes tratamientos de quimioterapia o radioterapia. Por último, también se está investigando la capacidad que tiene el tumor de alterar unas células que se encuentran junto a los vasos sanguíneos, los pericitos , que son claves para activar la respuesta inmunitaria. Si se pudiese impedir esa alteración, el sistema inmunitario podría detectar el tumor y combatirlo.
Son varias, pues, las líneas de investigación abiertas. Confiemos en que en unos años podamos disponer de nuevas vías para hacer frente a este agresivo tumor cerebral.
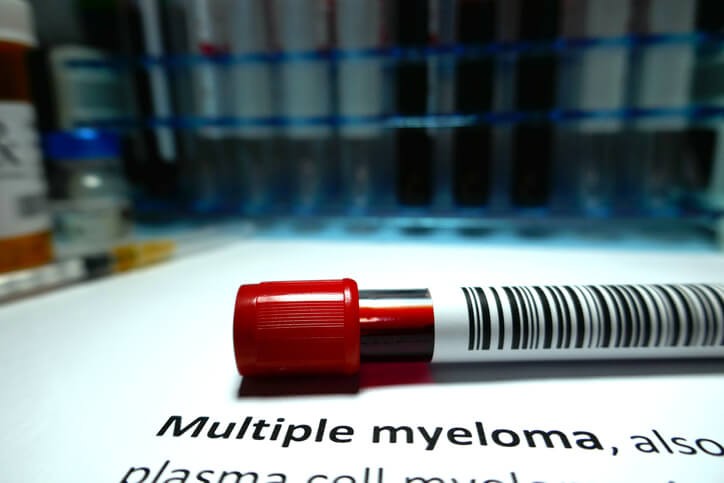
Artículo especializado
Mieloma Múltiple
El mieloma múltiple es un cáncer de células plasmáticas . Las células plasmáticas normales se encuentran en la médula ósea y son una parte esencial del sistema de defensa del organismo. El sistema inmunitario está integrado por diversos tipos de células que funcionan conjuntamente para hacer frente a las infecciones y otras enfermedades. Los linfocitos son uno tipo de glóbulos blancos del sistema inmunitario y pueden ser células T y células B.
Cuando las células B responden a una infección , dichos linfocitos maduran y se convierten en células plasmáticas, que son las encargadas de producir anticuerpos o inmunoglobulinas que ayudan al organismo a atacar y destruir los gérmenes. Las células plasmáticas se encuentran principalmente en la médula ósea.
Cuando las células plasmáticas se vuelven cancerosas se produce lo que se denomina un mieloma múltiple y estas células plasmáticas cancerosas producen una serie de anticuerpos anormales. Aunque el mieloma múltiple es la afectación cancerosa más frecuente de las células plasmáticas, existen otros tipos de trastornos neoplásicos de las mismas, como pueden ser:
Gammapatía monoclonal de significado incierto.
Mieloma múltiple indolente.
Plasmocitoma solitario.
Amiloidosis de cadenas ligeras.
Macroglobulinemia de Waldenström.
Anualmente se diagnostican cuatro casos nuevos por cada 100.000 habitantes y supone el 1% del total de los casos de cáncer que se detectan. El mieloma múltiple representa el 10% de los tumores hematológicos y su causa es desconocida. No existen factores o enfermedades que predispongan a padecerlo y es más frecuente en hombres de edad media o avanzada . Se cree que la exposición a determinadas sustancias químicas, así como la r adiación, ciertos virus o un sistema inmunológico comprometido pueden ser factores predisponentes a padecerlo. No se ha detectado que exista un factor genético o hereditario que contribuya a la aparición del mieloma, pero se ha visto que dos de cada tres pacientes tienen mutaciones en ≥1 oncogén, un gen mutado cuya activación puede potenciar la aparición de un tumor.
Los diferentes tipos de mieloma se establecen en función de la clase de paraproteína (inmunoglobulina anómala) que produce la célula del mieloma. Cada inmunoglobulina está formada por dos componentes principales, unas cadenas pesadas (G, A, D, E y M) y dos cadenas ligeras (kappa y lambda), que conforman una única molécula. El 65% de los mielomas múltiples son tipo G, seguido del A. Los mielomas tipo D, E y M son mucho menos frecuentes.
¿Produce síntomas?
Hasta casi un 30% de los pacientes que padecen un mieloma múltiple permanecen asintomáticos y el cáncer se diagnostica de manera casual al observar alteraciones analíticas , como una anemia leve, una elevación de la velocidad de sedimentación globular (VSG) o una la presencia de una paraproteína monoclonal en sangre, es decir, un tipo de anticuerpos producidos por las células plasmáticas enfermas.
De presentar síntomas, los más habituales en las personas con un mieloma múltiple son:
Dolor óseo , principalmente en la espalda, cadera, costillas, pelvis o cráneo; este dolor es debido a la activación de unas células llamadas osteoclastos, que son las encargadas de reabsorber el tejido óseo. Además del dolor, estas lesiones pueden provocar fracturas múltiples.
Hipercalcemia debida a la destrucción ósea, la cual puede causar cansancio, falta de apetito, náuseas, vómitos, aumento de la sed y del volumen de la orina, estreñimiento y confusión.
Afectación de la médula ósea ocupada por las células plasmáticas tumorales, lo cual impide que se produzcan las cantidades suficientes de las otras células sanguíneas, produciendo pues anemia, descenso de glóbulos blancos y de plaquetas.
Infecciones graves , sobre todo a nivel pulmonar y renal, a causa de la alteración del sistema inmune por la producción anómala de anticuerpos, lo cual deja al cuerpo expuesto a infecciones graves y potencialmente mortales.
Afectación renal por la acumulación de las cadenas ligeras de las paraproteínas en los riñones y el exceso de calcio en la sangre, que se excretan por la orina y dañan la función renal, lo que conlleva a la larga una insuficiencia renal severa.
Aumento de la viscosidad de la sangre por el exceso de paraproteínas, lo cual favorece la aparición de trombosis —sobre todo a nivel neurológico y oftalmológico— y la aparición de insuficiencia cardíaca.
Aparición de tumores en tejidos linfáticos fuera de la médula ósea que se denominan plasmocitomas.
¿Cómo se diagnostica?
El diagnóstico inicial puede ser casual al ver alteraciones en la analítica de sangre, especialmente la presencia de una paraproteína en ella. Si se sospecha en la analítica se debe valorar la función renal, los niveles de calcio, los niveles de las otras células sanguíneas y la alteración de la coagulación. Se deberá realizar una punción ósea para cerciorarse de la excesiva presencia de células plasmáticas en la misma, lo cual confirma el diagnóstico. Para valorar las lesiones óseas se pueden realizar diferentes pruebas de imagen, como la radiografía simple o el escáner.
Los pacientes que, en el momento del diagnóstico, se encuentren asintomáticos no requieren tratamiento desde el principio, ya que no se ha comprobado que hacerlo prolongue la supervivencia de los pacientes. Los objetivos del tratamiento son reducir la masa tumoral, lograr la remisión completa si es posible, retrasar la progresión del mieloma y mejorar las condiciones de vida y de supervivencias de los pacientes.
Tratamiento
En caso de iniciar tratamiento, las opciones terapéuticas son varias, como la quimioterapia , la radioterapia , el tratamiento con interferones, la inmunoterapia mediante anticuerpos monoclonales, la lenalidomida con dexametasona, la talidomida, el bortezomib o el trasplante de médula ósea, ya sea de uno mismo (autólogo) o de un donante (alogénico). Asimismo, es muy importante el tratamiento de las complicaciones del mieloma, como las infecciones, la hipercalcemia o la afectación renal.
Con el tratamiento y en función de cuán avanzada esté la enfermedad, la esperanza de vida oscila mucho , entre los 4 y 8 años de vida . La función renal, la edad y el estado de salud de base del paciente son factores claves para determinar la supervivencia. Con todo, cabe decir que más del 50% de los pacientes que se someten a un trasplante de médula ósea logran una remisión completa, es decir, quedan libres de la enfermedad. Asimismo, la detección de ciertos oncogenes permitiría utilizarlos como dianas terapéuticas y poder realizar un tratamiento más personalizado a cada paciente en función de estos genes mutados.

Artículo especializado
Los Tipos de Cáncer con Mayor Porcentaje de Metástasis
Aún hay esperanza: la aparición de metástasis no implica que no haya curación posible. Pese a que son un factor que indica que el tumor está más evolucionado y tiene peor pronóstico inicialmente, con el tratamiento adecuado, en muchas ocasiones se puede conseguir un control de la enfermedad e incluso su curación.
¿Qué son las metástasis?
Una metástasis es la aparición de un tejido canceroso que aparece en un órgano o tejido lejano al que se originó. Recordemos que un cáncer se produce cuando una célula del organismo sufre una mutación que provoca que se reproduzca sin control. Ese crecimiento celular puede originar una tumoración en la zona donde ha aparecido la mutación, creando un tumor primario. Pero en algunas ocasiones, esas células que se reproducen sin control consiguen penetrar al sistema venoso o al sistema linfático y migrar a otra parte del cuerpo. Esas células que viajan a través del torrente circulatorio pueden adherirse a la altura de algún órgano a las paredes vasculares y comenzar a reproducirse a esa altura, originando un tumor en esa localización. Ese nuevo tumor, formado por células tumorales que se originaron en otro órgano recibe el nombre de metástasis.
¿A qué órganos afectan?
La localización de las metástasis dependerá en gran medida del tipo de tumor primario de que se trate y de su localización.
Ganglios linfáticos
Un primer punto de aparición muy frecuente de las metástasis es a nivel de los ganglios linfáticos. Las células cancerosas pueden pasar al torrente sanguíneo pasando directamente al sistema venoso, pero lo más frecuente es que la llegada a la circulación venosa se haga a través de los vasos linfáticos. El sistema linfático, que forma parte del aparato circulatorio, es un sistema similar al sistema sanguíneo, pero que transporta el líquido linfático en lugar de sangre. El sistema linfático converge finalmente en el sistema venoso por lo que las células tumorales que puedan viajar por él, podrán acabar también en el sistema venoso. Sin embargo, es muy frecuente que, durante su viaje por el sistema linfático, parte de las células tumorales queden estacionadas a nivel de los ganglios linfáticos, donde prosigan su crecimiento tumoral ocasionando las llamadas adenopatías (ganglios linfáticos de gran tamaño). En este caso, hablaremos de adenopatías tumorales. Así pues, la aparición de adenopatías en muchos casos es un factor previo a la aparición de las metástasis y es un dato muy útil de cara a establecer el pronóstico de la enfermedad y el tratamiento idóneo para cada paciente. El mecanismo de diseminación tumoral a través de los vasos linfáticos es el más frecuente en tumores como la mama, el colon, el pulmón o el melanoma . Tumores como los óseos o de tejidos blandos (llamados sarcomas) suelen tener una diseminación directamente a través del sistema circulatorio, sin pasar por el sistema linfático, por lo que originarán metástasis sin presentar adenopatías.
Otros órganos
A parte de en los ganglios linfáticos, las metástasis pueden aparecer en cualquier órgano. Sin embargo, hay factores que provocarán que unos tengan más predisposición a presentar metástasis que otros. Así pues, aquellos órganos que reciben más vascularización (mas aporte de sangre) son los más expuestos a presentar metástasis, como por ejemplo el hígado, el pulmón, el cerebro o los huesos . Pero el lugar de aparición de las metástasis también dependerá mucho del tipo tumoral del que se trate y de su localización. Por ejemplo, los tumores digestivos, como el tumor de colon, suelen ocasionar metástasis a nivel del hígado (la mayor parte de la sangre recogida del aparato digestivo se dirige al hígado), pero si el tumor se localiza en el recto (la parte final del intestino grueso), las metástasis pueden aparecer a nivel pulmonar. El cáncer de próstata tiene tendencia a ocasionar metástasis a nivel de las glándulas suprarrenales pero también de los huesos mientras que el cáncer de mama suele provocar metástasis a nivel pulmonar.
¿SABÍAS QUÉ?
Es muy importante destacar que un cáncer con metástasis no significa que éste no sea curable. La potencial curación dependerá de la localización y número de metástasis . Bien es cierto que pueden considerarse un factor de mal pronóstico, pues significa que el tumor está más evolucionado, sin embargo, en algunas ocasiones, con un tratamiento adecuado se puede conseguir una remisión completa tumoral (desaparición completa del cáncer).
¿Cómo se manifiesta?
Las metástasis, al igual que el cáncer primario, pueden ser asintomáticas (no provocar ninguna sintomatología). En general, las metástasis, igual que los tumores primarios, pueden ocasionar en un inicio una sintomatología inespecífica, como la pérdida de peso, pérdida de apetito, cansancio o anemia.
En caso de que den algún síntoma más específico, éste dependerá de la localización de la metástasis y de su tamaño. Por ejemplo, las metástasis óseas pueden provocar fracturas (llamadas fracturas patológicas), las metástasis cerebrales pueden provocar dolor de cabeza, convulsiones o mareos. Las metástasis hepáticas pueden provocar ictericia (coloración amarillenta de la piel).
¿Qué implicaciones tienen?
a aparición o no de metástasis tiene gran importancia para valorar el pronóstico de la enfermedad y el tratamiento a realizar. El cáncer metastásico generalmente suele precisar de un tratamiento con quimioterapia . Esto es debido a que la aparición de una metástasis implica que el tumor ha desarrollado la capacidad de viajar por el torrente sanguíneo , por lo que aparte de tratar el tumor primario, no podemos estar seguros de que no haya células tumorales viajando por la circulación. Por ello, para evitar que esas células que podrían estar circulando por la sangre hagan más metástasis en el futuro, debemos de dar un tratamiento que elimine las células tumorales allá donde se encuentren, y este tratamiento sería la quimioterapia. Sin embargo, el hecho de que la aparición de metástasis implique casi siempre un tratamiento con quimioterapia, esto no implica que no pueda realizarse un tratamiento quirúrgico. Existen ejemplos, como el cáncer de colon con metástasis hepáticas, en el que, según el número y localización de las metástasis en el hígado, se puede realizar una operación para eliminar la parte del hígado enferma, de igual forma que en los casos de aparición de metástasis únicas pulmonares, también candidatas a cirugía en determinadas ocasiones.

Artículo especializado
Cuáles son los Factores de Crecimiento
¿Has oído hablar de los factores crecimiento ? ¿Sabes qué son? Se trata de un conjunto de proteínas presentes en el plasma y en las plaquetas de la sangre, que tienen una función protagonista en los procesos de reparación y regeneración de los tejidos de nuestro cuerpo. Tienen un papel importante dentro de la medicina regenerativa, sobre todo en las especialidades de dermatología, reumatología y traumatología para la cura de lesiones en la piel, músculo esqueléticas o inflamatorias articulares.
Esto es debido a que son capaces de desencadenar en las células procesos biológicos como la proliferación y la diferenciación celular, la generación de vasos sanguíneos (angiogénesis) y la migración o desplazamiento de células a lugares donde son necesarias (quimiotaxis). En otras palabras, los factores de crecimiento son mensajes que utiliza nuestro organismo para informar a las células cuándo crecer, cómo diferenciarse o a dónde moverse para reparar un tejido dañado. Además, ayudan a que el lugar dónde se repara la lesión esté protegido de infecciones y disminuya el dolor y la inflamación.
Un poco de historia
Rita Levi-Montalchi, una científica italiana especialista en neurología, fue la descubridora del primer factor de crecimiento conocido, el NGF (factor de crecimiento neuronal ), por lo que fue laureada con el Premio Nobel de Medicina en 1986. Este trabajo realizado en la Universidad Washington, en San Luis, fue imprescindible para descubrir que las células sólo comienzan a reproducirse cuando reciben la orden de hacerlo, orden que transmiten unas proteínas llamadas factores de crecimiento.
Tipos de factores de crecimiento
Hay una gran cantidad de factores de crecimiento en nuestro organismo, y aquí te vamos a explicar los más importantes:
Hormona del crecimiento (HC): es una hormona fabricada por la glándula hipófisis, que se sitúa en el cerebro. Tiene un efecto global en nuestro organismo. Es producida durante toda la vida, pero en la infancia es sumamente importante para que el niño crezca adecuadamente y alcance su talla normal de acuerdo a su genética. En el ser humano tiene dos funciones importantes: estimula el crecimiento de los tejidos (promueve la mitosis o división de las células) y tiene un papel básico en el metabolismo de los carbohidratos, lípidos y proteínas.
Factor de crecimiento derivado de las plaquetas (FCDP): es una proteína sintetizada y liberada por las plaquetas que estimula la multiplicación celular 10 minutos tras coagular una herida y ayuda a la reparación del tejido lesionado.
Factor de crecimiento vascular endotelial (FCVE): es una sustancia importantísima en el crecimiento de los vasos sanguíneos durante el periodo embrionario y en la formación de nuevos vasos capilares en el ser humano adulto.
Factor transformador del crecimiento-beta (FTC-beta): ayuda a la síntesis de colágeno y a la reparación del tejido conectivo.
Factor fibroblástico ácido y básico (FCFa y FCFb): ayuda en la reparación de los tejidos lesionados mediante la formación de colágeno.
¿Sabes que los factores de crecimiento pueden ser tu medicina?
Los factores de crecimiento se usan como tratamiento de muchas enfermedades desde hace un par de décadas. Por ejemplo, son ampliamente utilizados en enfermedades hematológicas (de la sangre) tales como las granulocitopenias, los síndromes mielodisplásicos, las leucemias, las anemias aplásicas y los trasplantes de médula ósea. Por ejemplo, la eritropoyetina (EPO) se utiliza en pacientes con anemia e insuficiencia renal.
Otro de sus usos es dentro de la medicina regenerativa, sobre todo en las especialidades de dermatología, reumatología y traumatología para la cura de lesiones en la piel, músculo esqueléticas o inflamatorias articulares.
¿Qué es la medicina regenerativa?
La medicina regenerativa es una parte de la medicina relativamente moderna. Tal y como su nombre indica, su objetivo es regenerar tejidos dañados por la vejez o por un traumatismo. Este tipo de medicina se vincula a diferentes áreas científicas como la terapia celular avanzada, la ingeniería genética o la de tejidos. El uso de células madre, hematopoyéticas (las células de la sangre que proceden de la médula), la terapia génica (consiste en insertar un gen en una célula para sustituirlo o bloquear su función), la ingeniería de tejidos (desarrollo de órganos bioartificiales cultivados en el laboratorio) o el uso de sustancias como los factores de crecimiento.
Usos de los factores de crecimiento y medicina regenerativa
Hace unos años sería imposible pensar que podemos mejorar una lesión o frenar la progresión de una artrosis utilizando sustancias que fabrica nuestro propio cuerpo. Este planteamiento tiene ciertas ventajas ya que no presenta efectos secundarios, intolerancia o rechazo porque no estamos introduciendo ninguna sustancia extraña en nuestro organismo.
En el tratamiento de las tendinitis o las artrosi s (sobre todo de grandes articulaciones como la cadera o la rodilla) los factores de crecimiento promueven la regeneración del cartílago y reducen la inflamación, la deformidad y el dolor, mejorando el movimiento de la articulación y el bienestar del paciente.
En lesiones músculo esqueléticas, producidas, por ejemplo, tras un accidente o las que puede padecer un deportista, la aplicación de factores de crecimiento reduce el tiempo de recuperación y acelera la curación y cicatrización del tendón, músculo o hueso dañado.
En el pie diabético y otras úlceras crónicas por presión de la piel (heridas crónicas en la piel que no cicatrizan), los factores de crecimiento pueden favorecer su curación.
Parece ser que también han hecho su incursión en la medicina estética, ya que regulan la remodelación y reparación de la piel envejecida si se aplican de forma subcutánea.
Este tratamiento solo está contraindicado en caso de i nfección en la zona a tratar, procesos neoplásicos y ciertas enfermedades de la sangre.
¿Cómo se aplica?
El tratamiento se realiza bajo prescripción médica , en un ambiente estéril y sin anestesia. Para poder obtener los factores de crecimiento del paciente hemos de realizar una extracción sanguínea . Es el mismo proceso que una analítica. Esta sangre se procesa y se separa el plasma que es rico en factores de crecimiento. Tras obtener el concentrado se infiltra en la zona a tratar.
El proceso, que puede durar entre 25 y 40 minutos, se realiza en un ambiente estéril y sin anestesia en la mayoría de los casos. Puede usarse en una articulación o durante una intervención quirúrgica. El número de infiltraciones, en patología articular, que es la más frecuente, suelen ser tres sesiones durante tres semanas consecutivas, con una sesión de recuerdo a los seis meses o un año si la evolución es favorable.

Artículo especializado
Linfoma no Hodking en Adultos
El linfoma no Hodgkin es el tumor de las paradojas: el tumor que no es un tumor sino muchos y que en ocasiones es mejor cuando es peor (la probabilidad de curación aumenta cuando el tumor es más agresivo).
¿Qué es?
Un linfoma es un tipo de tumor maligno originado en el tejido linfoide . Se inicia cuando una de las células del tejido linfoide sufre una mutación genética que provoca que se multiplique sin control, creando un tumor que va creciendo y frecuentemente afectando a tejidos de su alrededor. El tejido linfático está distribuido por todo nuestro organismo en forma de vasos linfáticos (un sistema similar al sistema venoso) y de ganglios linfáticos , aunque también pertenecen al tejido linfático órganos como el bazo, las amígdalas o el timo (un pequeño órgano situado en la parte superior del tórax, por detrás del esternón). Gran parte de este tejido está directamente relacionado con el sistema inmune (las defensas) del organismo, por lo que este tipo de tumores pertenecen a los llamados tumores hematológicos, como las leucemias.
¿Dónde se produce?
Dado que el tejido linfático está distribuido por todo nuestro cuerpo, el tumor puede originarse en cualquier localización, aunque es más frecuente que se origine en el cuello, en el tórax o en el abdomen . En raras ocasiones, estos tumores pueden originarse en otras localizaciones como en la piel, el cerebro, el corazón, etc.
El linfoma no Hodgkin no se trata en realidad de un tipo concreto de cáncer, sino que bajo este nombre se engloban más de 20 tipos distintos , cada uno con unas particularidades que lo diferencian del resto. El nombre de Linfoma no Hodgkin se utiliza para diferenciarlo del Linfoma de Hodgkin, un tipo concreto de linfoma con unas características y un pronóstico muy diferente al resto de linfomas.
¿A cuánta gente afecta?
Se estima que en 2017 se han diagnosticado aproximadamente unos 6.429 nuevos casos de Linfoma no Hodgkin, siendo el noveno tipo de cáncer más frecuente de nuestro país. Es alrededor de un 30% más frecuente en hombres que en mujeres.
¿SABÍAS QUE…
La mortalidad del Linfoma no Hodgkin ha ido disminuyendo progresivamente en los últimos años gracias a los avances en los tratamientos que se utilizan, llegando en la actualidad a una tasa de supervivencia media a los cinco años superior al 70%, aunque para los tipos de más bajo riesgo la tasa de supervivencias a los cinco años es superior al 91%.
¿Por qué se produce?
El motivo de la aparición de un Linfoma no Hodgkin, como ya hemos dicho, es una mutación en una de las células del tejido linfático. La causa de estas mutaciones es desconocida, pero lo que sí que se conocen son factores que pueden favorecer su aparición:
La edad: es el principal factor de riesgo conocido. La mayoría de pacientes que presentan un Linfoma no Hodgkin se encuentran por encima de los 60 años. Existen casos también de Linfomas no Hodgkin diagnosticados en niños, pero mucho menos frecuentemente de lo que se diagnostican en adultos.
Exposición a productos químicos : algunos estudios demuestran mayor incidencia en la aparición de linfoma en pacientes expuestos a herbicidas o insecticidas. Como ya hemos comentado, algunos tratamientos inmunosupresores como la quimioterapia utilizada para tratar otro tipo de cánceres, pueden aumentar también el riesgo de desarrollar un Linfoma no Hodgkin.
Exposición a radiaciones : la exposición incontrolada a radiación puede aumentar el riesgo de presentar tumores hematológicos, como leucemias o linfomas. Sin embargo, cabe destacar que la radiación recibida al realizar estudios radiológicos como radiografías o TACs (escáneres) es muy limitada y no supone un riesgo para desarrollar este tipo de enfermedades.
Enfermedades que afecten al sistema inmune : las personas con algunos tipos de infecciones (VIH, virus de Epstein-Barr o el virus herpes humano tipo 8, entre otras), enfermedades autoinmunes, algunos síndromes genéticos, y las personas que han precisado un trasplante de órganos, tienen un riesgo algo superior al del resto de la población para desarrollar esta enfermedad.
¿Cómo se presenta?
Los síntomas que puede provocar un linfoma no Hodgkin son muy inespecíficos, ya que dependen en gran parte de la localización en la que aparezca el tumor y del tipo de tumor en concreto que se trate.
Más del 60% de los casos se detectarán por la palpación de un bulto en alguna localización (en muchas ocasiones un ganglio aumentado de tamaño).
En alrededor de un 40% de los casos se presenta un síndrome con síntomas generales como fiebre, pérdida de peso, episodios de sudoración profusa sin motivo aparente, etc. Más rara es la presentación del linfoma en forma de cansancio, falta de apetito, malestar general, dolores óseos, etc.
¿Cómo se diagnostica?
Dependerá en gran medida de la localización del tumor. Se suelen usar técnicas de imagen como la ecografía (en tumores más superficiales) o el TAC (en tumores más profundos como en tórax o abdomen) para identificar la localización y el número de lesiones (en muchos casos pueden haber varios ganglios afectados).
Es preciso realizar un estudio del tejido mediante una biopsia (en la mayoría de casos obtenida mediante cirugía), aunque en algún caso se puede realizar un diagnóstico con una punción del tumor o incluso con una biopsia de médula ósea (alrededor de un 40% de casos afectan también a la médula ósea).
¿Cómo se trata?
En el caso del Linfoma no Hodgkin es muy importante destacar que hay tipos agresivos y tipos indolentes, por lo que el tratamiento y el pronóstico se basarán en gran medida en el tipo concreto de tumor del que se trate. El tratamiento también dependerá de la edad del paciente, de la extensión y de la localización de la enfermedad. En general, el tratamiento se basará en el uso de quimioterapia y en aquellos casos de tumores más localizados, de radioterapia.
En este tipo de cáncer, se produce la paradoja de que los tumores más indolentes (menos malignos), pese a que tienen buena respuesta al tratamiento, en escasas ocasiones se consigue su curación completa, y en muchas ocasiones se reproducen al cabo de los años. Sin embargo, los tumores más agresivos responden incluso mejor al tratamiento de quimioterapia que los tumores más indolentes, y en muchas ocasiones se consigue la curación completa de la enfermedad.
Artículo especializado
Tratamiento para el Cáncer de Próstata
Empezar con un dato positivo en un artículo sobre cáncer no es fácil, pero como en este caso lo tenemos, aquí va: en el 70% de los casos el cáncer de próstata se diagnostica cuando todavía está solamente en la próstata y no se ha extendido a otras estructuras, adyacentes o en la distancia. Una buena noticia si tenemos en cuenta que se trata del tumor más frecuente en hombres y supone la tercera causa de muerte por cáncer (después del de pulmón y colorrectal). El tratamiento se establecerá en función del grado de extensión y agresividad del cáncer de próstata.
Qué es la próstata
La próstata es una glándula que forma parte del aparato reproductor masculino. Se encuentra bajo la vejiga, por detrás del pubis y por delante del recto, y pesa unos 20 gramos aproximadamente, más o menos como una castaña. Está formada por dos zonas :
Parte externa: se denomina cápsula y se localiza en la periferia. En ella se hallan las glándulas que producen la secreción prostática , uno de los principales componentes del esperma. Es precisamente en esta zona donde se pueden ubicar los cánceres de próstata.
Parte central: a través de ella pasa la uretra .
El cáncer de próstata es lo que se llama un adenocarcinoma , un tumor que se forma a partir de las glándulas de la próstata. El 99% de los cánceres de próstata son de este tipo y solamente un 1% son de otros tipos, como sarcomas , carcinomas o bien metástasis de otros tumores primarios, como de vejiga, colon, pulmón, melanoma o linfoma. El adenocarcinoma de próstata es un tumor multifocal, es decir, que puede aparecer simultáneamente en diferentes puntos de la próstata.
Cómo se origina el cáncer
Cada año se diagnostican 30 nuevos casos de cáncer de próstata por cada 100.000 habitantes. Este cáncer, como la mayoría, es multifactorial , es decir, son varios los factores que pueden influir en su aparición, siendo los principales:
Edad avanzada
Alteraciones genéticas diversas
Tabaquismo
Obesidad
Dieta rica en grasa animales
Niveles elevados de testosterona
Hoy en día se detectan un mayor número de cánceres de próstata en parte porque la esperanza de vida es mayor, han descendido otras causas de muerte, han mejorado los protocolos de detección precoz y se realizan más intervenciones quirúrgicas para solventar la hiperplasia benigna de próstata y, en algunos casos, se halla en dichas próstatas focos de cáncer que no habían sido detectados previamente.
¿Da síntomas?
El cáncer de próstata es un tipo de tumor cuyo crecimiento es muy insidioso , muy lento , por lo que puede que no de síntomas hasta un estado más avanzado. Por esto mismo es esencial la detección precoz de estos tumores.
En caso de dar síntomas el cáncer de próstata se puede manifestar como :
Molestias al orinar
Urgencia para orinar
Orinar con frecuencia y pequeñas cantidades
Necesidad de levantarse varias veces por la noche a orinar
Goteo tras la micción
Disminución de la fuerza y el calibre del chorro de la orina
Sangre en la orina o en el esperma
El cáncer de próstata crece lentamente y se extiende hacia las vesículas seminales y la vejiga urinaria. Si no se trata se puede diseminar por la sangre y originar metástasis , principalmente a nivel óseo y, con menor frecuencia, en los pulmones, el hígado, las glándulas suprarrenales o el cerebro.
Diagnóstico
El diagnóstico del cáncer de próstata se fundamenta inicialmente en la exploración física mediante el tacto rectal . Al tacto se puede palpar una zona indurada y no dolorosa a nivel de la próstata.
Es fundamental valorar los niveles en sangre del antígeno prostático específico o PSA. El PSA es una sustancia que se produce exclusivamente en la próstata y que permite que el semen sea más fluido. Sus valores normales son inferiores a 4 ng/ml. Esta sustancia puede elevarse en casos de prostatitis , hiperplasia benigna de próstata , tras una biopsia o si ha habido una eyaculación reciente. Con valores superiores a 10 ng/ml las posibilidades de padecer un cáncer de próstata son de un 67%, por lo que se debe llevar a cabo una biopsia prostática para confirmarlos. En caso de que los valores estén entre 4 y 10 ng/ml, el riesgo disminuye a un 25%, por lo que antes de someterse exploración agresiva como es la biopsia se realizarán una ecografía prostática.
La biopsia de la próstata será la prueba que permitirá tener un diagnóstico de certeza. La biopsia se lleva a cabo bajo anestesia local y se obtienen diferentes muestras de tejidos de los dos lóbulos prostáticos. Al valorar las células al microscopio se puede valorar el grado agresividad el tumor.
Una vez establecido el diagnóstico se tiene que llevar a cabo un estudio de extensión mediante una tomografía axial computadorizada (TAC) y una gammagrafía ósea .
Tratamiento
El tratamiento, como en todos los tumores, será multidisciplinar y se deben valorar varias aproximaciones en cada caso. Algunas de las opciones terapéuticas son:
Cirugía, bien abierta, laparoscópica o robótica
Ultrasonidos focalizados de alta intensidad (HIFU)
Radioterapia, bien externa o localizada (braquiterapia)
Hormonoterapia
Inmunoterapia
Quimioterapia
El tratamiento se establecerá en función del grado de extensión y agresividad del cáncer de próstata.
Ante cualquier síntoma urológico , es de vital importancia ponerse en contacto con un urólogo que pueda asesorarnos en el diagnóstico y el tratamiento.
Artículo especializado
¿Qué es el Carcinoma Basocelular?
Estamos ante el tumor maligno más frecuente de todos los que aparecen en los seres humanos, aunque suele crecer e invadir la piel sin provocar metástasis a distancia. Afecta en general a personas mayores con piel blanca y ojos claros , que han pasado muchas horas al sol por su trabajo o sus aficiones (playa, golf, camping). En general su solución es la extirpación mediante cirugía.
¿Qué tipos de carcinoma basocelular hay? ¿Cómo es su aspecto?
Se distinguen diferentes tipos:
El nodular, que se manifiesta como una “bolita” o granito brillante, con aspecto que recuerda al de una perla, que crece muy lentamente, y cuando alcanza un cierto tamaño, sangre, se ulcera o forma costras.
El infiltrante tiene otro aspecto, de herida que no cura, que descama, sangra o forma costras, y que va invadiendo la piel en profundidad sin límites claros, haciendo más complicado el extirparlo completamente con la cirugía convencional.
El tipo superficial aparece más en el tórax (pecho y espalda) a diferencia de los otros, que aparecen en la cara. Tiene un aspecto que recuerda a una mancha de eczema o psoriasis. No invade la piel en profundidad, y su tratamiento es más sencillo.
¿Existen carcinomas basocelulares que se heredan?
Existe un síndrome llamado Gorlin que se hereda de padres a hijos, y comporta el desarrollar carcinomas basocelulares múltiples . Además, los pacientes presentan una cara peculiar, con cejas muy pobladas, y quistes en la mandíbula. Es importante detectar a las familias con Gorlin para llevar un control estricto.
Tratamiento del carcinoma basocelular
El tratamiento está basado en la cirugía con extirpación del tumor con márgenes correctos. Debe asegurarse un buen resultado estético , porque muchos aparecen en zonas visibles de la cara. Para los tipos infiltrantes, o cuando el tumor ha vuelto a aparecer tras una primera extirpación incompleta, existe una técnica denominada cirugía micrográfica de Mohs que asegura la curación en prácticamente el 100% de los casos. Mediante esta técnica, el tumor va extirpándose por capas que son inmediatamente analizadas al microscopio, y se repiten etapas hasta asegurar que todos los márgenes de la extirpación no tienen células tumorales. Al acabar, se procede a la reconstrucción del defecto obtenido mediante cierre directo , movimientos de piel , o injertos. Una cirugía de Mohs puede ser larga en función de lo invasivo y extendido que esté el carcinoma, pero el paciente podrá irse a su casa totalmente curado.
En casos no operables es posible utilizar radioterapia. También existe una quimioterapia llamada vismodegib para los carcinomas basocelulares múltiples, gigantes o no operables. Su precio elevado hace que en todos los casos deba ser administrada por el sistema nacional de salud .
Medidas preventivas del carcinoma basocelular
Las medidas preventivas del carcinoma basocelular se basan en una correcta protección solar y en la detección precoz mediante autoexploración o visita al dermatólogo . El paciente de riesgo debe ser entrenado para reconocer los signos precoces del carcinoma, y acudir a su dermatólogo para diagnóstico. Un crecimiento nuevo en la piel, que forma costras o sangre, o una herida que no cura en un área expuesta al sol suelen ser los signos más típicos del carcinoma basocelular.

Artículo especializado
Cómo Prevenir el Cáncer Testicular
No existen medidas preventivas específicas para este tipo de cánceres, por eso en caso de detectar un bulto en el testículo es esencial ponerse en contacto cuanto antes con el urólogo para que nos asesore.
Una manera de prevenir sí que pasa por operar lo antes posible los testículos que no hayan descendido a la cavidad abdominal al nacer . Pero en el caso de que los testículos estén descendidos en el saco escrotal, la autoexploración física en busca de bultos es la mejor medida para poder diagnosticar este tipo de tumores en sus estadios más precoces, pudiendo el paciente beneficiarse de los tratamientos menos agresivos, pese a que siempre será necesario operar. Por suerte, gracias a las nuevas pautas terapéuticas, este tipo de cáncer tiene una tasa global de curación del 90%.
Prevalencia baja
El cáncer de testículo es un cáncer que no es muy prevalente, dado que afecta a una proporción inferior al 2% de los hombres. Los tumores que se asientan en los testículos se dan con más frecuencia entre los 15 y los 35 años . La incidencia, es decir, el número de casos nuevos que se diagnostican cada año es, en el caso de España, de 2 por cada 100.000 habitantes.
¿Hay factores de riesgo para este tipo de cáncer?
No existen factores de riesgo claramente definidos, a diferencia de lo que sí ocurre con otro tipo de cánceres, para los tumores testiculares. No obstante, sí que se establece una clara relación entre el riesgo de padecer un cáncer de testículo y la presencia de un testículo que no haya bajado de la cavidad abdominal , donde se encuentran inicialmente durante el desarrollo embrionario, hasta el escroto. La presencia de un testículo no descendido en el momento del nacimiento puede ser habitual y, si no desciende por sí solo, lo que se recomienda es intervenir quirúrgicamente para hacer descender el testículo al escroto y fijarlo a él antes de los 2 años de edad .
Si por algún motivo no se ha hecho descender el testículo antes de la adolescencia, sería aconsejable operar entonces para extirparlo , pudiendo prevenir así la aparición de un posible cáncer en ese testículo en el futuro. Estudios de estos pacientes han demostrado que, en algunos casos, existían algunas alteraciones en el cromosoma 12 que podrían predisponer a la aparición de susodichos tumores.
Tipos de cáncer de testículo
Los tumores testiculares pueden ser de diferentes tipos:
Tumores germinales :
Seminomas
No seminomas:
Teratocarcinoma
Carcinoma embrionario
Tumor del seno endodérmico
Coriocarcinoma
Teratoma
Tumores no germinales :
Linfomas
Sarcomas
El 95% de los tumores testiculares se derivan de alteraciones de las células germinales , es decir, de aquellas células a partir de las cuales se forman los espermatozoides. Solo un 5% de los tumores testiculares son linfomas o sarcomas. Los seminomas son los tumores testiculares más frecuentes, seguidos por los teratocarcinomas y los carcinomas embrionarios, siendo el resto de tumores germinales y no germinales menos frecuentes.
¿Da síntomas?
Los tumores testiculares, por desgracia, no suelen doler (a menos que el tumor esté invadiendo terminaciones nerviosas), y los pacientes lo refieren en la consulta como la presencia de una masa en el testículo que se han encontrado por casualidad. Estas masas o bultos son unilaterales, duras, indoloras y de crecimiento lento. Con mucha menor frecuencia se pueden dar otros síntomas más abigarrados, como la inflamación de los ganglios inguinales, un aumento del tamaño de las mamas —lo que se llama ginecomastia— o bien signos de pubertad precoz en niños preadolescentes, con la aparición de vello a nivel facial, axilar y púbico, producidos por un aumento de los niveles de testosterona .
A VECES SÍ QUE HAY DOLOR
Hemos dicho que, en principio, estos tumores no duelen . Sin embargo, un 10% de los cánceres testiculares se pueden manifestar inicialmente como un dolor a nivel del escroto de inicio brusco, de intensidad elevada y que condiciona un malestar general, con mareos y vómitos. Este cuadro se denomina escroto agudo y se trata de una urgencia, en ocasiones quirúrgica. Las principales causas de un escroto agudo son la torsión testicular y la orquitis, es decir, una infección aguda del testículo. No obstante, en algunos casos, un tumor testicular se puede presentar de este modo, como un dolor agudo a nivel del escroto .
Diagnóstico
Cuando en consulta palpamos una masa testicular y sospechamos que puede ser un tumor se deben realizar una serie de pruebas que ayuden a confirmar o descartar el diagnóstico de cáncer testicular, como son:
Una analítica de sangre , en la cual valoraremos diversas hormonas, como la testosterona, la alfafetoproteína (AFP) y betagonadotrofina coriónica humana (βHCG).
Una ecografía testicular, la prueba de imagen por excelencia, que nos permitirá valorar el tamaño y el contorno del tumor, y diferenciarlo de lesiones de tipo quístico, con líquido dentro. En caso de dudas, si la imagen ecográfica no es clara, se podría realizar una resonancia magnética nuclear (RMN).
¿Y qué hay del tratamiento?
El tratamiento del cáncer de testículo diferirá en función de la clase de tumor que sea y de la extensión del mismo. En cualquier caso, siempre se debe extraer todo el testículo . Una vez extirpado el tumor y curado el paciente, se puede colocar una prótesis testicular por motivos estéticos. Pese a la primera aproximación quirúrgica, algunos tumores deberán tratarse también mediante radioterapia o quimioterapia.

Artículo especializado
Etapas del Cáncer de Vejiga
Existe cura para el cáncer de vejiga, y es que hasta el 80% de pacientes diagnosticados de este tipo de tumores sobrevivirán más allá de cinco años tras su diagnóstico. Este porcentaje es incluso superior en España respecto a otros países desarrollados, ya que la supervivencia media a cinco años en la Unión Europea se sitúa en torno al 69%.
Más frecuente en hombres
El cáncer de vejiga es el quinto cáncer más frecuencia en nuestro país , con más de 21.000 nuevos casos anuales. Pese a esta prevalencia, es el octavo tipo de cáncer por mortalidad, siendo el responsable de unas 4.300 muertes al año. Su frecuencia es muy superior en el sexo masculino , con más de 17.000 casos anualmente respecto a los 3.600 nuevos casos que se diagnostican en el sexo femenino. Por edades suele afectar a personas entre los 65 y 75 años, con el pico de incidencia alrededor de los 70 años.
¿Qué es?
El cáncer es una enfermedad producida por una mutación genética que provoca una reproducción incontrolada de las células de un tejido. Dicha reproducción incontrolada provoca un crecimiento del tumor que va invadiendo los tejidos de su alrededor y que en ocasiones puede infiltrarse en un vaso sanguíneo y migrar e implantarse en otros órganos ocasionando las metástasis.
El cáncer de vejiga es un tipo de cáncer que se origina frecuentemente en la capa mucosa de la vejiga (la capa interna que está en contacto con la orina), formando así el llamado carcinoma urotelial. En este tipo de tumores, podemos diferenciar dos subtipos:
Cáncer urotelial de bajo grado : rara vez invade tejidos en profundidad u ocasiona metástasis a distancia, pero sin embargo tiene tendencia de reaparecer tras su extirpación
Cáncer urotelial de alto grado : más agresivo. Va invadiendo los tejidos que lo rodean, en profundidad en la vejiga, y en ocasiones puede extenderse a otros órganos provocando metástasis.
¿Qué factores de riesgo existen?
El principal factor de riesgo evitable para el cáncer de vejiga es el tabaquismo . Se estima que los fumadores tienen el triple de riesgo de desarrollar un cáncer vesical respecto a los no fumadores. Esto puede ser producido porque muchos de los tóxicos del tabaco se eliminan por la orina.
Además del tabaquismo, los antecedentes familiares de cáncer de vejiga representan otro factor de riesgo importante para la aparición de un cáncer vesical.
Existen otros factores de riesgo, pero con una importancia menor como son las exposiciones a sustancias químicas como colorantes, derivados del petróleo o arsénico, entre otros.
¿Cómo se presenta?
El síntoma más frecuente en el cáncer vesical es la hematuria (la presencia de sangre en la orina). Sin embargo, ésta puede ser provocada por múltiples enfermedades como por ejemplo la presencia de piedras en los conductos urinarios (cólicos nefríticos), infecciones (cistitis) o enfermedades renales.
Al contrario que en la mayoría de enfermedades que pueden producir sangrado por la orina, el ocasionado por un cáncer de vejiga suele ser asintomático, es decir, el paciente únicamente verá sangre en la orina, pero no presentará molestias importantes, dolor ni otra sintomatología.
Además de la hematuria, los tumores vesicales pueden presentarse como polaquiuria (aumento de la frecuencia de micciones), disuria (molestias al orinar), nicturia (aumento de las micciones durante la noche) o tenesmo urinario (sensación continua de ganas de orinar).
¿Cómo se diagnostica?
La primera prueba diagnóstica que habrá que hacer es un análisis de orina y un análisis sanguíneo . Con ellos descartaremos otras causas de hematuria. Además, en algunos casos permite visualizar células tumorales que se expulsan con la orina, lo que nos permitiría asegurar que existe un cáncer en las vías urinarias, aunque no nos daría la localización exacta (podría tratarse de un tumor vesical pero también de un tumor en algún otro punto de las vías urinarias como los uréteres o la uretra).
La ecografía es una técnica útil en algunos casos ya que permite visualizar el tumor dándonos información de su tamaño y posible afectación de otros órganos.
La urografía endovenosa es una prueba radiológica que permite visualizar las vías urinarias y descartar la existencia de otras tumoraciones a lo largo de las mismas.
Pero ante todas, la prueba más útil en el diagnóstico del cáncer vesical es la cistoscopia. Es una técnica que consiste en introducir un tubo muy fino con una cámara en su punta, a través de la uretra para así poder visualizar el interior de la vejiga. Permite así ver directamente el tumor, su extensión y coger muestras (biopsias) para analizarlo. Además, como veremos más adelante, en muchas ocasiones permite también extirpar el tumor y tratar así la enfermedad.
Una vez diagnosticado ya el cáncer vesical, se suele hacer un estudio para descartar extensión del tumor a distancia a través de una TAC abdominal , una radiografía o TAC de tórax y en algunos casos una gammagrafía ósea para descartar metástasis en los huesos.
¿Cómo se trata?
La elección del tratamiento dependerá del tipo de tumor y del grado de afectación, tanto en profundidad de la vejiga como por la existencia o no de metástasis a distancia. Los tratamientos disponibles son la cirugía, la radioterapia y la quimioterapia.
En aquellos casos de tumores superficiales (tumores de bajo grado o tumores de alto grado, pero en fases muy precoces) el tratamiento básico será la cirugía. En muchas ocasiones se puede realizar la llamada RTU (resección transuretral), es decir, a través de una cistoscopia se extirpa la zona de tumor pudiendo curar por completo la enfermedad sin tener que hacer incisiones. En otros casos, por el contrario, será necesaria una cirugía mayor que implique una extirpación total o parcial de la vejiga de la orina.
La quimioterapia es otro de los tratamientos habituales en el cáncer vesical. Ésta puede administrarse de forma intravesical (se introduce por la uretra hasta el interior de la vejiga) o intravenosa.
La quimioterapia intravesical se suele utilizar tras una RTU en tumores superficiales y disminuye el riesgo de recidiva (reaparición) de la enfermedad. La quimioterapia intravenosa se emplea frecuentemente en caso de que existan metástasis o haya riesgo de que éstas aparezcan.
¿Y después del tratamiento?
Como ya hemos dicho, el cáncer vesical es un cáncer frecuente , pero en muchas ocasiones curable . Sin embargo, existe un riesgo elevado de recidivas, ya sea por reaparición del mismo tumor como por la aparición de otros tumores a nivel vesical. Se estima que el riesgo de recidiva en este tipo de tumores está entre un 40 y un 70%, aunque hay estudios que elevan ese porcentaje hasta el 90%. Por este motivo, es de especial importancia realizar un buen seguimiento tras haber superado un cáncer vesical, en muchas ocasiones incluso realizando cistoscopias seriadas para descartar la aparición de nuevas tumoraciones.
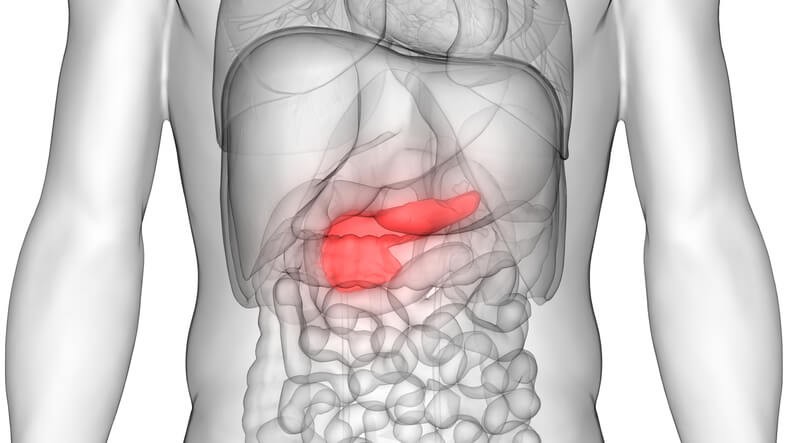
Artículo especializado
Pronóstico, Analítica y Test para Detectar el Cáncer de Pancreas
Infrecuente pero muy agresivo, el cáncer de páncreas es, además, difícil de diagnosticar en etapas tempranas porque, cuando da síntomas, en general ya suele estar en un estado avanzado, y muchas veces los síntomas son tan inespecíficos que se tarda en acudir al médico. Modificar los factores de riesgo que pueden propiciarlo está en nuestras manos, así que ¿por qué no hacerlo?
Cómo se produce
El cáncer de páncreas se origina cuando las células del páncreas comienzan a proliferar sin control y van acumulando cambios en la replicación del ADN que las hace invasivas y agresivas.
El páncreas tiene dos tipos de células, las exocrinas, que son las que producen una serie de enzimas que ayudan en la digestión de los alimentos, y las endocrinas , que producen diferentes hormonas, como la insulina o el glucagón. La mayoría de los tumores del páncreas se localizan en las células exocrinas , causando un adenocarcinoma de páncreas, mientras que los tumores endocrinos del páncreas son menos comunes.
Incidencia del tumor
No es un tumor muy frecuente : representa apenas el 2% del total de todos los cánceres). Cada año se diagnostican en el mundo unos 233.000 nuevos casos en todo el mundo. En España se detectan unos 4.000 casos anuales. Es un tumor un tanto más frecuente en los hombres que en las mujeres . La mayoría de los tumores de páncreas se diagnostican en personas entre los 65 y los 75 años.
Factores de riesgo
Este cáncer se ha relacionado con diversos factores de riesgo :
Hábito tabáquico.
Dietas ricas en grasas y en proteínas.
Pancreatitis crónica.
Cirrosis hepática.
Diabetes.
Colecistectomía.
Exposición a ciertos productos químicos (tintorería, industria metalúrgica).
Predisposición genética.
UN CÁNCER MUY AGRESIVO
El cáncer de páncreas es muy agresivo y se extiende a los tejidos que lo rodean con suma facilidad . Un 70% se diseminan a través de los vasos linfáticos y más del 50% lo hacen también por la sangre, de manera que las metástasis son habituales, sobre todo en el hígado, el peritoneo (la membrana que reviste por dentro la cavidad abdominal y sus órganos) o los pulmones.
Los estudios indican que un elevado número de cánceres de páncreas presentan alteraciones en unos genes concretos , el gen ras y el gen p53, ya sea en uno de ellos o muchas veces en ambos.
Síntomas
Por desgracia, la mayoría de estos tumores se detectan en un estado avanzado . El dolor de abdomen es el síntoma más habitual de este tipo de tumores. Suele tratarse de un dolor sordo y constante que se ubica en la zona superior e izquierda del abdomen y que se extiende hacia la espalda. Con frecuencia los pacientes lo describen como si les apretase un cinturón . Suele ser más frecuente durante la noche, no deja dormir. Se suele agravar al comer y al tumbarse, mientras que los pacientes explican un ligero alivio al inclinarse hacia adelante.
La pérdida de peso debida a un déficit de absorción de nutrientes suele ser el síntoma más precoz . Suele acompañarse de falta de apetito, cansancio importante y diarreas, al no poder digerir bien los alimentos por la alteración en la producción de las hormonas digestivas que produce el páncreas.
Otros síntomas habituales de los pacientes con cáncer de páncreas pueden ser:
Ictericia (coloración amarillenta de la piel por acumulación de bilirrubina).
Náuseas y vómitos .
Intolerancia a la glucosa o diabetes .
Pancreatitis aguda .
Es difícil diagnosticar el cáncer de páncreas en sus etapas tempranas porque, cuando da síntomas, en general, ya suele estar en un estado avanzado, y muchas veces los síntomas son tan inespecíficos que se tarda en acudir al médico. Hoy en día no existen pruebas de detección precoz ni se realiza ningún tipo de cribaje para el cáncer de páncreas.
Cómo se diagnostica
No existen marcadores específicos para el cáncer de páncreas que se puedan detectar en una analítica. Existen unos marcadores tumorales, el CEA y el CA 19.9 , que pueden estar elevados en los pacientes con cáncer de páncreas, pero son muy poco específicos. Es decir, pueden estar elevados como no estarlo y estos marcadores pueden aparecer elevados también por otros motivos que no sean el cáncer de páncreas, de manera que no son una herramienta útil para el diagnóstico de este tumor . Estos marcadores tumorales, como todos, son útiles, si están elevados, para valorar la respuesta a los tratamientos de quimioterapia, pero no para el diagnóstico de la enfermedad.
En aquellos pacientes con un elevado riesgo de padecer un cáncer de páncreas por una predisposición genética y familiar se pueden hacer estudios genéticos para valorar si existen alteraciones en ciertos genes que aumenten el riesgo de sufrir esta enfermedad . Ahora bien, que estos genes estén alterados no implica necesariamente que se vaya a padecer la enfermedad, sino que existe un riesgo mayor que el de otras personas.
Las principales herramientas para el diagnóstico del cáncer de páncreas siguen siendo los síntomas del paciente y las diferentes pruebas de imagen, como la ecografía, la ecoendoscopia, el escáner, la resonancia magnética nuclear o la tomografía por emisión de positrones (PET) . En una analítica de sangre se puede apreciar la elevación de ciertas enzimas hepáticas, como la lipasa y la amilasa, así como alteraciones de los niveles de glucosa o bilirrubina en determinados casos. Una vez se tiene el diagnóstico de sospecha se confirmará con la toma de una muestra de tejido del tumor mediante una PAAF o punción aspiración con aguja fina .
Tratamiento
El tratamiento del cáncer de páncreas dependerá del estadio. Por desgracia tan solo un 10%-20% de los cánceres de páncreas pueden ser tratados mediante cirugía cuando se diagnostican . En el resto de los casos las opciones quirúrgicas son paliativas. La quimioterapia y la radioterapia pueden ayudar a aumentar la supervivencia.
Con todo, el adenocarcinoma de páncreas es uno de los tumores que presentan un peor pronóstico. Se estima que solamente un 5% de las personas que padecen este tipo de tumor sobreviven más allá de 5 años desde el momento del diagnóstico. La mayoría de las muertes se producen a lo largo del primer año desde que se detecta la enfermedad.
LO QUE PODEMOS HACER…
Lo que está en nuestras manos para prevenir este tipo de cáncer, infrecuente pero muy agresivo, es modificar los factores de riesgo que pueden propiciarlo :
Abandonar el consumo de tabaco.
Mantener una dieta sana y equilibrada.
Limitar el consumo de alcohol.
Realizar una actividad física moderada.
Evitar la exposición laboral a ciertos productos químicos.

Artículo especializado
Las Consecuencias que Conlleva tener Cáncer de Ovario
En la sociedad actual, donde existe un auténtico “bombardeo” de información, es posible que hayamos recibido mensajes contradictorios acerca del padecimiento del cáncer de ovario, que pueden desembocar en confusión , alarma o preocupación innecesaria . Por eso, vamos a aclarar conceptos y tratar desde dentro un tema tan sensible para la mujer como es el cáncer de ovario.
Qué consecuencias puede tener
El diagnóstico de cáncer de ovario conlleva una cirugía , y un tratamiento médico que durante algunos meses generará un cambio significativo en la paciente y su entorno más cercano. La extirpación quirúrgica de ambos ovarios, de las trompas de Falopio y del útero conlleva la pérdida de la fertilidad, por lo que las mujeres que quieran tener hijos deberán someterse a una intervención de preservación de la fertilidad previa al tratamiento del cáncer. En el caso de que sea necesario extirpar los ganglios linfáticos situados en la pelvis podría dañarse el sistema linfático, provocándose una linfedema, un trastorno en el que el líquido linfático se acumula en las piernas y provoa su hinchazón.
Cómo se produce
El cáncer de ovario es un tumor, generalmente maligno, que se asienta en los tejidos que conforman este órgano incluido en el aparato reproductor femenino. El ovario es la glándula sexual femenina que produce óvulos y hormonas sexuales (estrógenos, progesterona…). Están situados a ambos lados del útero y serían el equivalente a los testículos masculinos.
El cáncer de ovario es más frecuente en los países industrializados de Europa Occidental, Israel, Canadá y EEUU , y representa entre el 4 y el 5% de los tumores femeninos. Es más común en las edades medias de la vida; la mayoría se diagnostican entre los 45 y los 75 años.
Factores de riesgo
De un modo general, en el medio que nos rodea, existen más de 100 agentes de los cuales se dispone de evidencia científica contrastada para poder asegurar que provocan cáncer a los humanos. En otros casos, no es tan fácil establecer esa relación.
En el caso concreto del cáncer de ovario no se conocen en profundidad los factores de riesgo que pueden inducir a la aparición de la enfermedad. Sin embargo, se han observado algunas circunstancias que pueden influir en su aparición, como son las siguientes:
Edad : como en la mayoría de los tumores, según avanza la edad también lo hace el riesgo de que la mujer sufra cáncer de ovario. No es frecuente antes de los 40 años.
Herencia genética : se calcula que sólo entre el 5% y el 10% de los tumores son hereditarios, es decir, son consecuencia de alteraciones genéticas heredadas de los progenitores. En estos casos, si la madre de una mujer y/o una hermana han presentado cáncer de ovario, de mama o de útero, ésta tiene un mayor riesgo de desarrollar la enfermedad que en la población general.
En las familias con predisposición hereditaria a padecer ciertos tipos de tumores se observan varios individuos integrantes de la familia afectados por el mismo tipo de cáncer (o de diferentes pero relacionados), así como diversas generaciones afectadas (abuela, madre, hija). Generalmente, los tumores hereditarios se diagnostican a una edad más joven de la habitual. El riesgo de padecer cáncer de ovario se correlaciona directamente con anomalías en los genes BRCA1 y BRCA2 (cuando estos genes funcionan adecuadamente, en realidad nos protegen de la aparición de tumores, pero cuando están alterados, aumentan el riesgo de desarrollar cáncer antes de cumplir los 70 años).
No haber tenido hijos : en diversos estudios se ha observado que las mujeres que han tenido varios hijos (multíparas) tienen menos riesgo de desarrollar cáncer de ovario que las que no han tenido hijos (nulíparas).
Anticonceptivos hormonales (ACH) : los anticonceptivos hormonales son fármacos que incluyen hormonas propias del ciclo menstrual femenino (estrógenos y progestágenos), que se utilizan como método de anticoncepción principalmente o, para otras finalidades como la regulación de los síntomas de la endometriosis, por ejemplo.
Vienen en múltiples formatos o presentaciones (comprimidos, anillos vaginales, parches, inyectables…) y se puede elegir el que se adapta mejor a nuestro estilo de vida y necesidades. Se ha constatado que los ACH tienen un efecto protector frente al padecimiento de cáncer de ovario y de endometrio uterino, pero, como contrapartida, son preparaciones que aumentan el riesgo de padecer cáncer de mama, de cérvix uterino y también de hígado.
Terapia hormonal sustitutiva (THS) : es un tratamiento con hormonas que se puede recomendar durante la menopausia para aliviar sus síntomas molestos (p.ej. sofocos, sequedad vaginal, etc.) Probablemente, si estás en la etapa menopáusica y has padecido estos síntomas que alteran tanto la calidad de vida, te habrás planteado si eres una candidata óptima para recibir este tipo de tratamientos. Plantéaselo a tu ginecólogo para poner sobre la mesa los beneficios y riesgos que conllevan, ya que este tipo de tratamientos aumentan el riesgo de padecimiento de cáncer de ovario, de mama y de endometrio, así como también de enfermedades cardiovasculares . Por ello, se intenta limitar al mínimo su uso o, en caso de utilizarse, tomarse a las mínimas dosis útiles y durante el mínimo tiempo posible, debido a que el riesgo disminuye progresivamente una vez se abandona el tratamiento.
Otros factores de riesgo serían: seguir dieta rica en grasas, el sobrepeso, el consumo de tóxicos como el tabaco, alcohol, y /o la exposición a radiaciones ionizantes (Rx, TC, radioterapia…), entre otros.
QUÉ PROTEGE
Los embarazos, la terapia anticonceptiva y dar lactancia materna protegen del cáncer de ovario, y en menor medida también son protectores el ejercicio moderado y seguir una dieta pobre en grasas animales y rica en frutas y vegetales.
Síntomas
Por lo general, el cáncer de ovario produce pocos síntomas, o directamente ninguno , hasta etapas de desarrollo avanzadas. El primer síntoma puede ser un ligero malestar en la parte inferior del abdomen, o hinchazón de este, pero la hemorragia uterina no es frecuente.
Diagnóstico
Debido a la escasez de síntomas anteriormente mencionada, la mayoría de los casos plantean un diagnóstico difícil y se detectan cuando la enfermedad ya está avanzada .
Desgraciadamente, además de ello, no existe actualmente ningún método eficaz que facilite el diagnóstico precoz del cáncer de ovario (no existen pruebas que cumplan los requisitos necesarios en la población general).
Tratamiento y pronóstico
El tratamiento incluye la intervención quirúrgica . En función de los hallazgos de la cirugía, será necesario complementar el tratamiento con quimioterapia .
Es importante tener en cuenta que el diagnóstico precoz permite reducir el impacto sobre la salud y la calidad de vida de la paciente, así como mejorarse el pronóstico de supervivencia .

Artículo especializado
Pruebas para Detectar el Cáncer Colorrectal
Es así, no existe una forma eficaz de prevenir la aparició n de un cáncer colorrectal, el tumor maligno más frecuente en nuestro país (con más de 40.000 nuevos casos cada año). Por suerte, contamos con pruebas de detección precoz y otras que nos pueden ayudar al diagnóstico y posterior tratamiento. Además, evitando algunos factores de riesgo podemos reducir la probabilidad de que aparezca. Por tanto, si hay algo en nuestra mano para evitarlo… ¡a qué esperamos!
Cómo se produce
El cáncer colorrectal es el tumor que afecta al colon (conocido como intestino grueso) o al recto (tramo final del intestino de unos 15 cm de longitud que desemboca en el ano). Se produce cuando algunas células del intestino sufren una mutación genética que provoca que se reproduzcan sin control, generando entonces una tumoración que crece continuamente afectando a los tejidos de alrededor. Esas células, frecuentemente obtienen la capacidad de entrar en el torrente sanguíneo , trasladarse a otros órganos del cuerpo, implantarse en esos órganos y seguir creciendo sin control, originando así las metástasis.
Causas
No existe una causa conocida que explique la aparición un cáncer colorrectal, pero sí hay varios factores que pueden favorecer su aparición:
Edad: suele presentarse en pacientes de más de 50 años. La edad media de aparición se sitúa en torno a los 65-70 años .
Sexo: existe una mayor predisposición en el sexo masculino (se diagnostican más de 24.000 casos nuevos anualmente en hombres frente a los 16.000 en mujeres).
Antecedentes familiares: tan solo un 5% de los cánceres de colon detectados se consideran genéticamente hereditarios (traspasados de padres a hijos a través de alguna mutación genética). Sin embargo, las personas con antecedentes familiares de cáncer de colon tienen aproximadamente el doble de probabilidad de presentar esta enfermedad a lo largo de su vida si los comparamos con personas sin antecedentes familiares de cáncer colorrectal.
Antecedentes personales de otros cánceres : las personas que han sufrido un cáncer colorrectal tienen un riesgo superior al de otras personas de presentar otro cáncer. También existe un riesgo superior en las mujeres que han presentado un cáncer de ovario o de útero.
Enfermedades intestinales: algunos tipos de enfermedades que afectan al intestino pueden aumentar el riesgo de padecer cáncer colorrectal , como por ejemplo la Enfermedad Inflamatoria Intestinal, la Poliposis Adenomatosa Familiar o el Síndrome de Gardner, entre otras.
Pólipos en el colon : los pólipos en el intestino grueso tienen riesgo de acabar degenerando en cáncer colorrectal a lo largo de los años. Por ese motivo, cuando se detectan a través de alguna prueba complementaria se recomienda su extirpación.
Obesidad : se considera que aproximadamente un 17% de los casos de cáncer colorrectal son atribuibles a la obesidad. Esto no quiere decir que la obesidad ocasione en sí misma el cáncer, pero facilita su aparición y dificulta su control, por lo que, erradicando la obesidad podríamos evitar el 17% de casos de cáncer colorrectal, además de prevenir muchas otras enfermedades.
Nutrición : el consumo de carnes rojas y carnes procesadas se relaciona claramente con el riesgo de cáncer colorrectal. Esto no quiere decir que no haya que consumir este tipo de carnes, pero sí que debe evitarse su abuso y consumirlas dentro de una dieta equilibrada.
Tabaquismo : aunque no es uno de los tumores que más claramente se relacionan con el tabaquismo, el cáncer colorrectal es más frecuente en personas fumadoras que en las no fumadoras.
Raza: las personas de raza negra tienen una probabilidad de desarrollar un cáncer colorrectal superior al de otras razas.
Síntomas
Gran parte de los casos de cáncer colorrectal no presentan síntomas hasta fases avanzadas , pero en muchos otros casos aparecen un conjunto de síntomas que, correctamente interpretados, pueden ayudarnos a diagnosticar precozmente la enfermedad. Los más frecuentes son:
Alteraciones del ritmo gastrointestinal : alternar deposiciones sólidas con deposiciones líquidas de manera repetida.
Sangrado con las deposiciones .
Tenesmo : sensación de vaciado incompleto tras la deposición.
Pérdida de peso sin causa aparente .
Anemia ferropénica (por déficit de hierro) sin otra causa que lo justifique
Existen otras manifestaciones pero que pueden ser muy inespecíficas y se presentan en muchas otras enfermedades intestinales, como por ejemplo molestias abdominales, distensión abdominal, cansancio y fatiga.
Detección precoz
Dado que el cáncer colorrectal suele aparecer en personas de más de 50 años , en muchas localidades de nuestro país se han empezado a realizar pruebas de screening (detección precoz) basadas principalmente en la detección de sangre oculta en heces . Estas pruebas consisten en la recogida de tres muestras de heces en las que se analiza si existen restos de sangre. En caso de que la prueba sea positiva , se debe continuar un estudio para comprobar el origen de la sangre, ya que problemas como hemorroides o fisuras anales pueden ser los causantes.
¿SABÍAS QUE…
La detección de marcadores tumorales (CEA) en el análisis sanguíneo no debería utilizarse como método de detección precoz de cáncer colorrectal, puesto que, por un lado, el 40% de los cánceres colorrectales no elevan los marcadores tumorales y, además, existen muchos casos de falsos positivos (pacientes que tienen marcadores elevados y sin embargo no presentan cáncer de colon).
Diagnóstico
El diagnóstico definitivo del cáncer colorrectal se realiza mediante la realización de una colonoscopia (tubo flexible con una cámara que se introduce por el ano y nos permite ver el interior del intestino). Con ella podemos visualizar el tumor y recoger muestras (biopsias) que nos darán el diagnostico específico de qué tipo de tumor se trata.
Hay otras pruebas diagnósticas que nos pueden ayudar en el diagnóstico o en el seguimiento del cáncer colorrectal, como la TAC abdominal , el enema de bario , el estudio de marcadores tumorales , entre otros, pero ninguno de ellos sustituye la colonoscopia para el diagnóstico definitivo.
SOBRE LA COLONOSCOPIA…
Es importante destacar que la colonoscopia es una prueba invasiva , no exenta de riesgos, incluso a veces potencialmente graves. En muchas ocasiones nos encontramos pacientes que, sin tener ningún factor de riesgo o ninguna sintomatología, quieren que se les realice una colonoscopia para descartar la existencia de un cáncer colorrectal. En esas ocasiones, se debe explicar correctamente los riesgos que conlleva la realización de dicha prueba y evaluar si compensa asumir esos riesgos frente a la posibilidad de detectar un tumor de colon en una persona asintomática y sin factores de riesgo.
Tratamiento
El tratamiento del cáncer colorrectal dependerá de múltiples factores, entre los que destacan la localización del tumor y su grado de diseminación (tanto local, en la zona del intestino en la que se ha originado, como a distancia, si ha hecho metástasis).
En la mayor parte de los casos, el tratamiento es quirúrgico acompañado de quimioterapia antes y/o después de la operación. En los casos de cáncer de recto (parte final del intestino antes de desembocar en el ano) se puede añadir también tratamiento con radioterapia.
Prevención
No existe una forma eficaz de prevenir la aparición de un cáncer colorrectal, aunque evitando los factores de riesgo ya explicados, podemos disminuir la probabilidad de que aparezca .
Pronóstico
La supervivencia global del cáncer colorrectal a los cinco años se estima en torno a un 63%, es decir, que el 63% de los pacientes diagnosticados vivirán más de cinco años. El pronóstico dependerá mucho de lo evolucionada que esté la enfermedad en el momento de su detección . Así, en los casos en los que el diagnóstico se realiza muy tempranamente (estado A de la enfermedad), la supervivencia puede aumentar hasta el 90%.
Artículo especializado
Problemas de Tiroides en Niños
Sí. A los niños también se les puede alterar el tiroides . El profesional especialista que los atiende es el endocrinólogo pediátrico.
Sobre el tiroides…
El tiroides es una glándula situada en la parte anterior del cuello (a la altura de “la nuez”), r esponsable de la secreción de las hormonas tiroideas (tiroxina o T4 y triyodotironina o T3), imprescindibles para el normal funcionamiento del organismo humano. Estas hormonas cumplen un papel relevante en los procesos metabólicos básicos y con repercusión sobre todos los órganos del cuerpo, así como también participan en el proceso de crecimiento y desarrollo de todos los tejidos corporales.
Solamente se puede asegurar que la función tiroidea es normal cuando los niveles en sangre de TSH (tirotropina: hormona cerebral), T4, T4 libre y T3 son normales.
Hipotiroidismo
El hipotiroidismo o insuficiencia tiroidea se produce por una disminución de la actividad biológica de las hormonas tiroideas a nivel de los órganos, que suele acompañarse también de reducción de sus niveles plasmáticos (en sangre).
Frecuencia
Es la endocrinopatía más frecuente , pues afecta al 0’15% de niños y adolescentes. El hipotiroidismo congénito (presente al nacimiento) ocurre en uno de cada 2.000-3.000 nacidos vivos y es una de las causas de retraso mental prevenible más frecuentes. Puede ser esporádico o hereditario y, según su evolución, alrededor del 90% de los casos son hipotiroidismos permanentes y el resto son transitorios. Los casos transitorios se resuelven en los primeros meses o años de vida. Algunas de sus causas son el déficit de yodo o el exceso de éste (por uso de antisépticos, exposición a contrastes yodados o determinados medicamentos durante la gestación).
Tipos
Como en los adultos, el hipotiroidismo puede ser primario (originado en la glándula tiroidea), que es lo más frecuente, o central (cerebral, de origen hipofisario o hipotalámico), mucho más raro. Puede, además, ser clínico (aumento de TSH y T4L baja) o subclínico (aumento de TSH y T4L normal).
Causas
En los países desarrollados la causa más común de hipotiroidismo adquirido (no congénito) es la tiroiditis crónica autoinmune o tiroiditis de Hashimoto , la cual, a su vez, es más frecuente en mujeres que en varones. En países en vías de desarrollo, el déficit de yodo en la dieta juega también un papel importante.
Algunos ejemplos de otras enfermedades menos frecuentes, causantes del subtipo central, podrían ser enfermedades infecciosas cerebrales como la tuberculosis, malformaciones cerebrales hereditarias o adquiridas, tumores cerebrales como el craneofaringioma o el adenoma hipofisario o inflamaciones como la hipofisitis autoimune…
Signos y síntomas
La manifestación más habitual en la niñez es la disminución en la velocidad de crecimiento , que origina una talla baja. También es habitual el bajo rendimiento escolar.
Otros muchos síntomas pueden ser: la apatía, la hipoactividad, la intolerancia al frío, la piel seca, el estreñimiento, el pelo escaso y fino, dolores musculares, retraso del desarrollo puberal, hipotensión arterial… entre otros muchos ejemplos.
Si es de tipo central, el niño también puede padecer dolores de cabeza, alteraciones visuales y otros déficits hormonales.
El tipo subclínico generalmente es asintomático o con síntomas muy sutiles o poco llamativos.
Diagnóstico
Por su ubicación, el tiroides puede explorarse directamente por palpación . El hallazgo más frecuente es la presencia de un bocio (inflamación de la glándula, en un 40% de los casos).
El hipotiroidismo congénito podrá ser detectado y, por tanto, precozmente tratado, gracias a la prueba de cribado neonatal o “prueba del talón”, que se practica desde los años 70-80 en todas las maternidades de nuestro país a los niños recién nacidos. Concretamente, se realiza mediante la detección de la TSH sobre muestra de sangre seca que impregna un papel absorbente estandarizado, extraída a las 48 horas de vida del recién nacido.
Tratamiento
El hipotiroidismo se trata con levotiroxina sódica sintética (LT4) por vía oral (Eutirox ®) , en dosis única diaria, en ayunas, unos 30 minutos antes de la toma de alimento para no interferir en su absorción intestinal. Las formas de presentación farmacéutica por vía oral son dos: comprimidos de 25, 50, 75, 100 y 150 microgramos y gotas, para uso hospitalario (1 gota= 5 microgramos), de más fácil administración en recién nacidos y lactantes.
Los elementos fundamentales en el tratamiento del hipotiroidismo son:
Iniciar el tratamiento precozmente.
Administrar una dosis inicial adecuada en el recién nacido.
Conseguir un correcto equilibrio terapéutico mediante un riguroso control evolutivo.
En el hipotiroidismo subclínico, las indicaciones de tratamiento con levotiroxina son:
Si los valores de TSH son >10: Tratar.
Si los valores de TSH son entre 5-10: Tratar si hay síntomas de disfunción tiroidea o si hay enfermedad autoinmune.
Hipertiroidismo
Es una alteración debida al exceso de producción y secreción de hormonas tiroideas.
Causa y frecuencia
La alteración autoinmune debida a la producción de anticuerpos estimuladores contra determinadas estructuras proteicas (receptores de TSH) llamada enfermedad de Graves es la causa más frecuente de hipertiroidismo en la edad pediátrica (95% de los casos). No obstante, ésta es una enfermedad poco diagnosticada en esta especialidad, siendo rara en menores de cinco años y más frecuentemente diagnosticada en la etapa de la pubertad y en el sexo femenino (5:1). El resto de causas sólo condicionan el 5% del total de los casos de hipertiroidismo.
Si una madre gestante padece enfermedad de Graves puede provocar hipertiroidismo fetal o neonatal a su hijo.
Signos y síntomas
Algunos ejemplos son:
Aumento de la velocidad de crecimiento y aceleración de la edad ósea sin repercusión.
Bocio (en el 100% de los casos).
Oftalmopatía (afectación ocular, 50-75% de los niños).
Dermopatía (enfermedad de la piel, denominada mixedema pretibial, de muy rara aparición).
No parece tener repercusión sobre el desarrollo puberal.
Aumento del apetito, pero pérdida de peso, taquicardia, nerviosismo, temblor, deposiciones frecuentes, intolerancia al calor, caída de cabello…
Los hijos de madres con enfermedad de Graves pueden padecer prematuridad o retraso de crecimiento intrauterino. El pronóstico a corto plazo viene determinado por la insuficiencia cardiaca y, a largo plazo, por la craneosinostosis (soldadura precoz de los huesos craneales) o retraso psicomotor.
Diagnóstico
Determinación de los niveles de hormonas tiroideas en sangre: los valores de TSH estarán suprimidos y los de T4L y T3 elevados para la edad.
Tratamiento
Existen tres opciones:
Fármacos antitiroideos (tionamidas, solución de Lugol) y betabloqueantes.
Tratamiento con radioyodo.
Cirugía.
La elección de una u otra opción se realiza tras valorar riesgos y beneficios en cada caso concreto. La mayoría de endocrinólogos infantiles recomienda comenzar con fármacos con la esperanza de que el paciente alcance la remisión y se mantenga con un tiroides normofuncionante. El radioyodo suele usarse cuando no es completamente exitoso el tratamiento farmacológico o se padecen sus efectos secundarios, preferentemente en niños mayores de 10 años. En edad pediátrica la cirugía no suele ser el tratamiento inicial, salvo en niños menores de cinco años con grandes bocios, siendo la técnica de elección la tiroidectomía total (extirpación completa del tiroides).
Artículo especializado
Qué Es y Cómo Tratar el Sarcoma
El concepto de “sarcoma de partes blandas” incluye un grupo heterogéneo de tumores malignos que afecta a los llamados tejidos blandos (tejido graso, músculos, tendones, vasos sanguíneos, nervios y tejidos profundos de la piel). Se clasifican s egún su línea de diferenciación y en función del tejido adulto al cual se asemejan. Su origen está en el denominado tejido conjuntivo o de sostén del organismo.
¿Son frecuentes este tipo de tumores?
Son tumores poco frecuentes , suponen un 1% del total de tumores malignos y contribuyen con un 2% en la mortalidad por cáncer. Su incidencia es levemente superior en hombres. Pueden aparecer a cualquier edad (incluso en la infancia), aunque la edad de mayor prevalencia es entre los 40 y los 60 años.
¿Qué pronóstico tienen?
Su pronóstico va a depender de su grado de diferenciación : cuanto menos diferenciado, peor pronóstico. Por ello, es importantísimo realizar un estudio histológico para prever su comportamiento. Un sarcoma bien diferenciado sería de bajo grado de malignidad o grado 1 y uno poco diferenciado sería de alto grado de malignidad o grado 3. Asimismo, debe valorarse el comportamiento local del tumor. Un sarcoma localizado, sin expansión local ni metástasis a distancia es de mejor pronóstico, mientras que un sarcoma de peor pronóstico tendrá un comportamiento localmente agresivo con invasión local y a distancia (metástasis). Los tumores de diferenciación intermedia suelen recidivar localmente, pero rara vez dan metástasis a distancia. Afortunadamente, las formas de comportamiento menos agresivo son mucho más frecuentes que los agresivos (con una relación: 100/1).
¿Cómo se originan?
Se ha encontrado una posible asociación con factores genéticos o ambientales como radioterapia previa, infecciones víricas, enfermedades hereditarias o deficiencias inmunitarias. Sin embargo, la mayoría de sarcomas se originan de forma espontánea y sin causa aparente que los desencadene.
¿Qué síntomas encontraremos?
En general, es frecuente el d ebut en forma de una masa indolora en cualquier localización (la mayoría de casos se da en las extremidades: piernas y brazos). Otras posibles ubicaciones pueden ser: tronco, cabeza, cuello, abdomen, sinovial (sobre todo cerca de grandes articulaciones), útero, etc.
En caso de tratarse de un sarcoma de localización superficial será de más fácil detección. En caso de localización profunda su detección es más tardía por lo que puede alcanzar un gran tamaño antes de manifestarse.
Al aumentar de tamaño, durante su progresión, puede afectar a estructuras vecinas provocando, por ejemplo, dolor.
Es importante realizar un diagnóstico diferencial de cualquier tumoración de partes blandas siendo especialmente relevantes las tumoraciones de tamaño superior a 5 centímetros o bien las de crecimiento rápido o ubicación profunda.
¿Qué tipos de sarcomas podemos encontrar?
Los diferenciaremos según el subtipo histológico. Existen más de 50 subtipos diferentes de sarcoma, dependiendo del tipo de célula por el que están constituidos, aunque poseen características comunes.
La determinación del grado histológico nos permitirá clasificar los sarcomas según su grado de agresividad. Como ya hemos citado, un sarcoma será de bajo grado o grado 1 o de alto grado (grados 2-3), siendo el grado 3 el más agresivo con crecimiento rápido y mayor tendencia a desarrollar metástasis en su evolución Los sarcomas de grado I tienen un crecimiento más lento y menos frecuentemente metastatizan a distancia, aunque pueden recidivar localmente.
E l pulmón es la localización más frecuente de metástasis a distancia siendo la causa de muerte en un gran porcentaje de casos. En caso de sarcomas de localización intraperitoneal es frecuente encontrar metástasis hepáticas.
La aparición de la recidiva local y/o las metástasis a distancia se produce, sobre todo, dentro de los 2-3 primeros años en los sarcomas de alto grado siendo en un periodo más prolongado en los de bajo grado.
¿Cómo se llega al diagnóstico de sarcoma?
Por tratarse de una lesión de partes blandas precisamos de la realización de una resonancia magnética para estudiarla . Nos aportará información sobre el tamaño, la ubicación y su comportamiento local.
Para identificar el tipo histológico y sus características de diferenciación se debe realizar un estudio anatomopatológico de una muestra obtenida generalmente por biopsia. Para la obtención de la muestra se suele realizar la llamada Punción-aspiración con aguja fina (PAAF) guiada mediante un control con ecografía o TAC. Con ella obtenemos un cilindro con el tejido a analizar. Es importante contar con un equipo con un alto bagaje para la obtención de la muestra.
En caso de que se confirme el diagnóstico se debe continuar el estudio para saber su comportamiento . El estudio de extensión nos indicará si el tumor está localizado o si presenta metástasis. Para ello, muy probablemente se solicitará la tomografía.
Una vez completado el estudio y conociendo el tamaño, su localización y el grado histológico se realizará la propuesta terapéutica para cada caso, de forma específica.
¿Qué tratamiento se realizará?
Teniendo en cuenta las características y el comportamiento del tumor se optará por el tratamiento indicado. Se contempla la cirugía, la radioterapia y la quimioterapia. En caso de un tumor localizado, se perseguirá la curación. En caso de un tumor diseminado se realizará tratamiento paliativo con la finalidad de asegurar el bienestar del paciente.
De cualquier manera, debemos realizar un seguimiento cuidadoso de todos los casos .

Artículo especializado
Descubre las Causas del Cáncer de Piel
Como cualquier órgano del cuerpo, la piel puede desarrollar tumores malignos o cánceres. Al estar en contacto con el exterior, y muy especialmente con la luz solar, que puede provocar alteraciones en las células, los cánceres de piel son muy frecuentes . Por fortuna, al ser visibles a simple vista, pueden curarse con un diagnóstico precoz y una actuación terapéutica correcta.
¿Qué tipos de cáncer de piel hay?
Existen centenares de tipos de cánceres de la piel, pero los más frecuentes son tres: el carcinoma basocelular, el carcinoma escamoso (también llamados “cáncer de piel no melanoma”) y el melanoma. De ellos, el más grave puede ser el melanoma , por su capacidad de extenderse e invadir otros órganos y provocar la muerte.
¿Cómo se produce el cáncer de piel?
En cualquiera de los tres tipos de cáncer mencionados, la luz solar parece ser el factor más claramente implicado , especialmente el haber padecido muchas quemaduras solares en la infancia o el permanecer muchas horas al sol sin protección adecuada. No es el único factor, ya que vemos melanomas y carcinomas en zonas donde no toca el sol, como las axilas o las plantas de los pies. El tabaco, otras radiaciones o factores genéticos parecen jugar un papel, aunque menos importante que el sol.
Síntomas del cáncer de piel
El carcinoma basocelular suele manifestarse como un granito brillante de crecimiento muy lento o una herida que no cura y crece.
El carcinoma escamoso puede tener un aspecto algo similar, aunque forma más costra, y el crecimiento es más rápido.
El melanoma es muy diferente, ya que se manifiesta como una peca especialmente irregular, asimétrica o de diferentes colores (sobre todo si hay un color muy negro), que puede aparecer sobre una peca presente anteriormente y que ha cambiado, o sobre cualquier otra zona de la piel sin pecas.
Diagnóstico del cáncer de piel
Es importantísimo acudir al dermatólogo a revisarse periódicamente la piel, especialmente si se han padecido muchas quemaduras solares, si hay historia de cáncer de piel en la familia, y si se es una persona de piel y ojos claros.
Los dermatólogos estamos muy bien entrenados para reconocer posibles cánceres de piel, y utilizamos unos dispositivos para la exploración llamados dermatoscopios , que son como pequeños microscopios portátiles que permiten ver el interior de la piel. En caso de necesitar extirpar alguna lesión por sospechosa de cáncer debe hacerse con biopsia para saber el tipo del tumor y para asegurar que está completamente extirpado.
Tratamiento del cáncer de piel
El tratamiento pasa por extirpar el tumor con unos márgenes suficientes para asegurar que no volverá a crecer, e intentando obtener unos resultados estéticos aceptables, ya que una gran mayoría de los cánceres “no melanoma” aparecen en la cara.
En casos de carcinomas basocelulares de tipo infiltrante, existe una técnica denominada cirugía micrográfica de Mohs que asegura la curación en prácticamente el 100 % de los casos. En casos no operables es posible utilizar radioterapia. También existe una quimioterapia llamada vismodegib para los carcinomas basocelulares múltiples, gigantes o no operables.
En el caso del melanoma , los márgenes de extirpación dependerán del grosor del tumor en el momento de extirparlo. Además, en función de la fase de crecimiento en que se encuentra, puede ser necesario buscar afectación de los ganglios (ganglio “centinela”). Asimismo, el dermatólogo u oncólogo buscará extensión de la enfermedad por otros órganos del cuerpo mediante radiografías, TACs, o PETs (diferentes pruebas radiológicas). Para el melanoma con metástasis el pronóstico es malo. Existen diferentes tipos de quimioterapia aprobados.
Medidas preventivas del cáncer de piel
Las medidas preventivas del cáncer de piel se basan en una correcta protección solar y en la detección precoz mediante autoexploración o visita al dermatólogo . En personas con elevado riesgo de melanoma por una historia familiar, por haber padecido muchas quemaduras solares o presentar muchas pecas, se realiza un mapeado de todo el cuerpo con una técnica de microscopía de epiluminiscencia, con el fin de detectar cambios en las pecas o pecas nuevas que pueden ser melanomas incipientes. Un melanoma detectado y extirpado a tiempo puede estar completamente curado.
Artículo especializado
Es Hereditario el Cáncer de Pulmón
Hay datos para la esperanza respecto al cáncer de pulmón, y es que, aunque en la actualidad es el tumor con mayor mortalidad de nuestro país , en aquellos casos en los que se detecta de forma precoz, la supervivencia puede llegar al 70%. El tabaco es el principal causante de este tipo de cáncer.
¿Qué es?
El cáncer de pulmón se produce cuando algunas células pulmonares sufren una mutación que provoca que se multipliquen sin control. Esto genera una masa de células que va creciendo continuamente, de forma desestructurada. Este crecimiento puede ir afectando a las estructuras cercanas, pero también puede producirse el hecho de que alguna de las células tumorales penetre en algún vaso sanguíneo y se traslade a otro órgano del cuerpo originando una metástasis.
¿Cuánto nos afecta?
El cáncer de pulmón, a nivel global, es el tercer cáncer con más frecuencia en nuestro país , por detrás del cáncer de próstata o de colon. Cada año se detectan aproximadamente unos 60 nuevos casos de cáncer de pulmón por cada 100.000 habitantes. Sin embargo, si diferenciamos entre su prevalencia por sexos, vemos que ésta es muy superior en hombres, entre los que se detectan unos 22.500 casos anuales, comparado con los 5.900 casos detectados en mujeres. Esta diferencia por sexos se aprecia también en la evolución de la incidencia en los últimos años, ya que en los hombres la incidencia ha disminuido más de un 8% en la última década comparado con el aumento de incidencia del 93% en mujeres.
Pese a ser el tercer cáncer más frecuente en nuestro país, el cáncer de pulmón es el que más muertes provoca , con algo más de 21.000 fallecimientos anuales. Así pues, tan solo algo más del 10% de pacientes diagnosticados de cáncer de pulmón sobrevivirá más allá de 5 años. Sin embargo, esta cifra dependerá en gran medida del tipo de cáncer de pulmón y de su extensión en el momento del diagnóstico, llegando a supervivencias superiores al 70% cuando el diagnóstico es precoz.
¿Podemos evitarlo?
La única forma efectiva de disminuir el riesgo de cáncer de pulmón es evitando los factores de riesgo que favorecen su aparición. Y entre ellos hay uno que destaca por encima de todos. El tabaco.
Bien es cierto que existen casos de cáncer de pulmón en personas no fumadoras, pero alrededor del 90% de los casos se presenta entre los fumadores . Y si tenemos en cuenta que, según los últimos datos, alrededor de un 30% de la población es fumadora habitual, podemos concluir que el consumo habitual de tabaco aumenta en un 2.000% el riesgo de padecer cáncer de pulmón (21 veces más riesgo).
La exposición pasiva al tabaco (el fumador pasivo) tiene un riesgo aumentado también de desarrollar cáncer de pulmón, estimándose dicho riesgo en torno a un 20% superior al de una persona no expuesta al humo del tabaco.
Existen otros factores de riesgo para el desarrollo del cáncer de pulmón, como la contaminación del aire, la exposición al radón, asbesto, arsénico, etc., pero son de menor relevancia comparado con el riesgo que ocasiona el tabaquismo.
¿Cómo se manifiesta?
Uno de los principales problemas del cáncer de pulmón es que los síntomas que provoca son poco específicos y muchas veces se presentan de forma tardía , provocando que el diagnóstico se efectúe cuando el tumor ya está extendido:
La tos: es el síntoma más común del cáncer de pulmón, muchas veces acompañada de expectoración. El principal problema es que la tos es uno de los síntomas más frecuentes en una consulta de salud. La principal causa de tos son los cuadros catarrales o infecciones respiratorias.
La expectoración con sangre : llamada hemoptisis. Es un síntoma más específico y que nos llevará a iniciar un estudio radiológico, aunque la principal causa de hemoptisis sigue siendo las sobreinfecciones pulmonares.
La falta de aire: llamada disnea. Es un síntoma poco específico y puede estar causado tanto por infecciones pulmonares como por problemas cardíacos, entre otros.
El dolor torácico : en el caso de tumores que afectan a la pared torácica o la pleura (membrana que recubre los pulmones). Puede ser uno de los síntomas iniciales de este tipo de tumores.
Existen otro tipo de síntomas menos frecuentes como pueden ser la disfonía (cambios de voz), la disfagia (dificultad para deglutir) o síntomas inespecíficos y comunes a cualquier tipo de cáncer como son la pérdida de peso, debilidad, cansancio, etc.
QUE NO TE ASUSTE LA TOS
En multitud de ocasiones nos encontramos con pacientes que presentan una tos de varios días de evolución tras un proceso catarral y que están asustados por si pudiera estar provocada por algún tipo de cáncer de pulmón. Tras un cuadro catarral, la tos puede prolongarse durante varias semanas, y hasta pasadas las ocho semanas consecutivas de tos, no podemos hablar de una tos crónica que nos llevaría a iniciar un estudio en profundidad.
¿Cómo se diagnostica?
Las principales pruebas que se suelen solicitar para diagnosticar un cáncer de pulmón son:
La radiografía de tórax. Es una prueba sencilla y con poca irradiación, pero los tumores de pequeño tamaño son difíciles de visualizar mediante esta técnica.
El TAC de tórax : es una muestra mucho más sensible para aquellos tumores de pequeño tamaño, pero también supone un aumento en la radiación sobre el paciente, por lo que su realización debe estar justificada en una duda diagnóstica.
La citología de esputo : consiste en el estudio microscópico del esputo del paciente para descubrir la presencia de células tumorales. Da un diagnóstico definitivo, pero es poco sensible.
La broncoscopia : consiste en la inspección visual del árbol bronquial a través de unas cámaras que se introducen en la vía respiratoria.
Otras pruebas diagnósticas útiles en ocasiones podrían ser el PET/TC o la RMN.
¿Cómo se trata?
En general el tratamiento se basará en cirugía, quimioterapia o radioterapia , y variará en función del tipo de célula que ocasiona el cáncer y de su extensión. Como norma general:
Por tipo celular : el cáncer de pulmón tipo “Célula pequeña” suele tener una buena respuesta a la quimioterapia por lo que, en general, no se trata con cirugía. Por el contrario, el cáncer de pulmón tipo “No célula pequeña” tiene una respuesta inferior a la quimioterapia, por lo que en muchos casos se valorará la posibilidad de realizar cirugía.
Por extensión : alrededor de uno de cada tres pacientes diagnosticados de cáncer de pulmón lo presentan de forma localizada, cosa que permite realizar una resección quirúrgica (extirpación). Sin embargo, otro tercio presentará diseminación tumoral a nivel ganglionar, por lo que, en general, se les recomendará quimioterapia y/o radioterapia. El tercio restante de pacientes tendrá metástasis al diagnóstico, por lo que el tratamiento se basará en quimioterapia.
Contenidos sobre enfermedades
Somos conscientes de que los conceptos médicos pueden resultar confusos si no te los explican con claridad. Para evitar esto, le hemos pedido a nuestros profesionales que preparen estas fichas en donde podrás acceder a información relevante sobre enfermedades que te ayudará a entender de una manera sencilla por qué se producen y por qué es necesario su tratamiento.
Ver todas las enfemedades 
Enfermedad
Sarcoma de Kaposi
¿Qué es el sarcoma de Kaposi?
El sarcoma de Kaposi es un tipo de cáncer que se forma en el recubrimiento de los vasos sanguíneos y linfáticos. Suele manifestarse como puntos violáceos indoloros en las piernas, los pies o el rostro . También pueden aparecer lesiones en la zona genital, la boca o los ganglios linfáticos . En el caso del sarcoma de Kaposi grave, pueden darse lesiones en el tubo digestivo y los pulmones. Antes de la epidemia del VIH/sida, el sarcoma de Kaposi se presentaba principalmente en hombres mayores, y rara vez, en mujeres mayores. Es más frecuente en personas judías y de ascendencia mediterránea. Entre este grupo, los tumores se desarrollaban lentamente . En las personas con VIH/sida, el cáncer se puede desarrollar rápidamente. Es una enfermedad poco común pero grave, ya que puede ocasionar la muerte de la persona que la padece.
Tipos de sarcomas
Existen más de 50 tipos de sarcoma. Los tipos más frecuentes son:
Fibrosarcoma : es un tumor de origen mesenquimatoso (las células mesenquimatosas se sitúan normalmente alrededor de los vasos sanguíneos y el tejido conjuntivo ), de alta malignidad, infiltrante, metastásico, y que aparece en los tejidos blandos, en los huesos y en la musculatura estriada.
Histiocitoma fibroso maligno : es un tumor poco frecuente y que aparece principalmente en la vida adulta , entre los 50 y los 70 años. Este tipo de tumor puede estar relacionado en algunos casos con el empleo de radioterapia.
Dermatofibrosarcoma : es un tumor raro originado en la dermis . En muchos aspectos esta enfermedad es clasificada como tumor benigno , sin embargo, del 2% al 5% de los casos pueden originar metástasis, y por eso debe considerarse potencialmente maligno.
Liposarcoma : es un tipo de tumor que se presenta en los tejidos profundos de las extremidades y en el retroperitoneo . Es el sarcoma de partes blandas más frecuente y corresponde al 20% del total de los casos.
Rabdomiosarcoma : es el tipo de sarcoma más frecuente en niños y adolescentes. Se desarrolla en la musculatura esquelética o en los tejidos fibrosos y puede afectar a cualquier región del cuerpo. Es un tumor agresivo e invasivo con recidivas y con metástasis.
Leiomiosarcoma : es un tumor caracterizado por la presencia de grandes células fusiformes de músculo liso . Ataca más comúnmente al útero , a la región retroperitoneal y a las extremidades superiores e inferiores .
Linfangiosarcoma : es un tumor maligno que se origina en las células endoteliales de los vasos linfáticos. La mayoría de los linfosarcomas se desarrollan en regiones donde hay linfedema crónica y después de una mastectomía radical seguida de radioterapia, en el miembro superior del lado de la cirugía.
Neurofibrosarcoma : es un tumor maligno que se desarrolla en las células que están alrededor de los nervios periféricos . Estos son nervios que reciben mensajes del sistema nervioso central (cerebro y médula espinal), y cuya función es estimular el movimiento voluntario . El neurofibrosarcoma es también conocido como tumor de vaina nerviosa , Schwannoma maligno y sarcoma neurogénico .
Osteosarcoma : es el cáncer primario de hueso más común . Se presenta frecuentemente en adolescentes, en los sitios de mayor crecimiento del hueso. Cualquier hueso puede ser afectado, sin embargo, se desarrolla más comúnmente en brazos y piernas , particularmente en las zonas próximas a las rodillas.
Sarcoma de Ewing : es el segundo tumor maligno más frecuente en niños . Es un tumor que se puede desarrollar en cualquier parte del cuerpo , pero donde suele iniciarse es en los huesos. Cualquier hueso puede desarrollar este tumor, pero los de la pelvis , el fémur y la tibia son los más comúnmente afectados.
Causas del sarcoma de Kaposi
La causa fundamental del sarcoma de Kaposi es una infección con un virus llamado virus del herpes humano 8 (VHH-8) . Por lo general, en las personas sanas, la infección por el VHH-8 no suele provocar síntomas porque el sistema inmunitario lo mantiene controlado. Sin embargo, en las personas con el sistema inmunitario débil, el VHH-8 puede desencadenar el sarcoma de Kaposi.
Síntomas del sarcoma de Kaposi
Los síntomas del sarcoma de Kaposi pueden incluir :
Erupciones cutáneas, lesión en la piel, bultos, hinchazón, protuberancias pequeña o úlceras.
Dificultad para respirar y tos.
Fiebre, ganglios linfáticos inflamados, placas en la garganta y úlcera bucal, entre otros síntomas.
Los tumores aparecen con mayor frecuencia como protuberancias en la piel de color rojo azulado o púrpura . Son de color rojo púrpura debido a que son abundantes en vasos sanguíneos.
Tratamiento para el sarcoma de Kaposi
Las opciones de tratamiento para el sarcoma de Kaposi pueden incluir: terapia antiviral contra el VIH , dado que no hay una terapia específica para el HHV-8, quimioterapia de combinación , congelamiento de las lesiones , radioterapia , resección quirúrgica , crioterapia , electrocoagulación o posiblemente imiquimod para las lesiones superficiales, radioterapia local para lesiones múltiples o enfermedad ganglionar y terapia antirretroviral , entre otras opciones de tratamiento.
En cuanto al sarcoma de Kaposi relacionado con el sida, el primer paso del tratamiento es comenzar o cambiar a una combinación de medicamentos antivirales para reducir la cantidad del virus que causa el VIH/sida y aumentar la cantidad de ciertas células inmunitarias en el organismo. A veces, este es el único tratamiento necesario.
Cuando es posible, las personas con sarcoma de Kaposi relacionado con trasplantes pueden suspender el consumo de medicamentos que inhiben el sistema inmunitario. Esto permite que, en algunos casos, el sistema inmunitario elimine el cáncer. También es posible que el paciente mejore por cambiar a diferentes medicamentos inmunodepresores .
Pruebas complementarias del tratamiento del sarcoma de Kaposi
Para el diagnóstico y tratamiento del sarcoma de Kaposi las pruebas que se realizan son: análisis de sangre oculta en heces , broncoscopia , radiografía de tórax , endoscopia superior y colonoscopia , entre otras pruebas.
Factores desencadenantes del sarcoma de Kaposi
El factor desencadenante principal es el virus del herpes denominado virus del herpes humano tipo 8 (VHH-8) .
Factores de riesgo del sarcoma de Kaposi
Las personas infectadas con el virus de la inmunodeficiencia humana (VIH), el virus que causa el sida, son las que corren mayor riesgo de padecer sarcoma de Kaposi . El daño al sistema inmunitario que provoca el VIH permite que las células que contienen el VHH-8 se multipliquen. A través de mecanismos desconocidos, se forman las lesiones características.
Existen también otros factores que podrían actuar en el desarrollo del sarcoma de kaposi. Entre los posibles cofactores , se incluye la hiperactividad del sistema inmunitario con niveles elevados de citoquinas que estimulan el crecimiento de células precoces de sarcoma de Kaposi, que con el tiempo podrían llegar a ser cancerosas.
Los receptores de trasplantes de órganos que toman inmunosupresores para prevenir el rechazo del órgano trasplantado también corren riesgo de padecer sarcoma de Kaposi.
Complicaciones del sarcoma de Kaposi
Las complicaciones pueden ser :
Tos persistente, en su mayoría con sangre.
Dificultad para respirar.
Hinchazón de las piernas que puede doler.
Los tumores pueden reaparecer incluso después de tratamiento.
El sarcoma de Kaposi puede ser mortal para una persona con sida.
Prevención del sarcoma de Kaposi
Las prácticas sexuales con precaución pueden prevenir la infección por el VIH . Esto previene el SIDA y sus complicaciones, incluyendo el sarcoma de Kaposi.
Especialidades a las que pertenece el sarcoma de Kaposi
El sarcoma de Kaposi pertenece a las especialidades de oncología y dermatología . La oncología es la parte de la medicina que se encarga del estudio de los tumores y su tratamiento, y la dermatología es la parte de la medicina que se encarga del estudio de la piel y sus enfermedades.
Preguntas frecuentes
¿Qué es el cáncer de linfoma no Hodgkin?
El linfoma no Hodgkin es un tipo de cáncer que se origina en el sistema linfático , la red que combate las enfermedades y que se extiende por todo el cuerpo. En el linfoma no hodgkiniano , los tumores se forman a partir de linfocitos, un tipo de glóbulos blancos.
¿Qué es un sarcoma de partes blandas?
El sarcoma de tejido blando es un tipo de cáncer poco frecuente que comienza en los tejidos que conectan, sostienen y recubren otras estructuras del cuerpo. Esto comprende los músculos, la grasa, los vasos sanguíneos, los nervios, los tendones y el revestimiento de las articulaciones.
¿Cuáles son los tejidos blandos?
Los tejidos blandos del cuerpo son los músculos , los tendones (bandas de fibras que conectan los músculos con los huesos), la grasa , los vasos sanguíneos , los vasos linfáticos , los nervios y los tejidos que rodean las articulaciones .
¿Qué es el liposarcoma?
El liposarcoma es un tipo de cáncer poco frecuente que comienza en las células grasas . Se considera que el liposarcoma es un tipo de sarcoma del tejido blando . Puede producirse en las células grasas de cualquier parte del cuerpo, pero, en la mayoría de los casos, se producen en los músculos de las extremidades o del abdomen .
¿Qué es un lipoma?
Un lipoma es un bulto de grasa de crecimiento lento que, la mayoría de las veces se sitúa entre la piel y la capa muscular oculta. Un lipoma, que se siente pastoso y, por lo general, no duele , se mueve con facilidad al presionarlo ligeramente con los dedos.
Enfermedad
Sarcoma de Ewing
¿Qué es el sarcoma de Ewing?
El sarcoma de Ewing es un tipo de tumor óseo maligno que crece en los huesos y los tejidos blandos. Están formados por células pequeñas y redondas no diferenciadas , y se pueden desarrollar en cualquier parte del cuerpo, pero afectan principalmente a brazos, piernas, costillas, columna vertebral y pelvis. Es el segundo cáncer de huesos más común en la infancia y se presenta en niños, adolescentes y adultos jóvenes de entre 10-20 años de edad . Es más frecuente en el sexo masculino que en el femenino. Es una enfermedad poco común o rara , y es considerada de tipo grave , pero si se trata a tiempo puede tener un buen pronóstico.
Tipos de sarcoma
Existen más de 50 tipos de sarcoma, los más frecuentes son:
Fibrosarcoma : es un tumor de origen mesenquimatoso (las células mesenquimatosas se sitúan normalmente alrededor de los vasos sanguíneos y el tejido conjuntivo), de alta malignidad, infiltrante, metastásico, y que aparece en los tejidos blandos, en los huesos y en la musculatura estriada.
Histiocitoma fibroso maligno : es un tumor poco frecuente y que aparece principalmente en la vida adulta , entre los 50 y los 70 años. Este tipo de tumor puede estar relacionado en algunos casos con el empleo de radioterapia.
Dermatofibrosarcoma : es un tumor raro originado en la dermis . En muchos aspectos esta enfermedad es clasificada como tumor benigno, sin embargo, del 2% al 5% de los casos pueden originar metástasis, y por eso debe considerarse potencialmente maligno.
Liposarcoma : es un tipo de tumor que se presenta en los tejidos profundos de las extremidades y en el retroperitoneo . Es el sarcoma de partes blandas más frecuente y corresponde al 20% del total de los casos.
Rabdomiosarcoma : es el tipo de sarcoma más frecuente en niños y adolescentes . Se desarrolla en la musculatura esquelética o en los tejidos fibrosos y puede afectar a cualquier región del cuerpo. Es un tumor agresivo e invasivo con recidivas y metástasis.
Leiomiosarcoma : es un tumor caracterizado por la presencia de grandes células fusiformes de músculo liso . Ataca más comúnmente al útero, a la región retroperitoneal y a las extremidades superiores e inferiores.
Linfangiosarcoma : es un tumor maligno que se origina en las células endoteliales de los vasos linfáticos . La mayoría de los linfosarcomas se desarrollan en regiones donde hay linfedema crónica y después de una mastectomía radical seguida de radioterapia, en el miembro superior del lado de la cirugía.
Neurofibrosarcoma : es un tumor maligno que se desarrolla en las células que están alrededor de los nervios periféricos . Estos son nervios que reciben mensajes del sistema nervioso central (cerebro y médula espinal), y cuya función es estimular el movimiento voluntario. El neurofibrosarcoma es también conocido como tumor de vaina nerviosa, Schwannoma maligno y sarcoma neurogénico.
Osteosarcoma : es el cáncer primario de huesos más común . Se presenta frecuentemente en adolescentes, en los sitios de mayor crecimiento del hueso. Cualquier hueso puede ser afectado, sin embargo, se desarrolla más comúnmente en brazos y piernas, particularmente en las zonas próximas a las rodillas.
Sarcoma sinovial : es un tipo de sarcoma de tejido blando , que habitualmente se forma en el tejido que rodea las articulaciones de los brazos y las piernas. También se puede formar en el tronco (pecho y abdomen), o cabeza y cuello. Se puede diseminar a los pulmones, los huesos y los ganglios linfáticos, y se suele presentar en niños y adultos jóvenes.
Sarcoma de Kaposi : es un tipo de cáncer que se forma en el recubrimiento de los vasos sanguíneos y linfáticos causado por el virus del herpes 8 (VHH-8)
Causas del Sarcoma de Ewing
Las causas por las cuales se genera el sarcoma de Ewing se desconocen. Los estudios indican que tanto el sarcoma de Ewing como los tumores neuro ectodérmicos primitivos provienen de la misma célula madre derivada de la médula ósea . El intercambio genético entre cromosomas puede causar que las células se tornen cancerosas, como las células metastásicas del sarcoma de Ewing, que es el resultado de la translocación (desplazamiento) entre los cromosomas 11 y 22, los cuales se fusionan.
Síntomas del sarcoma de Ewing
El sarcoma de Ewing suele presentar pocos síntomas , el más común es el dolor en el lugar del tumor, hinchazón, sensación de calor, fractura en el hueso donde está el tumor después de una lesión menor, y en ocasiones puede aparecer fiebre.
Tratamiento para el sarcoma de Ewing
El tratamiento del sarcoma de Ewing depende de muchos factores, como el tamaño y la ubicación del tumor y si la enfermedad se ha extendido mediante metástasis.
El tratamiento comienza, sistemáticamente con quimioterapia para matar las células cancerosas y reducir el tamaño del tumor primario, antes de quitarlo con una intervención quirúrgica o con radioterapia. También para erradicar o impedir la propagación de las células cancerosas a otras partes del cuerpo (metástasis) y como prevención después de quitar el tumor para que las células cancerosas no aparezcan . La quimioterapia suele durar entre 6 meses y un año, y requiere ingreso hospitalario en el momento de la sesión del tratamiento por las complicaciones y los efectos secundarios causados por la medicación, la cual se administra vía endovenosa.
Si el paciente necesita una operación, se puede administrar radioterapia para reducir el tumor antes de la extirpación. La radioterapia también puede ser recomendable en lugar de la operación cuando esta es muy peligrosa o la ubicación del tumor es muy difícil. Durante este tratamiento, se dirigen rayos X de alta energía hacia el lugar donde se encuentra el tumor para destruir las células cancerosas y evitar que este siga creciendo y expandiéndose.
La extirpación quirúrgica : La mayoría de los tumores se extirpan quirúrgicamente después de un tratamiento de quimioterapia o radioterapia . Es posible que el tejido extirpado deba reemplazarse por un injerto de tejido vivo , que se adquiere del cuerpo del mismo paciente o de un donante, o también por un injerto artificial . Si el tumor ha afectado los nervios y vasos sanguíneos alrededor del tumor, la amputación de la extremidad es la única opción.
Pruebas complementarias del tratamiento del sarcoma de Ewing
Para el diagnóstico y tratamiento del sarcoma de Ewing es necesario realizar un buen examen físico y realizar una historia clínica completa . Las pruebas complementarias que se deben realizar son una radiografía tanto del tumor y de tórax, resonancia magnética y/o una gammagrafía ósea, así como una tomografía computarizada de tórax. También se debe realizar una biopsia para extraer una muestra del tumor realizándose diferentes exámenes en este tipo de tejido para ayudar a determinar qué tan agresivo es el cáncer y cuál será el mejor tratamiento.
Factores desencadenantes del sarcoma de Ewing
No existen factores desencadenantes del sarcoma de Ewing.
Factores de riesgo del sarcoma de Ewing
No se conocen factores de riesgo evidentes para el sarcoma de Ewing
Complicaciones del sarcoma de Ewing
Las complicaciones del sarcoma de Ewing son :
Diseminación a otras partes del cuerpo (metástasis).
Infección en la herida quirúrgica.
Fracaso del injerto óseo.
Anemias, sangrado, lesiones en el riñón, hígado o el corazón debido a los riesgos de los medicamentos utilizados en la quimioterapia a corto y largo plazo.
Prevención del sarcoma de Ewing
No existen medidas de prevención para el sarcoma de Ewing.
Especialidades a las que pertenece el sarcoma de Ewing
Las especialidades a la que pertenece el sarcoma de Ewing suele ser una intervención multidisciplinar de varias áreas con oncología , que es la rama de la medicina que estudia y trata las neoplasias (tumores benignos y malignos) para su diagnóstico y tratamiento, y las áreas de ortopedia y traumatología y pediatría.
Preguntas frecuentes
¿Qué es un sarcoma de partes blandas?
Un sarcoma de partes blandas es un tumor maligno que se origina en el tejido conectivo o de soporte del organismo y se localiza en las partes blandas (es decir, excluyendo hueso y cartílago), pero que incluye el tejido graso y el muscular, los tendones, los vasos sanguíneos, los nervios y los tejidos.
¿Cuál es la esperanza de vida de una persona con sarcoma de Ewing?
La esperanza de vida de una persona con sarcoma de Ewing depende de la fase en la que se encuentre la enfermedad. Si la enfermedad es diagnosticada a tiempo y se utiliza el tratamiento adecuado, el pronóstico es bueno, curando la enfermedad en más de un 70% de los casos. Es importante mantener revisiones médicas por si aparece alguna recaída poder actuar a tiempo.
¿Qué es un sarcoma sinovial?
El sarcoma sinovial es un tipo de sarcoma de tejido blando , que habitualmente se forma en el tejido que rodea las articulaciones de los brazos y las piernas. También se puede formar en el tronco (pecho y abdomen), o en la zona de cabeza y cuello. Se puede diseminar a los pulmones, los huesos y los ganglios linfáticos, y se suele presentar en niños y adultos jóvenes.
Enfermedad
Sarcoma
¿Qué es el sarcoma?
Se denomina sarcoma a aquel tumor maligno que se desarrolla en los tejidos blandos del organismo como músculos, grasa y vasos linfáticos o sanguíneos derivados del tejido conectivo, así como los que se producen en los huesos. Son tumores muy raros , representado el 1% de todos los tumores malignos en los adultos y el 15% de los tumores en niños . Es una enfermedad grave, cuyo mayor inconveniente es que de forma muy frecuente se diagnostica en estadíos muy avanzados.
Tipos de sarcoma
Hay gran variedad de sarcomas según el tejido que se ve afectado por la alteración, describiéndose hasta más de 50 subtipos . El sitio de localización más frecuente es en un 43% en extremidades, 10% en el tronco, 19% órganos, 15% retroperitoneo (parte posterior de la cavidad abdominal) y el 9% en cabeza y cuello. Dentro de ellos cabe reseñar por su frecuencia de aparición los siguientes:
Sarcoma pleomórfico indiferenciado : afecta al tejido fibroso de los brazos y las piernas.
Liposarcoma : tumor de tejido graso.
Leiomiosarcoma : tumor de músculo liso.
Sarcoma sinovial : tumor que deriva de células similares a las de la membrana que recubre el interior de la cápsula articular.
Tumores malignos de la vaina de los nervios periféricos : tumores en membranas de revestimiento de los nervios que llevan la información al cuerpo.
Tumor del estroma gastrointestinal : aparecen en cualquier parte del tejido digestivo pero más frecuentemente en estómago e intestino.
Otros de los tumores, con menor frecuencia de presentación son el rabdomiosarcoma (del músculo estriado), el condrosarcoma y el osteosarcoma (de los huesos), y el angiosarcoma (de vasos sanguíneos).
Causas del sarcoma
La causa de los sarcomas, como la de cualquier tumor, es una serie de alteraciones genéticas , alguna de ellas correctamente identificada, que producen en definitiva una masa celular de crecimiento incontrolado.
Síntomas de sarcoma
Los sarcomas se manifiestan por la aparición de una masa o tumor que va aumentando de forma progresiva , pueden producir dolor o ser asintomáticos. En su evolución aparece pérdida de peso, anemia e incapacidad funcional. Pueden aparecer en regiones del organismo donde existan cicatrices o hayan sufrido previamente un traumatismo .
Aquellos que aparecen en el abdomen se caracterizan por dolor abdominal , edemas en los miembros inferiores, aparición de una masa abdominal palpable, asociación con otros síntomas como ictericia (coloración amarillenta de piel y mucosas), oclusión intestinal, y sangrado por heces u orina.
Tratamiento para el sarcoma
El tratamiento de elección es la cirugía , con amplia resección del tumor dejando bordes libres para evitar recidivas , lo que aumenta las posibilidades de supervivencia y curación. La cirugía se utiliza en los estadíos menos avanzados de la enfermedad y en casos seleccionados de fases más avanzadas. En determinados casos de sarcomas que afectan a las extremidades, puede estar indicado la amputación de dicha extremidad.
En aquellos casos, sobre todo en los que haya afectación de las extremidades, tras la cirugía, se pautan tratamientos de rehabilitación y fisioterapia .
En los sarcomas que se consideran irresecables , es decir, que no pueden someterse a cirugía, el tratamiento que se aplica es la quimioterapia y la radioterapia . En algunos casos en los que inicialmente no se puede hacer cirugía, se aplica radioterapia o quimioterapia previa para disminuir el tamaño del tumor y así poder realizar posteriormente la cirugía y extracción del mismo. Igualmente, para mayor control de la enfermedad, en aquellos tumores más agresivos y de mayor tamaño, a veces se precisa el uso de la quimioterapia o radioterapia después de la cirugía , y en otros casos la combinación de ambas.
Pruebas complementarias del tratamiento de sarcoma
La entrevista clínica y la exploración física son fundamentales para realizar un diagnóstico del tumor que, además, puede requerir la realización de pruebas como:
Radiografía de tórax.
Radiografía ósea: localizada donde se produzcan los síntomas.
TAC: tomagrafía axial computerizada o escáner.
Resonancia magnética nuclear.
Biopsia: extracción de pequeña cantidad de tejido para su estudio en el laboratorio de anatomía patológica.
Factores desencadenantes del sarcoma
El factor desencadenante de los sarcomas, como de cualquier tumor maligno del organismo, es la alteración en el material genético de una célula de algún tejido conectivo en el que se produce una capacidad no corregida para la división sin control celular, lo que hace crecer la masa tumoral que, además, puede adquirir otras alteraciones, como la capacidad de migración de alguna célula y crecimiento en otra parte del organismo, lo que produce las metástasis.
Factores de riesgo del sarcoma
La gran mayoría de los sarcomas no están asociados a ningún factor de riesgo conocido, aunque en algunos casos se han descrito factores que pueden influenciar en su desarrollo como:
Padecer enfermedades raras como la neurofibromatosis o la enfermedad de Von Recklinghausen.
Inmunodepresión.
Padecer infecciones por algunos virus como el herpesvirus tipo 8, el virus de Epstein Barr, o VIH.
Haber tenido un tratamiento radioterápico previo .
Antecedentes de un traumatismo previo.
Exposición a químicos como clorofenoles y/o dioxinas.
Padecer linfedemas (acumulación de la linfa y consecuente inflamación de los tejidos blandos del cuerpo).
Alteraciones genéticas hereditarias .
Complicaciones del sarcoma
Recidivas locales tras su tratamiento.
Metástasis , más frecuentemente en el pulmón .
Dolor intenso difícil de controlar con la medicación.
Dificultad respiratoria si hay metástasis en los pulmones.
Anorexia, falta de apetito, dificultad para alimentarse según el tiempo de evolución de la enfermedad y la afectación gastrointestinal
Incapacidad funcional para el movimiento del miembro afecto.
Prevención del sarcoma
En muchas ocasiones no hay medidas preventivas específicas para evitar el padecimiento de los sarcomas.
Es importante evitar factores de riesgo como el contagio de infecciones como el VIH o el virus de Epstein Barr.
Es fundamental consultar ante cualquier tumoración de crecimiento rápido en los miembros y/o dolores en los miembros o en el abdomen persistentes.
Especialidades a las que pertenece el sarcoma
El diagnóstico y tratamiento del sarcoma es un trabajo de un equipo multidisciplinar en el que intervienen el especialista en oncología junto con otros especialistas según el tipo de tumor y el tejido que este esté afectando. Es frecuente que muchos de ellos requieran de la participación del especialista en traumatología, dermatología o ginecología , entre otros.
Preguntas frecuentes
¿Cómo se detecta un sarcoma?
La sospecha del padecimiento de un sarcoma puede basarse en la presencia de un tumor en las extremidades o tejidos blandos como el músculo , con aparición de una masa que está adherida a planos profundos, tiene un crecimiento rápido, dolor en la zona afectada, aparición de edemas, tumefacción de las zonas afectadas, otros síntomas asociados en los casos de afectación abdominal como obstrucción intestinal.
¿Cuál es la esperanza de vida de una persona con sarcoma?
La esperanza de vida de un paciente con sarcoma depende siempre del tipo de sarcoma que padezca , el estadío de la extensión del tumor cuando se diagnostica y se inicia el tratamiento, la salud de base que tiene el paciente, su edad, y el tipo de tratamiento que se puede realizar. En general un 85% de los pacientes con diagnóstico en etapas iniciales puede sobrevivir a los 5 años tras el diagnóstico, mientras que este porcentaje disminuye al 10-20% en los estadíos avanzados.
¿Qué son los tejidos blandos?
Los tejidos blandos hacen referencia a aquellos tejidos del organismo que sirven de apoyo y soporte como son los músculos, el tejido adiposo (la grasa), los tendones, los ligamentos, vasos sanguíneos…etc.
¿Qué es la metástasis del sarcoma?
La metástasis del sarcoma, como las del resto de tumores malignos, hacen referencia a la capacidad que tienen estos tumores de que una de sus células migre a través de los vasos sanguíneos o linfáticos hacia regiones del organismo diferentes a su lugar de origen, se establezcan y comiencen su multiplicación incontrolada, lo que provoca la aparición de tumores de características similares al primario, pero con otras localizaciones. En caso de los sarcomas, el sitio donde más frecuentemente metastatizan es el pulmón.

Enfermedad
Leishmaniasis
¿Qué es la leishmaniasis?
La leishmaniasis es una enfermedad parasitaria producida por la Leishmania , que es un protozoo que se transmite por la picadura de un insecto flebotomo (que se alimenta de sangre). En España se detectan unos 110 casos de leishmaniasis humana al año, se presenta principalmente en casos de adultos y niños inmunodeprimidos. Los perros son el reservorio animal y se considera una enfermedad endémica en los mismos. Es una enfermedad considerada como grave.
Tipos de leishmaniasis
Los diferentes tipos de leishmaniasis son:
Leishmaniasis cutánea : es la forma más común de leishmaniasis y produce úlceras en las zonas expuestas del cuerpo.
Leishmaniasis mucocutánea : conduce a la destrucción de la mucosa de nariz, boca y garganta.
Leishmaniasis visceral o Kala-azar : en un 95% de casos es mortal si no se trata, produce fiebre, pérdida de peso, aumento del tamaño del hígado, del bazo y provoca anemia.
Causas de la leishmaniasis
La causa es la picadura del mosquito flebotomo infectado transmitiendo el protozoo por la picadura.
Síntomas de la leishmaniasis
Los síntomas de la leishmaniasis cutánea son, en primer lugar, un bulto en la zona de la picadura , que posteriormente puede dar lugar a bultos en más zonas. El bulto inicial se irá agrandando y dará lugar a una úlcera costrosa. Estas úlceras pueden curar por sí mismas pasados unos meses, pero dejarán lesiones cicatriciales.
Los síntomas de la leishmaniasis mucocutánea se inician con una úlcera en la piel, que se cura por sí misma, seguida de lesiones en el interior de la nariz , la garganta y la boca , pudiendo producir sangrado.
Los síntomas de la leishmaniasis visceral son: fiebre de forma discontinua, diarrea, pérdida de peso, sensación de cansancio , anemia y aumento de tamaño del hígado del bazo y de los ganglios linfáticos.
Tratamiento para la leishmaniasis
En el tratamiento de la leishmaniasis cutánea se usará terapia de calor o frío sobre las úlceras y Paramomicina en pomada sobre las úlceras. En casos de leishmaniasis más agresiva se pueden usar fármacos intravenosos u orales como el Fluconazol , la Anfotericina B, Estibogluconato de sodio y Miltefosina . Estos mismos fármacos se usan para los caso de leishmaniasis mucocutánea.
La leishmaniasis visceral se trata con Anfotericina B Liposomal , en zonas de América Latina, se usan fármacos con Antimonio , y en casos de resistencia a antimonio se trata con Miltefosina .
Pruebas complementarias del tratamiento de la leishmaniasis
Las pruebas complementarias serán la observación del parásito de las zonas donde se encuentre y también la búsqueda de anticuerpos en la sangre de los pacientes.
Factores desencadenantes de la leishmaniasis
El factor desencadenante es la picadura del flebotomo infectado junto con un estado de inmunodepresión del individuo.
Factores de riesgo de la leishmaniasis
Las malas condiciones de vida y las viviendas insalubres aumentan el riesgo de infección por leishmaniasis. También lo hacen el hacinamiento, ya que este atrae a los flebotomo, así como la malnutrición, la deforestación y el ocupar hábitat previamente boscosos.
Complicaciones de la leishmaniasis
Infecciones intercurrentes.
Osteomielitis (inflamación simultánea de la médula ósea y del hueso).
Meningitis.
Septicemia (infección grave y generalizada de todo el organismo).
Úlceras con cicatrices importantes.
Prevención de la leishmaniasis
Uso de mosquiteras con insecticida en las camas.
Mosquiteras en las ventanas para evitar que entren los mosquitos.
Repelentes de insectos en la piel.
Evitar pasear en las zonas de mosquitos en las horas donde se produce el vuelo del mismo (generalmente al final de la tarde).
Especialidades a las que pertenece la leishmaniasis
La leishmaniasis la tratan especialistas de medicina interna con la subespecialidad de medicina infecciosa.
Preguntas frecuentes:
¿Cuál es el parásito de la leishmaniasis?
Hay tres parásitos de la leishmaniasis que son diferentes según la zona del mundo donde se encuentran, así, encontramos la leishmania donovani, da lugar a leishmaniosis visceral y se da principalmente en el continente indio, China, África e Irak, la leishmania infantum, típica de la cuenca mediterránea europea y africana, y la leishmania chagasi causante de la leishmaniasis visceral en América.
¿Es posible la leishmaniasis en personas o solo en perros?
Sí, es posible tener la enfermedad en personas . La leishmaniasis es una zoonosis, esto quiere decir que desde animales donde se encuentran como pueden ser perros, conejos, zarigüeyas y zorros que tienen la enfermedad, puede pasar al humano, tras ser picados por un mosquito.
¿Cómo se transmite la leishmaniasis?
La leishmaniasis se transmite por la picadura de la hembra del mosquito q ue tiene el parásito . Cuando pica al humano u otro animal va a inyectar el parásito por medio de la picadura.
¿Qué son los antimoniales pentavalentes?
Los antimoniales pentavalentes son el Glucantime (se usa más en el primer mundo) y Pentostam (se usa en países en desarrollo) son los fármacos de primera línea en el tratamiento de la leishmaniasis. Aunque no se conoce bien su mecanismo de acción, parece que actúan alterando el funcionamiento de las enzimas de los protozoos. Se administra en dosis inyectable durante 20 días de forma diaria si se trata de leishmaniasis cutánea y el tratamiento se prolonga hasta 28 días en dosis intravenosa si es leishmaniasis mucocutánea. Son fármacos tanto más efectivos cuanto más rápido se usan tras la infección.
Artículos por especialidad
CertificadosAlergologíaAnatomía PatológicaAnestesiología y ReanimaciónAngiología y Cirugía VascularAnálisis ClínicosAparato DigestivoCardiologíaChequeosCirugía General y del Aparato DigestivoCirugía General y del Aparato Digestivo PediátricaCirugía Oral y MaxilofacialCirugía Ortopédica y TraumatologíaCirugía Ortopédica y Traumatología PediátricaCirugía PediátricaCirugía Plástica y ReparadoraCirugía TorácicaClínica u HospitalDermatología Médico-Quirúrgica y VenereologíaEndocrinología y NutriciónEnfermeríaFisioterapiaGenética HumanaGinecología y ObstetriciaInmunologíaLogopedia y FoniatríaMedicina Estética y Unidad LaserMedicina Física y RehabilitaciónMedicina GeneralMedicina InternaMedicina NuclearMedicina del DeporteNefrologíaNeumologíaNeurocirugíaNeurofisiología ClínicaNeurologíaNutrición y DietéticaOdontología y EstomatologíaOftalmologíaOncología MédicaOncología RadioterápicaOsteopatíaOtorrinolaringologíaPediatríaPodologíaPoliclínicasPreparación al PartoPsicologíaPsiquiatríaRadiodiagnóstico-Diagnóstico Por ImagenReumatologíaTricologíaUnidad del DolorUrgencias HospitalariasUrología
Todas las especialidades  Savia
Savia