Inmunología
La especialidadArtículos especializados
Enfermedades
Síntomas
Otros contenidos
Artículo especializado
Lupus, ¿Qué Debes Saber?
Ante todo, debemos saber que el nombre completo de esta enfermedad es lupus eritematoso sistémico (LES). En España, nueve de cada 10.000 la sufren, siendo mucho más frecuente en mujeres (90%), y la edad de inicio alrededor de los 30-35 años . Sus síntomas son más leves en los pacientes de mayor edad.
Sus principales características son:
Es una enfermedad sistémica (puede afectar a cualquier órgano del cuerpo).
Es crónica (cursa con períodos de exacerbaciones y remisiones).
Tiene una base autoinmune (el sistema inmunitario ataca las células sanas del cuerpo por error). Esta alteración puede darse en otras enfermedades relativamente frecuentes como la enfermedad celíaca, la diabetes tipo 1, la artritis reumatoide y la esclerosis múltiple.
¿Cuál es la causa del LES?
Se trata de una enfermedad multifactorial en la que influyen los factores genéticos y hormonales, las alteraciones inmunológicas y los agentes ambientales (infecciones, radiación ultravioleta y exposición a ciertos fármacos).
¿Qué síntomas ocasiona?
Su presentación es muy variable y dará síntomas diferentes dependiendo del órgano afectado. Principalmente, se afectan los riñones, la piel y las mucosas, el sistema músculo esquelético, el sistema cardiopulmonar y el sistema nervioso . Las manifestaciones más frecuentes son las lesiones cutáneo-mucosas, las articulares y las hematológicas.
En fase inicial de la enfermedad (cuando aún no ha dado síntomas) es posible detectar los autoanticuerpos circulantes en sangre.
Estos son los síntomas más frecuentes y sus principales características:
Lesiones cutáneas lúpicas: según las características de las lesiones cutáneas encontraremos el lupus discoide, el lupus subagudo cutáneo, etc.
El exantema malar o en alas de mariposa: es la lesión cutánea por excelencia. Se trata de un enrojecimiento típico que afecta a las mejillas y nariz.
Otras lesiones cutáneas no específicas son : fotosensibilidad (enrojecimiento tras exposición al sol), alopecia, úlceras orales, urticaria, fenómeno de Raynaud y vasculitis.
Manifestaciones músculo-esqueléticas : artralgias (dolores articulares), artritis (inflamación de las articulaciones) y mialgias (dolores musculares) son las más comunes, sobre todo en manos.
Manifestaciones sistémicas : malestar general, astenia (cansancio extremo), la fiebre o la pérdida de peso, pleuritis, pericarditis, endocarditis.
Manifestaciones renales : en uno de cada tres pacientes en forma de nefritis lúpica.
Manifestaciones neuropsiquiátricas: cefalea, crisis comiciales/convulsivas, alteraciones cognitivas, psicosis, neuropatías periféricas…
Manifestaciones hematológicas : las principales son la disminución de las series hemáticas como anemia.
¿Necesitamos realizar una analítica específica para detectar el LES?
Existen algunos parámetros que se encuentran típicamente elevados en el LES. Sin embargo, no son específicos de esta enfermedad y se pueden encontrar en otras enfermedades. Es el caso de los anticuerpos antinucleares (llamados ANA), presentes en otras enfermedades autoinmunes como la esclerosis sistémica, la dermatomiositis, la polimiositis, la artritis reumatoide, las tiroiditis, etc. Una curiosidad, unos ANA positivos no son específicos de LES, pero un LES sin ANA es poco probable.
Existen otros anticuerpos, los anti DNA , que son muy específicos de LES. Su título se correlaciona con su severidad y con la progresión de la enfermedad renal. Es decir, la presencia de anti DNA sugiere LES, además, cuanto mayor es el número o título de estos anti DNA más severa y rápidamente progresiva será la enfermedad. Por ello decimos que tienen un valor predictivo, orientándonos de la evolución que tendrá.
Los Anticuerpos anti-Sm: son patognomónicos de la enfermedad, sólo se encuentran en el LES.
¿Cómo llegamos al diagnóstico de LES?
El diagnóstico de LES no es sencillo dada la variabilidad de síntomas posibles, en función del órgano afectado. Ante la sospecha, es cuando debe solicitarse una analítica específica como estudio complementario dirigido.
En la actualidad para llegar al diagnóstico de LES nos basamos en unas tablas que contemplan las principales manifestaciones clínicas, datos analíticos y marcadores serológicos. La presencia de al menos cuatro de los criterios descritos en esa tabla confirma el diagnóstico de LES.
No debemos olvidar que, al confirmar el diagnóstico, hemos de conseguir que el paciente entienda y acepte su enfermedad, de forma que siga el tratamiento fielmente para evitar la progresión de la misma.
¿Cuál sería el tratamiento del LES?
El LES cursa con síntomas clínicos muy diferentes. El tratamiento, por tanto, varía a lo largo de la evolución y según el síntoma u órgano a tratar. También influye el grado de severidad. En el tratamiento del LES se ve implicado el reumatólogo (como principal médico responsable), pero trabaja en colaboración con otros especialistas que controlan el resto de afectaciones sistémicas, como el dermatólogo para tratar las lesiones cutáneas, o el nefrólogo para el control renal. Es fundamental advertir al paciente que debe evitar la exposición solar pues las lesiones cutáneas empeoran sustancialmente al ser expuestas (son fotosensibles).
El objetivo principal sería mantener la enfermedad inactiva o con la menor actividad posible y evitar la progresión del daño orgánico. Para mejorar la supervivencia, debemos emplear el mínimo de tratamientos posibles para minimizar los efectos secundarios. La presencia de manifestaciones graves en órganos importantes (renales, neurológicas, cardiopulmonares o hematológicas) requiere del uso de dosis altas de corticoides asociadas a inmunosupresores (cuya finalidad es atenuar la respuesta autoinmune del cuerpo frente a nuestros propios tejidos).
¿Qué evolución tiene el LES?
También va a depender del órgano afectado y del grado de severidad. Los pacientes afectados de LES tienen una morbimortalidad mayor que la población general (el riesgo de muerte en los pacientes con LES es de dos a tres veces mayor que en la población general).
¿Hay factores que marcan un mal pronóstico?
Entre los factores asociados a una mayor mortalidad podríamos citar la presencia de enfermedad renal, la hipertensión arterial y unos anticuerpos llamados antifosfolípido . Vamos a añadir, sin embargo, que la remisión de la enfermedad se consigue en algunos pacientes, permitiendo incluso llegar a retirar el tratamiento que se había instaurado con intención crónica. Por ello es fundamental contar con la implicación del paciente.
Artículo especializado
Mieloma Múltiple
El mieloma múltiple es un cáncer de células plasmáticas . Las células plasmáticas normales se encuentran en la médula ósea y son una parte esencial del sistema de defensa del organismo. El sistema inmunitario está integrado por diversos tipos de células que funcionan conjuntamente para hacer frente a las infecciones y otras enfermedades. Los linfocitos son uno tipo de glóbulos blancos del sistema inmunitario y pueden ser células T y células B.
Cuando las células B responden a una infección , dichos linfocitos maduran y se convierten en células plasmáticas, que son las encargadas de producir anticuerpos o inmunoglobulinas que ayudan al organismo a atacar y destruir los gérmenes. Las células plasmáticas se encuentran principalmente en la médula ósea.
Cuando las células plasmáticas se vuelven cancerosas se produce lo que se denomina un mieloma múltiple y estas células plasmáticas cancerosas producen una serie de anticuerpos anormales. Aunque el mieloma múltiple es la afectación cancerosa más frecuente de las células plasmáticas, existen otros tipos de trastornos neoplásicos de las mismas, como pueden ser:
Gammapatía monoclonal de significado incierto.
Mieloma múltiple indolente.
Plasmocitoma solitario.
Amiloidosis de cadenas ligeras.
Macroglobulinemia de Waldenström.
Anualmente se diagnostican cuatro casos nuevos por cada 100.000 habitantes y supone el 1% del total de los casos de cáncer que se detectan. El mieloma múltiple representa el 10% de los tumores hematológicos y su causa es desconocida. No existen factores o enfermedades que predispongan a padecerlo y es más frecuente en hombres de edad media o avanzada . Se cree que la exposición a determinadas sustancias químicas, así como la r adiación, ciertos virus o un sistema inmunológico comprometido pueden ser factores predisponentes a padecerlo. No se ha detectado que exista un factor genético o hereditario que contribuya a la aparición del mieloma, pero se ha visto que dos de cada tres pacientes tienen mutaciones en ≥1 oncogén, un gen mutado cuya activación puede potenciar la aparición de un tumor.
Los diferentes tipos de mieloma se establecen en función de la clase de paraproteína (inmunoglobulina anómala) que produce la célula del mieloma. Cada inmunoglobulina está formada por dos componentes principales, unas cadenas pesadas (G, A, D, E y M) y dos cadenas ligeras (kappa y lambda), que conforman una única molécula. El 65% de los mielomas múltiples son tipo G, seguido del A. Los mielomas tipo D, E y M son mucho menos frecuentes.
¿Produce síntomas?
Hasta casi un 30% de los pacientes que padecen un mieloma múltiple permanecen asintomáticos y el cáncer se diagnostica de manera casual al observar alteraciones analíticas , como una anemia leve, una elevación de la velocidad de sedimentación globular (VSG) o una la presencia de una paraproteína monoclonal en sangre, es decir, un tipo de anticuerpos producidos por las células plasmáticas enfermas.
De presentar síntomas, los más habituales en las personas con un mieloma múltiple son:
Dolor óseo , principalmente en la espalda, cadera, costillas, pelvis o cráneo; este dolor es debido a la activación de unas células llamadas osteoclastos, que son las encargadas de reabsorber el tejido óseo. Además del dolor, estas lesiones pueden provocar fracturas múltiples.
Hipercalcemia debida a la destrucción ósea, la cual puede causar cansancio, falta de apetito, náuseas, vómitos, aumento de la sed y del volumen de la orina, estreñimiento y confusión.
Afectación de la médula ósea ocupada por las células plasmáticas tumorales, lo cual impide que se produzcan las cantidades suficientes de las otras células sanguíneas, produciendo pues anemia, descenso de glóbulos blancos y de plaquetas.
Infecciones graves , sobre todo a nivel pulmonar y renal, a causa de la alteración del sistema inmune por la producción anómala de anticuerpos, lo cual deja al cuerpo expuesto a infecciones graves y potencialmente mortales.
Afectación renal por la acumulación de las cadenas ligeras de las paraproteínas en los riñones y el exceso de calcio en la sangre, que se excretan por la orina y dañan la función renal, lo que conlleva a la larga una insuficiencia renal severa.
Aumento de la viscosidad de la sangre por el exceso de paraproteínas, lo cual favorece la aparición de trombosis —sobre todo a nivel neurológico y oftalmológico— y la aparición de insuficiencia cardíaca.
Aparición de tumores en tejidos linfáticos fuera de la médula ósea que se denominan plasmocitomas.
¿Cómo se diagnostica?
El diagnóstico inicial puede ser casual al ver alteraciones en la analítica de sangre, especialmente la presencia de una paraproteína en ella. Si se sospecha en la analítica se debe valorar la función renal, los niveles de calcio, los niveles de las otras células sanguíneas y la alteración de la coagulación. Se deberá realizar una punción ósea para cerciorarse de la excesiva presencia de células plasmáticas en la misma, lo cual confirma el diagnóstico. Para valorar las lesiones óseas se pueden realizar diferentes pruebas de imagen, como la radiografía simple o el escáner.
Los pacientes que, en el momento del diagnóstico, se encuentren asintomáticos no requieren tratamiento desde el principio, ya que no se ha comprobado que hacerlo prolongue la supervivencia de los pacientes. Los objetivos del tratamiento son reducir la masa tumoral, lograr la remisión completa si es posible, retrasar la progresión del mieloma y mejorar las condiciones de vida y de supervivencias de los pacientes.
Tratamiento
En caso de iniciar tratamiento, las opciones terapéuticas son varias, como la quimioterapia , la radioterapia , el tratamiento con interferones, la inmunoterapia mediante anticuerpos monoclonales, la lenalidomida con dexametasona, la talidomida, el bortezomib o el trasplante de médula ósea, ya sea de uno mismo (autólogo) o de un donante (alogénico). Asimismo, es muy importante el tratamiento de las complicaciones del mieloma, como las infecciones, la hipercalcemia o la afectación renal.
Con el tratamiento y en función de cuán avanzada esté la enfermedad, la esperanza de vida oscila mucho , entre los 4 y 8 años de vida . La función renal, la edad y el estado de salud de base del paciente son factores claves para determinar la supervivencia. Con todo, cabe decir que más del 50% de los pacientes que se someten a un trasplante de médula ósea logran una remisión completa, es decir, quedan libres de la enfermedad. Asimismo, la detección de ciertos oncogenes permitiría utilizarlos como dianas terapéuticas y poder realizar un tratamiento más personalizado a cada paciente en función de estos genes mutados.
Artículo especializado
Leucocitos: La Armada Defensiva de Nuestro Cuerpo
A la gran mayoría de nosotros se nos ha realizado alguna vez en la vida una analítica sanguínea básica, aunque sea de rutina por nuestro médico de familia. Uno de los parámetros principales que se solicitan y que forman parte del hemograma (recuento de células sanguíneas) son los glóbulos blancos o leucocitos. Estas células están sujetas a una gran cantidad de variaciones absolutas y relativas, algunas de ellas de escasa importancia, pero otras que sí que pueden revestir gravedad. Por ello, resulta importante conocer algunos conceptos básicos sobre este tipo de células sanguíneas para saber cuándo es necesario ponernos en contacto con nuestro médico de manera prioritaria.
¿Qué son?
Los leucocitos son las principales células sanguíneas encargadas de la defensa del organismo frente a microorganismos infecciosos , otros agentes externos y células atípicas, es decir, las que son diferentes a la normalidad. Al igual que el resto de células sanguíneas, los glóbulos blancos se forman en la médula ósea , la cual genera miles de millones cada día. No obstante, sus valores de normalidad en sangre se expresan en número de células dividido por un volumen de sangre, siendo normal cifras de entre 4.000 a 11.000 leucocitos por microlitro de sangre. Estas cifras pueden variar sutilmente en función del laboratorio de análisis.
Subtipos de leucocitos
Inicialmente, todos los leucocitos comienzan siendo células madre que sufren un proceso de maduración y se terminan transformando en uno de los diferentes subtipos de glóbulos blancos: neutrófilos, linfocitos, monocitos, eosinófilos o basófilos . Los más abundantes (y también los de mayor relevancia clínica) son los neutrófilos y los linfocitos, principales responsables de velar por el sistema inmunitario del organismo.
Neutrófilos y linfocitos, como si de la defensa de un castillo se tratase…
Imaginemos que estamos en la Edad Media , en pleno siglo XIII d.C., y que nuestro castillo está siendo atacado por sorpresa. El hombre situado en lo alto de la más alta torre hará sonar la campana para avisar al resto de la población, entre la que se encontrarán los soldados. En primer lugar, éstos tratarán de contener el intento de ataque rápidamente mediante arcos y flechas desde el muro de castillo. Mientras tanto, el resto de guerreros tendrán tiempo de ir vistiendo sus armaduras, yelmos y espadas por si el intento inicial de contención no es eficaz. Por tanto, en el caso de fallar estos arqueros que han actuado de inicio, tendrán que ser estos guerreros ya armados y equipados los que bajen a las puertas del castillo a luchar contra el enemigo y los que decidirán el devenir de la batalla. Además, los más veteranos, con muchas batallas a sus espaldas, serán capaces de hacerlo rápidamente e intentarán ayudar en la contención inicial del ataque.
Con esta analogía, podemos comprender mejor la forma en el que funcionan estos dos tipos de glóbulos blancos: los neutrófilos serían los arqueros , que rápidamente son capaces de actuar y de intentar contener el ataque inicial del microorganismo infeccioso; los linfocitos, por tanto, serían los guerreros ya armados y equipados , a los que les cuesta entrar en acción inicialmente pero que después serán los encargados de eliminar el agente externo y de la curación. Estos últimos, además, tienen memoria inmunológica: son capaces de recordar anteriores estímulos de microorganismos infecciosos similares, pudiendo actuar inicialmente y de forma rápida como linfocitos específicos. Este es el principio en el que se basa la vacunación.
¿Qué es la leucocitosis?
Por todo lo anterior, una detección analítica de leucocitos altos o leucocitosis es significado de una activación de nuestro sistema inmune desencadenada principalmente por cualquier tipo de infección aguda, siendo los neutrófilos la fracción de glóbulos blancos elevada. Además, como otras causas frecuentes de leucocitosis podemos encontrar:
Inflamaciones no infecciosas.
Contusiones o traumatismos sobre cualquier tejido, incluido las quemaduras.
Hemorragias agudas.
El cáncer, trastornos de médula ósea y otras enfermedades metabólicas.
Ansiedad y estrés.
Ejercicio físico de intensidad elevada y alto impacto.
Además de realizar una analítica sanguínea para valorar un aumento de leucocitos, estas células también tienen la capacidad de excretarse por vía urinaria cuando están aumentadas en la sangre. Esto resulta especialmente útil ante la sospecha de una infección de orina: únicamente analizando una muestra miccional en el laboratorio o a través de una tira reactiva de orina podemos descartar con alta fiabilidad la presencia o no de una infección de vías urinarias.
¿Y los eosinófilos?
Por último, otro de los subgrupos de glóbulos blancos que reviste interés son los eosinófilos . Esta fracción minoritaria de leucocitos corresponden a un 1%-3% de su total, siendo igual de importantes en la defensa del organismo, pero encargándose de funciones diferentes a las mencionadas por neutrófilos y linfocitos. Sus valores elevados tienen especial relevancia en ciertas enfermedades tales como:
Infecciones por parásitos.
Asma y rinitis alérgica.
Lesiones dermatológicas alérgicas como eczemas o urticarias.
Vasculitis y otros trastornos inmunitarios.
Ciertos tipos de cánceres hematológicos como leucemias o linfomas.
El tratamiento para el aumento de leucocitos, sea la fracción que sea de los cinco tipos, depende de la causa desencadenante que esté provocando esta elevación. Debido al inmenso diagnóstico diferencial que existe ante una alteración en estas células sanguíneas, siempre es recomendable consultar con tu médico habitual ante cualquier hallazgo fuera de lo normal.

Artículo especializado
¿Qué es el Herpes Zoster?
Conocido comúnmente como “culebrilla”, el herpes zóster es una infección de la piel causada por el virus varicela-zóster , un virus de la familia de los herpesvirus, similar por lo tanto al herpes simple que produce las “calenturas” en el labio. Son infecciones muy frecuentes y, aunque en la mayoría de los casos se resuelven sin secuelas, pueden comportar complicaciones en algunos pacientes. En el caso del zóster, la más importante es un dolor intenso y prolongado.
¿Cómo se produce?
El virus varicela-zóster se manifiesta en dos fases.
La primera es la varicela , una infección típica de niños, que hasta hace pocos años se debía pasar de forma natural, como otras enfermedades víricas muy conocidas (la rubeola, el sarampión, etc), hasta que se ha instaurado la vacuna en el calendario vacunal.
Tanto si se pasa de forma natural como con la vacuna (la vacuna consiste en realidad en administrar el virus más débil o atenuado), el virus queda latente o escondido en el organismo, y puede dar lugar al zóste r en una segunda fase en algún momento de la vida. Es decir, la enfermedad o la vacuna crean anticuerpos, pero estos no son capaces de neutralizar el virus completamente. Esta segunda fase, el zóster, consiste en una reactivación del mismo virus, sólo en un territorio de la piel, de forma unilateral Es, por lo tanto, como pasar una “ segunda varicela ” en una zona de la piel, con la diferencia de que en esta fase la enfermedad puede provocar como complicación un intenso dolor, y no sólo picor, como la varicela.
¿A quién afecta?
Puede aparecer a cualquier edad sobre cualquier persona que haya pasado la varicela o haya sido vacunada para esta enfermedad, ya que tiene el virus latente, y éste puede volver a crecer y viajar a la piel para producir los síntomas. En general, el zóster aparece a edades más avanzadas, a partir de los 60 años . También es típico que aparezca en situaciones de estrés o enfermedades que comportan “bajadas de defensas”, como una pulmonía o un tratamiento con quimioterapia para un cáncer.
Síntomas
La zona más frecuentemente afectada es la región torácica o lumbar, apareciendo las lesiones típicas sobre una franja en forma de cinturón que abarca desde la línea media del abdomen a la línea media de la espalda, es decir, sólo media circunferencia del cuerpo. Por ello, se le conoce comúnmente como “culebrilla”.
En la piel primero hay un intenso dolor o escozor , que puede parecer un esguince o un “tirón” de una costilla, o incluso puede simular el dolor de una angina de pecho, un fuerte golpe, o un infarto de miocardio.
En 24 o 48 horas aparece enrojecimiento , y granitos con líquido en su interior, agrupados sobre la zona, que duran una o dos semanas hasta que se van secando y formando costras.
Puede dejar cicatrices si ha sido muy intenso.
El zóster puede afectar a cualquier zona del cuerpo, incluso la cara, con una posible afectación del ojo que puede comportar gravedad y necesitar de la colaboración de un oftalmólogo para su correcto diagnóstico y tratamiento.
El síntoma más temido: la neuralgia postherpética
El virus provoca inflamación en los nervios de la piel , y una vez eliminado correctamente con tratamiento, ese dolor puede persistir semanas o meses, y necesita ser tratado para no interferir con la calidad de vida. La neuralgia postherpética aparece más cuanto más avanzada es la edad (en general por encima de los 70 años), cuanto más extenso es el zóster, o cuanto más debilitado este el paciente.
Puede ser un dolor muy intenso, continuo, que impide el sueño , como “un puñal clavado” o como “latigazos”. En otros casos, el dolor se describe más como quemazón o escozor . Como en el momento de presentarse la neuralgia, lo único que hay es inflamación en los nervios, deben administrarse tratamientos dirigidos a controlarla, y en general no está recomendado seguir administrando más antibióticos contra el virus (antivíricos). En muchos casos, el tratamiento de la neuralgia puede necesitar de la colaboración de un neurólogo (especialista en las enfermedades del sistema nervioso).
Diagnóstico
Cualquier médico entrenado, y por supuesto un dermatólogo, somos capaces de reconocer la clínica de un herpes zóster. En casos de duda, puede obtenerse líquido por raspado de los “granitos” de la piel, y realizarse una citología , que es una prueba rápida que puede confirmar la infección de las células por el virus. Si existen dudas sobre si el paciente ha pasado o no la varicela o ha sido vacunado, el médico puede pedir una prueba en sangre llamada “serología” para saber si el cuerpo ha producido anticuerpos para el virus, y si la infección es pasada o reciente.
En las primeras 24 o 48 horas, cuando sólo hay dolor y no se observa nada en la piel, puede ser difícil asegurar que se trata de un zóster. Cuando existe esa posibilidad, el médico puede dar tratamientos para el dolor, y dar una cita al paciente para el día siguiente para volver a explorar la piel. Esto es muy importante, porque el tratamiento para frenar al virus (con antivíricos) será más eficaz cuanto antes se inicie, en los primeros dos o tres días del comienzo del zóster.
Tratamiento
El tratamiento es sencillo si se diagnostica a tiempo, y se basa en el empleo de los antivíricos en pastillas. Estos son aciclovir, famciclovir o brivudina entre otros. Los antivíricos en pomada , como los que se dan para los herpes simples del labio, no son eficaces para el herpes zóster. El tratamiento suele durar una semana, y las dosis son diferentes para cada medicamento. El médico puede necesitar ajustar la dosis si el paciente es mayor, o diabético o tiene alguna enfermedad que haga que el riñón funcione mal.
El paciente debe aplicar en la piel alguna solución secante , como povidona o alcohol, para ayudar a secar las lesiones y que hagan costras lo más rápido posible.
En el caso de presentarse neuralgia, puede ser necesario dar analgésicos como paracetamol, metamizol o codeína, y en casos en los que no se controle, hay que recurrir a medicamentos más potentes como gabapentina o pregabalina. En casos muy invalidantes, con dolor que no responde a medicamentos, el paciente puede ser remitido por el dermatólogo o el neurólogo a una clínica del dolor, una consulta realizada habitualmente por anestesistas, para la administración de otros tratamientos.
Medidas preventivas
Si un paciente con herpes zóster está en contacto con personas que no hayan pasado la varicela, como niños muy pequeños, o mujeres embarazadas que pueden pasarle la infección al bebé, debe evitar tocarlas o compartir toallas u objetos que la puedan transmitir.
Por lo demás, no existe una manera de evitar el herpes zóster. La vacuna para la varicela, que se lleva administrando más de 10 años, no ha demostrado reducir de momento la incidencia del zóster.
Artículo especializado
Inmunoterapia Contra el Cáncer
¿Existe luz al final del túnel? La inmunoterapia puede ser la clave que nos ayude a ganar definitivamente la batalla en la lucha contra el cáncer.
La inmunoterapia es un tratamiento que ha aparecido en los últimos años como herramienta fundamental en el tratamiento de determinados tipos de cáncer . En pocos años, este tipo de tratamiento ha pasado a ser uno de los avances más importantes en la lucha contra el cáncer. Prueba de ello es que en el año 2013, la prestigiosa revisa Science designó a la inmunoterapia contra el cáncer “Revelación del año”.
¿Qué papel tiene el sistema inmune en el cáncer?
El tratamiento con inmunoterapia contra el cáncer se basa en la estimulación del sistema inmune para frenar o erradicar las células tumorales . Antes de proseguir, es muy importante conocer el papel que desempeña el sistema inmune frente al cáncer.
El sistema inmune (las defensas) es un sistema que tiene nuestro organismo para identificar y eliminar células que nuestro cuerpo identifica como extrañas (ajenas). Así pues, cuando sufre una infección por un virus o una bacteria, por ejemplo, el sistema inmunitario es capaz de identificar que esas células no son células propias y actúa contra ellas, destruyéndolas. Esta identificación la realiza mediante la identificación de las proteínas que presentan las células en sus membranas (sus paredes).
Como hemos comentado, las células tumorales son células de nuestro organismo que sufren una mutación que provoca que crezcan sin control. En muchas ocasiones, esa mutación provoca que aparezcan nuevas proteínas en la superficie celular y gracias a ello, el sistema inmune puede actuar contra ellas y eliminar el tumor o frenar su crecimiento. De hecho, el sistema inmune elimina muchas células que sufren mutaciones incluso antes de que lleguen a provocar tumores.
Gran parte de los cánceres están provocados por defectos en el sistema inmune , que deja de identificar a las células tumorales como células ajenas y deja de actuar sobre ellas.
¿Y cómo actúa la inmunoterapia?
La inmunoterapia es un tipo de tratamiento que intenta estimular al sistema inmune del organismo para que éste sea el encargado de luchar contra las enfermedades.
Tipos de inmunoterapia
Anticuerpos monoclonales : los anticuerpos son proteínas que produce el organismo para identificar y eliminar células nocivas (generalmente infecciones). Hoy en día, los avances científicos nos han permitido crear anticuerpos en un laboratorio. Esos anticuerpos pueden tener principalmente dos objetivos: unirse a las células tumorales como agentes extraños y facilitar que el sistema inmune del paciente identifique más fácilmente esas células o, por el contrario, unirse a las células tumorales bloqueando su funcionamiento y frenando de esa manera su reproducción y crecimiento.
Inmunoterapias no específicas (citoquinas): son tratamientos que mejoran el funcionamiento del sistema inmune del paciente. Ejemplos de ellos son las interleuquinas, que aumentan el crecimiento y la actividad de las células inmunitarias, o los interferones, que mejoran la respuesta inmunitaria contra el cáncer.
Vacunas: las vacunas clásicas ya eran un tipo de inmunoterapia. Cuando nos vacunamos frente a una infección, no estamos haciendo otra cosa que estimular al sistema inmune para que detecte y actúe rápidamente en caso de que se identifique un determinado virus o bacteria. Este tipo de estimulación también se puede utilizar en el tratamiento contra el cáncer. El objetivo de las vacunas contra el cáncer es que el organismo reconozca las células tumorales y las destruya antes de que estas lleguen a provocar una enfermedad.
Transferencia celular adoptiva: es un tipo de terapia en la que se extraen células del sistema inmune del paciente (glóbulos blancos -células T) que se modifican en un laboratorio para hacer que sean más efectivas en la detección y eliminación de un tipo de células cancerosas. Esas células se cultivan y multiplican en el laboratorio y se vuelven a introducir en el paciente de forma que puedan actuar contra su cáncer.
¿Cuándo se utiliza?
El tratamiento con inmunoterapia ha evolucionado mucho en los últimos años. Cada vez son más los estudios que buscan demostrar su eficacia para nuevos tipos de tumores. Aunque su uso no es tan extendido como el de las quimioterapias tradicionales, cada vez son más los tipos de tumores que pueden tratarse ya con este tipo de fármacos. Cánceres como el de pulmón, el melanoma, el cáncer de vejiga o el cáncer de cérvix son ejemplos en los que la eficacia de la inmunoterapia ya está totalmente comprobada.
¿Qué efectos secundarios puede presentar?
Tal y como el resto de tratamientos contra el cáncer, la inmunoterapia también puede ocasionar efectos secundarios no deseados. Estos efectos dependerán del tipo específico de inmunoterapia, pero los más frecuentes son síntomas similares a los de una gripe, debilidad, mareos, fatiga o problemas digestivos. Algunos tipos de inmunoterapias pueden favorecer la aparición de infecciones e incluso de otros tumores. En ocasiones, pueden producirse reacciones alérgicas al tratamiento (como a cualquier otro tratamiento), que pueden ser incluso graves.
Aunque pueda parecer que existen muchos efectos adversos, es importante valorarlos con su médico especialista, puesto que en general, el beneficio potencial de utilizar este tipo de fármacos es infinitamente superior.

Artículo especializado
Linfoma no Hodking en Adultos
El linfoma no Hodgkin es el tumor de las paradojas: el tumor que no es un tumor sino muchos y que en ocasiones es mejor cuando es peor (la probabilidad de curación aumenta cuando el tumor es más agresivo).
¿Qué es?
Un linfoma es un tipo de tumor maligno originado en el tejido linfoide . Se inicia cuando una de las células del tejido linfoide sufre una mutación genética que provoca que se multiplique sin control, creando un tumor que va creciendo y frecuentemente afectando a tejidos de su alrededor. El tejido linfático está distribuido por todo nuestro organismo en forma de vasos linfáticos (un sistema similar al sistema venoso) y de ganglios linfáticos , aunque también pertenecen al tejido linfático órganos como el bazo, las amígdalas o el timo (un pequeño órgano situado en la parte superior del tórax, por detrás del esternón). Gran parte de este tejido está directamente relacionado con el sistema inmune (las defensas) del organismo, por lo que este tipo de tumores pertenecen a los llamados tumores hematológicos, como las leucemias.
¿Dónde se produce?
Dado que el tejido linfático está distribuido por todo nuestro cuerpo, el tumor puede originarse en cualquier localización, aunque es más frecuente que se origine en el cuello, en el tórax o en el abdomen . En raras ocasiones, estos tumores pueden originarse en otras localizaciones como en la piel, el cerebro, el corazón, etc.
El linfoma no Hodgkin no se trata en realidad de un tipo concreto de cáncer, sino que bajo este nombre se engloban más de 20 tipos distintos , cada uno con unas particularidades que lo diferencian del resto. El nombre de Linfoma no Hodgkin se utiliza para diferenciarlo del Linfoma de Hodgkin, un tipo concreto de linfoma con unas características y un pronóstico muy diferente al resto de linfomas.
¿A cuánta gente afecta?
Se estima que en 2017 se han diagnosticado aproximadamente unos 6.429 nuevos casos de Linfoma no Hodgkin, siendo el noveno tipo de cáncer más frecuente de nuestro país. Es alrededor de un 30% más frecuente en hombres que en mujeres.
¿SABÍAS QUE…
La mortalidad del Linfoma no Hodgkin ha ido disminuyendo progresivamente en los últimos años gracias a los avances en los tratamientos que se utilizan, llegando en la actualidad a una tasa de supervivencia media a los cinco años superior al 70%, aunque para los tipos de más bajo riesgo la tasa de supervivencias a los cinco años es superior al 91%.
¿Por qué se produce?
El motivo de la aparición de un Linfoma no Hodgkin, como ya hemos dicho, es una mutación en una de las células del tejido linfático. La causa de estas mutaciones es desconocida, pero lo que sí que se conocen son factores que pueden favorecer su aparición:
La edad: es el principal factor de riesgo conocido. La mayoría de pacientes que presentan un Linfoma no Hodgkin se encuentran por encima de los 60 años. Existen casos también de Linfomas no Hodgkin diagnosticados en niños, pero mucho menos frecuentemente de lo que se diagnostican en adultos.
Exposición a productos químicos : algunos estudios demuestran mayor incidencia en la aparición de linfoma en pacientes expuestos a herbicidas o insecticidas. Como ya hemos comentado, algunos tratamientos inmunosupresores como la quimioterapia utilizada para tratar otro tipo de cánceres, pueden aumentar también el riesgo de desarrollar un Linfoma no Hodgkin.
Exposición a radiaciones : la exposición incontrolada a radiación puede aumentar el riesgo de presentar tumores hematológicos, como leucemias o linfomas. Sin embargo, cabe destacar que la radiación recibida al realizar estudios radiológicos como radiografías o TACs (escáneres) es muy limitada y no supone un riesgo para desarrollar este tipo de enfermedades.
Enfermedades que afecten al sistema inmune : las personas con algunos tipos de infecciones (VIH, virus de Epstein-Barr o el virus herpes humano tipo 8, entre otras), enfermedades autoinmunes, algunos síndromes genéticos, y las personas que han precisado un trasplante de órganos, tienen un riesgo algo superior al del resto de la población para desarrollar esta enfermedad.
¿Cómo se presenta?
Los síntomas que puede provocar un linfoma no Hodgkin son muy inespecíficos, ya que dependen en gran parte de la localización en la que aparezca el tumor y del tipo de tumor en concreto que se trate.
Más del 60% de los casos se detectarán por la palpación de un bulto en alguna localización (en muchas ocasiones un ganglio aumentado de tamaño).
En alrededor de un 40% de los casos se presenta un síndrome con síntomas generales como fiebre, pérdida de peso, episodios de sudoración profusa sin motivo aparente, etc. Más rara es la presentación del linfoma en forma de cansancio, falta de apetito, malestar general, dolores óseos, etc.
¿Cómo se diagnostica?
Dependerá en gran medida de la localización del tumor. Se suelen usar técnicas de imagen como la ecografía (en tumores más superficiales) o el TAC (en tumores más profundos como en tórax o abdomen) para identificar la localización y el número de lesiones (en muchos casos pueden haber varios ganglios afectados).
Es preciso realizar un estudio del tejido mediante una biopsia (en la mayoría de casos obtenida mediante cirugía), aunque en algún caso se puede realizar un diagnóstico con una punción del tumor o incluso con una biopsia de médula ósea (alrededor de un 40% de casos afectan también a la médula ósea).
¿Cómo se trata?
En el caso del Linfoma no Hodgkin es muy importante destacar que hay tipos agresivos y tipos indolentes, por lo que el tratamiento y el pronóstico se basarán en gran medida en el tipo concreto de tumor del que se trate. El tratamiento también dependerá de la edad del paciente, de la extensión y de la localización de la enfermedad. En general, el tratamiento se basará en el uso de quimioterapia y en aquellos casos de tumores más localizados, de radioterapia.
En este tipo de cáncer, se produce la paradoja de que los tumores más indolentes (menos malignos), pese a que tienen buena respuesta al tratamiento, en escasas ocasiones se consigue su curación completa, y en muchas ocasiones se reproducen al cabo de los años. Sin embargo, los tumores más agresivos responden incluso mejor al tratamiento de quimioterapia que los tumores más indolentes, y en muchas ocasiones se consigue la curación completa de la enfermedad.

Artículo especializado
Cómo Saber si Tengo Sepsis
La sepsis o septicemia es una situación médica grave en la cual se produce una respuesta inmunitaria severa y fulminante ante una infección, independientemente de su origen. Puede aparecer de manera imprevisible y su evolución suele ser rápida, de ahí que suponga una emergencia médica. La gran mayoría de infecciones no van a acabar en una sepsis , pero antes los síntomas de mala evolución que describiremos es importante acudir cuanto antes a los servicios de emergencias más cercanos.
Cómo reacciona el cuerpo ante una infección
Ante la presencia de una infección, ya sea de origen bacteriano, vírico o fúngico (hongos), el organismo libera a la sangre una serie de sustancias químicas que forman parte del sistema inmunitario y cuya misión es ayudar a combatir la infección. Estas sustancias desencadenan una reacción inflamatoria generalizada en todo el organismo . Dicha reacción facilita que se formen coágulos en los vasos sanguíneos y que se puedan producir hemorragias a diferentes niveles. Estos sucesos hacen que la circulación sanguínea se vea alterada y los órganos se vean afectados, dado que se compromete el aporte de nutrientes y oxígeno a las células, lo cual puede causar daños severos e irreparables.
En los casos más graves de sepsis, se produce una insuficiencia de uno o más órganos . Suele ser una concatenación de lesiones que van haciendo que los órganos fallen y, en el peor de los casos, se da una disminución de la presión sanguínea y un descenso de la frecuencia cardíaca el paciente puede entrar en un estado de shock séptico. Rápidamente se ven afectados los riñones, los pulmones y/o el hígado y la situación puede llegar a ser mortal.
Causas de una sepsis
Existen diversos tipos de microorganismos que pueden causar sepsis, bacterias, hongos y virus ; con todo, las bacterias suelen ser los principales agentes infecciosos que pueden desencadenar un cuadro de sepsis. Es frecuente que sea difícil establecer cuál es el agente causante de la infección y, consiguientemente, de la sepsis.
Los casos más graves de sepsis suelen ser el resultado de una infección generalizada, de todo el organismo, que se disemina a través del torrente sanguíneo. Los principales focos de origen de una sepsis son:
Infección pulmonar.
Infección de las vías urinarias.
Infección cutánea.
Infección de la cavidad abdominal (apendicitis, peritonitis).
Manipulación de vasos sanguíneos (vías venosas periféricas o centrales, cateterismos).
Quiénes son más vulnerables
Afortunadamente, no todas las infecciones van a derivar en una sepsis (de hecho, la gran mayoría de infecciones se resuelven sin problema) ni todos los pacientes van a tener el mismo riesgo de padecer una sepsis. Aquellas p ersonas con mayor riesgo de sufrir una sepsis son :
Neonatos y niños.
Ancianos.
Diabéticos.
Inmunodeprimidos (pacientes con SIDA, pacientes oncológicos).
Insuficiencia hepática.
Insuficiencia renal.
Incidencia
En España se diagnostican unos 50.000 casos de sepsis cada año , es decir, unos 104 casos por cada 100.000 habitantes. De estos casos, 17.000 personas fallecen anualmente por culpa de una sepsis, más muertes que las debidas al cáncer de mama, de colon o de páncreas, así como 13 veces más que por accidentes de tráfico. La pronta instauración de un tratamiento es fundamental, dado que, tras cuatro horas de haberse instaurado un choque séptico, las probabilidades de supervivencia caen por debajo de un 50%. Asimismo, el coste económico aproximado por el tratamiento y la hospitalización de un paciente con sepsis es de unos 17.000 euros por persona.
A nivel mundial, cada año mueren ocho millones de personas por un cuadro de sepsis , y se diagnostican entre 20 y 30 millones de caso anualmente. En la última década el número de pacientes se ha duplicado y los estudios estiman que la tendencia será que el aumento prosiga. En los países en vías de desarrollo la sepsis es la causante de la muerte de 6 millones de recién nacidos.
El aumento de las cifras globales de casos de sepsis puede ser debido a un mayor y mejor registro de los casos, a la existencia de una población más longeva y con mayor prevalencia de patologías crónicas, a la mayor resistencia de las bacterias a antibióticos, así como un uso más habitual de tratamientos inmunosupresores, como en pacientes oncológicos o trasplantados.
Qué síntomas nos alertan
Los síntomas más habituales de una sepsis pueden ser:
Fiebre.
Escalofríos.
Respiración acelerada.
Taquicardia.
Palidez y sudoración.
Malestar general intenso o sensación de muerte.
Confusión, somnolencia, incoherencia.
Estos síntomas son frecuentes en otro tipo de afecciones, por lo cual la sepsis es difícil de diagnosticar , especialmente en sus etapas iniciales, y pese a existir un contexto de infección.
Al acudir a un centro de urgencias se realizarán diversas pruebas para valorar si existe una sepsis, entre ellas una analítica de sangre, alguna prueba de imagen (radiografía, escáner), cultivos de sangre y un estricto control de las constantes del paciente para monitorizar la frecuencia cardíaca, la tensión arterial, la frecuencia respiratoria y la saturación de oxígeno en sangre.
Tratamiento
En caso de establecer un diagnóstico de sepsis los pacientes, debido a su estado grave, suelen ser tratados en las unidades de cuidados intensivos (UCI), para poder tener al paciente más controlado y tomar medidas para mantener estables las constantes del paciente . El objetivo del tratamiento es acabar con la infección, preservar los órganos vitales y evitar una caída de la presión arterial que pueda precipitar el daño en otros órganos. El tratamiento suele ser con una cobertura antibiótica amplia y un correcto aporte de líquidos por vena. En casos graves puede ser preciso intubar al paciente, realizar diálisis o bien someter al paciente a una intervención quirúrgica.
Muchos pacientes que logran superar una sepsis se recuperan por completo , pero siempre dependerá del estado basal del paciente. Si son personas más añosas o con enfermedades crónicas, algunos órganos pueden presentar daños permanentes, como los riñones, el corazón o los pulmones. Los estudios también indican que el padecer una sepsis grave puede causar una alteración en el sistema inmunitario que haga que estas personas sean más proclives a padecer futuras infecciones.

Artículo especializado
Utilidad de los Test Genéticos
El test genético es una prueba médica que ayuda a conocer si hay una mutación determinada en el ADN (organizado en forma de genes) de un individuo, la identifica y determina si ésta se asocia a una enfermedad concreta.
Cada individuo tiene un conjunto de genes, con una función determinada. La alteración de algunos de estos genes (mutación) puede aumentar la susceptibilidad de padecer una enfermedad, de presentarla o de que ésta sea de mayor o menor gravedad.
El estudio genético indica si la persona, una vez identificada la mutación, es portadora o no. Esto significa si ha heredado la alteración que le hace tener un mayor riesgo de sufrir una enfermedad. El hecho de ser portador no quiere decir que vaya a desarrollarla necesariamente sino que existe una mayor predisposición que en el resto de la población.
El procedimiento para el paciente es muy sencillo ya que se hace generalmente con una simple analítica en sangre, otras veces con muestras de células de piel o saliva. Lo que se estudia en el laboratorio es el ADN del individuo y si existen las alteraciones genéticas (genes específicos) descritas y asociadas con enfermedades hereditarias.
¿Cómo se interpreta?
Aunque la realización de la prueba es sencilla, su interpretación, por el contrario, es complicada y precisa ser hecha por un especialista, quien además debe tener otros datos como la historia médica y familiar del paciente.
El objetivo del test genético es establecer un plan preventivo para disminuir el riesgo de que el paciente desarrolle la enfermedad, por ejemplo, un cáncer de ovario. Para ello es fundamental tener otros datos que nos ofrezcan una imagen global de la situación de la persona estudiada. Es decir, por sí sola la información genética puede no ser concluyente. Entre otros factores, hay enfermedades de causa multifactorial (además de la genética intervienen otros actores) y de herencia poligénica (intervienen varios genes) lo cual hace que sea necesaria la valoración cuidadosa de cada caso y del riesgo del paciente antes de tomar medidas específicas de tratamiento.
Aclarando conceptos
Existe gran confusión en este campo, y por ello proliferan empresas en Internet que hacen de forma económica un test genético, con el problema de que la interpretación no la realiza un especialista y pueden crear situaciones erróneas y confusas al solicitante. En Europa están prohibidos los diagnósticos genéticos directos al consumidor. Según la Ley de Investigación Biomédica “el diagnóstico genético requiere un proceso de consejo genético previo y posterior”. En otras palabras , es el médico quien recomienda o indica el test genético tras el estudio en consulta del paciente con el asesoramiento pertinente.
Actualmente, los hospitales universitarios de un gran número de ciudades españolas disponen de las llamadas Unidades de Consejo Genético , cuya función es el asesoramiento, la valoración y la indicación de pruebas genéticas en aquellos casos que lo consideren pertinente.
¿En qué áreas se aplica?
Los tests genéticos se indica sobre todo en:
Estudio diagnóstico de enfermedades de clara causa genética y hereditarias como la fibrosis quística.
Prevención y detección precoz en oncología, para descartar cánceres con un componente genético claro como el cáncer de ovario o el de mama.
En recién nacidos, para la determinación precoz de un panel de enfermedades genéticas.
En familiares de pacientes diagnosticadas de enfermedades hereditarias, por ejemplo, la miocardiopatía hipertrófica o la paraparesia espástica familiar.
Test genéticos y oncología
Uno de los avances más interesantes en los últimos años en el área de la oncología ha sido el estudio de la genética y su asociación con determinados tipos de tumores.
El conocimiento de los paneles genéticos (genes mutuados y el cáncer con el que se asocia) permite desarrollar diferentes estrategias, especialmente para la prevención y desarrollo de este tipo de tumor en los pacientes que sean portadores de esa mutación determinada.
Por ejemplo, en mujeres con una mutación determinada que se ha demostrado que aumenta el riesgo de cáncer de ovario, la realización de una ooforectomía (quitar los ovarios) lo elimina completamente.
Por tanto, la realización de test genéticos en cánceres hereditarios se ha ido incorporando a la práctica médica habitual.
¿Cuándo se realiza?
Se sospecha que puede haber un cáncer hereditario en aquellas con antecedentes médicos personales o familiares especiales. Entre ellos se incluyen: la presencia de varios casos de cáncer en la familia y/o si han aparecido a edades tempranas; haber presentado varios tipos de cáncer el mismo paciente, ser de un determinado grupo étnico que tienen mayor susceptibilidad, etc.
¿Qué tipos de cáncer son los más frecuentemente hereditarios?
Cáncer de mama hereditario: implicados los genes BRCA1 y BRCA2.
Cáncer de colon: gen APC.
Cáncer de piel (melanoma maligno).
Cáncer de ovario: genes BRCA1, BRCA2.
Cáncer medular de tiroides: gen RET.
Otros tipos de cáncer más raros: feocromocitoma-paraganglioma (genes, SDHC, SDHB, SDHA y SDHAF2), neoplasia endocrina múltiple (Gen MEN1), retinoblastoma (gen RB1).
Las acciones que se pueden llevar a cabo de carácter preventivo se han de individualizar en cada caso, pero en líneas generales incluirán cirugía (mastectomía profiláctica, por ejemplo), quimioterapia (fármacos para reducir el riesgo) y diagnóstico precoz (pruebas de detección tempranas, por ejemplo colonoscopia en cáncer de colon).

Artículo especializado
Cuándo Podemos Sufrir Toxicodermia
Cuando la toma de un medicamento produce reacciones en la piel hablamos de una toxicodermia o toxidermia. Aunque no hayamos escuchado este término antes, lo cierto es que las toxicodermias son muy frecuentes, pero sólo una pequeña parte son potencialmente graves. Conozcamos más sobre ellas.
¿Una toxicodermia es una alergia?
Su diagnóstico y tratamiento compete más al dermatólogo que al alergólogo , porque sólo en algunas el mecanismo de producción es alérgico. La forma más frecuente de toxicodermia es el llamado exantema morbiliforme, que recuerda a las erupciones asociadas con las infecciones víricas infantiles, y no suele estar provocado por mecanismos alérgicos. Muchos pacientes piden pruebas de alergia cuando han tenido reacciones a medicamentos, y hay que explicarles muy claramente que no siempre sirven para estudiar la mayoría de estos cuadros. Incluso, algunos pacientes piden pruebas “para saber si son alérgicos”, y tampoco es posible siempre realizarlas con esta orientación. Un medicamento puede provocar toxicodermia sin haberlo hecho antes, y además puede no provocarla siempre que se vuelve a tomar ese medicamento. Esta compleja situación hace que tenga que ser el especialista en dermatología el que oriente al paciente sobre la reacción de forma muy individualizada .
Tipos y causas
Cualquier medicamento puede provocar toxicodermia, aunque algunos con mayor frecuencia . Es el caso de los antiepilépticos, algunos psicofármacos o antibióticos como las sulfamidas. Sin embargo, medicamentos tan utilizados como el ibuprofeno también pueden causar toxicodermias, y no hay manera de prevenirlo ni saberlo:
Exantema morbiliforme: se manifiesta como una erupción generalizada, que empieza por el tronco y avanza de forma centrífuga hacia las extremidades, con enrojecimiento y picor. Suele aparecer entre uno y 10 días después de la administración del medicamento causante.
Exantema fijo medicamentoso : se manifiesta con lesiones circulares rojas o violáceas que aparecen unos días después de recibir el fármaco, y vuelven a aparecer en la misma localización si el paciente vuelve a tomar el mismo fármaco. Puede afectar a piel y a las mucosas, como la zona genital, y a veces puede provocar ampollas.
Toxicodermias urticariformes : tienen el aspecto de una urticaria, con habones o ronchas que aparecen y desaparecen rápido, y se acompañan de intenso picor. Pueden tener un mecanismo alérgico.
El síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica son cuadros graves que aparecen como una erupción que confluye y se acompaña de despegamiento de la piel, con lo que el paciente puede tener la gravedad de un gran quemado. Las mucosas (ojos, genitales) pueden estar gravemente afectadas. Su gravedad es tal que requiere del ingreso en una unidad de cuidados intensivos para el tratamiento
Síndrome DRESS : es un tipo de toxicodermia que, además de una erupción en la piel, puede afectar a otros órganos, como el hígado y el riñón. Su causa más frecuente son los fármacos antiepilépticos.
Pustulosis exantemática aguda : es una reacción que incluye aparición de pústulas generalizadas y descamación, junto con fiebre y síntomas generales. Es importante no confundirla con una infección.
Dermatitis de contacto sistémicas : algunos pacientes presentan alergia de contacto a determinadas sustancias como los metales o los conservantes, y la ingestión de estas puede provocar una erupción generalizada. Para estudiarla cabe diagnosticar la alergia de contacto con unas pruebas específicas llamadas pruebas epicutáneas, que realizan alergólogos o dermatólogos.
¿Qué tratamiento tienen las toxicodermias?
La primera medida terapéutica debe ser, evidentemente, la suspensión del medicamento causante . En muchos casos, sobre todo en pacientes de edad avanzada, es frecuente la polimedicación, y no siempre es posible atribuir la reacción de la piel a uno u otro medicamento. En estos casos, deben intentar suspenderse aquellos fármacos que el paciente ha empezado a tomar más tarde, y sustituirlos por otros.
Además, es conveniente prestar atención a productos “naturales” u homeopáticos que el paciente haya consumido, porque también pueden ser los causantes de una reacción medicamentosa.
En algunos casos, la toxicodermia puede requerir tratamiento con corticoides tópicos u orales, antihistamínicos u otros medicamentos , a criterio del dermatólogo.
¿Cómo prevenir las toxicodermias?
Es importante evitar la automedicación. Por parte del médico, se deben prescribir medicamentos adecuados y a las dosis correctas. Debe minimizarse la toma de productos de herboristería o de medicina natural y homeopática, de dudosa eficacia y no exentos en ocasiones de efectos secundarios.
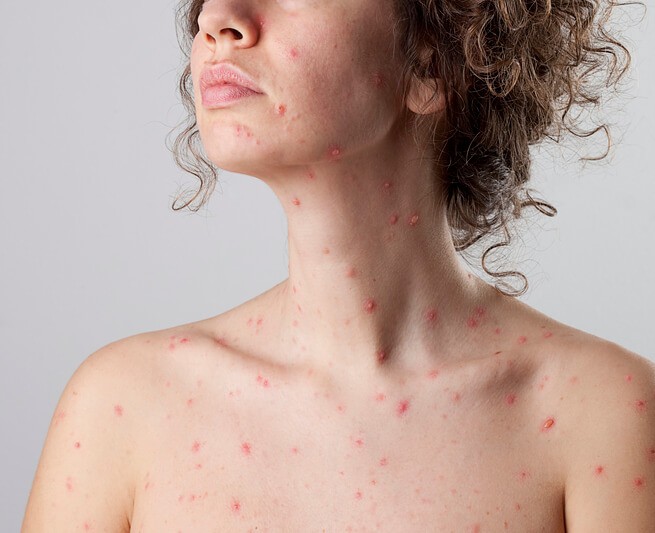
Artículo especializado
La Varicela en Adultos
Casi todos los niños han pasado la varicela, pero si no se ha tenido en la infancia, puede afectar a adultos jóvenes y entonces es más virulenta y puede complicarse. La varicela, en su estado natural, por eso, suele curar sin ningún tipo de secuelas, salvo algunas cicatrices con poco impacto estético.
La varicela es la principal enfermedad producida por el virus varicela-zóster, y es una infección infantil bien conocida. En su forma natural, se pasa durante la primera infancia o la pubertad, en general entre el primer año de vida y los nueve años. Se manifiesta con fiebre y una erupción generalizada en forma de vesículas (granitos con líquido) que van formando costras, y ocasionan un intenso picor. Cuando no se ha pasado de niño, puede afectar a adultos jóvenes, en cuyo caso es más virulenta, pudiendo ocasionar complicaciones incluso graves como la encefalitis o la neumonía. También puede ser más peligrosa cuando la pasan niños de menos de dos años. Por todo ello, y aunque en general es benigna y cura sin tratamiento, hace años que se vacuna a la mayoría de los niños de los países desarrollados con una preparado de virus atenuados, y se evita pasar una enfermedad que provoca molestias o secuelas.
¿Cómo se manifiesta?
El tiempo de incubación (el que transcurre entre el momento del contagio y el inicio de los síntomas) es de 12 a 20 días. Habitualmente, uno empieza con fiebre, vómitos, dolor de cabeza o pérdida de apetito durante dos o tres días, y es entonces cuando aparecen los primeros signos de la enfermedad en la piel : lesiones rojas en forma de granitos que en 24 horas se transforman en vesículas (granitos con líquido en su interior), y que poco a poco se van secando y formando costras. Cada lesión va sufriendo la misma evolución, y es típico ver estos granitos en diferentes fases, lo que se conoce como “patrón en cielo estrellado”. Es muy típico que afecten primero a la cabeza, y que luego se extiendan a todo el cuerpo, incluso a los genitales. También es habitual que el picor sea intenso hasta que la enfermedad va remitiendo y toda la erupción se va secando.
¿Cuándo deja marcas y cicatrices?
La varicela no deja cicatrices por sí misma, pero sí lo hace cuando los granitos se sobreinfectan por bacterias normales de la piel. En este caso las costras se hacen más aparentes y hay mucho enrojecimiento alrededor de las lesiones. Por ello, es habitual que los médicos receten antibióticos en pomada a aplicar en las lesiones más inflamadas o que crean más costras. Cuando hay sobreinfección, las lesiones pueden dejar cicatrices en general poco aparentes, de un tamaño de 3-4 milímetros, redondas, y un poco hundidas. Estas persisten para siempre, aunque en algunos casos pueden ser corregidas con cirugía. Asimismo, los pacientes que tienen tendencia a formar queloides (unas cicatrices más duras y dolorosas), pueden tenerlos como resultado de la varicela, generalmente en el pecho y en la parte superior de la espalda.
¿Tiene tratamiento o se cura sola?
Cuando la enfermedad se pasa a las edades habituales, generalmente es poco extensa y cura sola sin ninguna complicación . Sin embargo, en bebés muy pequeños, adultos, o personas inmunocomprometidas (con las defensas bajas), en los que la enfermedad tiende a ser más virulenta, se puede emplear un antivírico, el Aciclovir, en forma de pastillas, jarabe o incluso administrado por vía endovenosa. Es fundamental que este medicamento se empiece a administrar pronto, idealmente en las primeras 24-48 horas, porque es más eficaz para frenar la replicación del virus en estas fases.
Además de plantear el tratamiento antivírico con Aciclovir, es necesario tratar el picor con antihistamínicos y la posible sobreinfección por bacterias con antibióticos en crema.
En los adultos, ¿cómo se manifiestan las complicaciones?
La neumonía por varicela es rara , afectando a dos casos por cada 400 varicelas, y puede sospecharse cuando el paciente tiene dificultad para respirar, opresión en el pecho, tos (también con sangre) y fiebre. Suele aparecer entre el primer y el sexto día tras el inicio de la erupción. La confirmación suele realizarse mediante una radiografía del pulmón, en la que se observan lesiones en forma de manchas provocadas por la infección del pulmón por el virus. Es muy importante diagnosticarla pronto, antes de que el paciente pueda sufrir un fracaso respiratorio que comporte un ingreso en la UCI para ventilación mecánica.
Además de la edad adulta, otros factores de riesgo para tener una neumonía por varicela son el ser fumador, presentar una historia de contacto estrecho con el paciente que le ha contagiado (por ejemplo, cuando es su pareja o su hijo), sufrir una enfermedad pulmonar crónica previa, y tener fiebre que dura más de tres días.
La encefalitis por varicela , por su parte, debe sospecharse ante un fuerte dolor de cabeza, pérdida del nivel de conciencia, cambios de personalidad, alteraciones del habla, convulsiones o pérdida del equilibrio. Es importante diagnosticarla rápido para iniciar tratamiento lo más pronto posible y evitar secuelas permanentes. El método diagnóstico de elección es el electroencefalograma, o la resonancia magnética craneal.
Contenidos sobre enfermedades
Somos conscientes de que los conceptos médicos pueden resultar confusos si no te los explican con claridad. Para evitar esto, le hemos pedido a nuestros profesionales que preparen estas fichas en donde podrás acceder a información relevante sobre enfermedades que te ayudará a entender de una manera sencilla por qué se producen y por qué es necesario su tratamiento.
Ver todas las enfemedades 
Enfermedad
Rubéola
¿Qué es la rubéola?
Conocida también como tercera enfermedad , sarampión alemán o sarampión de los tres días . La rubéola es una enfermedad infecciosa exantemática producida por un virus del género Rubivirus .
Antes de la introducción de la vacunación infantil, la rubéola afectaba más a los niños entre 5 y 9 años . Desde el desarrollo de la vacuna la prevalencia de la enfermedad, en niño, ha disminuido drásticamente y pueden verse más episodios en adulto. Es una enfermedad endémica , con presentación de casos anuales aislados y ciclos epidémicos sobre todo en primavera , existiendo mayor riesgo en aquellas regiones donde hay una baja vacunación contra la rubéola (en estos casos con afectación infantil mayoritariamente).
Suele ser un proceso benigno autolimitado , aunque siempre hay riesgo de que surja una complicación.
Tipos de rubéola
Rubéola en la infancia y adultos (postnatal): Padecimiento de las manifestaciones clásicas de la enfermedad con lesiones dérmicas en la piel (exantema).
Rubéola prenatal o síndrome de rubéola fetal: A través de la transmisión de la mujer embarazada se producen malformaciones congénitas en el feto o embrión.
Causas de la rubéola
La causa de la rubéola es la infección por el virus de la rubéola ( Rubivirus de la familia Togaviridae ), transmitido por vía respiratoria (secreciones, saliva, etc), de persona a persona por contacto prolongado con un paciente que padece la enfermedad. El virus se reproduce en la mucosa del sistema respiratorio y a través del sistema linfático llega a la sangre, desde donde se localiza posteriormente en la piel. En el caso de mujeres embarazadas, el virus llega a la placenta lo que puede dar lugar a una infección del feto.
Síntomas de la rubéola
Rubéola en la infancia y adultos: Tras un periodo de incubación de 14 – 21 días, aparece la fase prodrómica de 1 – 2 días de duración en la que se presentan síntomas catarrales , malestar general y aumento del tamaño de los ganglios linfáticos (adenopatías) cervicales y retroauriculares (detrás de las orejas). Después, aparece la fase exantemática con aparición de una erupción dérmica a modo de pequeñas manchas no confluentes (que no se unen) en la cara y después en el resto del torso, desapareciendo al tercer día con mínima descamación.
Rubéola prenatal: La rubéola durante el embarazo puede presentarse en el embrión o en el feto de múltiples maneras; desde la no afectación al aborto o muerte fetal. Las manifestaciones más frecuentes en el recién nacido son la sordera, retraso mental, afectaciones oculares, cardiopatías congénitas, lesiones hepáticas, microcefalia (desarrollo insuficiente del cráneo), fisura palatina (deformación del paladar y el labio), etc.
Tratamiento para la rubéola
El tratamiento es sintomático con administración de analgésicos como el paracetamol para el control de la fiebre y el malestar general. En el caso de complicaciones o afectación congénita en el recién nacido, dependerá del tipo de manifestación que presente el paciente se requerirá un tipo u otro de tratamiento (cirugía, rehabilitación, etc).
Pruebas complementarias del tratamiento de rubéola
El diagnóstico es fundamentalmente clínico . Puede realizarse una analítica de sangre para la determinación de serología, cultivo o detección de anticuerpos (detección del virus en sangre o de producción de sustancias de defensa específicas contra el virus).
Factores desencadenantes de la rubéola
El principal factor de riesgo que desencadena la rubéola es no estar vacunado .
Factores de riesgo de la rubéola
No haber recibido la vacuna contra la rubéola contenida en la vacuna triple vírica.
Complicaciones de la rubéola
Artralgias (dolores articulares).
Artritis (infección e inflamación de las articulaciones).
Encefalitis (infección e inflamación del cerebro).
Dolor testicular.
Hepatitis (inflamación e infección del hígado).
Púrpura trombocitopénica (enfermedad hemorrágica con destrucción de las plaquetas).
En la rubéola prenatal pueden desarrollarse sordera, cataratas, afectación cardíaca y otras malformaciones.
Prevención de la rubéola
Vacunación (con virus atenuado dentro de la vacuna llamada triple vírica).
Adecuada higiene de manos y medidas de prevención en aquellos pacientes que presenten la enfermedad para evitar su transmisión (uso de pañuelos de papel, reposo domiciliario, etc).
Especialidades a las que pertenece la rubéola
En casos de rubéola no complicada, el diagnóstico y tratamiento puede llevarse a cabo por el médico de familia o pediatra .
Si existen complicaciones dependerá del tipo de manifestación clínica . Debe realizarse una evaluación hospitalaria por el servicio médico específico que trate cada complicación (neurología, hematología, etc.)
En el caso de infecciones producidas en una mujer embarazada , el ginecólogo será el encargado de hacer el seguimiento de la paciente junto con el apoyo de otros especialistas como médico internista, etc.
Los niños con rubéola congénita serán evaluados y tratados en el servicio de pediatría hospitalaria.
Preguntas frecuentes
¿Cuál es la vacuna de la rubéola?
La vacuna de la rubéola se incluye en la vacuna triple vírica junto con la vacuna del sarampión y la de la parotiditis (paperas).
¿Cuánto tiempo dura la rubéola?
Desde los primeros síntomas hasta la desaparición de las lesiones dérmicas pueden pasar en torno a 8 días (la fase prodrómica catarral de 1-5 días y las lesiones dérmicas 2-3 días).
¿Qué efectos produce la rubéola?
La forma más frecuente de presentación es un proceso catarral de vías respiratorias altas, aumento del tamaño de los ganglios linfáticos (estaciones del sistema de defensa) detrás de las orejas y en la nuca, con aparición de un “sarpullido” rosado en la cara que se extiende por todo el tronco y desaparece en 3 días.
¿Cómo se transmite la rubéola?
La rubéola se transmite por vía respiratoria a través de las pequeñas gotas que se expulsan con los estornudos, la tos, la saliva, secreciones, etc. Y por el contacto de persona a persona (sólo se transmite entre humanos). La rubéola congénita se transmite de la madre al feto a través de la placenta .
¿Qué pasa si una mujer embarazada tiene la rubéola?
Dependiendo del momento del embarazo en el que la madre adquiera la infección, el feto puede adquirir unas malformaciones u otras, sufriendo el llamado síndrome de rubéola fetal.

Enfermedad
Miocarditis
¿Qué es la miocarditis?
La miocarditis es la inflamación del músculo cardíaco o miocardio . La miocarditis puede afectar al músculo cardíaco y el sistema eléctrico del corazón, lo que reduce la capacidad del corazón de bombear y producir ritmos cardíacos rápidos o anormales . El miocardio es la pared muscular del corazón o músculo cardíaco. Se contrae para bombear la sangre fuera del corazón y luego se relaja a medida que el corazón se llena con la sangre que regresa.
La incidencia no está del todo clara, es la mayor causa de muerte súbita o inesperada, alrededor del 20% de los casos ocurre en adultos jóvenes menores de 40 años. Sin embargo, una serie de autopsias rutinarias 1-9% de todos los pacientes presentaron evidencias de inflamación al miocardio. Es un trastorno poco común y puede ser grave.
Tipos de miocarditis
La miocarditis se puede clasificar según su curso clínico en:
Miocarditis aguda: Es la causa de aproximadamente el 10% de las insuficiencias cardíacas de comienzo agudo y del 20% de la muertes súbitas en adultos jóvenes. El momento de inicio es menos claro, en una parte de los pacientes la disfunción del ventrículo izquierdo avanza hasta miocardiopatía dilatada (enfermedad del músculo cardíaco).
Miocarditis crónica: Insuficiencia cardíaca progresiva que produce una alteración de la estructura del miocardio que puede dar lugar a una dilatación de las cámaras del corazón (miocardiopatía dilatada) y finalmente a un sufrimiento y necrosis (muerte) de las células miocárdicas.
Miocarditis fulminante: Se presenta con un cuadro de insuficiencia cardíaca aguda. Los síntomas aparecen de manera brusca y clara, progresando hasta llegar incluso a un shock cardiogénico. La disfunción del miocardio cede espontáneamente o conduce a la muerte.
Causas de la miocarditis
La miocarditis es una enfermedad poco común. La inflamación del músculo cardíaco puede ser causada por:
Una infección vírica, bacteriana o fúngica : Muchos virus se asocian frecuentemente con la miocarditis, entre ellos, los virus que causan el resfriado (adenovirus), la hepatitis B y C, el parvovirus, que provoca una erupción leve, usualmente en los niños y el virus del herpes simple.
La fiebre reumática: Puede producirse si los anticuerpos que el organismo envía para combatir una infección atacan a los tejidos de las articulaciones y el corazón.
Las enfermedades del tejido conectivo: Lupus o la artritis reumatoide.
La intoxicación medicamentosa o química: Como la exposición a ciertas sustancias químicas, como el monóxido de carbono y la radiación que, en ocasiones, puede causar miocarditis.
Síntomas de la miocarditis
Los síntomas de la miocarditis incluyen:
Dolor en el pecho.
Ritmos cardíacos anormales o acelerados (arritmias).
Fatiga y sensación de desmayo.
Fiebre y otros signos de infección, incluso dolor de cabeza, dolores musculares, dolor de garganta, diarrea o erupciones cutáneas.
Dificultad para respirar, en reposo o durante la actividad física.
Retención de líquidos con hinchazón de las piernas, los tobillos y los pies.
Palidez.
Manos y pies fríos. Entre otros síntomas.
Tratamiento para la miocarditis
El tratamiento para la miocarditis se centra en la causa y los síntomas, como insuficiencia cardíaca. La miocarditis se trata con analgésicos y antiinflamatorios . Si la miocarditis es parte de otra enfermedad, el tratamiento empleado para esa enfermedad también será beneficioso para el corazón. Si la miocarditis es causada por una infección bacteriana, se recetarán antibióticos.
En los casos leves, las personas deben evitar realizar deportes competitivos durante, al menos, tres a seis meses. Si la miocarditis no ha dañado mucho el corazón, posiblemente sólo sean necesarios los medicamentos y las citas de seguimiento.
Los pacientes que sufren un daño mayor, posiblemente deban limitar algunas de sus actividades y tomar medicamentos el resto de su vida. Los pacientes que sufren un daño muy grave pueden necesitar un trasplante cardíaco.
Pruebas complementarias del tratamiento de la miocarditis
Para el diagnóstico y tratamiento de la miocarditis se necesitan pruebas como: electrocardiograma, radiografía de tórax, resonancia magnética, ecocardiografía , análisis de sangre, cateterismo cardíaco y biopsia endomiocárdica.
Factores desencadenantes de la miocarditis
En la mayoría de los casos la miocarditis se desencadena por agentes patógenos.
Factores de riesgo de la miocarditis
Los factores de riesgo de la miocarditis son:
Las infecciones por patógenos como son virus, bacterias, hongos o parásitos.
Enfermedad autoinmune.
Sustancias tóxicas.
Complicaciones de la miocarditis
Las complicaciones de la miocarditis incluyen:
Miocardiopatía.
Ataque cardíaco o accidente cerebrovascular.
Ritmos cardíacos anormales o acelerados (arritmias).
Pericarditis.
Insuficiencia cardíaca.
Muerte súbita por ataque cardíaco.
Prevención de la miocarditis
No hay prevención específica para la miocarditis. Es difícil prevenir la inflamación del miocardio, pero sí se pueden tomar medidas para reducir el riesgo de padecerla como son:
Realizar un tratamiento oportuno de enfermedades que pueden conducir a la miocarditis puede reducir el riesgo de desarrollar esta afección.
Tratar de forma adecuada las infecciones (por ejemplo, gripe, resfriado o diarrea), deberá hacer reposo y no practicar deportes durante algún tiempo para no favorecer la aparición de la inflamación.
Especialidades a las que pertenece la miocarditis
La miocarditis pertenece a la especialidad de cardiología, es la parte de la medicina que se encarga del estudio, diagnóstico, y cuidado de las enfermedades que puedan afectar al corazón.
Preguntas frecuentes:
¿Cuál es la insuficiencia cardíaca más común?
La insuficiencia cardíaca más común es la insuficiencia cardíaca crónica . Es una enfermedad crónica y degenerativa del corazón que impide que éste tenga capacidad suficiente para bombear la sangre y, por tanto, de hacer llegar suficiente oxígeno y nutrientes al resto de los órganos. Está enfermedad se va manifestando gradualmente, pero los síntomas se intensifican con el paso del tiempo.
¿Qué secuelas pueden quedar de una miocarditis?
La miocarditis puede dejar secuelas como la insuficiencia cardíaca y arritmia.
¿Qué significa que una miocarditis es fulminante?
La miocarditis fulminante se presenta con un cuadro de insuficiencia cardíaca aguda grave y shock cardiogénico.
¿Es contagiosa miocarditis?
La miocarditis no es contagiosa.
¿Es hereditaria la miocarditis?
No se han encontrado pruebas de que la miocarditis sea hereditaria.

Enfermedad
Mononucleosis
¿Qué es la mononucleosis?
La mononucleosis o enfermedad del beso es una enfermedad infecciosa de origen vírico, producida por el virus de Epstein-Barr. La mayor incidencia es en adolescentes, y alrededor del 95% de los adultos de entre 35 y 40 años han sido infectados. El virus se transmite a través de la saliva , puede precisar asistencia de urgencia si se da un gran aumento del bazo o se presenta el síndrome de Guillain Barré. Es una enfermedad de tipo leve.
Tipos de mononucleosis
La mononucleosis es una enfermedad infecciosa que puede presentarse en forma poco sintomática en niños, o bien presentar más síntomas, pero esto es más típico de adultos. No existen distintos tipos de mononucleosis, solo diferencia de gravedad en los síntomas.
Causas de la mononucleosis
La mononucleosis tiene como causa la infección por el virus de Epstein Barr. Este virus se contagia por contacto con saliva de un paciente infectado.
Síntomas de la mononucleosis
Los síntomas de la mononucleosis son: fiebre, malestar general, dolor muscular, amígdalas aumentadas de tamaño con secreciones pegadas a las mismas, adenopatías cervicales y aumento del bazo.
Tratamiento para la mononucleosis
La mononucleosis no tiene tratamiento para la infección, será necesario tratamiento sintomático con analgésicos, reposo y líquidos abundantes , así como evitar los deportes de contacto.
Pruebas complementarias del tratamiento de la mononucleosis
Se harán analíticas de sangre en las que se busca presencia de glóbulos blancos más altos de lo normal, con presencia de linfocitos atípicos, anticuerpo frente al virus de Epstein Barr.
Factores desencadenantes de la mononucleosis
El factor desencadenante es la infección con virus de Epstein Barr.
Factores de riesgo de la mononucleosis
El factor de riesgo central de la mononucleosis es el contacto con saliva de pacientes enfermos , ya sea mediante besos o por contacto con vasos o cubiertos de la persona enferma.
Complicaciones de la mononucleosis
Síndrome de Guillain Barré.
Convulsiones.
Anemia.
Hepatitis con ictericia.
Aumento y rotura del bazo.
Erupción cutánea.
Prevención de la mononucleosis
No compartir vasos o cubiertos de personas enfermas.
No besar a personas enfermas.
Especialidades a las que pertenece la mononucleosis
El especialista que controla la mononucleosis es el médico de familia, pero en caso de complicaciones, puede ser necesario el control por un médico de medicina interna o de la especialidad de neurología.
Preguntas frecuentes:
¿Cómo se contagia la mononucleosis?
La mononucleosis se contagia a través del contacto con saliva de las personas infectadas, ya sea por besos o por compartir vasos o cubiertos. En casos excepcionales se puede contagiar por trasplante de médula ósea.
¿Por qué se inflama el bazo?
En la mononucleosis se produce una esplenomegalia inmune, esto se da como reacción a la infección por el virus de Epstein-Barr.
¿Cuál es la función del bazo?
El bazo tiene un a función inmunológica, produciendo sustancias que tratan de dañar a las bacterias y virus infecciosos, pero también actúa como sistema de filtro de la sangre eliminando células sanguíneas anormales, o aquellas que se deben eliminar por su envejecimiento.
¿Qué es la esplenomegalia?
La esplenomegalia es aumento del tamaño del bazo por encima de lo normal, eso se puede producir por enfermedades infecciosas como la mononucleosis, o inflamatorias, como la artritis reumatoide.
¿Cómo se llama la operación del bazo?
La operación del bazo se conoce como esplenectomía , y en ella se procede a retirar el bazo. Puede ser consecuencia de un traumatismo en el cual se rompe, siendo necesaria su extirpación para controlar el sangrado, o bien en casos de secuestro de células sanguíneas, en el cual el bazo procede a mantener en su interior células como las plaquetas, alterando la función de ellas y siendo necesario extirparlo. La esplenectomía no lleva consigo más riesgos que el poder tener más infecciones, por ello, tras la esplenectomía, le recomiendan al paciente que se vacuna de neumonía y gripe.

Enfermedad
Miastenia Gravis
¿Qué es la miastenia gravis?
La miastenia gravis es una enfermedad autoinmune, que afecta a la unión neuromuscular de un músculo estriado que produce una debilidad muscular tras realizar ejercicio . Puede haber entre 15 a 20 casos por cada 1.000.000 habitantes/año. Es una enfermedad grave que puede conducir a la muerte por una crisis respiratoria.
Tipos de miastenias
Miastenia gravis ocular: Supone el 20 de los diagnósticos.
Miastenia gravis generalizada : Se ven afectados los músculos oculares, tronco y extremidades. Dentro de ella hay diferentes subtipos como por ejemplo la bulbar, que afecta a músculos de la cara, el paladar y la deglución.
Respiratoria: Es la más grave y afecta a músculos respiratorios.
Seronegativa: No tiene anticuerpos, anti colinérgicos sin anticuerpos ni anti-musk, y tiene peor pronóstico.
Neonatal transitoria: Se da en niños de madres con miastenia y desaparece en 2 o 3 meses después del nacimiento. Se debe al paso de anticuerpos de la madre a través de la placenta.
Inducida por medicamentos como la penicilamina.
Remisión espontánea: Hasta un 20% remiten solas en el inicio de su evolución.
Causas de la miastenia gravis
No se conoce la causa actual de la miastenia, aunque al haber anticuerpos frente a la acetilcolina, se piensa tiene una base autoinmune.
Síntomas de la miastenia gravis
El síntoma principal de la miastenia gravis es la debilidad muscular, que aparece con mayor intensidad tras ejercicio intenso. Dicha fatiga se va produciendo a lo largo del día y desaparece con el reposo.
Los primeros síntomas que aparecen son:
La ptosis palpebral (caída del párpado superior) y la diplopía (visión doble) ya que lo primero a lo que afecta es a la musculatura del ojo. Aparece en casi en el 80% de los pacientes.
Dificultad para tragar, para hablar o para masticar .
Afectación a las extremidades no siendo simétrica, esto quiere decir que un lado del cuerpo puede estar más débil que el otro.
Afectación de la musculatura respiratoria: Produce disnea e insuficiencia respiratoria. Esto se conoce como crisis miasténica y puede necesitar ingreso hospitalario.
Tratamiento para la miastenia gravis
Tratamiento farmacológico: Con anticolinesterásicos y piridostigmina, es el tratamiento el más frecuente. Su acción es prolongar el efecto de la acetilcolina en el receptor de la unión neuromuscular.
Las inmunoterapias crónicas: Tienen como efecto controlar la cantidad de anticuerpos en la sangre. Se trata de glucocorticoides, azatioprina, ciclosporina y tacrolimus.
La inmunoterapia rápida: Se usa en la crisis miasténica. Se utiliza la plasmaféresis para retirar los anticuerpos del plasma sanguíneo y las inmunoglobulinas intravenosas para neutralizar los anticuerpos.
El tratamiento quirúrgico: Dicho tratamiento se realiza sobre el timo. El timo es un órgano glandular situado detrás del esternón, donde maduran los linfocitos, imprescindibles en el sistema inmune adaptativo por el cual el organismo se adapta a los invasores externos. Puede ser necesario extirparlo en estos pacientes durante los tres primeros años de la enfermedad, que es el momento en que es más efectivo
Pruebas complementarias del tratamiento de la miastenia gravis
Analíticas de sangre: Para buscar los anticuerpos anti colinérgicos y anticuerpos anti musk.
La prueba de edrofonio : Este fármaco es administrado al paciente para revertir el cuadro de miastenia durante unos cinco minutos.
Estudios electrofisiológicos : Como en el estudio de fibra única, se estudian dos fibras musculares y se alarga el tiempo de reacción de la segunda frente a la primera, y la estimulación nerviosa repetitiva de un nervio comprobando si altera la contracción muscular.
TAC o RMN para reconocer la posibilidad de un timoma (inflamación del Timo).
Factores desencadenantes de la miastenia gravis
No se conocen factores desencadenantes de la miastenia gravis
Factores de riesgo de la miastenia gravis
No hay factores de riesgo conocidos, los hombres desarrollan la enfermedad con mayor frecuencia por encima de los 60 años y las mujeres entre los 20 y los 60. Las personas con antecedentes familiares de miastenia gravis tienen mayor riesgo de sufrir la enfermedad.
Complicaciones de la miastenia gravis
Crisis miasténica y crisis colinérgica por exceso de medicación.
Prevención de la miastenia gravis
No existe forma de prevenir la miastenia gravis.
Especialidades a las que pertenece la miastenia gravis
Pueden ser tratadas por médicos de medicina interna y en algunos casos por neurólogos.
Preguntas frecuentes:
¿Qué es una crisis de miastenia?
La crisis de miastenia es un proceso grave, en cual se produce la a fectación de los músculos respiratorios del paciente. Éste va a necesitar de ingreso hospitalario urgente en una UVI, ya que de no tratarse puede dar lugar a la muerte.
¿Cómo es la debilidad muscular?
La debilidad muscular es la falta de capacidad de los músculos para contraerse, esto es una falta de fuerza en los mismos lo que se traduce en sensación de cansancio importante para el individuo que lo padece. Se puede definir también como fatigabilidad muscular. No es simétrica, sino que se produce en mayor medida en un lado del cuerpo que en el otro.
Artículos por especialidad
CertificadosAlergologíaAnatomía PatológicaAnestesiología y ReanimaciónAngiología y Cirugía VascularAnálisis ClínicosAparato DigestivoCardiologíaChequeosCirugía General y del Aparato DigestivoCirugía General y del Aparato Digestivo PediátricaCirugía Oral y MaxilofacialCirugía Ortopédica y TraumatologíaCirugía Ortopédica y Traumatología PediátricaCirugía PediátricaCirugía Plástica y ReparadoraCirugía TorácicaClínica u HospitalDermatología Médico-Quirúrgica y VenereologíaEndocrinología y NutriciónEnfermeríaFisioterapiaGenética HumanaGinecología y ObstetriciaInmunologíaLogopedia y FoniatríaMedicina Estética y Unidad LaserMedicina Física y RehabilitaciónMedicina GeneralMedicina InternaMedicina NuclearMedicina del DeporteNefrologíaNeumologíaNeurocirugíaNeurofisiología ClínicaNeurologíaNutrición y DietéticaOdontología y EstomatologíaOftalmologíaOncología MédicaOncología RadioterápicaOsteopatíaOtorrinolaringologíaPediatríaPodologíaPoliclínicasPreparación al PartoPsicologíaPsiquiatríaRadiodiagnóstico-Diagnóstico Por ImagenReumatologíaTricologíaUnidad del DolorUrgencias HospitalariasUrología
Todas las especialidades  Savia
Savia