Cirugía General y del Aparato Digestivo
La especialidadArtículos especializados
Enfermedades
Síntomas
Otros contenidos

Artículo especializado
Apendicitis en niños: Síntomas y tratamiento
La apendicitis es un proceso inflamatorio agudo que afecta al apéndice. Es la primera urgencia quirúrgica y una causa frecuente de dolor abdominal agudo en los niños.
El apéndice vermiforme es un pequeño trozo de tejido de tamaño variable conectado a la parte inicial del colon. Está situado en la zona inferior derecha del abdomen y desempeña un papel fisiológico como reservorio de la flora intestinal (microbiota intestinal), y en él se originan células madre mesenquimales del colon.
Los casos de apendicitis aguda varían mucho en su presentación clínica y el diagnóstico se hace más difícil por la multiplicidad de diagnósticos diferenciales en los niños. Puede iniciarse con un cuadro clínico que es común a muchos procesos abdominales, incluyendo entre otros:
Intususcepción.
Divertículo de Meckel.
Gastroenteritis víricas y bacterianas.
Hasta la mitad de los casos en niños se presentan con síntomas inespecíficos. De este modo antes de un diagnóstico definitivo debe mantenerse al paciente en observación por un tiempo prudencial.
Suele ser más común en la etapa infantil y durante la primera etapa adulta (entre los diez y los 30 años de edad). El pico de incidencia se produce entre la escuela primaria y la adolescencia, de los 10 a 19 años.
¿Cómo se produce la apendicitis?
La causa de la obstrucción del apéndice puede ser debida a la inflamación de la pared, la presencia de fecalito (heces duras) y apendicolitos (depósitos calcificados). Otro motivo puede ser la hiperplasia linfoide. En esta, el abundante tejido linfoide del apéndice en la mucosa y la submucosa determina la propensión a desarrollar una hiperplasia que provoca una obstrucción del lumen del apéndice.
La obstrucción puede provocar un aumento de la presión en el apéndice. Este continúa segregando líquido de la mucosa, lo que provoca la distensión e inflamación de los tejidos. La alterada vascularización del órgano, el sobrecrecimiento bacteriano y la eventual perforación son consecuencias de la distensión. Es un proceso progresivo en el que los síntomas del niño o adolescente empeoran hasta que se produce la perforación con el riesgo de peritonitis, es decir, que se produzca la difusión de la infección por todo el abdomen. Por tal motivo, la aparición de una apendicitis requiere de atención médica de manera urgente.
Síntomas de apendicitis en niños
El síntoma más común de la apendicitis es el dolor abdominal agudo. Se trata de un dolor alrededor del ombligo que suele aparecer después de síntomas inespecíficos como febrícula. El dolor migra entonces al cuadrante inferior derecho del abdomen, puede aumentar al caminar o al hacer movimientos bruscos.
También pueden presentarse náuseas o vómitos después de la aparición del dolor. Y también síntomas urinarios y perdida del apetito.
Los antecedentes habituales son síntomas atípicos o vagos, como dolor abdominal difuso asociado a fiebre baja. La presencia de diarrea puede retrasar el diagnóstico si los síntomas se confunden con una gastroenteritis.
Diagnóstico de la apendicitis
En primer lugar, el médico puede sospechar de la presencia de apendicitis en función de los síntomas que presente el niño.
Un cambio en la localización del dolor desde el abdomen superior al cuadrante inferior derecho se asocia a menudo con la apendicitis. En los niños y adolescentes, el interrogatorio y la exploración física deben adaptarse a la edad y a la etapa de desarrollo del paciente. La experiencia del examinador es importante, especialmente cuando el paciente es un niño pequeño. En los niños, la ausencia de náuseas y vómitos, sensibilidad abdominal y leucocitosis descarta la apendicitis con una fiabilidad del 98%.
La clave para diagnosticar una apendicitis es la palpación del abdomen. Existen ciertos puntos y maniobras de palpación que ayudan al médico a diagnosticar apendicitis (punto de McBurney’s, signo de Blumberg, signo de Rovsing y del psoas).
También se pueden realizar otras pruebas complementarias para apoyar o confirmar el diagnóstico:
En un análisis de sangre es frecuente que aparezcan unos niveles aumentados de leucocitos con neutrofilia y marcadores elevados de inflamación como la proteína C reactiva.
Técnicas de imagen como una ecografía abdominal, una radiografía, una tomografía computarizada o una resonancia magnética del abdomen pueden ser de utilidad para confirmar la apendicitis. La ecografía es el método de primera elección, especialmente en los niños, aunque la tomografía es superior para diagnosticar apendicitis y sus complicaciones, principalmente cuando hay dudas con el diagnóstico.
¿Cómo se trata la apendicitis?
El tratamiento de la apendicitis suele ser quirúrgico y consiste en la extirpación del apéndice (apendicectomía). Cuando es posible su aplicación, se pueden utilizar técnicas quirúrgicas por laparoscopia, menos invasivas que la cirugía abierta. En los niños, también se ha descrito una técnica mínimamente invasiva para la apendicetomía asistida por laparoscopia transumbilical. La apendicetomía laparoscópica asistida por un solo puerto, aunque todavía no se ha convertido en el estándar de oro, también se ha realizado en niños y se ha comprobado que es segura.
Recientemente se ha planteado el tratamiento conservador con antibióticos en apendicitis no complicadas, sin embargo, esta práctica no está todavía bien reconocida ni establecida.
Ante la sospecha de apendicitis, el paciente no debe recibir nada por la boca y se indican antibióticos de manera profiláctica.
En ocasiones, las pruebas realizadas no aciertan con el diagnóstico, por lo que no es excepcional que en el transcurso de la operación se compruebe que el apéndice no está afectado.
En una apendicitis no complicada la operación quirúrgica suele ser sencilla y el tiempo de recuperación es relativamente corto. Si el apéndice se ha visto perforado, la operación es más compleja y existe más riesgo de complicaciones, por lo que la recuperación es más lenta y precisa de más días de ingreso hospitalario. La estancia posoperatoria varía, según la gravedad del cuadro. Las complicaciones pueden incluir los abscesos de la pared abdominal, hemorragias, obstrucción intestinal, absceso intrabdominal, etc. De ahí la importancia de realizar un diagnóstico y tratamiento adecuado en las primeras 24-48 horas tras el inicio de los síntomas.
Artículo especializado
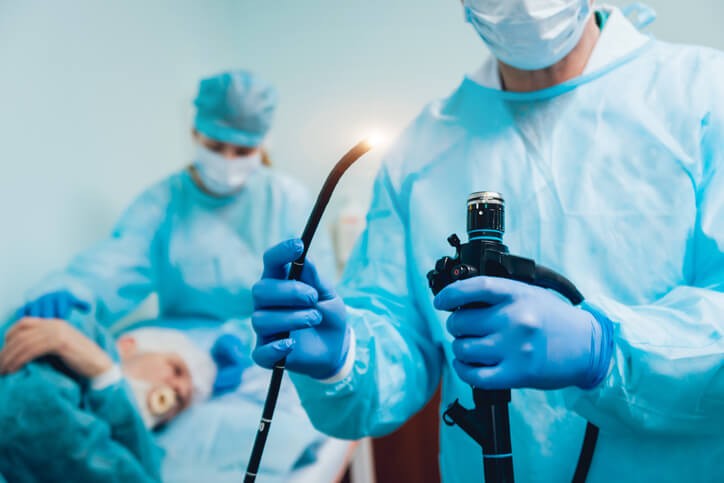
Endoscopia: Tipos, Técnicas y Preparación
¿Qué significa endoscopia? Literalmente quiere decir: mirar (endo) el interior (scopia). Se trata de una técnica médica que emplea una cámara o lente dentro de un tubo flexible (endoscopio) que, al ser introducido por un orificio, cavidad o incisión nos permite visualizarlos. A su vez, podremos coger muestras de las lesiones detectadas o extirparlas para su estudio anatomopatológico. Es, por tanto, un método de diagnóstico y tratamiento (mínimamente invasivo) de diferentes patologías.
Todo procedimiento diagnóstico que emplee un endoscopio se llama endoscopia. Sin embargo, al emplear ese [] término nos referimos concretamente al estudio del tubo digestivo.
En función de la zona anatómica a explorar diferenciaremos diversos tipos de endoscopio. Por ejemplo, dispondremos de un artroscopio (para visualizar una articulación), un Broncoscopio (para examinar la vía aérea), un colonoscopio (para visualizar el colon), un Cistoscopio (para visualizar el interior de la vejiga), etc.
Si tenemos en cuenta el orificio anatómico por el que se accede para el estudio tendremos:
Boca : podemos acceder hasta el duodeno permitiendo visualizar el esófago, el estómago y el duodeno. También se llama endoscopia digestiva alta porque nos permite visualizar la parte superior del tubo digestivo.
Ano : nos permite visualizar de ano a colon. También se llama endoscopia digestiva baja.
Uretra : nos permite visualizar hasta la vejiga urinaria. Recibe el nombre de cistoscopia.
Nariz : por esta vía de entrada podremos acceder hasta la laringe o bien hasta los bronquios (broncoscopia).
Vagina : nos permite llegar hasta útero (histeroscopia).
No olvidemos que un endoscopio es un tubo flexible que también puede penetrar por una incisión realizada por un cirujano de forma que podemos acceder directamente a la rodilla (artroscopia de rodilla) aunque no tenga un orificio natural de entrada o bien a la cavidad abdominal (laparoscopia) a través de unas incisiones en la pared abdominal para visualizar el espacio entre las vísceras abdominales.
Por cierto, ¿crees que el embarazo es una contraindicación para la realización de una laparoscopia? En absoluto, aunque debe estar absolutamente justificada. Se puede incluso visualizar el feto (fetoscopia).
¿Qué cambios ha supuesto la introducción de la laparoscopia en la práctica médica?
Ha supuesto un cambio drástico tanto en el diagnóstico como en el abordaje quirúrgico y la recuperación post-operatoria.
Hasta hace unos años la única manera de acceder a la cavidad abdominal era mediante una incisión abdominal de mayor o menor tamaño, según el órgano a tratar. Ello implicaba una cicatriz abdominal con su consecuente traducción estética. Desde la introducción de la endoscopia se realizan intervenciones (apendicetomía, colecistectomía) a través de pequeños portales de entrada por donde se introducen el tubo con la cámara, el instrumental quirúrgico y el aire o líquido para visualizar el campo. Tras esta cirugía el paciente se recupera más precozmente. Existe menor incidencia de complicaciones postoperatorias (como infecciones de herida, hernias, eventraciones, fugas, hemorragias, etc.) así como una estancia hospitalaria y una recuperación más cortas.
¿Tiene complicaciones?
No obstante, la laparoscopia no está exenta de posibles complicaciones y exige un proceso de aprendizaje del manejo tanto de la tecnología como de la instrumentación necesarias. Como hemos comentado, para tener una mejor visión del campo, suele insuflarse aire en el abdomen durante la laparoscopia el cual puede resultar muy molesto hasta ser eliminado durante las horas posteriores a la instrumentación. Otros riesgos asociados podrían ser, por ejemplo: el sangrado tras la biopsia de una lesión o la perforación accidental .
Asimismo, debemos tener presente la preparación previa necesaria para la realización de la endoscopia. Es importante para todo tipo de endoscopias ya sea digestiva, laparoscopia o artroscopia. Tiene una explicación muy lógica. El paciente debe ir en ayunas dado que debe someterse a un procedimiento anestésico (diferente según el tipo de procedimiento que deba realizarse). En caso de ser preciso realizar una endoscopia el paciente debe ser sometido a una sedación para lo cual se deberán realizar unas pruebas preoperatorias previas que serán interpretadas por el anestesista, quién, por otro lado, indica el tipo de anestesia necesaria para cada procedimiento. Por otro lado, es lógico pensar que las cavidades digestivas deben estar vacías para ser exploradas. En caso de una colonoscopia se requiere, además un vaciado absoluto de los restos fecales de todo el tubo digestivo (para ello el paciente debe realizar una preparación colónica el día antes de la exploración). En ocasiones, deberá suspender determinados tratamientos para la exploración.
En general, no se permite comer ni beber ocho horas antes del procedimiento. También se prohíbe fumar o masticar chicle durante este tiempo. Tampoco se permite al paciente conducir las siguientes horas tras la endoscopia. Se podrá reanudar la dieta normal y los medicamentos inmediatamente después de la exploración.
La endoscopia inalámbrica
Una vez expuesta la endoscopia me gustaría añadir una pincelada sobre la llamada endoscopia inalámbrica. ¿Has oído hablar de ella? Se trata de un dispositivo en forma de cápsula con una microcámara en su interior, una fuente de luz, una batería y un radiotransmisor. Es de un solo uso. Recorre todo el trayecto del tubo digestivo tomando diferentes fotos a lo largo del mismo. El paciente debe ingerir la cápsula vía oral y la elimina vía anal 24 horas después (no se digiere ni se absorbe). Durante su recorrido envía las imágenes a un receptor que se acopla a la cintura o el hombro del paciente mediante un cinturón especial. Después de expulsar la cápsula, el paciente sólo tiene que entregar a su médico el cinturón . Las imágenes del receptor son descargadas por el técnico e interpretadas en el ordenador por el médico quién, a su vez, emitirá el diagnóstico.
¿Cuál será el siguiente avance tecnológico? ¿Será una cápsula que al ser expulsada arrastre las lesiones detectadas en su camino? ¿Podrá una cápsula arrastrar el apéndice inflamado en caso de apendicitis? La investigación apuesta de forma incansable por los métodos mínimamente invasivos. El futuro es prometedor.

Artículo especializado
Tratamiento y Dieta para la Diverticulitis
La dieta tiene un papel fundamental en el tratamiento de la diverticulitis , y consumir abundantes alimentos ricos en fibra es la mejor prevención para evitar su aparición.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
¿De qué hablamos?
Cuando hablamos de enfermedad diverticular o diverticulosis nos referimos a la presencia de divertículos en el tracto gastrointestinal , generalmente en el intestino grueso. Estos divertículos son protuberancias con forma de saco que se producen por un aumento en la presión interna de la pared del colon , provocando que las capas internas se hernien. Se sabe que cuantos menos alimentos ricos en fibra se consumen, existe más probabilidad de tener estreñimiento y ello conlleva que para realizar las deposiciones se haga más esfuerzo, aumentando así la presión en el colon y, como consecuencia, la formación de estas protuberancias . Seguir una dieta baja en fibra, compuesta en su mayoría de alimentos procesados, es su principal causa de aparición.
Los divertículos, en la mayoría de los casos, no suelen dar molestias o son asintomáticos, pero si se inflaman o infectan se produce una diverticulitis y requiere de atención médica urgente. La diverticulitis se caracteriza por síntomas como dolor abdominal intenso, fiebre y náuseas y, si es diagnosticada como leve sólo suele precisar reposo, cambios en la dieta y tratamiento con antibiótico. Sin embargo, puede complicarse y ser grave o aguda y, en estos casos, requerirá de cirugía.
¿Qué papel juega la dieta?
La dieta tiene un papel fundamental en la prevención y tratamiento de la diverticulitis. En una fase inicial, si es aguda o grave, se debe seguir una dieta absoluta para evitar el riesgo de perforación. Una vez se inicia la mejoría clínica, se puede iniciar con precaución una dieta pobre en residuo para disminuir al máximo el volumen fecal que pasa por la zona inflamada y así disminuir el dolor. Posteriormente se puede ir introduciendo la fibra según tolerancia personal, llegando a una alimentación lo más variada posible.
A continuación, encontrarás unas recomendaciones para seguir en las fases de brote e inflamación (diverticulitis):
Fraccionar la ingesta en comidas frecuentes y poco copiosas , entre cinco o seis tomas al día, para disminuir en lo posible el estímulo sobre el movimiento intestinal (peristaltismo).
Evitar aquellos alimentos que irritan la mucosa digestiva y producen aumento del peristaltismo: café, zumo de naranja, especies, picantes.
Evitar las temperaturas extremas ya que aumentan el movimiento intestinal.
Restringir alimentos ricos en fibra : verduras, frutas, legumbres, frutos y frutas secas y productos integrales (muesli, cereales integrales, pan integral, arroz integral…)
No ingerir alimentos con semillas o que contengan pepitas como pueden ser el higo, las uvas y el kiwi, ya que pueden ubicarse en el divertículo e inflamarlo.
Preferir la fruta cocida o al horno sin piel, en almíbar sin el jugo o bien en forma de zumos colados no ácidos y sin azúcar. Probar alimentos que contienen pectina (fibra soluble con efecto astringente): manzana rallada y oscurecida (ligeramente oxidada), pera cocida, patata hervida «chafada» o en forma de puré, membrillo, plátano maduro, albaricoque.
Consumir las carnes y aves sin piel ni grasa visible. Preferir los cortes magros.
Preferir el pescado blanco al azul, ya que tiene menos grasa.
Evitar la bollería y la repostería.
Evitar alimentos grasos como aguacate, aceituna y frutos secos.
Evitar técnicas grasas como rebozados, empanados, guisos y fritos.
Restringir los condimentos irritativos de la mucosa intestinal como: vinagre, café, chocolate, pimienta, pimentón y guindilla.
Evitar el consumo de alcohol.
Moderar el uso de sal y azúcar.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
En la siguiente tabla se especifica qué alimentos son los más aconsejados y cuáles se deben evitar para la elaboración de una dieta pobre en residuo.
ALIMENTOS
PERMITIDOS
A EVITAR
Lácteos
y derivados
Yogur desnatado, queso fresco bajo en grasa, leche desnatada (excepto si hay déficit de lactasa).
Leche y resto de lácteos cremosos o enteros.
Cereales
y tubérculos
Pan blanco, cereales dextrinados, sémola, arroz, pasta, tapioca y patata sin piel.
Pan integral y cereales integrales, arroz integral, salvado (galletas integrales, pasta integral, etc.)
Legumbres
y frutos secos
Ninguno.
Legumbres en general.
Frutos secos en general.
Verduras
y hortalizas
Caldos vegetales colados.
Cuando se inicia la introducción, según tolerancia. Empezar por: zanahoria pelada, calabacín sin piel y puntas de espárrago. Siempre cocidas.
Todas las verduras y hortalizas:
Las últimas a introducir una vez acaba el episodio:
Verduras fibrosas (col, rábanos, lechuga, apio, brécol, escarola nabos)
Fruta
Zumos de fruta licuados.
Cuando se inicia la introducición, según tolerancia. Empezar por: fruta cocida y sin piel como: manzana, pera, membrillo, o plátano maduro.
Todas las frutas:
las últimas a introducir una vez acaba el episodio: Frutas fibrosas (frambuesa, mora, ciruelas, higos), ácidas y todas las pieles de las frutas.
Carne, pescado
y huevos
Carne magra no fibrosa, picada o bien cocinada (ternera, lomo de cerdo, pollo, pavo, conejo).
Pescado blanco.
Huevos.
Carne dura y fibrosa (con cartílagos) (ternera, cordero, cerdo) pescado azul. Embutidos y paté.
Grasas
y aceites
En cantidades limitadas aceites vegetales, preferiblemente aceite de oliva, margarina y mantequilla.
En cantidades importantes.
Mayonesa y derivados.
Postres
y dulces
Gelatinas sin azúcar y galletas tipo “María” no integrales.
Aquellos que están hechos con harina integral o cereales integrales o frutos secos.
Bebidas
Agua e infusiones.
Café, té, bebidas carbonatadas y
alcohólicas.
Otros
Sal, azúcar.
Hierbas aromáticas.
Platos precocinados, salsas
comerciales y especias.
Nota: con respecto a la introducción de alguna verdura o fruta en la dieta, priorizar las indicaciones del médico. En una dieta pobre en residuo estricta sólo se podrían tomar caldos vegetales colados y zumos de fruta licuados.
En la diverticulosis o fase asintomática la ingestión de fibra dietética se contempla como una medida coadyuvante al tratamiento. No obstante, como medida de prevención se deben desaconsejar alimentos que contengan semillas que no puedan ser digeridas completamente en la parte superior del tracto gastrointestinal, puesto que el residuo podría alojarse dentro de un divertículo favoreciendo la aparición de diverticulitis aguda. Así pues, se desaconseja la ingesta de semillas no trituradas o alimentos que contengan pepitas o semillas, excepto que estas se eliminen antes de la ingesta (por ejemplo, pimientos, tomates, kiwis, uvas…).
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Artículo especializado
Densitometría Osea, ¿Cómo Están Tus Huesos?
La densitometría ósea es la prueba principal para valorar la densidad mineral ósea , es decir, el calcio en los huesos y, por tanto, la presencia de una patología que afecta a un elevado sector de la población, la osteoporosis. A nivel mundial, la sufren 200 millones de personas, y en España, concretamente, afecta al 35% de mujeres de más de 50 años y al 72% mayores de 70 años.
Es una patología que afecta sobre todo a la calidad de vida debido al deterioro que sufre la calidad de los huesos y el elevado riesgo de fracturas asociado a ello. El impacto de esta enfermedad sobre la población es tan elevada que algunos expertos hablan de que “las fracturas por osteoporosis superan el total de casos de infarto agudo al miocardio, paro cardiaco y cáncer de mama juntos”, con el agravante de que las fracturas, en la mayoría de ocasiones, pasan desapercibidas y pueden ocasionar muchos problemas a posteriori.
Para reducir el riesgo de osteoporosis , las sociedades médicas recomiendan la realización de pruebas de valoración de la densidad mineral ósea, y la prueba que mejores resultados da es la absorciometría dual de rayos x (DXA o DEXA ) o también conocida como densitometría ósea.
¿En qué consiste?
Es una técnica de diagnóstico por la imagen en la que existe radiación de rayos X, pero la radiación total es muy baja si se compara con la que recibe el paciente que se somete a una radiografía convencional de tórax (20 veces inferior a ésta), por lo que el riesgo-beneficio es evidente. A diferencia de otras pruebas en los que se emiten rayos X, en este caso no es necesario usar protectores de plomo al estar muy concentrada la zona a valorar.
Es necesario informar al profesional que realiza la prueba si hay posibilidad de estar embarazada, así como si en las dos semanas previas nos hemos realizado algún estudio de radiodiagnóstico en el que se haya recibido contraste. Si este fuera el caso sería necesario esperar unas dos semanas para poder someterse a la DEXA. Tanto el embarazo como el contraste son contraindicaciones para su realización, en el primer caso absoluta y en el segundo caso temporal.
El paciente se tumbará en una camilla durante 10 a 20 minutos. Si se quiere estudiar la columna la posición será con las piernas elevadas y flexionadas encima de una especie de almohada cuadrada o triangular, mientras que si la valoración es de la cadera las piernas estarán estiradas, pero con una abrazadera que mantiene la posición idónea para realizar el estudio. Es importante mantenerse inmóvil durante el momento en que se realiza la prueba para evitar que la imagen quede distorsionada y pueda interferir en la posterior valoración.
¿CÓMO ME PREPARO PARA LA PRUEBA?
Para la realización del examen no se requiere de ninguna preparación específica, y se puede seguir una dieta normal . En cuanto la ropa, se recomienda llevar ropa cómoda y holgada que no comprima, evitando aquellas que tengan material metálico ya que en este caso será necesario sacársela. En ocasiones se solicita al paciente que se ponga una bata en lugar de su ropa pare evitar inconvenientes. Será necesario quitarse joyas, relojes y otros accesorios.
Los resultados
Las imágenes y los resultados que se derivan de la prueba los valorará el profesional. Estos situarán al paciente en un estrato diagnóstico en función de dos valores mundialmente aceptados como referentes:
T-Score: este valor muestra la cantidad ósea que presenta el paciente, comparado con un adulto joven del mismo género con masa ósea máxima.
Una puntuación superior a -1 se considera normal. Una puntuación entre -1 y -2,5 se clasifica como osteopenia (masa ósea baja). Una puntuación inferior a -2,5 se define como osteoporosis. La puntuación T se utiliza para calcular el riesgo que tiene de desarrollar una fractura.
Z-Score: este valor muestra la cantidad ósea que presenta el paciente en comparación con otras personas de su grupo étnico, edad y género. La valoración de la Z-score puede ser de utilidad en mujeres premenopáusicas y en varones en quienes la validez de la clasificación de la OMS (Organización Mundial de la Salud) no se encuentra establecida, así como en la monitorización de pacientes sometidos a intervenciones terapéuticas.
Pueden existir diferencias entre los resultados de una localización u otra y ello queda reflejado en la gráfica que suele acompañar el informe final que entrega el especialista al paciente. Los colores de las distintas zonas sitúan al paciente en zona de mayor o menor riesgo en función de su densidad mineral ósea.
Debido a su relativa baja inocuidad y los buenos resultados que ofrecen se han establecido unas indicaciones para su realización siendo estas las siguientes:
Mujeres ≥ 65 años
Personas que sufran enfermedades en las que exista pérdida de masa mineral ósea
Mujeres posmenopáusicas (< 5 años):
Uno o más factores de riesgo.
Historia personal o familiar de fractura (una historia materna de factura dobla el riesgo para el paciente).
Si los resultados pueden influir sobre intervenciones terapéuticas.
Hábito tabáquico activo.
Utilización de esteroides por vía oral durante más de tres meses.

Artículo especializado
Riesgos y Beneficios de la Cirugía Bariátrica
La obesidad es un proceso crónico que tiene múltiples causas y en cuyo tratamiento están implicadas modificaciones dietéticas y de estilo de vida (ejercicio), terapias psicológicas y tratamientos farmacológicos que, en conjunto, pueden conseguir pérdidas de peso alrededor del 10% a medio plazo, hecho que reduce algunas de las comorbilidades asociadas a la obesidad.
Sin embargo, a largo plazo estos tratamientos pueden perder eficacia ya que, si no hay un buen establecimiento de hábitos, el peso se puede volver a recuperar en un plazo inferior a cinco años. Por ello, las técnicas quirúrgicas mejoran las expectativas de pérdida de peso a largo plazo y además conllevan una mejoría de las comorbilidades y de la calidad de vida de los pacientes.
¿Quién puede ser candidato a una cirugía bariátrica?
Los criterios de selección de pacientes candidatos a cirugía bariátrica son:
Pacientes de entre 18 y 55 años (salvo excepciones consideradas por el cirujano).
Personas con IMC mayor o igual a 40 kg/m 2 o personas con IMC mayor de 35 kg/m 2 asociado a comorbilidades mayores susceptibles de mejorar tras la pérdida peso: diabetes mellitus, hipertensión, dislipemia, síndrome de apnea obstructiva crónica.
Obesidad mórbida con un mínimo de cinco años de evolución.
Fracasos continuados con tratamientos médico-dietéticos debidamente supervisados por dietista-nutricionista.
Ausencia de trastornos endocrinológicos que sean causa de la obesidad.
Estabilidad psicológica : ausencia de abuso de alcohol o drogas y de alteraciones psiquiátricas mayores (esquizofrenia, psicosis), ausencia de retraso mental y exclusión de trastornos del comportamiento alimentario.
Capacidad para comprender los mecanismos por los que se pierde peso con la cirugía y entender que no siempre se alcanzan óptimos resultados.
Comprender que el objetivo de la cirugía no es alcanzar el “peso ideal” sino un peso saludable.
Compromiso de adhesión al seguimiento postquirúrgico.
Consentimiento informado después de haber recibido toda la información necesaria (oral y escrita).
Compromiso por parte de las mujeres en edad fértil de evitar la gestación al menos durante el primer año post cirugía.
Tipos de técnicas que engloban la cirugía bariátrica
La cirugía bariátrica actúa sobre los mecanismos anatómicos para reducir la ingesta alimentaria y a su vez influir en la regulación fisiológica a través del equilibrio entre las sensaciones de hambre/apetito.
No obstante, los cambios metabólicos posteriores a una cirugía dependerán del tipo de técnica utilizada, entre las que destacamos:
Técnicas restrictivas
Su objetivo es reducir el volumen útil del estómago , consiguiendo una saciedad precoz y prolongada que contribuye a modificar el hábito alimentario. Entre las técnicas restrictivas, destacamos:
Gastroplastia vertical anillada.
Banda gástrica ajustable.
Gastrectomía tubular.
Técnicas mixtas
Son aquellas en las que se actúa, por una parte, reduciendo el estómago, y por otra parte, haciendo una derivación del intestino ( mediante asa en Y-de-Roux). Entre las técnicas mixtas, destacamos:
Derivación biliopancreática (DBP).
Cruce duodenal (CD).
By-pass gástrico en Y-de-Roux (BPG).
Gastroplastia vertical asociada a BPG.
Ante este abanico de posibilidades, el cirujano debe valorar individualmente qué técnica utilizar para cada paciente según su grado de obesidad, sus expectativas, su compromiso de cambio de hábitos a largo plazo o sus comorbilidades presentes. No obstante, la técnica quirúrgica “ideal” será aquella que cumpla con los siguientes requisitos:
Que sea útil a más del 75% de los pacientes a largo plazo , es decir, que el paciente logre un IMC inferior a 35 kg/m2
Que sea segura, es decir, con una morbilidad menor del 10% y mortalidad inferior a 1%.
Que sea duradera, es decir, que los beneficios persistan al menos 5 o más años y que el índice de re-intervenciones al año no supere el 2%
Que sea reproducible por la mayoría de los cirujanos
Que evite consecuencias que limiten la calidad de vida del paciente y con escasas complicaciones a largo plazo
Que sea reversible desde el punto de vista funcional.
Ventajas y riesgos de las principales técnicas de cirugía bariátrica
La cirugía bariátrica constituye una herramienta eficaz en pacientes con obesidad mórbida refractaria al tratamiento médico. Además, el éxito de una cirugía bariátrica radica en una buena elección de la técnica acorde con las características de cada paciente. Sin embargo, estas técnicas quirúrgicas, pueden conllevar ciertos riesgos o complicaciones que varían según el tipo de técnica utilizada y que mostraremos en el esquema siguiente:
Principales técnicas
Ventajas
Inconvenientes/complicaciones
Posibles candidatos
Gastroplastia vertical anillada
-No modifica la fisiología digestiva.
-Técnica sencilla y de bajo riesgo quirúrgico.
-La banda gástrica es ajustable y es una técnica reversible.
-Reflujo gastroesofágico.
problemas locales de la banda (estrechamiento, migración, infección, etc.)
-Menor pérdida de peso.
-Poca efectividad a largo plazo.
-Vómitos e intolerancia alimentaria
dilatación y herniación gástrica (en banda gástrica).
-IMC 35-45.
-Pacientes jóvenes.
-Alta capacidad de colaboración.
Banda gástrica ajustable
By-pass gástrico en Y-de-Roux (BPG)
-Buena pérdida de peso
-Buena calidad de vida (no malnutrición ni deficiencias severas de vitaminas / minerales)
-En el caso de DBP: no requiere restricciones en la ingesta de alimentos
-Fístulas.
-Estenosis anastomosis gastro-yeyunal.
-Alto riesgo de úlceras 8hemorragias digestivas).
-Obstrucción intestinal.
-Síndrome de Dumping.
-En algunos casos, déficit de hierro y vitamina B12.
IMC 40-52
no “picoteadores”
Derivación biliopancreática (DBP)
Diarrea, flatulencias, esteatorrea
colelitiasis, malnutrición proteica, hiperparatiroidismo, secundario, osteoporosis, anemia, déficit de B12, déficit de oligoelementos,
síndrome de Dumping
Cruce duodenal (CD)
-Buena pérdida de peso
-Integridad del estómago
-No síndrome Dumping
-No requiere restricciones calóricas
-Cirugía muy compleja.
-Diarrea esteatorrea.
-Déficit de vitaminas liposolubles (A, D, E, K).
Evaluación pre-operatoria
Una vez el cirujano especialista haya decidido qué tipo de cirugía es más adecuada en cada caso, se deben realizar pruebas en las que se valora el perfil analítico (control de vitaminas y minerales o descartar la presencia de Helicobacter pylori para erradicarlo), el estado respiratorio y se descarta la posibilidad de presentar una apnea obstructiva del sueño (aunque no existan síntomas claros) porque se pueden mejorar las condiciones respiratorias (con fisioterapia) antes de la cirugía.
Pautas alimentarias post-operatorias
Por último, hay que tener en cuenta que todas las personas sometidas a una cirugía bariátrica deben llevar a cabo unas pautas concretas de alimentación ya que dichas técnicas promueven una reducción de la ingesta calórica total y selectiva intolerancia a ciertos alimentos, hecho que puede provocar déficits nutricionales. Por ello, la dieta deberá proporcionar todos los nutrientes necesarios para satisfacer, por lo menos, las cantidades mínimas diarias recomendadas, con un aporte de volumen reducido y, si es necesario, se deberá valorar la suplementación con vitaminas y oligoelementos.
Siempre deberemos tener en cuenta que para minimizar o evitar estas deficiencias nutricionales, es necesario un estricto control y seguimiento médico-nutricional, así como la aceptación y el compromiso por parte del paciente de mantener las directrices marcadas por el equipo multidisciplinario.
Artículo especializado
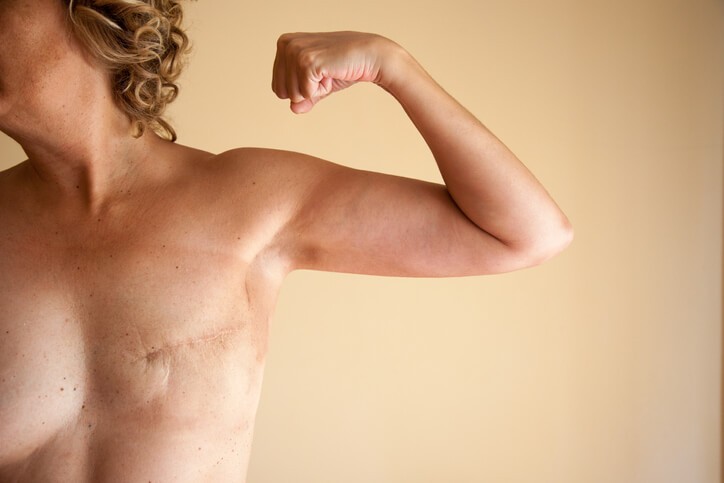
Mastectomía
La mastectomía es un procedimiento quirúrgico que se realiza para extirpar tejido mamario de origen sospechoso maligno. La reconstrucción posterior se puede realizar en el mismo acto quirúrgico o bien en una fecha posterior, así como de forma uni o bilateral. Es una opción de tratamiento en diferentes tipos de cánceres : carcinomas ductal in situ, cáncer de mama estadios I, II (temprano), III (post-quimioterapia), enfermedad de Paget, y cáncer de mama inflamatorio.
Es un procedimiento quirúrgico interdisciplinario, que puede realizarse por cirujanos generales, ginecólogos o cirujanos plásticos.
¿Cuándo se indica?
Se realizará una mastectomía cuando la paciente presente dos o más tumores , depósitos de calcio, recurrencia, embarazo y cáncer de mama, mutaciones genéticas, y enfermedades del tejido conectivo y cáncer de mama.
¿Cómo se realiza el diagnóstico?
El cáncer de mama se diagnostica en un inicio mediante mamografía, ecografía o RMI ; y se confirma mediante biopsia ; la cual determina el grado del tumor. Existen tres grados, del 1 al 3, de menor a mayor riesgo de que las células sean cancerígenas. Existen también pruebas genéticas (receptores de progesterona y estrógeno, y HER2), que determinan el riesgo de recurrencia y el efecto de los fármacos quimioterapicos.
Mastectomía preventiva: el efecto Angelina Jolie
La mastectomía preventiva (profiláctica), implica retirar ambos senos y reducir considerablemente el riesgo de contraer cáncer de mama en el futuro. Está reservada para mujeres con un riesgo muy alto de cáncer de mama, con fuertes antecedentes familiares o presencia de mutaciones genéticas.
Durante los últimos años, la tasa de demanda de mastectomía profiláctica se ha incrementado debido al llamado “efecto Angelina Jolie”. En el año 2013, la actriz sorprendió al mundo cuando reveló que se había sometido a una doble mastectomía preventiva para evitar el cáncer de mama, y a la extirpación de los ovarios y trompas de Falopio en forma bilateral. Presentaba un gran componente familiar, y un alto componente genético, que la ponía en situación de riesgo de padecer cáncer de mama.
Al hacer pública su decisión, se produjo un incremento del número de mujeres que solicitaban someterse a las mismas pruebas. Toda prevención debe estar regulada y controlada por el profesional a cargo del estudio de la paciente, para evitar confusiones y cometer errores.
La mastectomía profiláctica presenta determinadas indicaciones: cáncer recurrente, antecedentes familiares, mutaciones genéticas de BRCA1 y 2, carcinoma lobular in situ, mamas densas, y antecedentes de radiación torácica en la infancia.
¿Cómo es la cirugía?
Se debe realizar un examen exhaustivo de la paciente, determinando el tipo de mastectomía a realizar y, también, las posibilidades de reconstrucción inmediata o diferida. Existen diferentes tipos de mastectomía:
Mastectomía radical modificada , donde se extirpa el tejido mamario, la areola, el pezón y la mayoría de los ganglios linfáticos axilares (disección completa de ganglios axilares).
Mastectomía simple (total) , donde se extirpa el tejido mamario, la areola y el pezón, y se podrá hacer una biopsia de ganglios linfáticos centinelas.
Mastectomía con conservación de piel , donde se extirpa todo el tejido mamario, el pezón y la areola, pero no la piel de la mama.
Mastectomía con conservación de pezón (subcutánea), donde se extirpa el tejido mamario, con conservación de la piel, el pezón y la areola. También se podrá realizar una biopsia de ganglios linfáticos centinelas.
La reconstrucción mamaria inmediata o diferida, realizada por un cirujano plástico o reconstructivo, se puede realizar de diferentes maneras:
Con expensares mamarios con implantes salinos o de siliconas.
Con el propio tejido del cuerpo.
Con una combinación de reconstrucción de tejidos e implantes.
Debe realizarse siempre en espacio estéril quirúrgico, con anestesia general y con estancia hospitalaria con control multidisciplinario. Los efectos secundarios posibles de una mastectomía incluyen infección, dolor, sangrado, inflamación de brazos, hematomas, dolor y rigidez.
¿Qué es la biopsia de ganglio centinela?
Permite conocer si el cáncer de mama se ha extendido . Puede realizarse una extirpación total de los ganglios axilares, o realizarse una biopsia del primer o segundo ganglio a donde drena el tumor (ganglios centinelas). Si hay cáncer se resecarán todos los ganglios o se hará radioterapia. Si no hay, no es necesario. Previamente, se inyectará una sustancia azul que marcará los ganglios y permitirá localizarlos rápidamente para extirparlos.
Tras el procedimiento, todo el material obtenido se estudia, y la paciente es vendada en el postoperatorio inmediato, con colocación de uno o dos drenajes (si es bilateral); los cuales se retirarán cuando el débito de sangre sea de 30 cm3 o menor . El vendaje debe ser compresivo , para evitar inflamación y morados. En los primeros 10 a 15 días la paciente no moverá los brazos en exceso, y no realizará esfuerzos (sobre todo si se realiza vaciamiento ganglionar axilar); y deberá ser controlada semanalmente por el cirujano.
De acuerdo a los resultados obtenidos, el cirujano puede contactar a otros profesionales, como oncólogos, cirujanos reconstructivos, o grupos de autoayuda para la paciente.
Siempre se debe evaluar cada caso en particular, con un equipo multidisciplinario , explicando a la mujer y su familia las posibles soluciones y también los riesgos para cada caso particular. Es importante realizar un control anual ginecológico obligatorio, para descartar cualquier patología.
Artículo especializado
Tipos de Hemorroides y Cuándo Operarlas
¿Qué son las hemorroides y por qué han tenido que pasarte justamente a ti? Para empezar, y para que no te sientas solo, te diremos que es uno de los problemas sanitarios más comunes entre las personas adultas de mediana edad.
Las hemorroides (también llamadas coloquialmente “almorranas”) son dilataciones venosas localizadas en las paredes del recto y del ano . Las principales causas que promueven su aparición son:
La dieta y las consecuencias que puede tener, como el estreñimiento crónico debido a un consumo pobre de fibra. Los esfuerzos que se producen al defecar aumentan la presión de sangre en los vasos hemorroidales, y esto puede causar la aparición de hemorroides.
Malos o inadecuados hábitos higiénicos , como puede ser permanecer demasiado tiempo sentado en la taza pues aumenta la presión en la zona llamada “cojín anal”.
El sedentarismo o la práctica de determinadas modalidades deportivas, como la equitación o el ciclismo.
Embarazo y parto : se debe a la presión del útero aumentado de tamaño sobre los vasos hemorroidales, añadido al problema frecuente de estreñimiento, causado por la relajación de los músculos pelvianos y de la pared abdominal (a su vez, provocados por acción del aumento de los niveles de la hormona progesterona) que ocurren durante este proceso fisiológico de la vida de la mujer.
Enfermedades como la hipertensión arterial, infecciones anales , abuso de laxantes irritantes, etc.
Predisposición hereditaria.
Tipos, signos y síntomas
Las hemorroides pueden ser internas (están presentes en el canal anal y no pueden verse, llegando a tamaños considerables) o externas (son las que se prolapsan -caen- a través del esfínter anal al defecar y después vuelven a su posición habitual por sí mismas o tras empujarlas uno mismo a través del ano).
Las hemorroides son a menudo asintomáticas, pero otras veces presentan diversos síntomas, que dependerán de su localización, de su tamaño o extensión, y de la presencia o no de posibles complicaciones. Los síntomas más comunes y fácilmente controlables son:
El picor o prurito anal: es el síntoma más típico y se debe a la inflamación.
Irritación o escozor anal : puede ser constante o aparecer en el momento de la defecación.
Dolor : si éste es persistente, se recomendará al paciente consultar al médico.
Hemorragia : es el sangrado que se produce durante la defecación, en forma de sangre fresca de color rojo brillante que recubre las deposiciones o en forma de gotas de sangre que manchan la taza de inodoro y/o el papel higiénico.
Otros signos/síntomas más graves serían:
Incontinencia fecal: incapacidad para cerrar el esfínter (musculatura circular) anal.
Prolapso anal o protusión hemorroidal : es la salida de las hemorroides al exterior del ano. Es frecuente tras la defecación. No suele ser dolorosa salvo complicación por infección, trombosis o estrangulamiento de la hemorroide.
Trombosis hemorroidal: se manifiesta con la aparición de dolor intenso y constante, acompañado de un bultoma (una bola) del tamaño de una uva.
¿Cómo se tratan?
Los pacientes acuden a diario a las oficinas de farmacia solicitando medicamentos para el tratamiento de las hemorroides. Es necesario realizar un cuidadoso interrogatorio por parte del farmacéutico y, ante cualquier duda o sospecha de complicación, es necesaria la remisión al médico para que valore el cuadro clínico. Debido a que es frecuente que la persona se avergüence del padecimiento de esta enfermedad, es usual la automedicación y también que se consulte a menudo primero al farmacéutico antes que al médico.
Es importante que la dispensación de productos para tratarlas esté acompañada de consejos adecuados para su buena utilización y que se eduque en la adopción de determinados hábitos higiénicos y dietéticos que pueden prevenir o paliar la aparición de hemorroides.
Medidas higiénicas
Es conveniente lavar la zona anal con agua templada o fría (con o sin jabón neutro) tras cada deposición, para evitar irritaciones. También se pueden usar toallitas húmedas especialmente destinadas a este uso, indicando limpiar con pequeños toquecitos, porque el hecho de frotar puede agravar los síntomas.
Realizar el secado de la zona anal con celulosa o algodón, evitando el papel que pueda producir irritación.
Debido a que el exceso de lavado puede provocar que desaparezca el manto graso natural de la piel de la zona tratada, es recomendable el uso de vaselina o pomadas antihemorroidales para evitar irritaciones.
Realizar baños de asiento en un bidé con agua tibia durante 10 min varias veces al día.
Medidas dietéticas
Incremento de la ingesta de alimentos ricos en fibra en la dieta, así como la ingesta de abundantes líquidos al día.
Se puede utilizar un laxante estimulante durante uno o dos días para aliviar el estreñimiento hasta que actúen las medidas anteriormente mencionadas.
Medidas farmacológicas
Existen numerosos principios activos a utilizar:
Medicamentos anestésicos locales (para calmar el dolor), como la lidocaína o la benzocaína.
Corticoides tópicos (para la inflamación), como la hidrocortisona.
Principios antipruriginosos (para calmar el picor), como el fenol o el mentol.
Medicamentos vasoconstrictores, como la efedrina.
Preparados antisépticos (para evitar la infección) como la hexetina.
Preparados emolientes (para hidratar la piel), como el “bálsamo de Perú”.
Protectores de la piel, como el óxido de zinc y el caolín.
Medidas quirúrgicas
Hay circunstancias en las que el médico aconsejará un tratamiento quirúrgico encaminado a reforzar el mecanismo de sujeción natural de los vasos hemorroidales o a extirpar el problema. Las opciones son:
Ligamento de las hemorroides : se coloca una banda elástica en la base de la hemorroide, y, al causar el cese de la circulación sanguínea en ella, ésta se seca a los pocos días y se desprende, dejando una cicatriz. Suele realizarse sin anestesia y de forma ambulatoria, aunque puede requerir varias sesiones de tratamiento.
La fotocoagulación con infrarrojos o con láser (contrariamente a la creencia popular, no son menos dolorosas), la electrocoagulación, la escleroterapia (se interrumpe el riego sanguíneo de la hemorroide mediante la inyección de una sustancia química en su base) o la criocirugía no mejoran los resultados obtenidos con la técnica anterior.
La anopexia circular mecánica : es una intervención donde se usa una grapadora o bien una sutura mecánica, recolocando y fijando las hemorroides en el interior del ano.
La hemorroidectomía: es la intervención quirúrgica consistente en la extirpación completa de las hemorroides. Es la técnica de elección en los casos de fracaso de las ligaduras, en los casos de existencia de trombosis hemorroidal o si nos hallamos ante un caso grave de hemorroides (las denominadas hemorroides de grado IV). Se realiza bajo anestesia y suele requerir una hospitalización y un período de inactividad laboral.
¿SABÍAS QUE…?
Las cremas y pomadas pueden utilizarse en las hemorroides internas y externas. Deben aplicarse por la mañana y por la noche y tras cada deposición. Si precisan aplicarse interiormente, se introducirán con la cánula que se incluye en el envase.
Los supositorios se recomiendan para las hemorroides internas. La inserción es más fácil cuando el paciente está tumbado o de cuclillas.
Las personas que no mejoren de sus síntomas en una semana, las que presenten incontinencia fecal y en las que se aprecie una protusión (abombamiento) de la hemorroide fuera del ano, se aconseja su remisión al médico especialista.
Los niños deben derivarse siempre al médico.
No es un buen consejo la automedicación. Puede existir interacción entre los medicamentos añadidos y los tratamientos ya administrados habitualmente.
Las hemorroides no producen cáncer . No existe ninguna relación entre las hemorroides y el cáncer.
Artículo especializado
Hernia de Hiato: Preguntas con Respuesta
Hiato, del latín hiatus , aplicado en anatomía significa orificio o hendidura en alguna parte del cuerpo. En el diafragma tenemos un orificio natural o hiato a través del cual el esófago llega al estómago, separando la cavidad torácica de la cavidad abdominal. Cuando se forma una hernia de hiato, esta barrera anatómica no cumple su función y se crea una abertura en el diafragma , provocando que la parte superior del estómago suba a la cavidad torácica.
¿Qué relación tiene con el reflujo?
Esta situación, que se estima que afecta al 20% de la población, suele favorecer el reflujo del contenido gástrico hacia el esófago, debilitando la pared del esófago por su acidez, llegando incluso con el tiempo, en algunos casos, a dañar las células epiteliales del esófago, dando lugar al esófago de Barret, donde el tejido del esófago se reemplaza por un tejido similar al del revestimiento intestinal. Este efecto dañino, si no se pone remedio, puede derivar a una displasia , situación que predispone al cáncer de esófago.
Sin embargo, aunque el reflujo gastroesofágico suele asociarse con la hernia de hiato, la mayoría de las personas que padecen una hernia de hiato no presentan síntomas. Y cuando se manifiestan, los más comunes suelen ser acidez o ardor de estómago, dolor torácico, tos seca, dificultad para tragar alimentos y halitosis o mal aliento. Cuando estos síntomas aparecen o persisten se debe acudir al médico especialista (gastroenterólogo) para que valore el caso y el tipo de tratamiento más adecuado. En la mayoría de los casos la toma de medicación o la combinación de los mismos, junto con una modificación de algunos hábitos del estilo de vida, ayudan a controlar los síntomas. Se suelen administrar fármacos que reduzcan la producción de ácido y que facilitan el vaciamiento gástrico. Si los síntomas persisten y no mejoran con la medicación se suele recurrir a la cirugía, como mejor opción.
¿Qué causas tiene la hernia de hiato?
En la mayoría de los casos la causa es desconocida, aunque se cree que ciertos esfuerzos físicos realizados de forma repentina pueden provocar un debilitamiento de la musculatura del diafragma y favorecer su aparición. También existen factores de riesgo que predisponen a su aparición como la propia edad (por el envejecimiento del músculo diafragmático), fumar, sufrir estreñimiento (por el esfuerzo ejercido para evacuar) y estar obeso (por la presión que ejerce la grasa en los músculos del abdomen). En niños también puede darse, pero su causa suele ser hereditaria.
¿Qué papel juega la dieta?
En cuanto a la dieta, ciertas recomendaciones dietéticas pueden ayudar a reducir las molestias, teniendo en cuenta la propia tolerancia individual.
Evitar las comidas abundantes : es preferible realizar cinco o seis comidas a lo largo del día, masticar despacio y de manera relajada, dedicando un mínimo de 30 minutos a cada comida.
Procurar no beber mucho durante las comidas o justo después de las mismas, pues retrasan la digestión al diluir los jugos gástricos.
Cenar dos o tres horas antes de acostarse y evitar tumbarse después de las comidas. Si de todas formas notas molestia sería aconsejable que levantases la cabecera de la cama unos 15-20 cm, para permitir que la gravedad mantenga el contenido del estómago en su interior.
No utilizar ropa que te oprima el abdomen. Evitar el cinturón apretado.
Introducir alimentos de fácil digestión y evitar aquellos considerados irritantes. Aunque en algunos casos depende de la tolerancia individual (ver tabla)
Cocinar con técnicas de cocción saludables que utilicen poca grasa : hervido, vapor, plancha, horno, etc.
Los alimentos muy calientes o muy fríos pueden provocar molestias. Introducir según tolerancia individual
Evitar tomar alimentos y bebidas que disminuyan la fuerza de los músculos del esófago como:
Alcohol contenido en bebidas alcohólicas y bebidas gaseadas
Alimentos carminativos (favorecedores de la expulsión de gases), como menta, ajo o cebolla. Provocan una estimulación de la secreción gástrica, por lo que deben tomarse según tolerancia.
Chocolate.
Alimentos de elevado contenido graso (fritos, aceite, mantequilla o margarina, carnes grasas, etc).
Evitar alimentos o bebidas que irritan el esófago como :
Cítricos y zumos (tomate, naranja, uva…).
Café o té (sustituir por achicoria, malta o infusiones).
Pimienta, guindilla, especias y alimentos condimentados. Entre las hierbas aromáticas el eneldo, laurel, tomillo y romero, entre otras, favorecen la digestión.
Derivados del tomate.
Alimentos muy salados o en escabeche por su acción irritativa.
Vinagre de vino (mejor utilizar el vinagre de manzana).
Evitar ciertas hortalizas : nabo, rábano, ajo y cebolla y aquellas que causan muchos gases (col, coliflor).
Se recomienda tomar con mayor frecuencia los siguientes alimentos:
Alimentos ricos en proteínas , pero con bajo contenido en grasa (carnes magras, leche desnatada, quesos bajos en grasa, etc).
Alimentos ricos en hidratos de carbono y bajo contenido en grasa (pan, cereales, pasta, arroz, patata, etc.).
Alimentos ricos en mucílagos . Este tipo de fibra suaviza la mucosa, sus fuentes alimentarias son: calabaza, calabacín y borraja.
Artículo especializado
Fístulas Perianales
Una fístula no es más que un conducto que comunica dos zonas. Cuando nos referimos a fístulas anales o perianales , hacemos referencia a la aparición de un pequeño túnel que comunica el interior del canal anal con el exterior a través de una apertura en la piel de alrededor del ano.
¿Por qué se produce?
El canal anal normal está formado por una especie de criptas con forma glandular. Si estas glándulas se obstruyen y no pueden drenar correctamente su contenido, se producen infecciones locales que en un principio pueden pasar desapercibidas. Las infecciones provocan la aparición de material purulento que el organismo intentará eliminar buscándole una salida. Si no se consigue un buen drenaje hacia el canal anal, el organismo intentará buscar otra salida hacia el exterior y lo hará conduciéndolo hacía la piel de la zona más cercana creando así una fístula perianal. Determinadas enfermedades como la enfermedad de Crohn, la tuberculosis, la actinomicosis, la diverticulosis , los antecedentes de traumatismo en la zona perianal o la radioterapia, son factores que predisponen a la aparición de fístulas perianales.
¿FÍSTULA O ABSCESO?
En ocasiones, el acúmulo de material purulento es mayor y el organismo no tiene el tiempo suficiente para buscarle una salida. En estos casos, se puede producir lo que se denomina un absceso perianal . Así pues, el origen de un absceso perianal y una fístula sería el mismo, con la diferencia de que en una fístula el organismo ha conseguido encontrar una salida al exterior para el material purulento, y en un absceso no.
¿Qué tipos de fístulas perianales existen?
Las fístulas perianales se clasifican según la altura a la que se localiza el orificio fistuloso interno (en el canal anal) y las estructuras que atraviesa hasta su salida al exterior. Esta clasificación es muy importante para valorar el mejor tratamiento posible y su riesgo de complicaciones.
Así pues, las fístulas pueden clasificarse en:
Fístula superficial: aquella que en su recorrido no llega a atravesar ninguno de los esfínteres anales.
Fístula interesfinteriana: pasa por el espacio que existe entre el esfínter anal interno y el externo.
Fístula transesfinteriana: atraviesa en su recorrido ambos esfínteres anales. A su vez, este tipo de fístulas los clasificamos en fístulas transesfinterianas bajas, si afectan a menos del 50% del esfínter, o fístulas transesfinterianas altas cuando afectan a más del 50%.
Fístula supraesfinteriana: rodea todo el esfínter anal externo, saliendo a la superficie por un orificio exterior al esfínter.
Fístula extraesfinteriana : su orificio interno se produce en el recto (parte final del intestino grueso) en lugar de en el canal anal.
¿Qué síntomas provoca?
En muchas ocasiones, una fístula perianal puede ser completamente asintomática. De forma intermitente en el tiempo, el paciente puede notar drenaje purulento en la zona del ano, así como sensación de humedad o picor . Es posible que pueda incluso haber identificado un orificio en la piel perianal, que en muchas ocasiones aparecerá con un aspecto como de grano indurado en esa zona.
Sin embargo, todas las fístulas tienen tendencia a la sobreinfección, por lo que, en la mayor parte de los casos, de no tratarse, acabará provocando la aparición de abscesos perianales cuando el conducto fistuloso se haya obstruido.
Cabe destacar que no todos los abscesos perianales están completamente relacionados con la existencia de una fístula, pero en aquellos casos en los que se produzcan abscesos de repetición en una misma zona debe descartarse la existencia de una fístula anal subyacente.
¿Cómo se diagnostica?
En gran parte de los casos, el diagnóstico es simplemente visual. El hecho de observar un orificio fistuloso externo en la zona perianal será básico para orientar la existencia de una fístula a este nivel.
Para clasificar el tipo de fístula del que se trata se suele emplear en muchas ocasiones una ecografía endoanal que visualiza los esfínteres anales y el recorrido de la fístula. En muchas ocasiones, se puede inyectar suero o agua oxigenada a través del orificio fistuloso externo mientras realizamos la ecografía para ver con seguridad el trayecto de la fístula.
En aquellas ocasiones en las que una ecografía no llega a visualizar correctamente el trayecto fistuloso en las que tenemos dudas, se puede realizar una Resonancia Magnética de la zona anal.
¿Qué tratamientos existen?
El tratamiento de una fístula perianal es siempre necesario. Incluso cuando ésta es asintomática, se recomienda su intervención para evitar posibles complicaciones en forma de abscesos o empeoramiento de la fístula con aparición de múltiples trayectos (cosa que dificultará su tratamiento).
En la mayoría de casos, el tratamiento de las fístulas perianales será quirúrgico.
Cuando la fístula no es muy profunda (fístula superficial, interesfinteriana e incluso transesfinteriana baja) el tratamiento quirúrgico de elección es la fistulotomía. La fistulotomía consiste en la puesta a plano del trayecto fistuloso. Para realizarlo, el cirujano introducirá una guía metálica (normalmente un estilete) a través del orificio fistuloso externo hasta que salga por el orificio fistuloso interno. Tras ello, realizará una sección del tejido que queda por encima de la guía, de forma que dejará una herida abierta cuyo fondo será el trayecto fistuloso. El organismo es el que se encargará de cicatrizar la herida creada sin dejar rastro de la fístula previa.
En aquellos casos de fístulas altas, que comprometen una parte importante de los esfínteres (fístula transesfinteriana alta o supraesfinteriana), se puede utilizar la t écnica del setón . Consiste en introducir un sedal a través del orificio fistuloso externo hacia el interno y una vez canalizado el trayecto fistuloso, se anuda el sedal en el exterior, de forma que queda colocado como un anillo, dejándose en esta posición durante varios días o semanas. Con el paso del tiempo, el setón va arrastrando la fístula y haciéndola cada vez más superficial mientras que el organismo va cicatrizando el trayecto.
¿Riesgos de la cirugía?
El riesgo de las técnicas quirúrgicas es, a parte del dolor postoperatorio y del riesgo de reaparición de la fístula (que en algunos casos llega al 10%), el riesgo de incontinencia anal posterior, que será más elevado cuanto más alta sea la fístula. Por este motivo, en los últimos años han aparecido diversas técnicas que intentan evitar la sección del trayecto fistuloso. Entre las más novedosas estarían:
La colocación de un tapón biodegradable: consiste en la colocación de un material en el trayecto fistuloso que ayuda a fomentar la regeneración de los tejidos ayudando a la cicatrización del trayecto fistuloso.
El uso de colas de fibrina : es la única no quirúrgica, consiste en la impregnación del trayecto fistuloso de una especie de cola biológica que sella el trayecto y produce su cicatrización posterior.
Por último, cabe destacar que la existencia de tantas técnicas denota que no existe una que sea de elección para todos los casos, por lo que será el cirujano colorrectal el que podrá aconsejar qué técnica se adecúa más a cada paciente.

Artículo especializado
Etapas del Cáncer de Vejiga
Existe cura para el cáncer de vejiga, y es que hasta el 80% de pacientes diagnosticados de este tipo de tumores sobrevivirán más allá de cinco años tras su diagnóstico. Este porcentaje es incluso superior en España respecto a otros países desarrollados, ya que la supervivencia media a cinco años en la Unión Europea se sitúa en torno al 69%.
Más frecuente en hombres
El cáncer de vejiga es el quinto cáncer más frecuencia en nuestro país , con más de 21.000 nuevos casos anuales. Pese a esta prevalencia, es el octavo tipo de cáncer por mortalidad, siendo el responsable de unas 4.300 muertes al año. Su frecuencia es muy superior en el sexo masculino , con más de 17.000 casos anualmente respecto a los 3.600 nuevos casos que se diagnostican en el sexo femenino. Por edades suele afectar a personas entre los 65 y 75 años, con el pico de incidencia alrededor de los 70 años.
¿Qué es?
El cáncer es una enfermedad producida por una mutación genética que provoca una reproducción incontrolada de las células de un tejido. Dicha reproducción incontrolada provoca un crecimiento del tumor que va invadiendo los tejidos de su alrededor y que en ocasiones puede infiltrarse en un vaso sanguíneo y migrar e implantarse en otros órganos ocasionando las metástasis.
El cáncer de vejiga es un tipo de cáncer que se origina frecuentemente en la capa mucosa de la vejiga (la capa interna que está en contacto con la orina), formando así el llamado carcinoma urotelial. En este tipo de tumores, podemos diferenciar dos subtipos:
Cáncer urotelial de bajo grado : rara vez invade tejidos en profundidad u ocasiona metástasis a distancia, pero sin embargo tiene tendencia de reaparecer tras su extirpación
Cáncer urotelial de alto grado : más agresivo. Va invadiendo los tejidos que lo rodean, en profundidad en la vejiga, y en ocasiones puede extenderse a otros órganos provocando metástasis.
¿Qué factores de riesgo existen?
El principal factor de riesgo evitable para el cáncer de vejiga es el tabaquismo . Se estima que los fumadores tienen el triple de riesgo de desarrollar un cáncer vesical respecto a los no fumadores. Esto puede ser producido porque muchos de los tóxicos del tabaco se eliminan por la orina.
Además del tabaquismo, los antecedentes familiares de cáncer de vejiga representan otro factor de riesgo importante para la aparición de un cáncer vesical.
Existen otros factores de riesgo, pero con una importancia menor como son las exposiciones a sustancias químicas como colorantes, derivados del petróleo o arsénico, entre otros.
¿Cómo se presenta?
El síntoma más frecuente en el cáncer vesical es la hematuria (la presencia de sangre en la orina). Sin embargo, ésta puede ser provocada por múltiples enfermedades como por ejemplo la presencia de piedras en los conductos urinarios (cólicos nefríticos), infecciones (cistitis) o enfermedades renales.
Al contrario que en la mayoría de enfermedades que pueden producir sangrado por la orina, el ocasionado por un cáncer de vejiga suele ser asintomático, es decir, el paciente únicamente verá sangre en la orina, pero no presentará molestias importantes, dolor ni otra sintomatología.
Además de la hematuria, los tumores vesicales pueden presentarse como polaquiuria (aumento de la frecuencia de micciones), disuria (molestias al orinar), nicturia (aumento de las micciones durante la noche) o tenesmo urinario (sensación continua de ganas de orinar).
¿Cómo se diagnostica?
La primera prueba diagnóstica que habrá que hacer es un análisis de orina y un análisis sanguíneo . Con ellos descartaremos otras causas de hematuria. Además, en algunos casos permite visualizar células tumorales que se expulsan con la orina, lo que nos permitiría asegurar que existe un cáncer en las vías urinarias, aunque no nos daría la localización exacta (podría tratarse de un tumor vesical pero también de un tumor en algún otro punto de las vías urinarias como los uréteres o la uretra).
La ecografía es una técnica útil en algunos casos ya que permite visualizar el tumor dándonos información de su tamaño y posible afectación de otros órganos.
La urografía endovenosa es una prueba radiológica que permite visualizar las vías urinarias y descartar la existencia de otras tumoraciones a lo largo de las mismas.
Pero ante todas, la prueba más útil en el diagnóstico del cáncer vesical es la cistoscopia. Es una técnica que consiste en introducir un tubo muy fino con una cámara en su punta, a través de la uretra para así poder visualizar el interior de la vejiga. Permite así ver directamente el tumor, su extensión y coger muestras (biopsias) para analizarlo. Además, como veremos más adelante, en muchas ocasiones permite también extirpar el tumor y tratar así la enfermedad.
Una vez diagnosticado ya el cáncer vesical, se suele hacer un estudio para descartar extensión del tumor a distancia a través de una TAC abdominal , una radiografía o TAC de tórax y en algunos casos una gammagrafía ósea para descartar metástasis en los huesos.
¿Cómo se trata?
La elección del tratamiento dependerá del tipo de tumor y del grado de afectación, tanto en profundidad de la vejiga como por la existencia o no de metástasis a distancia. Los tratamientos disponibles son la cirugía, la radioterapia y la quimioterapia.
En aquellos casos de tumores superficiales (tumores de bajo grado o tumores de alto grado, pero en fases muy precoces) el tratamiento básico será la cirugía. En muchas ocasiones se puede realizar la llamada RTU (resección transuretral), es decir, a través de una cistoscopia se extirpa la zona de tumor pudiendo curar por completo la enfermedad sin tener que hacer incisiones. En otros casos, por el contrario, será necesaria una cirugía mayor que implique una extirpación total o parcial de la vejiga de la orina.
La quimioterapia es otro de los tratamientos habituales en el cáncer vesical. Ésta puede administrarse de forma intravesical (se introduce por la uretra hasta el interior de la vejiga) o intravenosa.
La quimioterapia intravesical se suele utilizar tras una RTU en tumores superficiales y disminuye el riesgo de recidiva (reaparición) de la enfermedad. La quimioterapia intravenosa se emplea frecuentemente en caso de que existan metástasis o haya riesgo de que éstas aparezcan.
¿Y después del tratamiento?
Como ya hemos dicho, el cáncer vesical es un cáncer frecuente , pero en muchas ocasiones curable . Sin embargo, existe un riesgo elevado de recidivas, ya sea por reaparición del mismo tumor como por la aparición de otros tumores a nivel vesical. Se estima que el riesgo de recidiva en este tipo de tumores está entre un 40 y un 70%, aunque hay estudios que elevan ese porcentaje hasta el 90%. Por este motivo, es de especial importancia realizar un buen seguimiento tras haber superado un cáncer vesical, en muchas ocasiones incluso realizando cistoscopias seriadas para descartar la aparición de nuevas tumoraciones.
Artículo especializado
Pronóstico, Analítica y Test para Detectar el Cáncer de Pancreas
Infrecuente pero muy agresivo, el cáncer de páncreas es, además, difícil de diagnosticar en etapas tempranas porque, cuando da síntomas, en general ya suele estar en un estado avanzado, y muchas veces los síntomas son tan inespecíficos que se tarda en acudir al médico. Modificar los factores de riesgo que pueden propiciarlo está en nuestras manos, así que ¿por qué no hacerlo?
Cómo se produce
El cáncer de páncreas se origina cuando las células del páncreas comienzan a proliferar sin control y van acumulando cambios en la replicación del ADN que las hace invasivas y agresivas.
El páncreas tiene dos tipos de células, las exocrinas, que son las que producen una serie de enzimas que ayudan en la digestión de los alimentos, y las endocrinas , que producen diferentes hormonas, como la insulina o el glucagón. La mayoría de los tumores del páncreas se localizan en las células exocrinas , causando un adenocarcinoma de páncreas, mientras que los tumores endocrinos del páncreas son menos comunes.
Incidencia del tumor
No es un tumor muy frecuente : representa apenas el 2% del total de todos los cánceres). Cada año se diagnostican en el mundo unos 233.000 nuevos casos en todo el mundo. En España se detectan unos 4.000 casos anuales. Es un tumor un tanto más frecuente en los hombres que en las mujeres . La mayoría de los tumores de páncreas se diagnostican en personas entre los 65 y los 75 años.
Factores de riesgo
Este cáncer se ha relacionado con diversos factores de riesgo :
Hábito tabáquico.
Dietas ricas en grasas y en proteínas.
Pancreatitis crónica.
Cirrosis hepática.
Diabetes.
Colecistectomía.
Exposición a ciertos productos químicos (tintorería, industria metalúrgica).
Predisposición genética.
UN CÁNCER MUY AGRESIVO
El cáncer de páncreas es muy agresivo y se extiende a los tejidos que lo rodean con suma facilidad . Un 70% se diseminan a través de los vasos linfáticos y más del 50% lo hacen también por la sangre, de manera que las metástasis son habituales, sobre todo en el hígado, el peritoneo (la membrana que reviste por dentro la cavidad abdominal y sus órganos) o los pulmones.
Los estudios indican que un elevado número de cánceres de páncreas presentan alteraciones en unos genes concretos , el gen ras y el gen p53, ya sea en uno de ellos o muchas veces en ambos.
Síntomas
Por desgracia, la mayoría de estos tumores se detectan en un estado avanzado . El dolor de abdomen es el síntoma más habitual de este tipo de tumores. Suele tratarse de un dolor sordo y constante que se ubica en la zona superior e izquierda del abdomen y que se extiende hacia la espalda. Con frecuencia los pacientes lo describen como si les apretase un cinturón . Suele ser más frecuente durante la noche, no deja dormir. Se suele agravar al comer y al tumbarse, mientras que los pacientes explican un ligero alivio al inclinarse hacia adelante.
La pérdida de peso debida a un déficit de absorción de nutrientes suele ser el síntoma más precoz . Suele acompañarse de falta de apetito, cansancio importante y diarreas, al no poder digerir bien los alimentos por la alteración en la producción de las hormonas digestivas que produce el páncreas.
Otros síntomas habituales de los pacientes con cáncer de páncreas pueden ser:
Ictericia (coloración amarillenta de la piel por acumulación de bilirrubina).
Náuseas y vómitos .
Intolerancia a la glucosa o diabetes .
Pancreatitis aguda .
Es difícil diagnosticar el cáncer de páncreas en sus etapas tempranas porque, cuando da síntomas, en general, ya suele estar en un estado avanzado, y muchas veces los síntomas son tan inespecíficos que se tarda en acudir al médico. Hoy en día no existen pruebas de detección precoz ni se realiza ningún tipo de cribaje para el cáncer de páncreas.
Cómo se diagnostica
No existen marcadores específicos para el cáncer de páncreas que se puedan detectar en una analítica. Existen unos marcadores tumorales, el CEA y el CA 19.9 , que pueden estar elevados en los pacientes con cáncer de páncreas, pero son muy poco específicos. Es decir, pueden estar elevados como no estarlo y estos marcadores pueden aparecer elevados también por otros motivos que no sean el cáncer de páncreas, de manera que no son una herramienta útil para el diagnóstico de este tumor . Estos marcadores tumorales, como todos, son útiles, si están elevados, para valorar la respuesta a los tratamientos de quimioterapia, pero no para el diagnóstico de la enfermedad.
En aquellos pacientes con un elevado riesgo de padecer un cáncer de páncreas por una predisposición genética y familiar se pueden hacer estudios genéticos para valorar si existen alteraciones en ciertos genes que aumenten el riesgo de sufrir esta enfermedad . Ahora bien, que estos genes estén alterados no implica necesariamente que se vaya a padecer la enfermedad, sino que existe un riesgo mayor que el de otras personas.
Las principales herramientas para el diagnóstico del cáncer de páncreas siguen siendo los síntomas del paciente y las diferentes pruebas de imagen, como la ecografía, la ecoendoscopia, el escáner, la resonancia magnética nuclear o la tomografía por emisión de positrones (PET) . En una analítica de sangre se puede apreciar la elevación de ciertas enzimas hepáticas, como la lipasa y la amilasa, así como alteraciones de los niveles de glucosa o bilirrubina en determinados casos. Una vez se tiene el diagnóstico de sospecha se confirmará con la toma de una muestra de tejido del tumor mediante una PAAF o punción aspiración con aguja fina .
Tratamiento
El tratamiento del cáncer de páncreas dependerá del estadio. Por desgracia tan solo un 10%-20% de los cánceres de páncreas pueden ser tratados mediante cirugía cuando se diagnostican . En el resto de los casos las opciones quirúrgicas son paliativas. La quimioterapia y la radioterapia pueden ayudar a aumentar la supervivencia.
Con todo, el adenocarcinoma de páncreas es uno de los tumores que presentan un peor pronóstico. Se estima que solamente un 5% de las personas que padecen este tipo de tumor sobreviven más allá de 5 años desde el momento del diagnóstico. La mayoría de las muertes se producen a lo largo del primer año desde que se detecta la enfermedad.
LO QUE PODEMOS HACER…
Lo que está en nuestras manos para prevenir este tipo de cáncer, infrecuente pero muy agresivo, es modificar los factores de riesgo que pueden propiciarlo :
Abandonar el consumo de tabaco.
Mantener una dieta sana y equilibrada.
Limitar el consumo de alcohol.
Realizar una actividad física moderada.
Evitar la exposición laboral a ciertos productos químicos.

Artículo especializado
Pruebas para Detectar el Cáncer Colorrectal
Es así, no existe una forma eficaz de prevenir la aparició n de un cáncer colorrectal, el tumor maligno más frecuente en nuestro país (con más de 40.000 nuevos casos cada año). Por suerte, contamos con pruebas de detección precoz y otras que nos pueden ayudar al diagnóstico y posterior tratamiento. Además, evitando algunos factores de riesgo podemos reducir la probabilidad de que aparezca. Por tanto, si hay algo en nuestra mano para evitarlo… ¡a qué esperamos!
Cómo se produce
El cáncer colorrectal es el tumor que afecta al colon (conocido como intestino grueso) o al recto (tramo final del intestino de unos 15 cm de longitud que desemboca en el ano). Se produce cuando algunas células del intestino sufren una mutación genética que provoca que se reproduzcan sin control, generando entonces una tumoración que crece continuamente afectando a los tejidos de alrededor. Esas células, frecuentemente obtienen la capacidad de entrar en el torrente sanguíneo , trasladarse a otros órganos del cuerpo, implantarse en esos órganos y seguir creciendo sin control, originando así las metástasis.
Causas
No existe una causa conocida que explique la aparición un cáncer colorrectal, pero sí hay varios factores que pueden favorecer su aparición:
Edad: suele presentarse en pacientes de más de 50 años. La edad media de aparición se sitúa en torno a los 65-70 años .
Sexo: existe una mayor predisposición en el sexo masculino (se diagnostican más de 24.000 casos nuevos anualmente en hombres frente a los 16.000 en mujeres).
Antecedentes familiares: tan solo un 5% de los cánceres de colon detectados se consideran genéticamente hereditarios (traspasados de padres a hijos a través de alguna mutación genética). Sin embargo, las personas con antecedentes familiares de cáncer de colon tienen aproximadamente el doble de probabilidad de presentar esta enfermedad a lo largo de su vida si los comparamos con personas sin antecedentes familiares de cáncer colorrectal.
Antecedentes personales de otros cánceres : las personas que han sufrido un cáncer colorrectal tienen un riesgo superior al de otras personas de presentar otro cáncer. También existe un riesgo superior en las mujeres que han presentado un cáncer de ovario o de útero.
Enfermedades intestinales: algunos tipos de enfermedades que afectan al intestino pueden aumentar el riesgo de padecer cáncer colorrectal , como por ejemplo la Enfermedad Inflamatoria Intestinal, la Poliposis Adenomatosa Familiar o el Síndrome de Gardner, entre otras.
Pólipos en el colon : los pólipos en el intestino grueso tienen riesgo de acabar degenerando en cáncer colorrectal a lo largo de los años. Por ese motivo, cuando se detectan a través de alguna prueba complementaria se recomienda su extirpación.
Obesidad : se considera que aproximadamente un 17% de los casos de cáncer colorrectal son atribuibles a la obesidad. Esto no quiere decir que la obesidad ocasione en sí misma el cáncer, pero facilita su aparición y dificulta su control, por lo que, erradicando la obesidad podríamos evitar el 17% de casos de cáncer colorrectal, además de prevenir muchas otras enfermedades.
Nutrición : el consumo de carnes rojas y carnes procesadas se relaciona claramente con el riesgo de cáncer colorrectal. Esto no quiere decir que no haya que consumir este tipo de carnes, pero sí que debe evitarse su abuso y consumirlas dentro de una dieta equilibrada.
Tabaquismo : aunque no es uno de los tumores que más claramente se relacionan con el tabaquismo, el cáncer colorrectal es más frecuente en personas fumadoras que en las no fumadoras.
Raza: las personas de raza negra tienen una probabilidad de desarrollar un cáncer colorrectal superior al de otras razas.
Síntomas
Gran parte de los casos de cáncer colorrectal no presentan síntomas hasta fases avanzadas , pero en muchos otros casos aparecen un conjunto de síntomas que, correctamente interpretados, pueden ayudarnos a diagnosticar precozmente la enfermedad. Los más frecuentes son:
Alteraciones del ritmo gastrointestinal : alternar deposiciones sólidas con deposiciones líquidas de manera repetida.
Sangrado con las deposiciones .
Tenesmo : sensación de vaciado incompleto tras la deposición.
Pérdida de peso sin causa aparente .
Anemia ferropénica (por déficit de hierro) sin otra causa que lo justifique
Existen otras manifestaciones pero que pueden ser muy inespecíficas y se presentan en muchas otras enfermedades intestinales, como por ejemplo molestias abdominales, distensión abdominal, cansancio y fatiga.
Detección precoz
Dado que el cáncer colorrectal suele aparecer en personas de más de 50 años , en muchas localidades de nuestro país se han empezado a realizar pruebas de screening (detección precoz) basadas principalmente en la detección de sangre oculta en heces . Estas pruebas consisten en la recogida de tres muestras de heces en las que se analiza si existen restos de sangre. En caso de que la prueba sea positiva , se debe continuar un estudio para comprobar el origen de la sangre, ya que problemas como hemorroides o fisuras anales pueden ser los causantes.
¿SABÍAS QUE…
La detección de marcadores tumorales (CEA) en el análisis sanguíneo no debería utilizarse como método de detección precoz de cáncer colorrectal, puesto que, por un lado, el 40% de los cánceres colorrectales no elevan los marcadores tumorales y, además, existen muchos casos de falsos positivos (pacientes que tienen marcadores elevados y sin embargo no presentan cáncer de colon).
Diagnóstico
El diagnóstico definitivo del cáncer colorrectal se realiza mediante la realización de una colonoscopia (tubo flexible con una cámara que se introduce por el ano y nos permite ver el interior del intestino). Con ella podemos visualizar el tumor y recoger muestras (biopsias) que nos darán el diagnostico específico de qué tipo de tumor se trata.
Hay otras pruebas diagnósticas que nos pueden ayudar en el diagnóstico o en el seguimiento del cáncer colorrectal, como la TAC abdominal , el enema de bario , el estudio de marcadores tumorales , entre otros, pero ninguno de ellos sustituye la colonoscopia para el diagnóstico definitivo.
SOBRE LA COLONOSCOPIA…
Es importante destacar que la colonoscopia es una prueba invasiva , no exenta de riesgos, incluso a veces potencialmente graves. En muchas ocasiones nos encontramos pacientes que, sin tener ningún factor de riesgo o ninguna sintomatología, quieren que se les realice una colonoscopia para descartar la existencia de un cáncer colorrectal. En esas ocasiones, se debe explicar correctamente los riesgos que conlleva la realización de dicha prueba y evaluar si compensa asumir esos riesgos frente a la posibilidad de detectar un tumor de colon en una persona asintomática y sin factores de riesgo.
Tratamiento
El tratamiento del cáncer colorrectal dependerá de múltiples factores, entre los que destacan la localización del tumor y su grado de diseminación (tanto local, en la zona del intestino en la que se ha originado, como a distancia, si ha hecho metástasis).
En la mayor parte de los casos, el tratamiento es quirúrgico acompañado de quimioterapia antes y/o después de la operación. En los casos de cáncer de recto (parte final del intestino antes de desembocar en el ano) se puede añadir también tratamiento con radioterapia.
Prevención
No existe una forma eficaz de prevenir la aparición de un cáncer colorrectal, aunque evitando los factores de riesgo ya explicados, podemos disminuir la probabilidad de que aparezca .
Pronóstico
La supervivencia global del cáncer colorrectal a los cinco años se estima en torno a un 63%, es decir, que el 63% de los pacientes diagnosticados vivirán más de cinco años. El pronóstico dependerá mucho de lo evolucionada que esté la enfermedad en el momento de su detección . Así, en los casos en los que el diagnóstico se realiza muy tempranamente (estado A de la enfermedad), la supervivencia puede aumentar hasta el 90%.

Artículo especializado
Qué es una Pieloplastia
La unión pieloureteral es la zona donde los diferentes conductos que salen del riñón y recogen la orina se unen y conforman el uréter , que desciende hasta la vejiga y transporta la orina. Esta zona es la localización donde con mayor frecuencia se producen las obstrucciones de la vía urinaria por encima de la vejiga.
¿Cuáles son sus causas?
Son varias las causas que pueden originar esta alteración pero todas ellas provocan un trastorno en el tránsito normal de la orina. Las principales causas de la estenosis de la unión pieloureteral son:
congénita
presencia de válvulas ureterales
alteraciones de la inserción del uréter
adherencias
fibrosis
compresión por alteraciones vasculares
Sea cual sea la causa, la compresión produce una hidronefrosis , es decir, una dilatación de los tejidos del riñón y consecuentemente un fallo progresivo de la función renal. La mayoría de los casos la alteración se inicia en el estado fetal y va progresando hasta la vida adulta. Sin embargo, no se suele diagnosticar hasta la tercera década de la vida porque, en general, no da síntomas hasta que no existe una alteración marcada o bien se diagnostica casualmente durante la realización de otra prueba complementaria.
¿Dónde se produce?
Lo más frecuente es que la alteración se dé en el lado derecho y sobre todo en varones ; no obstante, en un 10-20% de los casos la alteración puede ser bilateral. Puede asociarse a otras alteraciones renales congénitas, como el riñón en herradura. Cuando se manifiesta suele hacerlo en forma de un dolor en la zona lumbar que recuerda al de un cólico nefrítico pero de características más sordas, menos intenso. Es frecuente que, a causa de la dificultad para drenar la orina, estos pacientes presenten también litiasis renales. También es frecuente que los pacientes refieran la presencia de sangre en la orina o bien infecciones de orina de repetición.
¿Cuál es su tratamiento?
El tratamiento de esta estenosis se basará en su corrección quirúrgica, que es lo que se llama una pieloplastia . A lo largo de los años las diferentes técnicas para realizar una pieloplastia han ido evolucionando para ser cada vez menos cruentas, siendo las opciones endoscópicas las menos agresivas para el paciente y con una mejor posoperatorio. La pieloplastia tiene dos objetivos fundamentales : detener el deterioro progresivo de la función renal y aliviar los síntomas que la obstrucción produce.
¿Cuáles son sus tipos?
Los tipos de pieloplastia pueden ser:
mediante cirugía abierta
mediante cirugía laparoscópica
mediante endoscopia
¿Qué técnicas se utilizan para su tratamiento?
La pieloplastia mediante cirugía abierta es la técnica más agresiva, se hace bajo anestesia general, se accede a la unión de la pelvis renal y el uréter y se secciona la zona para vencer la estenosis. Esta técnica tiene una tasa de éxito a largo plazo que oscila entre el 65% y el 100%.
La pieloplastia laparoscópica consigue unas tasas de éxito similares a las de la cirugía abierta y su ventaja es que se trata de una intervención menos agresiva para el paciente, de manera que se reduce la morbilidad que conlleva la cirugía abierta, así como el tiempo de hospitalización y las posibles complicaciones de la cirugía. Durante la cirugía se distiende el abdomen con gas y se accede al interior de la cavidad con una cámara. Se identifica el uréter, se secciona la parte estrechada y se vuelven a unir las partes sanas. La tasa de éxito de esta técnica oscila entre el 80% y el 100% y su principal desventaja es que el tiempo de la intervención es más largo dada su complejidad técnica y, en general, pueden darse más complicaciones que en las técnicas endoscópicas, aunque con un menor riesgo de sangrado.
La pieloplastia endoscópica consiste en acceder a la unión pieloureteral a través del conducto de la orina. Se accede por la uretra mediante una cámara, se llega a la vejiga y se asciende por el uréter hasta llegar a la zona estrechada, que se secciona mediante una cuchilla, un electrodo o bien mediante láser. Asimismo, se puede realizar una dilatación de la zona estrechada mediante un balón que se hincha a presión y que suele precisar que se realice también un pequeño corte en la zona estenosada. La gran ventaja de la pieloplastia endoscópica es la escasa morbilidad asociada que conlleva y un posoperatorio más breve; de hecho, esta intervención puede incluso hacerse de manera ambulatoria o con ingreso de solamente una noche. Sin embargo, el principal inconveniente de esta técnica es que presenta un mayor riesgo de sangrado. Con todo, la tasa de éxito global de esta técnica oscila entre el 70% y el 100%.
¿Cómo es su recuperación?
Tras cualquiera de estas técnicas se procederá a dejar puesto un catéter de drenaje . Este catéter puede ser del tipo llamado doble jota o pig-tail para ayudar al vaciado del riñón mientras cicatriza la nueva unión que se ha realizado. El catéter se coloca por vía endoscópica y se ancla a la parte alta del uréter y a la vejiga. Este catéter se deja aproximadamente unas 6 semanas y se retira de forma ambulatoria en la consulta del urólogo. En caso de que no pueda colocarse este catéter otra opción es dejar un drenaje externo, una nefrostomía, opción que es la más habitual cuando se realiza una pieloplastia abierta.
Si se tiene usted que someter a una pieloplastia por un problema renal confíe en su urólogo y plantéele todas las dudas que pueda tener.
Artículo especializado
Consecuencias de Tener Piedras en la Vesícula
Podemos tener piedras en la vesícula y no sufrir síntomas evidentes por lo que seguimos haciendo vida normal sin plantearnos que algo puede ir mal. En ocasiones, sin embargo, si esas piedras no se disuelven pueden ser la causa de fuertes ataques dolorosos, que médicamente se conocen como cólicos biliares. Pero, ¿qué es la vesícula y por qué se forman estas piedras?
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
La vesícula biliar es un pequeño órgano , con forma de pera, ubicado justo debajo del hígado, que almacena y concentra la bilis, secretada por el hígado. Al ingerir alimentos, ésta es expulsada a través de los conductos biliares hacia el intestino delgado facilitando la digestión de las grasas.
Cuando se acumulan sustancias dentro de la vesícula biliar debido a que la bilis no las puede disolver, se forman depósitos sólidos o cálculos conocidos como “piedras”. Por lo general, son inofensivos, pero pueden llegar a provocar molestias como dolor o cólico, náuseas e incluso inflamación, llegando a veces a ser necesaria la extirpación o colecistetomía. Prestar atención a la dieta es muy conveniente en estos casos para evitar estos síntomas y aliviar las molestias digestivas que se puedan derivar.
Los cálculos se clasifican según su composición. Destacan dos tipos principalmente:
Cálculos compuestos de colesterol : se forman por anomalías en el metabolismo de las sales biliares y del colesterol. Son los más frecuentes y suponen el 75% de los casos en los países occidentales. Estos cálculos son de color amarillo y su aparición está relacionada con la cantidad de grasa ingerida a través de la alimentación. Entre los factores de riesgo que se relacionan con su aparición destacan principalmente los que se denominan, en EEUU, como las 4 efes (The Four F): obesidad o sobrepeso (FAT), edad entorno a los 40 años (Forty), sexo femenino (Female) y edad fértil (Fertility). También favorecen la aparición de cálculos, la toma de anticonceptivos orales, la terapia hormonal con estrógenos, la herencia hereditaria, seguir dietas pobres en fibra y ricas en grasas o la pérdida brusca de peso. Además, algunas enfermedades están relacionadas con la aparición de cálculos (dislipemia por exceso de triglicéridos o bajo nivel de HDL” colesterol bueno”, diabetes mellitus o enfermedad de chron).
Cálculos compuestos de bilirrubina : se denominan pigmentarios y se forman por anomalías en el metabolismo de la bilirrubina (pigmento presente en la bilis). Se presentan cuando los glóbulos rojos se están destruyendo y hay demasiada bilirrubina en la bilis. Suponen el 25% restante de los casos en países occidentales.
Los factores de riesgo que se relacionan con su aparición son aún desconocidos por su complejidad, a menudo están relacionados con sobreinfecciones en la vesícula biliar y en los conductos biliares. Los cálculos pigmentarios no están relacionados con los hábitos alimentarios.
El papel de la dieta en caso de piedras en la vesícula
En ambos casos, las recomendaciones dietéticas que hacemos en consulta van dirigidas a favorecer el reposo del órgano y con ello evitar los síntomas agudos del cólico biliar y aliviar las molestias digestivas . Por tanto, la alimentación a seguir debe ser variada, pobre en grasas y colesterol, y fraccionada en cinco tomas diarias, de manera que se eviten las comidas copiosas ya que influyen en el desarrollo del episodio biliar. También se recomienda comer pausadamente y reposar después de las comidas para facilitar la digestión. Además, se aconseja:
Reducir la ingesta de grasa , teniendo en cuenta que las grasas vegetales crudas (aceite de oliva, y semillas como girasol, maíz y soja) se toleran mejor que las fritas y que las de origen animal (es muy importante limitar el aporte de colesterol). Para cocinar mejor optar por cocciones que añaden poca grasa y mejoran la digestibilidad de los alimentos (vapor, horno, plancha, salteado y rehogado con poco aceite)
Los hidratos de carbono deben ser fundamentalmente complejos (pan, pasta, arroz, maíz, avena) evitando al máximo los azúcares simples (azúcar de mesa, mermelada, miel) ya que se asocian a un mayor riesgo de cálculos biliares. Leer el etiquetado de los alimentos para evitar el azúcar oculto.
La dieta debe aportar una cantidad adecuada de fibra insoluble (salvado de trigo, arroz integral, pasta integral, pan integral) para evitar el estreñimiento y fibra soluble (fruta, legumbres y verduras) por su efecto hipocolesterolemiante (disminuyen la absorción de colesterol a nivel intestinal)
Reducir al máximo aquellos alimentos y bebidas que estimulan la contracción de la vesícula como los alimentos flatulentos o productores de gas (col, coliflor, coles de Bruselas, repollo, alcachofa, cebolla, pimiento crudo) y las bebidas con gas o carbonatadas.
También se aconseja evitar aquellos que estimulan las secreciones digestivas (café, té, mate, cacao), las bebidas alcohólicas y el zumo de naranja en ayunas porque provoca un vaciamiento brusco de la vesícula biliar.
En caso de estar en sobrepeso u obesidad se debe corregir la ingesta calórica de forma gradual para conseguir un peso saludable evitando el ayuno, por estar relacionado con una mayor incidencia de litiasis biliar.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Alimentos aconsejados y desaconsejados en caso de piedras en la vesícula
Para concretar las recomendaciones anteriores, recogemos en una tabla los alimentos que si están permitidos y aconsejados en caso de piedras en la vesícula porque suelen tolerarse bien y los que, por el contrario conviene consumir con moderación o evitar.
ALIMENTOS QUE SUELEN TOLERARSE BIEN
LECHE Y DERIVADOS
Leche descremada en pequeñas cantidades y aumentando progresivamente o sino bebidas vegetales (soja, almendra, avena o arroz)
Quesos frescos desgrasados (0% MG)
Yogur natural (sin azúcar añadido)
PURÉS y
SOPAS
Puré de patatas, patatas cocidas, al horno…
Puré de legumbres
Sopa de caldo vegetal, de tapioca, arroz blando, fideos o pasta
Papillas de harina de avena, de maíz, etc.
PASTA ALIMENTICIA
Tallarines, macarrones, fideos etc…refinados alternando con integrales
CARNES
Carnes no grasas: ternera, pollo sin piel, pavo sin piel, caballo, conejo,..
Jamón magro, poco salado o cocido, fiambre de pollo y pavo
PESCADOS
Pescado blanco: lenguado, merluza, pescadilla, rape, lubina etc., cocidos en agua, sazonados con un poco de aceite o limón, a la parrilla sin tostar en exceso o ligeramente rebozados con una capa de pasta
FRUTAS
Frutas maduras, asadas, cocidas o en forma de compota
VERDURAS Y HORTALIZAS
Todas en general. Se suelen tolerar mejor cocidas y en forma de puré. Evitar las más flatulentas (col, coliflor, repollo, coles de brusela, alcachofas, cebollas y pimiento en crudo)
PAN Y GALLETAS
Pan blanco, pan integral. Evitar recién horneado porque fermenta en el estómago y sienta mal
TIPOS DE COCCIÓN
Con poca grasa incorporada
Sin freír
Crudos, parrilla, hervidos, plancha sin tostar en exceso, vapor, papillote, salteado con poco aceite…
ESPECIAS
Siempre que no sean irritantes o picantes no hay problema
ALIMENTOS GRASOS QUE DEBEN TOMARSE CON MODERACIÓN
CARNES Y DERIVADOS
Se debe eliminar la grasa visible
Carnes grasas: cordero, cerdo, sesos…
PESCADOS
El pescado azul o pescado graso: debe vigilarse la cantidad
HUEVOS
La grasa está únicamente en la yema, se puede iniciar tomando tortilla de dos claras y una yema y observar tolerancia.
GRUPO DE ALIMENTOS GRASOS
El aceite crudo se tolera mucho mejor que el aceite de fritura que es desaconsejable. El aceite crudo debe repartirlo a lo largo de todo el día y no mucho a la vez. Se aconseja añadirlo una vez cocinado el alimento.
Los frutos secos grasos deben consumirse con moderación, 3-4 unidades pueden tomarse con ensaladas, como merienda… se desaconseja mucho de golpe.
El aguacate y las aceitunas también deben consumirse con moderación
ALIMENTOS GRASOS A EVITAR
Cacao (chocolate).
La leche entera y sus derivados. Todos los quesos, excepto los desgrasados (0%MG) contienen grasas y colesterol, por tanto están desaconsejados.
Embutidos grasos y preparados cárnicos
Marisco: el marisco es bajo en grasa pero está desaconsejado en un inicio por el nivel de colesterol. Se aconseja probar tolerancia individual porque suelen tolerarse bien. Los crustáceos (gambas, langostinos, cigalas, bogavantes y langosta) son los que tienen mayor cantidad de colesterol y se recomienda no aprovechar la cabeza porque es donde se encuentra la mayor parte del colesterol.
Las margarinas vegetales y las mantequillas están desaconsejadas.
Y también:
Alcohol: vinos fuertes y licores o destilados
Tabaco
Salsas, especias y picantes.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Artículo especializado
Qué es la Laparoscopia
El término laparoscopia procede del griego “laparo”, que significa abdomen, y “skopein”, que significa examinar. Es decir, la laparoscopia consiste en un examen visual de la cavidad abdominal . Aunque inicialmente fue desarrollada por los ginecólogos con fines diagnósticos, han sido los cirujanos los que la han orientado más a realizar tratamientos sobre diversas enfermedades.
La técnica se basa en introducir aire dentro de la cavidad abdominal para crear un espacio en el que se pueda trabajar. Para ello se hace una pequeña incisión a nivel del ombligo , se introduce un elemento plástico como un tubito, llamado trocar, y a través de él aire que hace expandir la cavidad. A través de este trocar se introduce un sistema óptico de visualización , es una cámara o endoscopio, conectada a un sistema de televisión externa que nos permite ver en directo lo que ocurre en el interior del cuerpo. Se realizan también varias puertas de entrada de pequeño tamaño por donde introducir el instrumental. Todas estas técnicas forman parte del concepto denominado en la actualidad cirugía mínimamente invasiva que consiste en realizar operaciones mayores a través de pequeñas incisiones , con sistemas de alta tecnología, y reduciendo al mínimo el traumatismo propio de la intervención.
A parte de toda esta tecnología también son necesarios diferentes instrumentos de trabajo. Se utilizan diversas pinzas de agarre, para sostener tejidos, tijeras, disectores, portas y agujas para realizar suturas… Los mismos elementos que se emplean en una cirugía convencional, pero de menores dimensiones. ¿Por qué son más pequeñas?, porque tienen que poder entrar a través de los trocares (instrumentos en forma de lápiz para proporcionar puertos de acceso durante la cirugía) ya que estos tienen un diámetro de pequeña envergadura.
Ventajas
Hoy día es considerada técnica de elección en muchos procedimientos por sus ventajas frente a la cirugía convencional. Estas ventajas frente a la cirugía abierta son varias:
Existe menos traumatismo de la pared abdominal, se debilitan menos los músculos abdominales y por eso son menores las apariciones de hernias.
Hay una disminución importante del riesgo de desarrollar de infección a nivel de las heridas sobre todo porque son más pequeñas.
Menos dolor después de la cirugía.
Todo ello contribuye a que la paciente esté menos tiempo ingresada, además se moviliza antes que, con una cirugía abierta, en general la recuperación postoperatoria suele ser más rápida y fácil.
Otra ventaja importante es que, al ser una cirugía poco invasiva, los órganos cercanos se manipulan mucho menos que en las cirugías convencionales, esto hace que haya menos irritación e inflamación y se evitan con mayor facilidad las adherencias.
Hay una ventaja estética evidente al no existir las grandes cicatrices que acompañan a la cirugía convencional, quedando reducidas a heridas menores de un centímetro en la gran mayoría de los procesos.
¿Es difícil la cirugía laparoscópica?
Es cierto que se necesita un mayor entrenamiento y especialización porque puede resultar una técnica más compleja , pero hoy en día en casi todos los hospitales se enseñan y se entrenan para este tipo de intervenciones quirúrgicas.
La cirugía laparoscópica puede ser empleada por varias especialidades quirúrgicas en las técnicas que realizan habitualmente:
Cirugía General y del Aparato Digestivo: cirugía de la vesícula biliar, cirugía del reflujo, cirugía de la pared abdominal (hernias), cirugía del esófago y del estómago, lo que incluye la cirugía de la obesidad mórbida, cirugía del colon y del recto, cirugía del apéndice, y cirugía del hígado, del páncreas y del bazo.
Urología: cirugía del riñón, cirugía de la glándula suprarrenal, cirugía de la próstata, cirugía de la vejiga urinaria, etc.
Ginecología: cirugía del útero, cirugía del ovario, cirugía de esterilización, etc.
Cirugía torácica: cirugía del pulmón, cirugía de la pleura, etc.
La tendencia actual de la cirugía es evolucionar hacia técnicas todavía de menos invasión . Así pues, se empieza a utilizar la cirugía laparoscópica de puerto único, es decir, a través de la incisión del ombligo se introduce un tubo con varios accesos sin necesidad de hacer otras incisiones en la piel. Otro avance un tanto curioso para la mayoría es la cirugía a través de orificios naturales (NOTES), esto quiere decir que no se hacen nuevos accesos para operar, sino que se utilizan los que ya tiene el cuerpo, por ejemplo, operar a través de la vagina, del recto o del estómago.
En conclusión, la cirugía evoluciona cada día junto con las nuevas tecnologías, hacia técnicas de menos invasión. Se puede decir que actualmente están demostradas las ventajas de la cirugía laparoscópica frente a la cirugía convencional en muchas técnicas de diferentes especialidades, siendo preciso un entrenamiento específico para el éxito de los procedimientos, el cual está cada vez más desarrollado en los distintos servicios quirúrgicos hospitalarios.

Artículo especializado
Balón Gástrico: Tratamiento, Beneficios y Contraindicaciones
Ante la epidemia del sobrepeso y la obesidad ( un 53% de la población adulta esté por encima de su peso ), las sociedades científicas han centrado sus esfuerzos en investigar diferentes métodos para el tratamiento de la pérdida de peso más allá de la intervención dietética, farmacológica o de cambios conductuales. Entre ellos, destacamos los procedimientos endoscópicos cuyo método más común es la inserción del balón intragástrico.
Entre los métodos para para el tratamiento de la obesidad debemos distinguir dos procedimientos, según la técnica utilizada:
Procedimientos quirúrgicos (cirugía bariárica)
Técnicas restrictivas (contribuyen a disminuir la ingesta de alimentos): gastroplastia, banda gástrica, manga gástrica, gastrectomía vertical.
Técnicas malabsortivas (contribuyen a disminuir la absorción de los alimentos): by-pass yeyunoileal.
Técnicas mixtas (contribuyen a disminuir tanto la ingesta como la absorción de alimentos): By-pass gástrico en Y de Roux, derivaciones biliopancreáticas.
Procedimientos endoscópicos
Balón o globo intragástrico (actúa produciendo ocupación o restricción de espacio en el estómago).
Balón ingerible, con los que no es necesario realizar una endoscopia (se introducen mediante una cápsula unida a un hilo que se hincha al llegar al estómago).
POSE (Primary Obesity Surgery Endolumenal): técnica endoscópica sin incisiones que reduce la capacidad volumétrica gástrica mediante la colocación de puntos de sutura. A diferencia del balón intragástrico, esta técnica está más indicada en casos de obesidad grave y se obtienen mejores resultados a largo plazo.
En este artículo nos centraremos en analizar los pros y contras de la implantación del balón intragástrico, así como la correcta elección de los beneficiarios de esta técnica.
¿Quién puede ser candidato al balón intragástrico?
Antes de elegir esta opción terapéutica para la pérdida de peso, hay que tener en cuenta los siguientes criterios de elección de los pacientes que son aptos:
Personas con obesidad (IMC entre 30 y 40) sin comorbilidades (más de una enfermedad al mismo tiempo) ni enfermedades metabólicas y que ya hayan intentado perder peso mediante otros tratamientos (dietético o farmacológico) sin éxito.
Personas con IMC a partir de 35 con comorbilidades que requieran esta técnica como paso puente a una cirugía bariátrica (reduciendo así el riesgo quirúrgico) o para mejorar sus enfermedades metabólicas asociadas.
Personas con obesidad cuya intervención quirúrgica está contraindicada por sus posibles complicaciones o cuando el paciente se niega a someterse a cirugía
Por el contrario, la implementación del balón intragástrico es un procedimiento contraindicado en los siguientes casos:
Personas que tienen un IMC superior a 40 (obesidad mórbida) o superior a 35 y que además presentan comorbilidades: en estos casos se requiere una cirugía bariátrica.
Personas con trastornos psicológicos y cognitivos graves .
Personas drogodependientes.
Personas que padecen enfermedades crónicas y graves (hepática, renal, cardiaca o pulmonar) o que hayan sido sometidas a otras cirugías por padecer reflujo gastroesofágico, hernia de hiato o úlcera duodenal y gástrica.
Procedimiento de colocación del balón intragástrico
En primer lugar, hay que tener en cuenta que esta intervención se realiza bajo anestesia general, tiene una duración de 20-30 minutos , no requiere de hospitalización y sólo puede ser realizada por un médico especialista en Endoscopia Digestiva.
En cuanto al proceso de intervención, primero se introduce un balón doblado de silicona resistente, pero flexible mediante endoscopia (de la boca hasta el estómago). Una vez en el estómago, se llena con 450-650 cc de suero fisiológico (ocupando entre el 40 y el 50% del volumen gástrico) y permanece flotando en el estómago por un periodo no superior a seis meses durante el cual se producirá una sensación de saciedad precoz tras la ingesta de alimentos.
Por último, una vez transcurridos los seis meses (o hasta un año en algunos tipos concretos de balones), se procede a la extracción del balón con una aguja de punción y un fórceps , retirándolo del estómago por endoscopia.
Beneficios y expectativas del balón intragástrico
Una de las ventajas de las técnicas endoscópicas (balón intragástrico) frente a la cirugía bariátrica es la disminución de riesgos y complicaciones , ya que se respeta por completo la anatomía gastrointestinal sin producir modificaciones irreversibles. Además, se trata de una técnica con una óptima eficacia sólo a corto plazo: se puede perder hasta un kilo por semana según la situación de cada paciente, aunque esta pérdida se puede revertir (es muy frecuente recuperar el peso perdido a largo plazo) si el paciente no realiza una correcta educación nutricional durante los meses que lleva el balón.
Complicaciones del balón gástrico
Las complicaciones de esta técnica son mínimas y, en caso de haberlas, se dan lugar durante el proceso de implantación y retirada del balón:
En la implantación, pueden darse complicaciones en la endoscopia, entre ellas: irritación de la mucosa estomacal o gastritis , úlceras o perforaciones.
En la retirada, también se pueden dar acumulaciones de fibra alrededor del balón, hecho que dificulta su extracción.
Además, hay que tener en cuenta que pueden aparecer ciertos efectos secundarios de carácter transitorio, sobre todo en las primeras 48-72 horas tras la colocación del balón: náuseas, vómitos, sensación de plenitud y dolor epigástrico.
La importancia de la reeducación alimentaria post-intervención
Tal y como hemos comentado, la implantación del balón intragástrico debe ser un “impulsor” para producir una pérdida de peso a corto plazo ya que son múltiples los estudios que concluyen que esta técnica no implica una mayor pérdida de peso a largo plazo en comparación con un tratamiento convencional para la obesidad (dieta y ejercicio).
Por eso, debido a su carácter temporal, el uso del balón intragástrico debe ir acompañado siempre de un cambio de hábitos de forma definitiva, para poder mantener la pérdida de peso conseguida una vez retirado el balón
En resumen, el éxito de esta intervención radica en la motivación del paciente para realizar cambios permanentes en sus hábitos de alimentación y ejercicio durante y después de la implementación del balón gástrico.

Artículo especializado
Operación de Apendicitis
¿Te preocupa no saber identificar un posible caso de apendicitis en tu hijo? Te vamos a dar unas pautas orientativas. El dolor abdominal agudo es uno de los motivos que con más frecuencia origina consultas en los Servicios de Urgencias Pediátricas todos los días, y precisamente la apendicitis es la enfermedad quirúrgica más frecuente en los niños con dolor abdominal.
La apendicitis aguda es la inflamación aguda del apéndice vermiforme (una prolongación en forma de fondo de saco situada en el margen derecho del colon). Es un divertículo de función desconocida, aunque la presencia de tejido linfoide (inmunitario) en su anatomía sugiere que ejerce un papel en el sistema inmune o de defensa.
¿Hay diferentes grados?
Los grados de la enfermedad se clasifican del siguiente modo:
Apendicitis leve: es la apendicitis aguda inflamada en ausencia de perforación, gangrena o absceso (infección encapsulada).
Apendicitis moderada: es la apendicitis aguda inflamada con gangrena, perforación o con presencia de absceso periapendicular (colección purulenta encapsulada). También incluye aquellas apendicitis con abundante líquido libre seroso-purulento en la cavidad abdominal.
Apendicitis grave: es el denominado plastrón apendicular (una especie de masa de tejidos abdominales adheridos) o la peritonitis apendicular (infección generalizada de la cavidad abdominal).
Causas y factores de riesgo
La causa fundamental de la apendicitis aguda es la obstrucción de su luz apendicular. Ésta puede ser provocada por un fecalito-apendicolito (“piedra” de heces), un parásito o un cuerpo extraño ingerido . Ello ocasiona un aumento de la secreción mucoide en su interior, aumento de la presión intraluminal y la consiguiente distensión de su pared, provocándose con ello que se inhiba el drenaje venoso primero, y después el arterial, apareciendo entonces isquemia (falta de oxígeno) y proliferación secundaria bacteriana. Puede llegar a la perforación.
Algunos factores de riesgo para padecer apendicitis son los siguientes:
Historia familiar de apendicitis.
Género masculino.
Edad entre 10-30 años.
Dieta pobre en fibra.
Consumo abundante de hidratos de carbono refinados.
Infección parasitaria tipo amebiasis.
Signos y síntomas de la apendicitis
Los más típicos son.
Dolor abdominal: suele ser el primer síntoma. Se trata de un dolor continuo y moderado, que aumenta progresivamente de intensidad, localizado en un primer momento alrededor del ombligo y que después se desplaza y localiza en el margen inferior derecho abdominal. El dolor empeora con la tos o al saltar. El peristaltismo (los ruidos intestinales) está disminuido. A la palpación abdominal suele haber una reacción de defensa involuntaria en el paciente, con dolor de rebote (por ejemplo, al saltar).
La anorexia (pérdida de apetito) y los vómitos suelen aparecer después del inicio del dolor abdominal. Los vómitos no suelen ser numerosos e, incluso, puede ser que no se presenten.
Fiebre: en las fases tempranas, se puede estar afebril o con febrícula (temperatura de 37’5ºC). La fiebre elevada sugiere posibilidad de perforación o de complicación.
El niño suele permanecer inmóvil y en postura antiálgica (en aquella postura que siente menos dolor). Al andar, lo hacen despacio e inclinados hacia el lado derecho.
Cabe destacar que los síntomas típicos sólo se presentan en un tercio de los casos y, especialmente, en niños más mayores. En menores de tres años, la presentación clínica, la mayoría de veces, es atípica, por lo que el diagnóstico frecuentemente es tardío.
Diagnóstico
Requiere de una entrevista médica y un examen clínico muy cuidadosos y meticulosos. En los casos de presentación atípica puede ser conveniente solicitar exámenes de laboratorio y de imagen para apoyar el diagnóstico.
Analítica de sangre: evidencia signos de activación leucocitaria (células de defensa) y de inflamación (por ejemplo, PCR -proteína C reactiva-).
Rx simple de abdomen: suele ser normal. En un 10% de los casos permite visualizar una imagen radiopaca compatible con un apendicolito (“piedra” que obstruye el apéndice).
Ecografía abdominal: es la prueba de imagen de elección cuando el estudio clínico es dudoso.
TAC (tomografía axial computerizada): provoca irradiación del paciente y un coste más elevado, por lo que se reserva para casos de duda diagnóstica después de la ecografía.
El diagnóstico diferencial se realizará con patologías, también de localización abdominal, como las siguientes.
Gastroenteritis aguda: en esta patología, el vómito precede al dolor abdominal, que se presenta como un cólico intermitente y que se acompaña de diarrea. El dolor abdominal cede momentáneamente cuando se emiten las deposiciones.
Estreñimiento crónico: si existe duda de la existencia de una posible apendicitis no debe administrarse ningún enema laxante.
Adenitis mesentérica: cuadro clínico en el que se produce una inflamación de los ganglios linfáticos abdominales, generalmente reactiva a una infección viral. En ella, al dolor abdominal le precede un cuadro viral respiratorio y éste no es localizado, sino difuso.
Patología ginecológica (torsión de ovario, quistes, ovulaciones dolorosas, enfermedad inflamatoria pélvica, endometriosis, abortos, embarazos…): ante la duda diagnóstica debe practicarse una ecografía pélvica.
Tratamiento
En un primer momento se aplicarán medidas de apoyo que mejoren el estado general del paciente, lo que se conseguirá mediante la administración de líquidos endovenosos adecuados al nivel de deshidratación, así como tratamiento para controlar el dolor, y tratamiento antibiótico .
El tratamiento definitivo es quirúrgico. El abordaje quirúrgico para la extirpación del apéndice enfermo (intervención denominada apendicectomía) puede realizarse por vía abierta (laparotomía, accediendo directamente a la cavidad abdominal tras su apertura) o por vía laparoscopia. El tipo de operación a realizar será elección del cirujano según cada caso. No se han evidenciado diferencias en el riesgo de complicaciones entre ambos procedimientos. No se recomienda la colocación de drenajes peritoneales postquirúrgicos. Se podrá proceder a la reintroducción de la alimentación por vía oral una vez los efectos de la anestesia se hayan resuelto.
En la actualidad, el uso de antibióticos como tratamiento único de la apendicitis no se recomienda.
¿Puede haber complicaciones?
Algunas de las complicaciones postoperatorias posibles pueden ser la aparición de un absceso intraabdominal o la infección de la herida quirúrgica , que serán tratados con la pauta antibiótica conveniente a cada caso. Otro ejemplo serían las obstrucciones intestinales, que requerirán también de un tratamiento quirúrgico.
No tiene por qué quedar ninguna secuela y la mortalidad derivada de esta enfermedad, afortunadamente, es casi inexistente en nuestro medio en la actualidad.

Artículo especializado
Qué Debes Saber Sobre la Colonoscopia
Ante una colonoscopia es normal que nos asalten algunas dudas, tanto sobre la intervención como sobre la preparación previa, en cuanto a dieta, que debe seguirse. Antes de nada, es conveniente recordar que la colonoscopia es una prueba médica segura y eficaz para examinar el revestimiento del colon y el recto, y tratar enfermedades del intestino grueso (colon). Para afrontar la prueba con la máxima tranquilidad, es importante que sigas las instrucciones y recomendaciones de tu médico. Aquí te explicamos en qué consiste, por qué suele solicitarse y cómo puedes prepararte.
Cómo se realiza
La prueba se realiza por medio del colonoscopio, instrumento tubular largo y flexible de 1 cm de diámetro y entre 122 y 183 cm de largo. Dispone de una luz y una pequeña cámara de video en su extremo cuya imagen se ve a través de un monitor. El colonoscopio se introduce por el orificio anal y se puede hacer avanzar por todo el colon para explorarlo, realizar biopsias y extirpar posibles pólipos.
La mayoría de las colonoscopias las efectúa un gastroenterólogo (médico especialista en enfermedades digestivas) de manera ambulatoria con un mínimo de incomodidad y molestias.
Motivos para realizar una colonoscopia
Los motivos más frecuentes por los que se puede solicitar una colonoscopia son:
Como prueba de cribado del cáncer de colon .
Especialmente en aquellas personas con antecedentes familiares de un cáncer de colon o en mayores de 50 años.
Como estudio de episodios de sangrados por el recto (rectorragias) o tras la aparición de sangre en las heces.
Para estudiar una diarrea crónica.
En casos de anemia ferropénica (por falta de hierro) cuando se sospecha que se debe a un sangrado crónico por el colon.
En casos de pérdida de peso inexplicada y brusca que pueda hacer sospechar de un cáncer de colon.
Para diagnosticar y controlar una enfermedad inflamatoria intestinal como la enfermedad de Crohn o la colitis ulcerosa .
En el estudio del dolor abdominal crónico.
Cómo prepararse para una colonoscopia
Para realizar una colonoscopia es necesario que el intestino esté bien limpio de restos fecales. Para ello, el médico recetará una solución laxante fuerte que ayudará a vaciar los intestinos antes del procedimiento. Además de la solución de preparación, hay otras medidas alimentarias que se deben seguir los días previos a la intervención. A continuación, te damos más detalles.
La dieta tres o cuatro días antes de la colonoscopia
Se debe comenzar una dieta baja en residuos por lo menos unos cuantos días antes de la colonoscopia. Los alimentos bajos en residuos minimizan los desechos sólidos que permanecen en el colon. Cuanto más nos vayamos acercando al día de la intervención más restrictiva tiene que ser la ingesta de alimentos con residuo.
Alimentos a evitar: ensaladas, verduras, legumbres, fruta, patatas (fritas o guisadas), carnes y pescados en salsa, embutidos, bollería, grasas, bebidas con gas, lácteos enteros, quesos grasos, productos integrales, chocolate, pasteles y frutos secos.
Alimentos permitidos: leche y yogur natural desnatados, queso fresco, pan blanco o tostado (no integral), galletas sencillas (no integrales), caldos o consomés sin verduras, arroz y pastas no integrales, carnes y pescados blancos a la plancha o cocidos, patatas hervidas (en puré o cocidas sin piel), membrillo, melocotón en almíbar, manzana o pera cocida o asada (sin piel), zumos, bebidas sin gas, café, té e infusiones ligeras.
La dieta el día antes
El día antes de la intervención la dieta cambia. El facultativo receta unas preparaciones en forma de soluciones laxativas para ayudar a la limpieza del colon. Se limita la ingesta de alimentos sólidos al menos unas tres o cuatro horas antes de la limpieza intestinal. Al tomar la solución de preparación, se deberá seguir una dieta de líquidos claros para asegurar que el colon esté completamente limpio en el momento de la colonoscopia. No se podrá consumir ningún alimento sólido a partir de este momento. En cuanto a los líquidos claros, no tienen que ser transparentes, pero deben evitarse líquidos rojos o morados, ya que pueden confundirse equivocadamente con sangre durante la colonoscopia. También debe evitarse el alcohol y los líquidos claros que contienen pulpa.
Al tomar la solución de preparación para la colonoscopia, el cuerpo puede perder mucho líquido, ocasionando una deshidratación. Es importante que se beban líquidos claros durante todo el proceso de preparación para mantener el cuerpo bien hidratado.
Los líquidos claros aceptables incluyen:
Agua.
Hielo.
Caldos claros, como de pollo o carne.
Jugo de fruta sin pulpa.
Té o café (sin leche ni cremas).
Gelatina de frutas (excepto roja o morada).
La dieta el día de la colonoscopia
El día de la colonoscopia se deben dejar de tomar líquidos claros unas cuatro horas antes de la prueba, excepto la mínima cantidad de agua para la toma de la última solución correspondiente que haiga pautado el especialista.
La duración de la prueba depende de las manifestaciones que se vayan produciendo, pero generalmente no suele durar más de 60 minutos. La prueba se realiza habitualmente con sedación, por este motivo, el médico indicará durante cuánto tiempo no se debe conducir ni manejar maquinaria peligrosa. Salvo que se indique algo diferente, después se puede realizar vida normal siguiendo una dieta habitual. También será conveniente que se beba suficiente líquido, al menos un litro de agua durante el resto del día de la intervención para compensar la deshidratación del día.

Artículo especializado
Cuándo se Indica una Abdominoplastia
Tener un abdomen plano y tonificado es el sueño de muchas mujeres. Los cambios de peso, los embarazos… hacen estragos en esta zona, que tiende a acumular grasa, y se vuelve flácida con el paso del tiempo. Para mejorar la apariencia del abdomen , los cirujanos plásticos cuentan con una técnica efectiva, la conocida como abdominoplastia. Conozcamos más acerca de ella.
¿En qué consiste?
La reducción de abdomen, cirugía abdominal o abdominoplastia es un procedimiento quirúrgico estético realizado para mejorar la apariencia de aquellos abdómenes que han estado sometidos a embarazos múltiples, daños en la piel, excesos grasos, flacidez y hernias de la pared. Durante una reducción de abdomen, el exceso de la piel se extrae, junto con la grasa . Es un procedimiento que se puede combinar con otros procesos, como la liposucción. Los tejidos de mayor flacidez se refuerzan con suturas, para dar mayor tonicidad al nuevo abdomen, junto con la piel restante, la cual es reubicada. El procedimiento debe realizarse por un cirujano plástico certificado, y puede realizarse tanto en hombres como en mujeres.
¿Cuándo se indica?
Un abdomen flácido es el resultado tanto de la acumulación de grasa, como de la pérdida de tensión de la banda muscular interna que mantiene tejidos y órganos en su lugar. Esto, sumado a un estilo de vida sedentario, junto con las ganancias y fluctuaciones de peso, y a la debilidad que presenta la pared abdominal tras cada embarazo, implican un mayor debilitamiento de los tejidos con el paso de los años.
Se puede realizar una abdominoplastia si existe exceso de piel en la llamada zona periumbilical, si existe una deformidad por el exceso de grasa en determinadas áreas (que se han ido depositando a lo largo de los años, con la influencia de las alteraciones de peso, y de los cambios hormonales del organismo). También puede realizarse tras una liposucción que ha sido incompleta, en los efectos esperados tanto para la paciente, como el profesional; y ante cicatrices posteriores a cesáreas múltiples, que se encuentren retraídas, y generan incomodidad estética.
¿Contraindicaciones?
Es un procedimiento que está contraindicado realizarlo en pacientes con diabetes e hipertensión no controlada, así como en personas con un Índice de Masa Corporal (IMC) mayor a 30 , que no hayan sido sometidos a un by-pass gástrico de pérdida de peso. Por otro lado, tampoco se indica si una mujer desea quedarse embarazada pronto (ya que el debilitamiento de los tejidos será una complicación si en el futuro quiere someterse de nuevo a esta intervención). Estados infecciosos de la piel, alteraciones de la coagulación, estados de enfermedad sistémica, entre otros, también contraindican el procedimiento.
¿Tiene riesgos?
Los riesgos que se pueden presentar luego de una abdominoplastia son :
Irregularidades del contorno corporal.
Presencia de seromas (acumulaciones liquidas), que aparecen debido al levantamiento de los tejidos. Para controlarlos, se dejan dos o más drenajes, que se retiran en los días posteriores a la cirugía. La compresión mediante fajas ayuda a que disminuya su producción.
Presencia de hematomas y de infecciones, por lo cual la paciente debe hacer un reposo de esfuerzo al menos los primeros 15 días tras la cirugía, tomar antibióticos, mantener las heridas limpias y secas, y controlarse con su cirujano semanalmente.
Malas cicatrizaciones de la herida, o aberturas. Debe indicarse el uso de faja obligatoria para evitarlo.
Alteraciones en la sensibilidad de la piel, que mejora en los meses siguientes a la cirugía.
Todas las personas que deseen realizarse este procedimiento deben ser evaluadas de forma individual, estableciendo con el cirujano las expectativas que tienen y las realidades a las que se podrán acercar. Siempre se debe dejar de fumar, al menos tres semanas antes de la cirugía; evitar medicamentos coagulopáticos, que incrementen el sangrado (como la aspirina); no realizar esfuerzos ni levantar peso durante los primeros 10 días posteriores; y no realizar ejercicios abdominales hasta pasados dos o tres meses.
¿Cómo se realiza?
Es un procedimiento que se realiza en quirófano bajo anestesia general , lo cual permite una máxima relajación de los músculos. A lo largo de la primera semana, la paciente deberá dormir inclinada, para que no se produzca tensión en las suturas internas, así como utilizar analgesia para el dolor, y antibióticos para disminuir la posibilidad de infección. Los primeros seis meses la inflamación bajará hasta lograr un efecto de mejoría total entre el año y el año y medio posterior a la cirugía.
Aconsejo a todas mis pacientes que, aunque los resultados de la cirugía sean duraderos, continúen con un estilo de vida saludable que les permita mantenerse en el peso deseado, para evitar futuras complicaciones.
Contenidos sobre enfermedades
Somos conscientes de que los conceptos médicos pueden resultar confusos si no te los explican con claridad. Para evitar esto, le hemos pedido a nuestros profesionales que preparen estas fichas en donde podrás acceder a información relevante sobre enfermedades que te ayudará a entender de una manera sencilla por qué se producen y por qué es necesario su tratamiento.
Ver todas las enfemedades 
Enfermedad
Litasis Biliar
¿Qué es la litiasis biliar ?
La litiasis biliar es la formación de cálculos, o piedras, en la vesícula biliar o en los conductos por donde se excreta la bilis hacia el intestino . Estos cálculos pueden ser de colesterol, de ácido úrico o de calcio.
Tipos de litiasis biliar
Existen diferentes tipos de litiasis biliar:
Litiasis biliar de colesterol : supone hasta el 75 % de los casos de litiasis biliar, es por tanto la causa más frecuente de los mismos. El colesterol precipita cuando disminuye las sales biliares o cuando aumenta el nivel de colesterol, suelen presentarse en número de 1 a 3, redondeados, de color amarillento, y su tamaño puede llegar a 2 centímetros.
Cálculos pigmentarios : se forman a partir de la precipitación de la bilirrubina, llegan a producir hasta un 25 % de los casos. Si son de color negro, se dan en enfermos cirróticos, los cálculos de color marrón se dan en las enfermedades hemolíticas (destrucción de los hematíes), suelen aparecer en mayor número que los de colesterol, hasta más de 5, y con frecuencia producen inflamación en la vesícula.
Litiasis de carbonato calcio : son muy poco frecuentes, y su aspecto es blanquecino, raramente causan inflamación en la vesícula.
Causas de la litiasis biliar
Las causas de la litiasis biliar están relacionadas con la alteración de la composición de la bilis , produciendo un aumento de las sustancias, que precipitan dando lugar a la litiasis.
En el caso del colesterol, se produce un aumento del mismo respecto a las sales biliares, provocando que el colesterol precipite y aparezca la litiasis biliar.
En los casos de los cálculos pigmentarios, se producen por el aumento de la bilirrubina. En los pacientes cirróticos es debido al mal funcionamiento del filtro hepático. En enfermedades hemolíticas, se produce por una mayor destrucción a lo normal de los hematíes, originando un aumento de la bilirrubina que hace que se precipite la misma.
Síntomas de la litiasis biliar
El síntoma principal de la litiasis biliar es el cólico biliar, en él se produce un dolor intenso en la zona derecha del abdomen, bajo las costillas, que se suele acompañar de náuseas y vómitos, que pueden ser intensos. Y, en algunas ocasiones, se produce una infección conocida como colecistitis que precisa de ingreso hospitalario para tratarla.
A veces, la piedra se mueve y produce una obstrucción del conducto, en este caso, el paciente además de dolor presenta ictericia, es decir, color amarillento de la piel. Esta obstrucción puede afectar al conducto del páncreas dando lugar a una pancreatitis como complicación de este proceso.
Tratamiento de litiasis biliar
El tratamiento de la litiasis biliar puede ser:
farmacológico, que pretenden disolver el cálculo. Se suministran sales biliares orales, deben ser cálculos de colesterol de menos de 1 centímetro de tamaño y con una actividad vesicular normal.
CPRE o colangiopancreatografía retrógrada endoscópica, se trata de disolver el cálculo o extraerlo mediante la canalización del colédoco. A través de una endoscopia se inyecta una sustancia que lo disuelve, debe ser un cálculo único y de pequeño tamaño.
Colecistectomía, es la exéresis (extracción) de la vesícula mediante cirugía mayor, puede ser realizada por medio endoscópico o por cirugía abierta, en ambos casos se retira la vesícula del paciente con los cálculos en su interior.
Pruebas complementarias de la litiasis biliar
La prueba complementaria más en uso en el momento actual para la detección de una litiasis biliar, es la ecografía . Prácticamente han quedado relegadas otras pruebas diagnósticas como la colangiografía, en la cual se introduce un contraste por vía oral que se deposita en la vesícula, realizando radiografías de la misma, o la colangiografía percutánea transhepática, en la que el contraste se inyecta a través de una punción abdominal.
Factores desencadenantes de la litiasis biliar
Son factores desencadenantes de la litiasis biliar las alteraciones en la dieta con consumo excesivo de grasa, provocando un aumento del colesterol.
También puede producirse por el exceso de consumo de alcohol, conllevando a una cirrosis en el paciente y provocando una alteración de la bilirrubina que producen cálculos biliares.
Factores de riesgo de la litiasis biliar
Son factores de riesgo para la litiasis biliar la multiparidad, la obesidad y el consumo de píldoras anticonceptivas.
Complicaciones de la litiasis biliar
La complicación más frecuente de la litiasis biliar es la colecistitis, que se produce cuando la obstrucción del conducto produce una infección en la zona de la vesícula.
La siguiente complicación en frecuencia es la pancreatitis, que es producida como consecuencia de la obstrucción del conducto de salida del páncreas, por una litiasis biliar, causando dolor en la zona, acompañado de vómitos y malestar general.
Prevención de la litiasis biliar
La prevención de litiasis biliar consiste en evitar la obesidad, realizar una dieta rica en frutas y verduras, pobre en grasas y sin consumo de alcohol.
Especialidades a las que pertenece
Las especialidades a las que pertenece la litiasis biliar es la de digestivo y cirugía general . Los especialistas en digestivo controlan los procesos de cólicos biliares o colecistitis, y los cirujanos, la exéresis de la vesícula biliar si es necesaria.
Preguntas frecuentes
¿ Cómo saber si tengo problemas de vesícula ?
La vesícula biliar no siempre produce síntomas, a veces, dolores abdominales asociados a vómitos o diarreas pueden hacer sospechar de padecer problemas en la vesícula . Lo mismo ocurre cuando aparece la clínica de un cólico biliar, la única forma de llegar a un diagnóstico certero es la realización de una ecografía de abdomen.
¿ Cuál es el signo de Murphy ?
El signo de Murphy forma parte de la exploración abdominal . Este es positivo cuando al realizar una inspiración profunda seguido de una espiración, en cuyo momento se introduce la mano bajo las costillas, produce dolor por el choque contra la vesícula.
¿ Qué pasa cuando uno vomita bilis ?
El vómito de bilis se produce cuando hay una descarga de bilis hacia el intestino sin alimento. Se vomita una sustancia que se conoce como vómitos de bilis, no es más grave que un vómito normal, pero este es de color verde. Puede ser un efecto secundario de la exéresis de la vesícula.
¿ Cuál es la importancia de la vesícula biliar ?
La importancia de la vesícula biliar es el mantenimiento de las sales biliares producidas en el hígado , hasta el momento que son necesarias para la digestión de los alimentos. Estos, al llegar al intestino, desencadenan la secreción de la sustancia acumulada en la vesícula.
¿ Qué causa el reflujo ?
El reflujo es causado por la falta del cierre del esfínter esofágico inferior de forma adecuada. Al contraerse el estómago, parte del alimento y de los jugos gástricos, suben a través del esófago originando el reflujo gastroesofágico.
Enfermedad
Quiste Pilonidal
¿Qué es el quiste pilonidal?
El quiste pilonidal es un saco cerrado de carácter membranoso que se forma alrededor de un folículo piloso, en cuyo interior, se encuentra pelo, de ahí su nombre de pilonidal. En la mayoría de ocasiones, su localización más frecuente es en la zona del pliegue interglúteo , aunque también se puede formar en otras localizaciones como las axilas, el ombligo y la zona de las ingles.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Tipos de quiste pilonidal
Existen dos tipos de quiste pilonidal:
Quiste pilonidal agudo: se produce un absceso de forma rápida que drena hacia el exterior.
Quiste pilonidal crónico: se produce una fistulización con drenaje que permanece en el tiempo.
Causas del quiste pilonidal
El quiste pilonidal se produce cuando el vello penetra debajo de la piel , dando lugar a una reacción del tejido subcutáneo que lo considera una sustancia extraña, provocando una reacción inflamatoria a su alrededor.
Síntomas del quiste pilonidal
Los síntomas que se presentan son enrojecimiento, inflamación y dolor de la zona afectad a, también puede aparecer infección en torno a ella, produciendo un absceso con pus en su interior. Este pus puede drenar hacia la parte exterior de la piel por los diversos orificios que tiene.
En algunos casos, aunque no de forma frecuente, el paciente puede tener fiebre cuando el quiste se infecta, pero en la mayoría de ocasiones, el paciente refiere dolor intenso que le impide sentarse.
Tratamiento del quiste pilonidal
El tratamiento del quiste pilonidal es diferente según la fase en que se encuentre. Cuando está abscesificado, puede ser necesario el drenaje del mismo, para ello, el cirujano, tras inyectar una mínima cantidad de anestesia local, realiza una apertura del quiste para conseguir el drenaje correcto del mismo. Suele ser recomendable tomar antibiótico para disminuir la infección, tanto antes de la cirugía como tras ella .
En los casos de fistulización crónica, se realiza una cirugía más compleja, en la que se procede a abrir el quiste, retirando todo el contenido de su interior y la membrana que lo recubre. En la mayoría de ocasiones, la herida se deja abierta hasta conseguir la cicatrización de la misma lo que puede demorar el proceso hasta 3 meses, precisando curas diarias durante este tiempo. Esta cicatrización es conocida como de segunda intención, hace que las recurrencias sean menos frecuentes.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Pruebas complementarias del quiste pilonidal
Para el diagnóstico del quiste pilonidal no es necesario realizar pruebas diagnósticas, es un diagnóstico clínico.
Para la realización de la cirugía, es necesario analítica de sangre con recuento celular , radiografía de tórax y electrocardiograma, junto con la visita al anestesista.
A veces, puede ser necesario realizar una ecografía o TAC antes de la cirugía que permita conocer la extensión del quiste.
Factores desencadenantes del quiste pilonidal
El factor desencadenante del quiste pilonidal parece ser la introducción de un pelo hacia el interior del tejido subcutáneo , dando lugar en este a una reacción inflamatoria al percibirlo como cuerpo extraño.
Factores de riesgo del quiste pilonidal
Los factores de riesgo del quiste pilonidal, además del exceso de vello en la zona, son los traumatismos que se puedan producir en la zona. Esto hace que sean más frecuentes en personas que conduzcan o realizan ciclismo. La obesidad también es un factor de riesgo para el quiste pilonidal .
Complicaciones del quiste pilonidal
La complicación más frecuente del quiste pilonidal es la infección con formación de absceso , dicha infección puede producir fiebre, aunque es poco frecuente.
Prevención del quiste pilonidal
La prevención del quiste pilonidal es evitar, en la medida de lo posible, los traumatismos sobre la zona del coxis. Y, en aquellos pacientes con mucho vello, el tratamiento con depilación láser puede ser eficaz para evitar los quistes pilonidales .
Especialidades a las que pertenece
La especialidad a la que pertenece el quiste pilonidal es la cirugía general .
También, en los casos que no necesitan cirugía, puede ser controlado por el médico de familia, quien puede pautar un tratamiento antibiótico si es necesario.
Preguntas frecuentes
¿Qué médico trata el quiste pilonidal?
El médico que controla y trata el quiste pilonidal es el cirujano general, este médico se encarga de la exéresis (extracción) de los quistes, decidiendo la técnica quirúrgica más beneficiosa para el paciente.
En algunos casos, puede decidir el drenaje del absceso, la extirpación del quiste con cierre de la herida con puntos o, en otros casos, la exéresis del proceso, dando lugar a un cierre por segunda intención lo que lleva a una recuperación más lenta, pero con menos recurrencias del proceso .
¿Qué es el quiste pilonidal del coxis?
El quiste pilonidal de coxis es el quiste que se produce por la introducción de un pelo en la zona del coxis . Es el quiste pilonidal más frecuente y se cree que está relacionado con traumatismos repetidos sobre la zona, siendo más frecuente en personas que permanecen mucho tiempo sentadas, conduciendo o que practican ciclismo.
¿Qué antibiótico puedo tomar para el quiste pilonidal?
Son varios los antibióticos que se pueden tomar para tratar un quiste pilonidal, entre ellos, la cloxacilina, la amoxicilina, la amoxicilina con clavulánico y la clindamicina.
No se debe tomar antibiotico nunca sin la prescripción de un médico, el uso indebido de los antibióticos produce resistencias bacterianas que se convierten en un problema de salud pública muy importante.
¿Cuánto tarda en cicatrizar un quiste pilonidal?
El quiste pilonidal puede tardar en curar desde unos días a meses, dependiendo de la circunstancia.
En los casos agudos con drenaje espontáneo puede durar unos 15 días.
Cuando se realiza un drenaje quirúrgico del mismo, las curas pueden demorarse hasta 3 semanas.
Cuando se realiza exéresis con cierre por segunda intención , el periodo de curas puede ser de hasta 3 meses.
¿Cómo eliminar un quiste pilonidal sin cirugía?
El quiste pilonidal no se puede eliminar sin cirugía cuando es una situación crónica , solo en el caso de procesos agudos puede eliminarse mediante tratamiento antibiótico.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.

Enfermedad
Síndrome de Cushing
¿Qué es el síndrome de Cushing?
El síndrome de Cushing o hipercortisolismo, es la enfermedad que se produce por exceso de cortisol , ya sea por producción excesiva de las glándulas suprarrenales del enfermo, o por efecto yatrógeno, esto quiere decir, como consecuencia secundaria de la administración de fármacos para tratamientos. También hay tumores neuroendocrinos que pueden producir una sustancia similar al cortisol que puede dar lugar a este síndrome. Es un síndrome muy poco frecuente que se producen de entre 35 a 40 casos por cada millón de personas, y se considera una enfermedad grave.
Tipos de síndromes de Cushing
Los tipos de síndrome de Cushing son:
Síndrome de Cushing ACTH (Hormona AdenoCorticoTropa): dependiente, se produce por tumores en la hipófisis o por tumores que provocan que se segregue esta hormona.
Síndrome de cushing ACTH independiente : se produce por tumores suprarrenales o hiperplasia suprarrenal yatrogénicos .
Causas del síndrome de Cushing
La causa es el trastorno hormonal que produce un aumento de cortisol o la toma de manera mantenida de medicamentos que contienen corticoides por enfermedades de origen inflamatorio.
Síntomas del síndrome de Cushing
Son síntomas de síndrome de Cushing: obesidad central, cara de luna llena ( cara redondeada ), acné , hipertensión arterial, diabetes , dolor de espalda , alteraciones en el ciclo menstrual , hirsutismo , impotencia en los varones, aumento de la sed , aumento de la micción , debilidad muscular , estrías de color vino, hematomas frecuentes, debilidad , irritabilidad , depresión , ansiedad y la alteración de la autoestima .
Tratamiento para el síndrome de Cushing
El tratamiento del síndrome de Cushing debe estar enfocado a reducir el nivel de cortisol.
Cuando el nivel de cortisol esté elevado por una causa yatrogénica , esto es, por ingerir medicamentos, el médico desciende la dosis de manera paulatina. Si esto no es posible, se intentará que el paciente consuma la menor dosis posible y se establecerá una vigilancia estrecha de este.
Si la causa es un tumor en la glándula hipofisaria, el médico indicará tratamiento quirúrgico, radioterapia o quimioterapia, según sea necesario.
Cuando la producción se debe a un tumor suprarrenal , el médico indicará un tratamiento quirúrgico para extraer el tumor. Si el tumor no puede extraerse se tratará de bloquear la acción de la hormona mediante medicamentos.
Pruebas complementarias para el diagnóstico del síndrome de Cushing
Las pruebas complementarias para el diagnóstico del síndrome de Cushing consisten en técnicas para medir la cantidad de cortisol:
Análisis de orina de 24 horas.
La prueba de supresión se dará 1 mg. de Dexametasona y se mide el cortisol a las 24 horas. Se puede hacer con 2 mg. de Dexametasona y haciendo la tasación de cortisol a las 48 horas, en ambos casos se realiza sobre sangre venosa ,
Se realizarán también pruebas de imagen, ya sean ecografías, tomografías o escáneres para valorar tanto las glándulas suprarrenales como la hipófisis .
Factores desencadenantes del síndrome de Cushing
El principal factor desencadenante es el exceso de cortisol .
Factores de riesgo del síndrome de Cushing
El principal factor de riesgo para el síndrome de Cushing es la toma indiscriminada de fármacos corticoides de forma diaria.
Complicaciones del síndrome de Cushing
Diabetes mellitus.
Hipertensión arterial.
Disfunción eréctil.
Hirsutismo: desarrollo de vello en cantidad mayor de lo normal.
Depresión.
Ansiedad.
Insomnio.
Alucinaciones.
Ideas paranoides.
Pérdida de memoria.
Prevención del síndrome de Cushing
No tomar fármacos corticoides sin control médico .
Especialidades a las que pertenece el síndrome de Cushing
El especialista en el control del síndrome de Cushing será el especialista en endocrinología . En cuanto al tratamiento, este será responsabilidad, tanto del endocrinólogo, como del cirujano general en los casos de tumores en las glándulas suprarrenales que deben ser extirpados, o bien neurocirujanos en el caso de alteraciones en la glándula hipófisis.
Preguntas frecuentes
¿Qué es el cortisol en el cuerpo humano?
El cortisol es una hormona que, producida por la glándula suprarrenal , se encuentra circulando en la sangre. Aumenta en las situaciones de estrés y actúa elevando el nivel de azúcar en la sangre y disminuyendo la inmunidad. Interviene en el metabolismo de grasas, proteínas y carbohidratos, y también actúa manteniendo en niveles adecuados los iones en sangre, así como la cantidad de agua en el organismo.
¿Qué es la enfermedad de insuficiencia suprarrenal?
La insuficiencia renal es la enfermedad en la que las glándulas suprarrenales no funcionan . Esto da lugar a una menor producción de cortisol, que deberá ser suministrado en forma de medicamento al paciente.
¿Qué es la glándula suprarrenal?
La glándula suprarrenal es una glándula endocrina que se encuentra situada encima de los riñones, de ahí su nombre. Su misión principal es la producción de sustancias como el cortisol, la aldosterona, la adrenalina y noradrenalina. También producen, pero en menor cantidad hormonales sexuales, como los estrógenos y la testosterona.
¿Cuál es la función de la glándula suprarrenal?
La función de la glándula suprarrenal es la producción de hormonas como el cortisol, la aldosterona, la adrenalina y la noradrenalina, que van a controlar el equilibrio de iones del organismo, mantener los niveles de azúcar, regular la respuesta inflamatoria, permitir que el cuerpo responda ante una situación de lucha o huida, mantener el embarazo, y comenzar la maduración sexual durante la pubertad.
¿Dónde se producen los mineralocorticoides?
Los mineralocorticoides son las hormonas que se van a producir en la parte exterior o corteza de las glándulas suprarrenales. Su misión en el organismo es mantener el equilibrio hidroelectrolítico actuando a nivel del riñón. La más importante es la aldosterona .
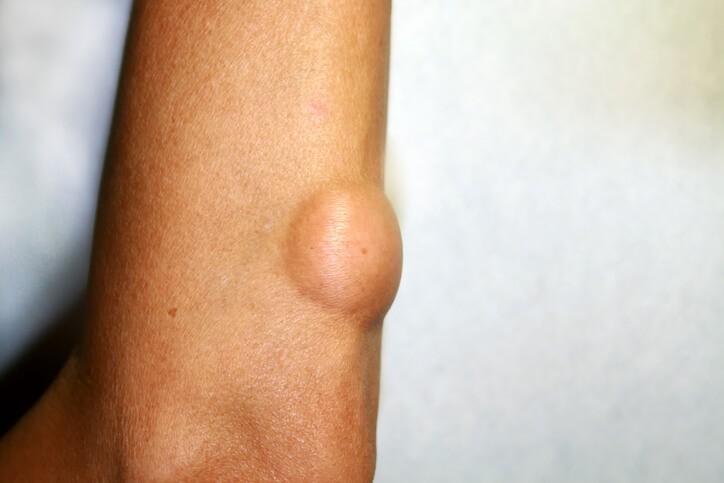
Enfermedad
Lipoma
¿Qué es un lipoma?
El lipoma es un tumor cutáneo benigno de origen adiposo (graso), localizado en el tejido celular subcutáneo (capa profunda de la piel). Puede aparecer de forma única o múltiple, y afectan sobre todo a mujeres en edad adulta. Son tumoraciones de tejido blando benignas y comunes, afectando a 1 de cada 1.000 personas.
Tipos de lipomas
Lipomatosis múltiple familiar : hereditaria, con aparición de múltiples y pequeños lipomas por todo el cuerpo con tendencia a aparecer simétricamente.
Lipomatosis benigna simétrica (enfermedad de Madelung) : aparecen pequeños lipomas múltiples no dolorosos en el cuello. En ocasiones también aparecen en el abdomen.
Lipomatosis congénita difusa : enfermedad hereditaria con aparición de lipomas en una o dos extremidades y que provocan un gigantismo en las mismas.
Adiposis dolorosa (enfermedad de Dercum) : síndrome donde aparece obesidad, cansancio, alteraciones psiquiátricas y aparición de lipomas repartidos por el cuerpo que son dolorosos.
Lipoma solitario : aparición de una sola lesión.
Causas del lipoma
En algunas ocasiones se ha establecido un origen genético en su padecimiento. En general su causa es desconocida, aunque parece que pudiera influir la pérdida de la función reguladora de las enzimas que controlan el crecimiento celular, produciéndose una organización de los adipocitos o células grasas de la piel en pequeños nódulos, cubiertos por una capa fibrosa de tejido conectivo, y dándoles la característica de encapsulado.
Síntomas del lipoma
Aparición en la piel de una masa o elevación circunscrita, redondeada, cubierta por piel normal y no dolorosa, que presenta una consistencia blanda y se desplaza fácilmente sin mostrar adherencia a planos más profundos de los tejidos. Pueden llegar a ser de gran tamaño y a producir síntomas por compresión de otras estructuras corporales adyacentes, aunque lo habitual es que tras una primera fase de crecimiento, mantengan una estabilidad llegando a medir unos 3-5 cm de diámetro. Se localizan más frecuentemente en cuello, espalda, brazos, glúteos y muslos, siendo raros en la cara, manos, piernas o pies.
A pesar de desarrollarse preferentemente en el tejido subcutáneo, en ocasiones pueden aparecer en otras zonas del cuerpo más profundas, por ejemplo, en relación a órganos profundos como órganos abdominales, intramusculares, cavidad oral, canal auditivo interno y tórax, entre otras.
Tratamiento del lipoma
Habitualmente los lipomas no requieren tratamiento. Si el tamaño del lipoma es grande y produce compresión de las estructuras anatómicas que tiene a su alrededor produciendo síntomas, entonces se plantea el tratamiento quirúrgico para su extracción.
Pruebas complementarias del tratamiento del lipoma
Para identificar correctamente los lipomas, aparte de la sospecha clínica por la exploración física, se suelen realizar pruebas de imagen como una ecografía de partes blandas, y si es preciso para la correcta identificación, una resonancia magnética.
Tras el tratamiento quirúrgico de extracción del lipoma siempre se envía el tejido extraído al laboratorio de anatomía patológica para su estudio y la confirmación de su diagnóstico.
Factores desencadenantes del lipoma
El factor desencadenante es la organización anómala de una masa de adipocitos o células grasas maduras.
Factores de riesgo del lipoma
Los pacientes obesos, el aumento de peso, y aquellos que padecen hipercolesterolemia o diabetes , tienen mayor riesgo de sufrir un lipoma.
Tener antecedentes familiares de enfermedades lipomatosas múltiples también es un factor de riesgo de haber heredado las alteraciones genéticas que producen la enfermedad.
Complicaciones del lipoma
Compresión de estructuras adyacentes, nervios, estructuras vasculares, articulaciones…etc.
Sobreinfección perilesional del lipoma.
Prevención del lipoma
Los lipomas no pueden prevenirse, una vez aparecen, sí que es conveniente no aumentar el peso porque con ello puede aumentar su tamaño
Especialidades a las que pertenece el lipoma
Los lipomas son tratados cuando son sintomáticos por compresión por los médicos dermatólogos y, en caso de lipomas más profundos por cirujanos generales.
Preguntas frecuentes:
¿Qué es la fibrolipoma?
El fibrolipoma es una variedad de lipoma que contiene una mayor cantidad de tejido fibroso
¿Qué es un liposarcoma?
El liposarcoma es un tumor maligno de tejido adiposo o graso.
¿Qué es la lipomatosis?
La lipomatosis es una alteración en la que existe un crec imiento excesivo difuso del tejido adiposo o graso , que infiltra las estructuras adyacentes.
¿En qué zona del cuerpo es más frecuente que salgan lipomas?
En el tronco, el cuello y la parte superior de los brazos y piernas.
¿Qué es un lipoma en el colon?
El lipoma de colon es una tumoración que se localiza en su submucosa (capa de la pared intestinal entre la mucosa y la pared muscular), sobre todo en el colon ascendente y el ciego, que no suele malignizarse. Produce síntomas como dolor abdominal, alteraciones en el tránsito intestinal y sangrados con las heces (rectorragias).
Artículos por especialidad
CertificadosAlergologíaAnatomía PatológicaAnestesiología y ReanimaciónAngiología y Cirugía VascularAnálisis ClínicosAparato DigestivoCardiologíaChequeosCirugía General y del Aparato DigestivoCirugía General y del Aparato Digestivo PediátricaCirugía Oral y MaxilofacialCirugía Ortopédica y TraumatologíaCirugía Ortopédica y Traumatología PediátricaCirugía PediátricaCirugía Plástica y ReparadoraCirugía TorácicaClínica u HospitalDermatología Médico-Quirúrgica y VenereologíaEndocrinología y NutriciónEnfermeríaFisioterapiaGenética HumanaGinecología y ObstetriciaInmunologíaLogopedia y FoniatríaMedicina Estética y Unidad LaserMedicina Física y RehabilitaciónMedicina GeneralMedicina InternaMedicina NuclearMedicina del DeporteNefrologíaNeumologíaNeurocirugíaNeurofisiología ClínicaNeurologíaNutrición y DietéticaOdontología y EstomatologíaOftalmologíaOncología MédicaOncología RadioterápicaOsteopatíaOtorrinolaringologíaPediatríaPodologíaPoliclínicasPreparación al PartoPsicologíaPsiquiatríaRadiodiagnóstico-Diagnóstico Por ImagenReumatologíaTricologíaUnidad del DolorUrgencias HospitalariasUrología
Todas las especialidades  Savia
Savia