Lupus, ¿Qué Debes Saber?
Ante todo, debemos saber que el nombre completo de esta enfermedad es lupus eritematoso sistémico (LES). En España, nueve de cada 10.000 la sufren, siendo mucho más frecuente en mujeres (90%), y la edad de inicio alrededor de los 30-35 años. Sus síntomas son más leves en los pacientes de mayor edad.
Sus principales características son:
- Es una enfermedad sistémica (puede afectar a cualquier órgano del cuerpo).
- Es crónica (cursa con períodos de exacerbaciones y remisiones).
- Tiene una base autoinmune (el sistema inmunitario ataca las células sanas del cuerpo por error). Esta alteración puede darse en otras enfermedades relativamente frecuentes como la enfermedad celíaca, la diabetes tipo 1, la artritis reumatoide y la esclerosis múltiple.
¿Cuál es la causa del LES?
Se trata de una enfermedad multifactorial en la que influyen los factores genéticos y hormonales, las alteraciones inmunológicas y los agentes ambientales (infecciones, radiación ultravioleta y exposición a ciertos fármacos).
¿Qué síntomas ocasiona?
Su presentación es muy variable y dará síntomas diferentes dependiendo del órgano afectado. Principalmente, se afectan los riñones, la piel y las mucosas, el sistema músculo esquelético, el sistema cardiopulmonar y el sistema nervioso. Las manifestaciones más frecuentes son las lesiones cutáneo-mucosas, las articulares y las hematológicas.
En fase inicial de la enfermedad (cuando aún no ha dado síntomas) es posible detectar los autoanticuerpos circulantes en sangre.
Estos son los síntomas más frecuentes y sus principales características:
- Lesiones cutáneas lúpicas: según las características de las lesiones cutáneas encontraremos el lupus discoide, el lupus subagudo cutáneo, etc.
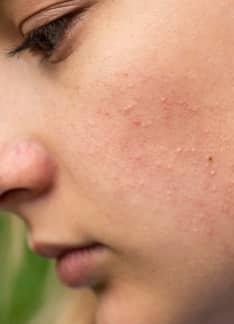
- El exantema malar o en alas de mariposa: es la lesión cutánea por excelencia. Se trata de un enrojecimiento típico que afecta a las mejillas y nariz.
- Otras lesiones cutáneas no específicas son: fotosensibilidad (enrojecimiento tras exposición al sol), alopecia, úlceras orales, urticaria, fenómeno de Raynaud y vasculitis.
- Manifestaciones músculo-esqueléticas: artralgias (dolores articulares), artritis (inflamación de las articulaciones) y mialgias (dolores musculares) son las más comunes, sobre todo en manos.
- Manifestaciones sistémicas: malestar general, astenia (cansancio extremo), la fiebre o la pérdida de peso, pleuritis, pericarditis, endocarditis.
- Manifestaciones renales: en uno de cada tres pacientes en forma de nefritis lúpica.
- Manifestaciones neuropsiquiátricas: cefalea, crisis comiciales/convulsivas, alteraciones cognitivas, psicosis, neuropatías periféricas…
- Manifestaciones hematológicas: las principales son la disminución de las series hemáticas como anemia.
¿Necesitamos realizar una analítica específica para detectar el LES?
Existen algunos parámetros que se encuentran típicamente elevados en el LES. Sin embargo, no son específicos de esta enfermedad y se pueden encontrar en otras enfermedades. Es el caso de los anticuerpos antinucleares (llamados ANA), presentes en otras enfermedades autoinmunes como la esclerosis sistémica, la dermatomiositis, la polimiositis, la artritis reumatoide, las tiroiditis, etc. Una curiosidad, unos ANA positivos no son específicos de LES, pero un LES sin ANA es poco probable.
Existen otros anticuerpos, los anti DNA, que son muy específicos de LES. Su título se correlaciona con su severidad y con la progresión de la enfermedad renal. Es decir, la presencia de anti DNA sugiere LES, además, cuanto mayor es el número o título de estos anti DNA más severa y rápidamente progresiva será la enfermedad. Por ello decimos que tienen un valor predictivo, orientándonos de la evolución que tendrá.
Los Anticuerpos anti-Sm: son patognomónicos de la enfermedad, sólo se encuentran en el LES.
¿Cómo llegamos al diagnóstico de LES?
El diagnóstico de LES no es sencillo dada la variabilidad de síntomas posibles, en función del órgano afectado. Ante la sospecha, es cuando debe solicitarse una analítica específica como estudio complementario dirigido.
En la actualidad para llegar al diagnóstico de LES nos basamos en unas tablas que contemplan las principales manifestaciones clínicas, datos analíticos y marcadores serológicos. La presencia de al menos cuatro de los criterios descritos en esa tabla confirma el diagnóstico de LES.
No debemos olvidar que, al confirmar el diagnóstico, hemos de conseguir que el paciente entienda y acepte su enfermedad, de forma que siga el tratamiento fielmente para evitar la progresión de la misma.
¿Cuál sería el tratamiento del LES?
El LES cursa con síntomas clínicos muy diferentes. El tratamiento, por tanto, varía a lo largo de la evolución y según el síntoma u órgano a tratar. También influye el grado de severidad.
En el tratamiento del LES se ve implicado el reumatólogo (como principal médico responsable), pero trabaja en colaboración con otros especialistas que controlan el resto de afectaciones sistémicas, como el dermatólogo para tratar las lesiones cutáneas, o el nefrólogo para el control renal. Es fundamental advertir al paciente que debe evitar la exposición solar pues las lesiones cutáneas empeoran sustancialmente al ser expuestas (son fotosensibles).
El objetivo principal sería mantener la enfermedad inactiva o con la menor actividad posible y evitar la progresión del daño orgánico. Para mejorar la supervivencia, debemos emplear el mínimo de tratamientos posibles para minimizar los efectos secundarios. La presencia de manifestaciones graves en órganos importantes (renales, neurológicas, cardiopulmonares o hematológicas) requiere del uso de dosis altas de corticoides asociadas a inmunosupresores (cuya finalidad es atenuar la respuesta autoinmune del cuerpo frente a nuestros propios tejidos).
¿Qué evolución tiene el LES?
También va a depender del órgano afectado y del grado de severidad. Los pacientes afectados de LES tienen una morbimortalidad mayor que la población general (el riesgo de muerte en los pacientes con LES es de dos a tres veces mayor que en la población general).
¿Hay factores que marcan un mal pronóstico?
Entre los factores asociados a una mayor mortalidad podríamos citar la presencia de enfermedad renal, la hipertensión arterial y unos anticuerpos llamados antifosfolípido. Vamos a añadir, sin embargo, que la remisión de la enfermedad se consigue en algunos pacientes, permitiendo incluso llegar a retirar el tratamiento que se había instaurado con intención crónica. Por ello es fundamental contar con la implicación del paciente.
 Savia
Savia